Introducción
Existen problemas médicos en espera de una solución o al menos de una mejor comprensión de su fisiopatología, por ejemplo, la hipertensión idiopática y otros tipos de hipertensión (Grimm & Sansom, 2010; Sachse et al., 2014), los diferentes tipos de epilepsia, sus causas, diagnóstico diferencial y posibles tratamientos (Du et al., 2005; Niestroj et al., 2020), entre otros. En estos ejemplos se encuentra involucrado el canal iónico BK.
Canales BK
Los canales BK son específicos de K+ y presentan alta conductancia (200 pS-300 pS); estos se expresan en diferentes células: neuronas, epitelios, células sensoriales y células de músculo liso (Cui et al., 2009). El disparo neuronal, la neurotransmisión, la contractilidad del músculo liso y el tono vascular están controlados por el canal BK (Latorre et al., 2017). Las canalopatías del canal BK están asociadas con epilepsia, alteraciones motoras, hipertensión, incontinencia urinaria e hipoacusia (Brenner et al., 2005; Du et al., 2005). Estas características hacen del canal BK un objetivo clave para las terapias farmacológicas (Rockman et al., 2020). Activadores farmacológicos del canal BK se postulan como fármacos terapéuticos en enfermedades donde un decremento en la función del canal BK está subyacente a la enfermedad (Bentzen et al., 2014).
Los canales BK tienen estructura homotetramérica y cuentan con sensores de voltaje y Ca2+, esto los hace dependientes de voltaje y del incremento de la concentración de Ca2+ intracelular ([Ca2+]i). Están asociados a subunidades β y γ (β1 - β4; γ1-γ4) que los modulan (Lee & Cui, 2009; Li & Yan, 2016). En los segmentos transmembranales se localizan los sensores de voltaje (VSD, S1-S4), y en el dominio intracelular se localizan dos sensores al Ca2+, reguladores citoplasmáticos de la conductancia de K+ (RCK1 y RCK2). El estudio de la corriente macroscópica BK (IBK) y las curvas conductancia-voltaje (curva G-V) permiten comprender la interacción entre estos sensores y el grado de activación para diferentes condiciones fisiológicas y patológicas (Geng et al., 2020).
Debido a las implicaciones del canal BK, comprender los mecanismos de activación del canal BK y estudiar las propiedades cinéticas y del estado estable de las corrientes macroscópicas en un rango de concentraciones de Ca2+ interno y de voltaje de membrana resultan muy importantes (Rockman et al., 2020).
Enseñanza de la electrofisiología
La interacción docencia-ciencia originó el desarrollo de prácticas de laboratorio para la enseñanza de las ciencias fisiológicas (Horrigan, 2018). Sin embargo, los altos costos de los equipos especializados de electrofisiología y los insumos, además del uso de animales de experimentación, aunado a grupos masivos, hacen imposible la mayoría de las prácticas de electrofisiología, razones que han motivado el desarrollo de simuladores como una alternativa (Reyes-Lazalde et al., 2012; Reyes-Lazalde et al., 2016). En el año 2020, derivado de la pandemia de COVID-19, se ha puesto énfasis en la enseñanza con laboratorios virtuales que puedan ser utilizados a distancia (Gamage et al., 2020; Pérez-Bonilla et al., 2020). Por las razones expuestas, es imposible realizar prácticas de laboratorio reales para el aprendizaje electrofisiológico del canal BK y no existen simuladores de este tema para fines de enseñanza.
Dada la importancia del canal BK para el área médica y neurocientífica, en el presente trabajo se presenta el desarrollo multidisciplinario de un simulador para el estudio electrofisiológico del canal BK con la técnica de fijación de voltaje, que sea ejecutable en cualquier computadora PC con el mínimo de recursos y que pueda ser utilizado en cursos presenciales y a distancia.
El simulador se diseñó bajo la siguiente hipótesis: Si el simulador genera adecuadamente las corrientes BK, entonces reproducirá las curvas experimentales conductancia-voltaje (G-V).
Se consideraron desde su diseño los siguientes objetivos de enseñanza, aprendizaje e investigación.
Objetivos de enseñanza
1. Utilizar el simulador como herramienta de enseñanza.
2. Realizar experimentos virtuales y mostrar los cambios en la IBK causados por diferentes [Ca2+]i y a diferentes potenciales de membrana.
Objetivos de aprendizaje
1. Comprender que el canal BK es dependiente de voltaje y [Ca2+]i.
2. Aprender a cuantificar resultados experimentales: medir la amplitud de la corriente BK (IBK) para cada estímulo de voltaje y [Ca2+]i y generar curvas G-V.
Objetivos de investigación
1. Mostrar la importancia de los modelos computacionales para investigar condiciones donde ciertas variables no se pueden manipular experimentalmente. En los modelos, esas variables o parámetros se pueden modificar a voluntad y observar los cambios que producen.
2. Puntualizar la importancia de los modelos como herramientas predictivas.
3. Reproducir experimentos reales del canal BK realizados con la técnica de fijación de voltaje y que aporten valores del voltaje donde se activan el 50% de los canales (V1/2) y de la variable z de las curvas G-V.
4. Recabar datos simulados y ejecutar ajustes matemáticos no lineales para determinar los parámetros que caracterizan al canal BK.
Materiales y Métodos
Se diseñó y desarrolló un simulador para la generación de la corriente macroscópica BK basados en el modelo matemático propuesto por Gupta y Manchanda (Gupta & Manchanda, 2019). Estos autores ajustaron los parámetros de este modelo al canal BK presente en células del músculo liso detrusor urinario (Gupta & Manchanda, 2019). En el presente trabajo, los parámetros fueron ajustados para reproducir las corrientes macroscópicas del canal mSlo-BK expresado en altas densidades en la membrana de Xenopus oocyte (Cui et al., 1997).
Se modeló la corriente BK mediante el formalismo de Hodgkin & Huxley (1952) (ecuación 1).
donde I BK es la corriente macroscópica BK, g max es la máxima conductancia de BK, m es la variable de compuerta del canal, V es el voltaje de membrana y E K es el potencial de equilibrio para el K+.
El valor de m cambia con respecto del tiempo de acuerdo con la ecuación 2.
donde m es la fracción de compuertas abiertas y τ m es la constante de tiempo a la que se aproxima m al estado estacionario (m∞).
Gupta & Manchanda (2019) adaptaron el modelo para que m∞ dependa del voltaje y de [Ca2+]i (ecuación 3):
donde m∞ es el valor de m en estado estacionario y sf es una función que depende de [Ca2+]i (ecuación 4).
Los parámetros originales fueron ajustados para el músculo detrusor (Gupta & Manchanda, 2019) (Figura 1: trazo superior). Aquí, los parámetros fueron adaptados para mSlo-BK (Cui et al., 1997) (Figura 1: trazo inferior). Una comparación de la gráfica de esta función entre BK del músculo liso detrusor y mSlo-BK en oocitos se muestra en la Figura 1.

Nota: El trazo superior es generado con los valores ajustados para el canal BK en músculo detrusor (Gupta & Manchanda, 2019). El trazo inferior es generado con valores para simular mSlo-BK en oocito. El simulador puede generar IBK de cualquier tipo de célula o canal BK (salvajes o mutados). El usuario puede desplazar esta función hacia arriba o abajo hasta encontrar los valores óptimos para el ajuste de cualquier canal BK.
Fuente: Elaboración propia con base en Gupta & Manchanda (2019).
Figura 1 Interfaz del simulador para graficar la función sf.
La constante de tiempo (τm) es dependiente de voltaje solamente y está determinada por la ecuación 5 (Gupta & Manchanda, 2019).
La IBK depende del V y [Ca2+]i. Experimentalmente, a la célula se le inyecta una concentración de Ca2+ y se le estimula en un rango de voltaje a un determinado intervalo, por ejemplo, -20 mV a 160 mV, con pasos de 10 mV. Para producir la curva G-V es necesario determinar la conductancia máxima. En el simulador se usaron los datos experimentales de Cui et al. (1997) , y las corrientes máximas fueron determinadas con un algoritmo computacional a partir del voltaje en que se alcanza la máxima conductancia en las curvas G-V experimentales para diferentes concentraciones de Ca2+, y se ajustaron con la ecuación 6. En el simulador se encuentra el factor Vf que desplaza esta función a la izquierda o la derecha para ajustar cualquier canal BK.
Análisis de datos
La relación G-V de los experimentos simulados para los diferentes casos fueron ajustadas con la ecuación de Boltzmann (ecuación 7) mediante el programa Origin Pro (OriginLab Corp., Northampton, MA, USA) usando el algoritmo de Levenberg-Marquardt para ajuste no lineal con mínimos cuadrados. De esta manera se determina el valor de z y V 1/2 (Cui et al., 1997).
donde T es la temperatura absoluta, R es la constante de los gases, F es la constante de Faraday, Z es el número de cargas equivalentes y V 1/2 es el voltaje en que se activa el 50% de los canales.
Se utilizó el modelo de Monod-Wyman-Changeux (modelo-MWC) para investigar la probabilidad de apertura dependiente de la interacción del Ca2+ con el canal (ecuación 8) (Lee & Cui, 2009). En este modelo, los sitios moleculares de unión al calcio están representados como uno solo. Los datos son ajustados con el programa Origin Pro.
donde Po es la probabilidad de apertura del canal, L 0 es la constante de equilibrio de los canales abiertos y cerrados en ausencia de Ca2+ unido y a un voltaje de 0 mV. T y z son las mismas que en la ecuación de Boltzmann, e es la carga unitaria, k B es la constante de Boltzmann, K c y K o son las constantes de disociación para el canal en estado cerrado y abierto, respectivamente.
La estadística se realizó con el programa Statgraphics Centurion XV (Statgraphics Technologies. Inc.), se consideró p < 0.05 como valores significativos.
Implementación del modelo
Las ecuaciones fueron implementadas en el programa Visual Basic 6.0 ® para ambiente Windows. Se utilizó el método de Runge-Kutta (dt = 0.01) para la solución de las ecuaciones diferenciales.
Adecuación del modelo matemático a los datos de Cui et al.
Para que el simulador reproduzca los datos experimentales de Cui et al. (1997) (Tabla 1), se ajustó la relación G-V, se determinaron los parámetros de V 1/2 y z (Figura 2) y se obtuvieron las ecuaciones 9 y 10. Con estas ecuaciones se implementó un módulo que permite generar valores teóricos de z y V 1/2 para cualquier concentración de Ca2+.
Tabla 1 Parámetros experimentales (Cui et al., 1997).
| Parámetros G-V (estado-estable) | ||
| [Ca2+] (µM) | V1/2 (mV) | Valor de z |
| 0.84 | 112 ± 3.8 n = 11 | 1.62 ± 0.066* Valor calculado 1.8453 |
| 1.7 | 84.6 ± 3.7 n = 13 | 1.79 ± 0.057 |
| 4.5 | 53 ± 4.3 n = 11 | 1.62 ± 0.079 |
| 10.2 | 29.9 ± 3.1 n = 16 | 1.46 ± 0.056 |
| 65 | -0.1 ± 3.2 n = 10 | 1.30 ± 0.042 |
| * dato fuera de rango. | ||
| Nota: Se estimó el valor por medio de ajuste de datos con la siguiente ecuación: 1.3 + 0.61153 * exp(-0.84/1.8453). | ||
Fuente: Datos tomados de Cui et al. (1997).

Fuente: Elaboración propia con base en Cui et al. (1997).
Figura 2 Ajuste de datos experimentales. a) Gráfica V1/2 -vs- Ca2+. V1/2 disminuye exponencialmente conforme se incrementa [Ca2+]i. La precisión del ajuste fue R2 = 0.98. b) Gráfica para los valores de z con respecto de [Ca2+]i. Se muestra que a valores pequeños de Ca2+, z es mayor y disminuye exponencialmente conforme aumenta el Ca2+. La ecuación ajustó los datos con R2 = 0.99.
Resultados
Se desarrolló un simulador interactivo que genera l BK macroscópica en condiciones de fijación de voltaje.
Interfaz de usuario
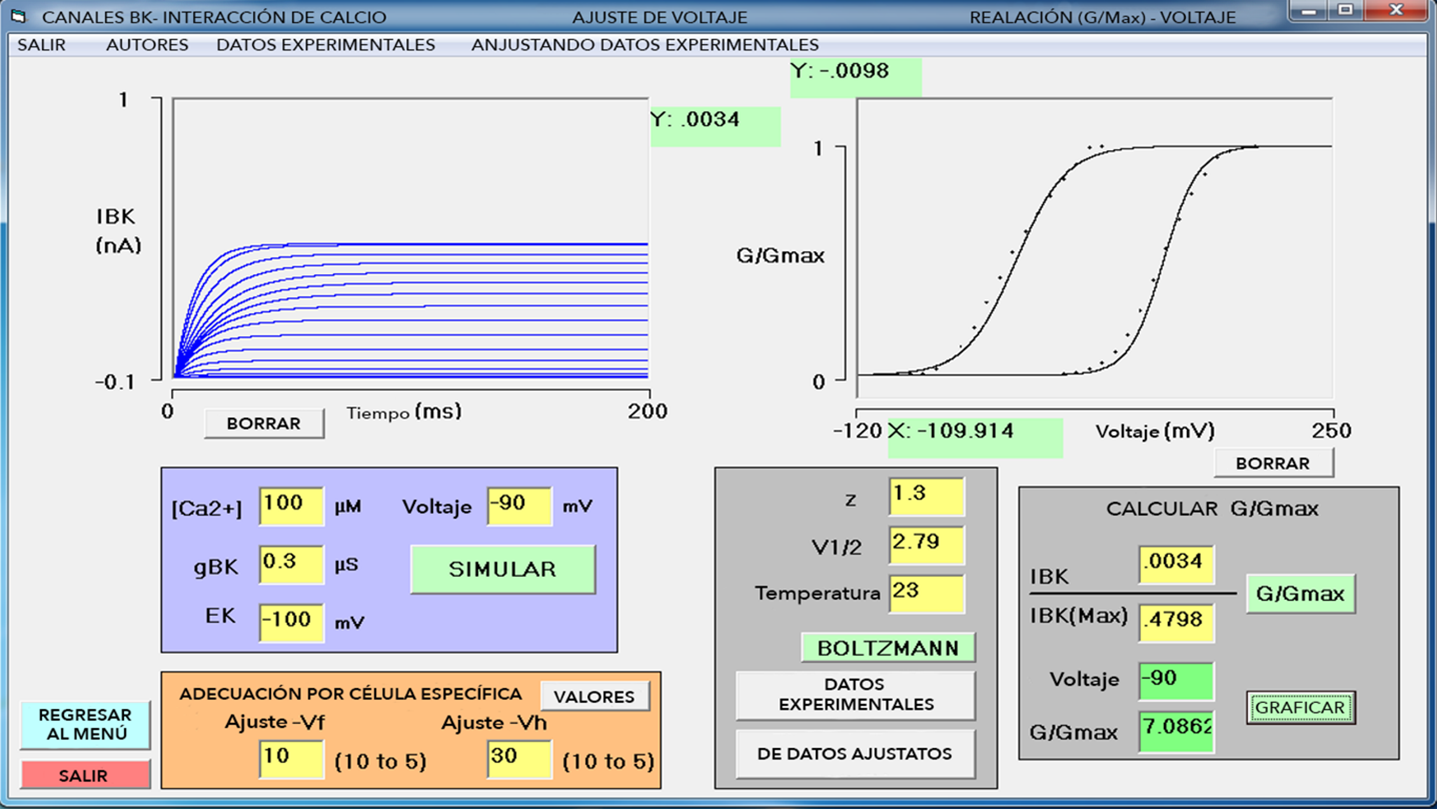
La Figura 3 muestra la interfaz de usuario, cuenta con cuatro módulos de entrada de datos. Módulo I: [Ca2+]i (µM), g BK (µS), E K (mV) y voltaje aplicado (mV). Módulo de ajuste: V f y V h (mV). Módulo de Boltzmann: z, V 1/2 (mV), temperatura (Co). Módulo de conversión de I BK a conductancia BK (GBK): I BK (nA), I BKmax (nA), voltaje aplicado (mV), normalización G/G max (conductancia/conductancia máxima). En la parte superior izquierda se despliega l BK , y del lado derecho se grafica la relación G-V normalizada.

Nota: Al iniciarse el simulador, se presentan valores predeterminados en el módulo de datos y en el módulo de ajustes. El usuario los puede cambiar según el experimento virtual a realizar. Se recomienda que los datos Voltaje y G/Gmax del módulo de conversión se anoten en la libreta de investigación o en algún programa de análisis como Origin Pro para realizar ajustes matemáticos a los datos. El usuario puede realizar mediciones con el cursor en el osciloscopio de despliegue de IBK y en la curva normalizada G/Gmax-V. La secuencia de pasos corresponde al ingreso de datos y los resultados generados (descripción en el texto).
Fuente: Elaboración propia con base en Cui et al. (1997).
Figura 3 Interfaz del simulador.
Modo de uso
Simulación de IBK a partir de datos experimentales
En este caso, se cuenta con los datos V 1/2 , z y temperatura para una [Ca2+]i dada. Paso 1: se ingresan en el módulo de Boltzmann y se presiona el botón ‹Boltzmann› (Figura 3). Como resultado, se traza la curva G-V experimental (curva continua), que servirá de guía para los ajustes. La Figura 3, además, muestra la simulación que reproducen los experimentos de Cui et al. (1997) para un canal mSlo-BK transfectado en oocito para [Ca2+]i = 1.7 µM. Paso 2: se estimula a partir de 100 mV y se aumenta el estímulo en pasos de 10 mV; hasta que la corriente no aumente más, se obtiene la corriente máxima. Con el cursor se mide la corriente en el estado estable (región donde no varía). Paso 3: el dato medido se ingresa al módulo de conversión en las casillas I BK e I BKmax (El dato de esta última casilla se conservará durante todo el experimento para dividir las siguientes corrientes medidas por este valor máximo y se normalice la curva G-V). Paso 4: se oprime el botón ‹G/Gmax› para realizar la conversión de corriente a conductancia. El valor normalizado aparece en la casilla G/Gmax. Se oprime el botón ‹GRAFICAR› y se grafica un punto en la curva G-V. En seguida, se estimula disminuyendo el voltaje en pasos de 10 mV y se mide la corriente generada, el valor se ingresa solamente en la casilla I BK del módulo de conversión para dividirlo por la corriente BK máxima (IBKmax) encontrado anteriormente. Se estimula en el rango de voltaje hasta completar la curva G-V. Si las corrientes I BK simuladas son correctas, estas deben de reproducir la curva G-V experimental.
Validación del simulador
Para validar el simulador fueron reproducidos los datos experimentales de una investigación realizada en Xenopus oocyte con canales BK expresados en su membrana, donde se estudió la corriente macroscópica mslo-IBK generada por un rango de [Ca2+]i y voltaje (Cui et al., 1997) (Tabla 1). Los experimentos virtuales se realizaron con [Ca2+]i: 0.84 µM, 1.7 µM, 4.5 µM, 10.2 µM y 65 µM. Los resultados se muestran en la Figura 4. Se observa cómo el grupo de corrientes generadas para cada concentración de Ca2+ es diferente. La corriente máxima se alcanza en voltajes positivos: 150 mV, 150 mV, 140 mV, 110 mV y 70 mV para [Ca2+]i de 0.84 µM, 1.7 µM, 4.5 µM, 10.2 µM y 65 µM, respectivamente. Los círculos pequeños en la curva G-V corresponden a los datos simulados y se encuentran muy próximos a la curva experimental (línea continua) y siguen su trayectoria. Los valores de voltaje y G/Gmax de cada experimento simulado fueron pasados al programa Origin Pro, se graficaron y se ajustaron con la ecuación de Boltzmann para obtener el valor V 1/2 , fijando z. Un ejemplo de este ajuste para la simulación con [Ca2+]i = 4.5 µM se muestra en la Figura 5a. El valor de V 1/2 fue de 55.84 (mV) (Chi2 = 0.00005; R2 = 0.99967). A los datos simulados se les ajustó el modelo-MWC para determinar L 0 , K c y K o (Figura 5b). A cada simulación con los correspondientes valores de [Ca2+]i se le realizaron los ajustes con la ecuación de Boltzmann y con el modelo-MWC.

Nota. Se simularon los experimentos de Cui et al. (1997) a diferentes concentraciones de Ca2+ (µM): 0.84 (a), 1.7 (b), 4.5 (c), 10.2 (d), 65 (e), con rangos de voltaje -60 mV a 200 mV con incrementos de 10 mV. Los puntos que se muestran en las curvas G-V corresponden al cálculo de G/Gmax a partir de las corrientes simuladas. Se observa cómo siguen adecuadamente las curvas experimentales (línea continua). (d) Relación G-V para las diferentes [Ca2+]i.
Fuente: Corrientes IBK simuladas de los datos de Cui et al. (1997).
Figura 4 Registros de corriente macroscópica.
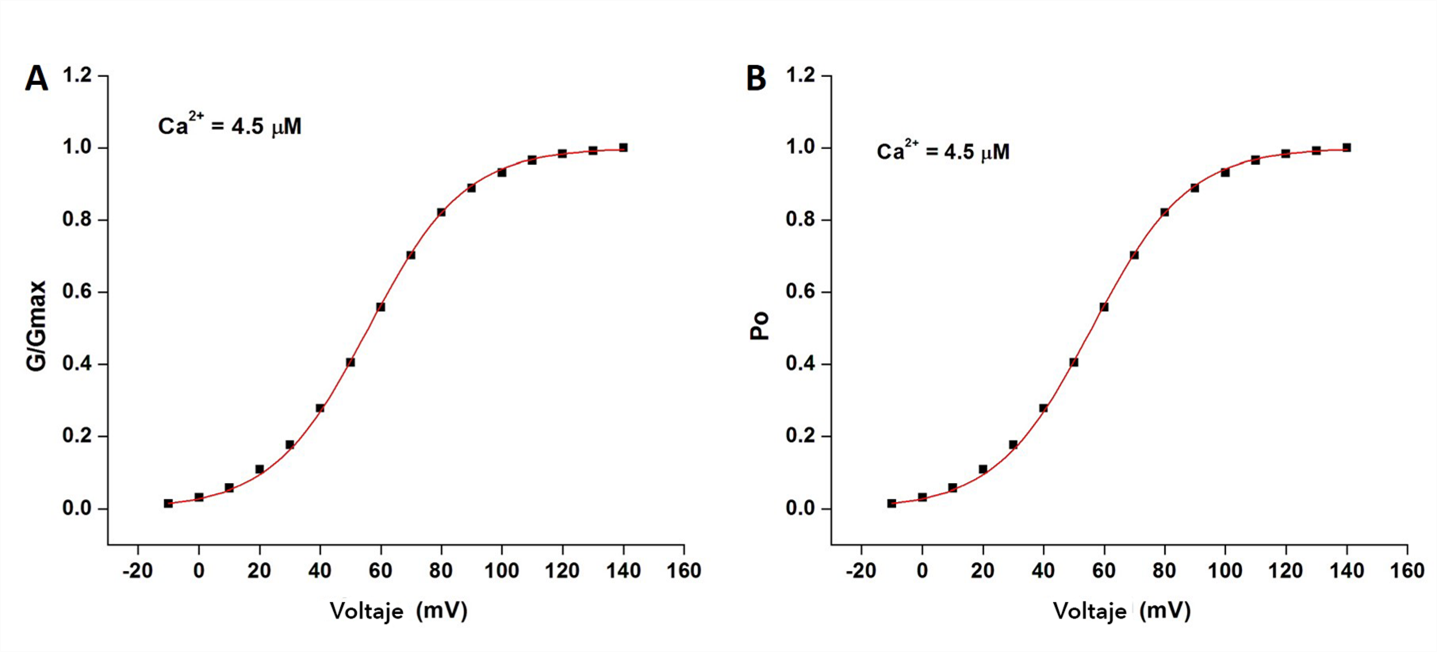
Boltzmann. Se determinó V1/2 = 55.84 (mV). b) Ejemplo de ajuste con el modelo-MWC. L0 = 1809, Kc = 5.0 µM, Ko = 1.09 µM.
Fuente: Elaboración propia con base en Cui et al. (1997) y Lee & Cui (2009).
Figura 5 Ajuste de datos simulados. a) Ejemplo de determinación de V1/2. Los datos de la curva G-V del experimento virtual con [Ca2+] = 4.5 (µM) fueron ajustados con la ecuación de
Se realizaron pruebas de hipótesis para determinar diferencias estadísticamente significativas entre V 1/2 reales y los simulados. Los resultados de p fueron: 0.25, 0.15, 0.4, 0.16 y 0.49 para 0.84 µM, 1.7 µM, 4.5 µM, 10.2 µM y 65 µM de Ca2+, respectivamente. La Tabla 2 compara datos experimentales contra los simulados y muestra el grado de ajuste en cada caso. Los resultados indican que no existen diferencias estadísticamente significativas entre las curvas G-V reales y las simuladas (p > 0.05).
Tabla 2 Pruebas estadísticas y ajuste de datos (experimental vs. simulado).
| Condición | Ca2+ (µM) | V1/2 media ± sd (n) |
z | Valor de p | Chi2 | R2 |
| EXP | 0.84 | 112 ± 3.8 (11) | 1.84 | |||
| SIM | 0.84 | 108 | 1.84 | 0.25 | 0.00074 | 0.9954 |
| EXP | 1.7 | 84.6 ± 3.7 (13) | 1.79 | |||
| SIM | 1.7 | 88.82 | 1.79 | 0.15 | 0.00051 | 0.9971 |
| EXP | 4.5 | 53 ± 4.3 (11) | 1.62 | |||
| SIM | 4.5 | 55.84 | 1.62 | 0.4 | 0.00005 | 0.9996 |
| EXP | 10.2 | 29.9 ± 3.1 (16) | 1.46 | |||
| SIM | 10.2 | 26.54 | 1.46 | 0.16 | 0.00052 | 0.9965 |
| EXP | 65 | -0.1 ± 3.2 (10) | 1.36 | |||
| SIM | 65 | -1.84 | 1.36 | 0.49 | 0.00095 | 0.9932 |
Fuente: Elaboración propia con base en Cui et al. (1997).
Sensibilidad al Ca2+
Se define sensibilidad al Ca2+ (ΔV1/2) como el desplazamiento de la curva G-V en respuesta al cambio de [Ca2+]i de 0 µM a 100 µM: ΔV1/2 = V1/2 (en 0 µM) - V1/2 (en 100 µM) (Zhang et al., 2010). El estudio de la sensibilidad del canal BK al voltaje se realiza a muy bajas concentraciones de Ca2+ interno y con fuertes despolarizaciones. En estas condiciones la concentración es tan pequeña que el canal se activa por voltaje antes de que el Ca2+ se una al canal (Cui et al., 1997). Experimentalmente, es difícil una [Ca2+]i = 0; el simulador permite una concentración de cero Ca2+ y se puede explorar la activación de BK solamente por voltaje. Con una [Ca2+]i = 100 µM se alcanza la saturación, la curva se desplaza a la izquierda. La diferencia de V 1/2 para estas concentraciones determina la sensibilidad al Ca2+. La figura 6 muestra las simulaciones en 0 µM y 100 µM. Se realizaron los ajustes con la ecuación de Boltzmann y se obtuvo: V1/2(0 µM) = 83.98, V1/2(100 µM) = 1.23 y ΔV1/2 = 85.21.
Simulaciones de IBK en otras células
El simulador permite reproducir experimentos en otras células que tienen canales BK. Cuenta con un módulo de ajustes del voltaje final (vf) y del V 1/2 (Vh). Estos parámetros modifican las ecuaciones, y la relación G-V se mueve en el eje del voltaje hasta lograr un ajuste adecuado con los datos experimentales a reproducir.
Ejemplo 1. Reproducción de los experimentos con la mutante mSlo-E399N realizados en células TSA201 (células embriológicas de riñón humano transfectadas) (Sweet & Cox, 2008). Como ejemplo, se reproducen experimentos con fijación de voltaje, con [Ca2+]i = 1.4 µM y 5.3 µM, con el parámetro de ajuste Vh = 5 mV y 8 mV, respectivamente y Vf = -5 mV para los dos experimentos. El rango de estímulo de voltaje fue -10 mV a 180 mV con pasos de 10 mV. La Figura 7 despliega el grupo de corrientes macroscópicas mSlo-BK para las dos concentraciones de Ca2+. La curva continua G-V corresponde a los datos experimentales. Los puntos que siguen a la curva continua son los datos simulados. El grado de ajuste de los datos simulados con la ecuación de Boltzmann fueron: para [Ca2+]i = 1.4 µM, R2 = 0.99402, Chi2 = 0.00098, V1/2 = 99.36 y z = 1.47; para [Ca2+]i = 5.3 µM, R2 = 0.99855, Chi2 = 0.00023, V1/2 = 55.71 y z = 1.38. La comparación entre datos experimentales y simulados se muestra en la Tabla 3. El ajuste con el modelo-MWC para [Ca2+]i = 1.4 µM fue L0 = 9438.61, Kc = 2.65 y Ko = 0.53; y para [Ca2+]i = 5.3 µM fue L0 = 6645.23, Kc = 2.22 µM y Ko = 0.39 µM.
Nota: Simulaciones a 0 µM y 100 µM. El simulador permite la simulación a cualquier concentración de Ca2+. Los trazos de IBK corresponden a [Ca2+]i = 100 µM. Las curvas G/Gmax - V corresponden, de izquierda a derecha, a 100 µM y 0 µM con -1.23 y 83.98 para V1/2, respectivamente. La sensibilidad al Ca2+ estimada fue 85.21.
Fuente: Elaboración propia con base en Zhang et al. (2010) y Cui et al. (1997).
Figura 6 Sensibilidad al Ca2+.

Fuente: Elaboración propia con base en Sweet & Cox (2008).
Figura 7 Simulación en células TSA201 transfectadas con mSlo-BK. a) Simulación con Ca2+ = 1.4 µM. b) Simulación con Ca2+ = 5.3 µM. En la curva G/Gmax - V se observa cómo los datos simulados (puntos) siguen adecuadamente a la curva experimental (línea continua).
Tabla 3 Comparación estadística (datos experimentales y simulados) y ajuste de datos.
| Condición | Ca2+ µM | V1/2 media ± sd (n) |
Z | Valor de p | Chi2 | R2 |
| Sweet & Cox (2008) | ||||||
| EXP | 1.4 | 101 ± 2.1 (3) | 1.47 | |||
| SIM | 1.4 | 99.36 | 1.47 | 0.39 | 0.00098 | 0.99402 |
| EXP | 5.3 | 59 ± 1.6 (3) | 1.38 | |||
| SIM | 5.3 | 55.71 | 1.38 | 0.08 | 0.00023 | 0.99805 |
| Guan et al. (2017) | ||||||
| EXP | 0 | 164 ± 3 (11) | 1.28 | |||
| SIM | 0 | 162.67 | 1.28 | 0.60 | 0.00037 | 0.99775 |
| EXP | 0* | 92 ± 6 (4) | 1.32 | |||
| SIM | 0* | 93.15 | 1.32 | 0.81 | 0.00181 | 0.98854 |
| *2 µM Malotoxina | ||||||
Fuente: Elaboración propia con base en Guan et al. (2017) y Sweet & Cox (2008) .
Ejemplo 2. Experimentos en células HEK-293 transfectadas con canales BK (Guan et al., 2017). Aquí se presentan las simulaciones con canales BKα en condiciones control y en presencia de un activador del canal (malotoxina, 2 µM) en ausencia de Ca2+, para determinar el grado de activación alcanzado por esta droga activadora. La Figura 8 muestra la relación G-V. La curva b corresponde al experimento con malotoxina (línea continua). La curva a es el resultado del experimento control (línea continua). Los puntos son el resultado de las simulaciones. Se realizaron ajustes con la ecuación de Boltzmann, y se mostró que entre los datos experimentales y los simulados no existen diferencias (p > 0.05). La Tabla 3 conjunta los datos estadísticos de los experimentos y simulaciones de Sweet & Cox (2008) y Guan et al. (2017). El grado de activación alcanzado por la malotoxina en la simulación fue: ΔV1/2 ≈ -69.52 mV: ΔV1/2 = V1/2(malotoxina) - V1/2(0 mV); esto es, ΔV1/2 = 93.15 - 162.67 (mV). Contra la activación experimental: ΔV1/2 = -72 mV. No existen diferencias estadísticamente significativas p = 0.33.

Fuente: Elaboración propia con base en Guan et al. (2017).
Figura 8 Curvas G-V con canal BKα. a) En línea continua datos experimentales, en puntos datos simulados, [Ca2+]i = 0. V1/2 = 164 ± 3 mV y V1/2 = 162.67, experimental y simulado, respectivamente. b) Curva G-V con [Ca2+]i = 0 y 2 µM de malotoxina. V1/2 = 92 ± 6 mV y V1/2 = 93.15, experimental y simulado, respectivamente. ΔV1/2 ≈ -69.52 mV (p = 0.33).
Discusión
Realizar experimentos reales para la enseñanza de la electrofisiología resulta prácticamente imposible debido a los altos costos. Una alternativa son los simuladores interactivos que permiten a los estudiantes reproducir experimentos reportados en la literatura científica (Diwakar et al., 2014; Pérez-Bonilla et al., 2020). El simulador que se presenta tiene la característica de poder reproducir experimentos reales y permite al estudiante obtener datos para su análisis, tal como se realiza en una investigación. Es claro que cada experimento reporta diferentes datos para el canal BK, esto depende en cierta medida de la estructura de cada canal analizado. Las subunidades auxiliares modulan la apertura del canal y, por tanto, la corriente iónica producida (Li & Yan, 2016) depende también del tipo de célula donde se localicen, del número de canales transfectados y de la dinámica de interacción con Ca2+ (Hou et al., 2016). En consecuencia, para que el simulador pueda reproducir cada uno de estos experimentos es necesario ajustar las ecuaciones a las diferentes condiciones modificando los parámetros que permiten esto. No es de extrañarse que los valores de ajuste sean diferentes en cada caso. Los resultados de las simulaciones probadas aquí no presentaron diferencias estadísticamente significativas (p > 0.05) con los datos reales.
Conclusiones
Las condiciones actuales de aislamiento por el COVID-19 han obligado al cierre de universidades. La enseñanza ha pasado a ser a distancia y las prácticas de laboratorio se han visto suspendidas. Se presenta el desarrollo de una herramienta didáctica en electrofisiología para la enseñanza-aprendizaje de la cinética de las corrientes I BK . Se puede ejecutar en ambiente Windows® (Windows 7 a Windows 10), en cualquier computadora PC compatible con el mínimo de recursos. Es un programa que no depende de ningún otro programa para su ejecución.
El simulador descrito aquí es capaz de reproducir las corrientes BK (IBK) para cualquier canal BK expresado en la membrana de diferentes células. Los experimentos virtuales realizados no presentaron diferencias estadísticamente significativas con los experimentos reales (p > 0.05, en todos los casos) y confirma la hipótesis planteada. Los parámetros V 1/2 y z son necesarios para reproducir los experimentos reales. El simulador permite explorar el efecto de [Ca2+]i no reportadas y predice la relación G-V para estos casos. Con el ajuste no lineal de las curvas G-V, resultado de las simulaciones, se pudo estimar los parámetros V 1/2 y z. Los parámetros V 1/2 en 0 µM y 100 µM de Ca2+ interno permiten calcular la sensibilidad al Ca2+. Con el ajuste del modelo-DWC se pueden determinar los parámetros L 0 , K c y K o . Estas características hacen que el simulador cumpla con los objetivos planteados.











 nueva página del texto (beta)
nueva página del texto (beta)


