Introducción
El nogal pecanero (Carya illinoinensis) es una planta de la familia Juglandaceae (GBIF Secretariat, 2017), nativa del norte de México (Secretaría de Agricultura, Ganadería, Desarrollo Rural, Pesca y Alimenctación [Sagarpa], 2002). México es uno de los líderes en la producción de nuez a nivel mundial; el 97.39% de la producción de nuez del país se obtiene de los estados de Chihuahua, Nuevo León, Durango y Coahuila (Sagarpa, 2002).
La Comarca Lagunera posee una superficie sembrada de 9208 ha, con un rendimiento aproximado de 1459 t/ha-1 de nuez (Servicio de Información Agroalimentaria y Pesquera [SIAP]-Sagarpa, 2016). Las variedades que predominan en los huertos de la Comarca Lagunera son Wichita, que se encuentra presente en el 62% de las huertas laguneras, y Western, presente en el 100% (Sagarpa, 2002).
Las plantas consumen una cantidad significativa de nutrientes y energía para mantener funciones principales, como crecimiento, respiración, reproducción y defensa; en numerosas ocasiones estas ocurren simultáneamente (Chapin et al., 1990; Li & Coleman, 2019; Villar-Salvador et al., 2015). Uno de los elementos que tiene mayor demanda es el nitrógeno, ya que es un elemento nutritivo muy importante para el crecimiento (Butnariu, 2018; Hu et al., 2017; Liu et al., 2017) y el desarrollo (Zein et al., 2011). El nitrógeno constituye parte esencial de ácidos nucleicos y proteínas de las plantas, por ello, es el cuarto elemento más abundante en la biomasa de las plantas (Kox & Jetten, 2015) y esencial para la formación del esqueleto de la clorofila (Moreau et al., 2019), así como para el establecimiento de nuevas estructuras celulares, rutas metabólicas y codificación genética (Baker, 1983). El contenido de nitrógeno total en las plantas se encuentra formado por el nitrógeno proteico, aminoácidos y nitratos (Gomez & Faurobert, 2002; Kang & Titus, 1980).
El déficit de este elemento nutritivo tiene repercusiones en el aspecto productivo, conduciendo, por ejemplo, a tener frutos de menor tamaño, un llenado pobre, un aumento en el porcentaje de frutos con golpe de sol (Carranca et al., 2018) y efectos en el crecimiento y desarrollo del árbol (Ferlian et al., 2017). En múltiples ocasiones es muy alta la demanda de elementos nutritivos que no pueden ser satisfechos por la absorción, y los árboles dependen de las reservas de compuestos almacenados (Villar-Salvador et al., 2015). Las reservas vegetativas se encuentran acumuladas en las plantas para ser utilizadas en los procesos de crecimiento y otras funciones (Babst & Coleman, 2018). En árboles de hoja caduca estos compuestos se almacenan durante la caída de las hojas y se movilizan durante la primavera (Babst & Coleman, 2018; Bazot et al. , 2013; Gilson et al., 2014; Rennenberg et al., 2010). Son escasos los estudios en especies leñosas. Algunas de estas especies reportadas en la literatura incluyen a Pyrus pyrifolia (Marafon et al., 2016), Quercus robur (Valenzuela-Núñez et al., 2011), Populus spp. (Cooke & Weih, 2005), Malus domestica Borkh (Cheng & Fuchigami, 2002) y Swietenia macrophylla (Tian et al., 2003). Las investigaciones que estudian el almacenamiento de compuestos nitrogenados en el tronco ( Núñez-Colima et al., 2019; Zein et al., 2011) y la movilización hacia los tejidos de nuevo crecimiento también son escasos (Villar-Salvador et al., 2015).
Por otra parte, los cambios ambientales pueden aumentar o retrasar el crecimiento de los árboles (Sellin et al., 2017), existen factores como la humedad relativa que pueden causar un descenso en la disminución de la biomasa en los árboles (Sellin et al., 2017); de igual forma, la radiación intensa solar puede reducir el crecimiento de las plantas (Dengel et al., 2009). De manera análoga se ha comprobado que la temperatura juega un papel fundamental en el nitrógeno almacenado en el árbol (Coder, 2016) al reducir el crecimiento y la reproducción (Marias et al., 2017). El nitrógeno proteico se almacena en los órganos perennes durante el otoño e invierno y se moviliza hacia los brotes (o meristemos) que inician el crecimiento durante la primavera. Es necesario conocer cuál es la variable ambiental (temperatura media, irradiación y humedad relativa) que más influye sobre el nitrógeno proteico almacenado en la biomasa del tronco en dos variedades (Western y Wichita), con la finalidad de contribuir con el manejo agronómico del nogal, ya que se trata de un cultivo de gran importancia económica, con una derrama económica de 728 millones de pesos en la Comarca Lagunera (SIAP-Sagarpa, 2016). Por lo anterior, el objetivo del presente estudio fue determinar las variables ambientales que tienen un efecto en el porcentaje de nitrógeno proteico almacenado en el tronco del árbol de las variedades Western y Wichita, además de desarrollar una función matemática que describa el comportamiento del porcentaje de nitrógeno proteico respecto a las variables ambientales.
Materiales y métodos
Área de estudio
El estudio se realizó en el campo experimental de la Universidad Autónoma Agraria Antonio Narro Unidad Laguna en Torreón, México (25º 33’ 22.63’’ N; 103º 22’ 07.77’’ O). El clima del área de estudio es muy seco semiárido (BWh) (Comisión Nacional del Agua [Conagua], 2015; Instituto Nacional de Estadística y Geografía [INEGI], 2015), con una precipitación promedio anual de 189.6 mm, una temperatura media anual de 22.64 ºC (Sagarpa-INIFAP, 2017) y una altitud media de 1120 m. s. n. m. (Conagua, 2015).
Muestreo
El muestreo realizado fue de tipo sistemático para cada una de las variedades (Western y Wichita) y de acuerdo con la metodología desarrollada por Briceño et al. (2018). Se seleccionaron cuatro árboles jóvenes de manera intercalada de una edad cercana a los 30 años en el centro de la huerta (con una extensión de 4 ha) para minimizar el efecto borde. Se extrajeron muestras de manera mensual durante un ciclo anual desde julio de 2016 hasta junio de 2017. Se extrajeron dos muestras del tronco de los arboles a una altura de 1.3 m con un taladro Pressler (Haglof BS072 ®). Posteriormente, las muestras se introdujeron en una hielera para ser transportadas al laboratorio.
Procesamiento de muestras
Las muestras fueron procesadas en el Laboratorio de Biología y Ecología Forestal en la Facultad de Ciencias Biológicas de la Universidad Juárez del Estado de Durango, se introdujeron y se etiquetaron en bolsas de papel aluminio previamente perforadas para su conservación. Las muestras se congelaron con nitrógeno líquido, inmediatamente se almacenaron en un ultracongelador (Revco Value Plus® Thermo Scientific®) a una temperatura de -70 °C, para posteriormente ser liofilizadas (Liofilizador Labconco® Freezone Triad Freeze Dry Systems®) durante siete días a -40 °C, con el propósito de deshidratar las muestras y evitar toda actividad enzimática. Una vez liofilizadas, las muestras fueron molidas en un equipo Pulverisette 15 Fritsch® para obtener un polvo fino.
Determinación de nitrógeno total
El nitrógeno se determinó en el Laboratorio de Genética INRA-URP3F Génétique en el Institut National de la Recherche Agronomique (INRA) del Centre de Recherche Nouvelle-Aquitaine- Poitiers, Francia. Se pesaron 2 mg de materia seca, previamente liofilizada, en una capsula de estaño, y se introdujeron en el analizador elemental de gases (Thermo Scientific® Fash 2000 Organic Elemental Analizer ®) de acuerdo a la metodología propuesta por Valenzuela-Núñez et al. (2011).
Estimación de la biomasa del árbol
Se calculó el volumen de madera del tronco de los árboles utilizando los valores de densidad de la madera determinados para nogal por el Instituto Nacional de Tecnología Industrial y el Centro de Investigación y Desarrollo de la Industria de la Madera y Afines (INTI-Citema, 2003), además del uso de ecuaciones alométricas en Carya, según Rodríguez et al. (2006). La biomasa del tronco se determinó mediante la siguiente ecuación:
Una vez calculado el contenido de nitrógeno total (kg) en el tronco, se estimó el porcentaje de nitrógeno proteico para cada variedad mediante la siguiente formula:
La constante (0.226 gN/g Proteico) permite conocer el contenido de nitrógeno en las proteínas (Yeoh & Wee, 1994). La radiación, la humedad relativa y la temperatura media mensual fueron obtenidas de la base de datos del INIFAP Campo Experimental La Laguna (CLIMA-INIFAP, 2018).
Análisis estadístico
Se realizó un análisis de regresión lineal múltiple para observar la influencia de las variables ambientales (temperatura, humedad relativa e irradiación) sobre el porcentaje de nitrógeno proteico en el tronco del árbol para cada una de las variedades de nogal. Una vez determinada la variable que más influyó sobre el porcentaje de nitrógeno proteico, se realizó un análisis de regresión lineal simple para observar su comportamiento con respecto al porcentaje de nitrógeno proteico en el tronco de nogal. Los procedimientos fueron realizados con la ayuda del software SPSS 18, con un nivel de significancia de 0.05.
Resultados
El resultado del análisis de regresión lineal múltiple de la variedad Wichita indicó que la temperatura, la irradiación y la humedad relativa predicen de manera significativa el contenido de nitrógeno proteico en el tronco del árbol para la variedad Wichita (F = 6.87; g.l. = 3,8; P = 0.013; R2 = 0.720). La ecuación de regresión fue la siguiente:
donde TMM = temperatura media mensual (°C); HR = humedad relativa (%); I = irradiación (MJ *m-2); Constante= 5.845. La temperatura media mensual fue la variable que más influyó en el porcentaje de nitrógeno proteico en el tronco de nogal de esta variedad.
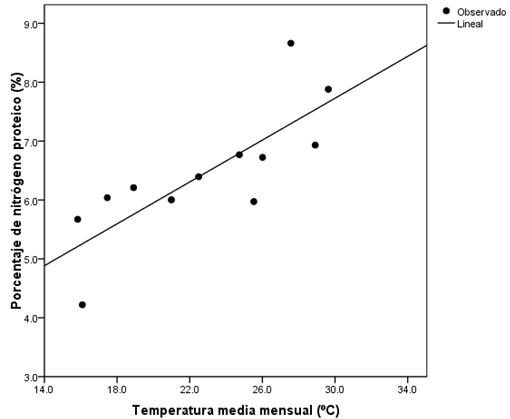
El resultado del análisis de regresión simple reveló que la temperatura predice de manera significativa la acumulación de nitrógeno proteico en el tronco del árbol en la variedad Wichita (F = 9.29; g.l. = 1,10; P = 0.012; R2 = 0.482). De esta manera se obtiene la siguiente ecuación:
La relación entre la temperatura y el porcentaje de nitrógeno proteico fue directamente proporcional. Si la temperatura aumenta, el porcentaje de nitrógeno proteico en el tronco tiende a aumentar, y si la temperatura disminuye, el porcentaje de nitrógeno proteico tiende a disminuir (Figura 1).

Fuente: Elaboración propia.
Figura 1 Regresión lineal simple entre la temperatura (ºC) y el porcentaje de nitrógeno proteico en el tronco de nogal variedad Wichita durante un ciclo anual productivo en Torreón, Coahuila, México.
WESTERN
De igual manera, la temperatura, la irradiación y la humedad relativa predicen de manera significativa la acumulación de nitrógeno proteico en el tronco del árbol para la variedad Western (F = 10.476; g.l. = 3,8; P = 0.004; R2 = 0.797). La ecuación de regresión obtenida para el porcentaje de nitrógeno proteico fue la siguiente:
donde TMM = temperatura media mensual (°C); HR = humedad relativa (%); I = irradiación (MJ *m-2); Constante= 5.316. La temperatura media mensual fue la variable que más influyó en el porcentaje de nitrógeno proteico en el tronco de nogal, así como la variedad antes mencionada. El resultado del análisis de regresión simple indicó que la temperatura predijo de manera significativa la acumulación de nitrógeno proteico en el tronco del árbol en la variedad Wichita (F = 16.70; g.l. = 1,10; P = 0.002; R2= 0.626). La ecuación de la regresión obtenida fue la siguiente:
Se observó que la relación entre la temperatura y el porcentaje de nitrógeno proteico es directamente proporcional, ya que cuando la temperatura aumenta, también lo hace el porcentaje de nitrógeno proteico (Figura 2).
Discusión
Los resultados obtenidos concuerdan con lo reportado por Staswick (1994), donde menciona que los cuerpos proteicos en las vacuolas deshidratadas representan cantidades superiores al 5%. El porcentaje de nitrógeno proteico de las variedades es muy similar al contenido de nitrógeno total reportado por Windels et al. (2003) en los troncos de Acacia berlandieri (1.8% a 6%).
Por otra parte, estos resultados difieren con el estudio de Kang & Titus (1980) en Malus domestica Borkh, donde se reportaron valores del 90% de nitrógeno de naturaleza proteica movilizado hacia el nuevo crecimiento y un 10% en forma de aminoácidos. De igual manera, en Prunus persica L. Batsch (Gomez & Faurobert, 2002) y en Fraxinus excelsior (Marmann et al., 1997) el contenido de nitrógeno proteico fue inferior al 20% del nitrógeno total, muy por encima del presente estudio, ya que se obtuvieron valores del 4% al 9% aproximadamente. Las diferencias en el contenido de porcentaje proteico podrían deberse a la variedad de especies, la etapa de desarrollo y la estación climatológica en la que se encuentren los árboles (Tromp & Ovaa, 1973). Los compuestos tienen predisposición a fluctuar en horas o días debido a la plasticidad en las plantas, además de que varían conforme a los factores ambientales (Villar-Salvador et al., 2013b).
En el presente estudio se puede observar que el porcentaje de nitrógeno proteico es proporcional a la temperatura, ya que cuando esta aumenta también lo hace el porcentaje de nitrógeno proteico. Del mismo modo, Brunner et al. (2015) reportan que cuando existen altos niveles de estrés por sequía, las plantas se ven obligadas a responder activando mecanismos que protegen a los tejidos contra el daño celular mediante el uso de proteínas. En el estudio de Taulavuori et al. (2014) se reportó que el contenido del nitrógeno aumenta con las bajas temperaturas. De igual forma, difiere con lo reportado por Coder (2016), donde hace referencia a que el porcentaje de nitrógeno contenido en el tronco del árbol disminuye conforme aumenta la temperatura.
Way & Oren (2010), al estudiar Quercus rubra, reportaron que el calentamiento promueve el crecimiento en los árboles de hoja caduca. En el estudio de McClaran et al. (2013) se utilizaron ecuaciones para calcular el contenido de nitrógeno en Prosopis velutina, obteniendo un coeficiente de determinación (R2 = 0.90), lo que difiere con el presente estudio, ya que los coeficientes de la regresión lineal múltiple fueron menores en Wichita (R2 = 0.72) y en Western (R2 =0.79), esta variación podría ser atribuida al tronco del árbol, ya que Northup et al. (2005) reporta que las predicciones de biomasa de troncos grandes son menos precisas que las de troncos pequeños.
Los resultados del presente estudio indican que las plantas pueden responder de manera positiva a las temperaturas (Wertin et al., 2011), aunque la respuesta de los árboles a la sequía depende de diversos factores ambientales relacionados con el sitio, tales como precipitación, temperatura, topografía y características del suelo (Lévesque et al., 2014; Weber et al., 2013). El nitrógeno es uno de los elementos más importantes para el crecimiento y desarrollo de las plantas (Villar-Salvador et al., 2013a), pero, así como toda reserva, puede fluctuar debido a las variables ambientales o geográficas (Núñez-Colima et al., 2019).
Conclusiones
El nitrógeno almacenado en forma de proteínas en dos de las variedades de Carya illinoinensis Koch (Western y Wichita) se puede predecir mediante una función matemática que involucre los factores ambientales siguientes: radiación solar, humedad relativa y temperatura media mensual. El nitrógeno presentó un comportamiento inversamente proporcional a la temperaura en las variedades estudiadas.
Conflictos de intereses
Los autores expresan que no se tiene ningún conflicto de interés.











 nova página do texto(beta)
nova página do texto(beta)