Introducción
Las especies de la familia Fabaceae dominan las comunidades de flora en los bosques secos tropicales del sureste de México (González-Valdivia, Cetzal-Ix & Dzib-Castillo, 2016), que a su vez son los ecosistemas terrestres más amenazados (Gentry, 1992; Janzen, 1988; Lerdau, Whitbeck & Holbrook, 1991). En México, estos bosques deciduos se conocen como selvas caducifolias, se distribuyen desde el nivel del mar hasta los 1700 msnm, tanto en la vertiente del Pacífico como del Atlántico (Rzedowski, 2006). Sin embargo, la demanda del recurso vegetal para la industria y el sustento de la población humana en las regiones con selvas tropicales ha causado su disminución además de una fuerte conversión de estas comunidades vegetales en áreas agrícolas, pecuarias y asentamientos humanos (Arias-Escobar & Barrera-Cataño, 2007; Gehring, Denich, Kanashiro & Vlek, 1999).
En la Península de Yucatán, este tipo de vegetación incluye al ja’abín, habín o jabín (Piscidia piscipula: Fabaceae), especie arbórea dominante o codominante en la región (Dzib-Castillo, ChantásigVaca & González-Valdivia, 2014; Román et al., 2014). En áreas fuertemente impactadas por la extracción de Cedrela odorata y Swietenia macrophylla, entre otras maderas de color, P. piscipula representa del 20% al 60% de los individuos; sin embargo, su madera pesada, de color y veteado muy atractivo y de buenas propiedades tecnológicas, es poco utilizada industrialmente, excepto para aplicaciones de poco valor agregado (Richter, Silva-Guzmán, Fuentes-Talavera, Rodríguez-Anda & Torres-Andrade, 2012).
P. piscipula ha sido empleada como postes en cercas, durmientes, leña (Richter et al., 2012), carbón, construcción rural, medicina tradicional, usos en ceremonias mágico-religiosas y elaboraciones culinarias (Zamora, Flores & Ruenes, 2009). Su contenido de piscidina le confiere utilidad como insecticida natural, antitusivo, analgésico, sedante y narcótico. El contenido de piscidina y rotenona puede llegar a conferirle toxicidad (Niembro, 1986). También es importante como néctar-polinífera, forrajera, ornamental y nodriza para otras plantas, además de que sus hojas y madera son utilizados en la cobertura del foso de rocas incandescentes, propias del proceso de elaboración del Pib, requerido para preparar el Pibil, una especialidad culinaria Maya de la Península de Yucatán (Zamora et al., 2009). Es resistente a la poda y capaz de rebrotar, de rápido crecimiento (Ayala, Krishnamurthy, Basulto & Leos, 2007; Haas-Ek, GonzálezValdivia, de Jong & Ochoa-Gaona, 2019) y bien adaptada a las condiciones de suelos y clima de la Península de Yucatán (Zapata, Bautista & Astier, 2009).
Sin embargo, en cuanto al proceso de reproducción, se debe tomar en cuenta que esta especie de la familia de las fabáceas suele presentar ciertos problemas en la germinación de sus semillas, ya que estas llegan a presentar dormancia y se considera que una semilla se encuentra en estado dormante cuando, por razones inherentes a su desarrollo morfológico, composición y estructura de sus cubiertas, la existencia de mecanismos fisiológicos inhibitorios, o la combinación de más de uno de estos factores, determinan que el proceso de germinación no ocurra a pesar de que las condiciones físicas del medio (humedad, temperatura e iluminación) sean óptimas para ello (Baskin & Baskin, 2014).
En consecuencia, existe una gran variedad de tratamientos pregerminativos que eliminan mecanismos de dormancia y también aceleran y sincronizan la germinación. Entre los tratamientos pregerminativos más utilizados y efectivos se destacan los de escarificación de cubiertas con ácido sulfúrico y agua hirviendo, así como los de escarificación mecánica total o parcial de las cubiertas seminales o del fruto. Otros que se emplean con éxito son los choques térmicos, alternancia de temperaturas y soluciones con fitohormonas (fundamentalmente con ácido giberélico) (Sánchez, Pernús, Torres, Barrios & Dupuig, 2019).
Lo anterior tiene que ver con la obtención de plántulas, lo que aseguraría el buen desarrollo de las plantaciones forestales debido a que está muy ligado a la calidad morfológica y fisiológica de las plántulas, la cual depende, a su vez, del modo en que estas son cultivadas en el vivero. En consecuencia, una de las prácticas en vivero que más incidencia tiene sobre las características funcionales de la planta y su posterior desarrollo en campo es la fertilización (Oliet-Palá, Planelles-González, López-Árias & Artero-Caballero, 1997).). Considerando sus efectos sobre el crecimiento, capacidad de regeneración de raíces, distribución de la biomasa, superficie y estructura foliar, tasa fotosintética o movilización de nutrientes desde los tejidos más viejos hacia los que están creciendo (Colombo, Glerum & Webb, 2003). Esta fertilización comúnmente se realiza con macronutrientes N, P, K (Nitrógeno, Fósforo y Potasio); ya que se ha reportado que el contenido de clorofila a, clorofila b y carotenoides aumenta en plantas fertilizadas con N, P y K, contribuyendo a un incremento en la tasa fotosintética (Kopsell, Kopsell, Lefsrud, Curran-Celentano & Dukach, 2004).
Sin embargo, para la especie P. piscipula no existe información sobre el crecimiento bajo manejo controlado de esta especie en su fase inicial (plántula), constituyendo un vacío de conocimientos aplicables a su manejo forestal; por tanto, el objetivo del presente trabajo fue aportar a la comprensión de los efectos de distintos tratamientos de escarificación y fertilización sobre la emergencia y crecimiento de plántulas de P. piscipula en condiciones de vivero.
Materiales y métodos
Área de estudio
El trabajo se realizó en el vivero forestal del área experimental del Instituto Tecnológico de Chiná, ubicado en el estado de Campeche, México, a cinco kilómetros de la capital (19° 45’ 37” N; 90° 29’ 46”), con una altitud sobre el nivel del mar de 20 m. El clima predominante es cálido subhúmedo con lluvias en verano de junio a octubre, con una temperatura anual promedio de 26 ºC y una precipitación que varía entre 1100 mm y 2000 mm (García, 2004).
Escarificación de semillas
Para la propagación de esta especie se recolectaron frutos en el mes de mayo de 2016, en árboles maduros y sanos, ubicados en la comunidad de Chiná, Campeche, México (19° 46’ 11.14’’ N; 90° 30’ 18.46’’O); la muestra botánica de esta especie se encuentra en el herbario de la Universidad Autónoma de Campeche. Posteriormente, se separaron de manera manual las cubiertas aladas del fruto para la obtención de las semillas. Del total de semillas obtenidas se tomó una muestra de 100 semillas para caracterizarlas tomando los datos del peso, largo y ancho de cada una. Por otro lado, se tomaron 200 semillas por tratamiento, considerando 50 semillas por repetición -cuatro repeticiones por tratamiento, las cuales se consideran para cumplir con los requerimientos estadísticos al momento del análisis de datos que brinde la validez requerida-, a las cuales se les aplicó diferentes tratamientos de escarificación (Tabla 1). Las semillas se sembraron directamente, sin una prueba de viabilidad, considerando que estas eran de recién cosecha, ya que se recolectaron en mayo y se sembraron en julio de 2016. Para esto se utilizaron tubetes de 20 cm de largo por 5 cm de diámetro, utilizando como sustrato una mezcla de tierra de suelo (40%) conocido como K´anK´ab (Bautista & Zinck, 2010) (en la clasificación Maya) o Luvisol (en la FAO-UNESCO), Peat Moss (20%), vermiculita (20%) y Agrolita (20%). Posterior a la siembra, se contabilizaron diariamente el número de plántulas que emergieron, tomando como día 1 el momento de la siembra hasta un total de 20 días, para obtener al final el total de plántulas para cada tratamiento.
Tabla 1 Tratamientos de escarificación aplicados a semillas de Piscidia piscipula.
| Tratamientos | Repeticiones | Semillas/Repetición | Semillas/Tratamiento |
| T1-. Sumergidas en ácido clorhídrico en una concentración de 0.5 mol durante 10 min. | 4 | 50 | 200 |
| T2-. Sumergidas en ácido clorhídrico en una concentración de 1 mol durante 10 min. | 4 | 50 | 200 |
| T3-. Sumergidas en agua a 100 °C durante 3 min. | 4 | 50 | 200 |
| T4-. Testigo. | 4 | 50 | 200 |
Fuente: Elaboración propia.
Tratamientos de fertilización
Una vez que se contabilizaron las plántulas que lograron emerger, estas fueron combinadas al azar y tomadas aleatoriamente para aplicarles tres tratamientos de fertilización, uniformando el conjunto de unidades experimentales para tener cuatro repeticiones por tratamiento, cuando las plántulas tenían 30 días de vida y ya contaban con hojas fotosintéticamente activas. En estas plántulas, fertilizadas diferencialmente, se midieron la altura y el diámetro de cada individuo una vez por semana para identificar el efecto de las opciones de fertilización sobre estas variables hasta alcanzar los 84 días a partir de la siembra.
Ambos experimentos, considerados independientes, se establecieron bajo el arreglo unifactorial del diseño experimental completamente al azar, considerando que las condiciones ambientales eran iguales, donde la temperatura promedio fue de 26.6 °C ± 3.7 °C, con mínimas de 20.6 °C y máximas de 40.8 °C; y la humedad relativa promedio de 87.8 ± 13.4 % con mínima de 45 % y máxima de 100 % con malla sombra del 50% y riegos homogéneos.
Análisis de datos
Los datos se analizaron utilizando el método estadístico no paramétrico de Kruskal Wallis, considerando que los datos no presentaron una distribución normal. Se comparó el número de plántulas que se obtuvo entre tratamientos de escarificación y el diámetro y la altura de las plántulas entre tratamiento de fertilización, utilizando el programa estadístico INFOSTAT.
Resultados
Caracterización morfométrica de las semillas
Los resultados de las mediciones del peso, largo y ancho de una muestra de 100 semillas mostraron que se pueden obtener hasta 59.524 semillas en un kilogramo de estas. El peso promedio por semilla fue de 0.02 g ± 0.0036 g, mientras que el tamaño de las semillas presentó un promedio de 4.68 mm ± 0.34 mm y 2.55 mm ± 0.21 mm de largo y ancho, respectivamente (Tabla 2).
Tabla 2 Estadísticas descriptivas de las características físicas de las semillas de Piscidia piscipula.
| Variable | N | Media | D. E. | Mínimo | Máximo |
| Peso (g) | 100 | 0.02 | 0.0036 | 0.01 | 0.03 |
| Largo (mm) | 100 | 4.68 | 0.34 | 3.39 | 5.51 |
| Ancho (mm) | 100 | 2.55 | 0.21 | 1.87 | 3.37 |
N = total de semillas medidas; D.E. = desviación estándar.
Fuente: Elaboración propia.
Escarificación de semillas
La inmersión de semillas en agua a 100 °C durante tres minutos (T3) aceleró la emergencia de plántulas y, además, fue el tratamiento con el mayor registro de plántulas emergidas con 110 de 200 (55%), seguido de los tratamientos en donde se sumergieron las semillas en ácido clorhídrico (T1 y T2), con 85 y 81 plántulas respectivamente; el testigo (T4) fue el que presentó el menor número de plántulas emergidas con 66, que representan el 33% del total de las semillas tratadas (Figura 1). Sin embargo, el análisis estadístico no mostró diferencias entre los tratamientos evaluados, aunque en las gráficas podemos notar diferencias numéricas; el T3 presentó el mejor resultado en este experimento, por lo cual podría recomendarse para aumentar la producción de plántulas (Figura 2).

Fuente: Elaboración propia.
Figura 1 Comportamiento de la emergencia de plántulas de Piscidia piscipula bajo diferentes tratamientos de escarificación. T1: ácido clorhídrico a una concentración de 0.5 mol durante 10 min; T2: ácido clorhídrico a una concentración de 1 mol durante 10 min; T3: agua a 100 °C durante 3 min; T4: Testigo que consistió en semilla sin tratar.

Fuente: Elaboración propia.Tratamientos de fertilización
Figura 2 Porcentaje y promedio de la emergencia de plántulas de Piscidia piscipula bajo diferentes tratamientos de escarificación. T1: ácido clorhídrico a una concentración de 0.5 mol durante 10 min; T2: ácido clorhídrico a una concentración de 1 mol durante 10 min; T3: agua a 100 °C durante 3 min; T4: Testigo que consistió en semilla sin tratar.
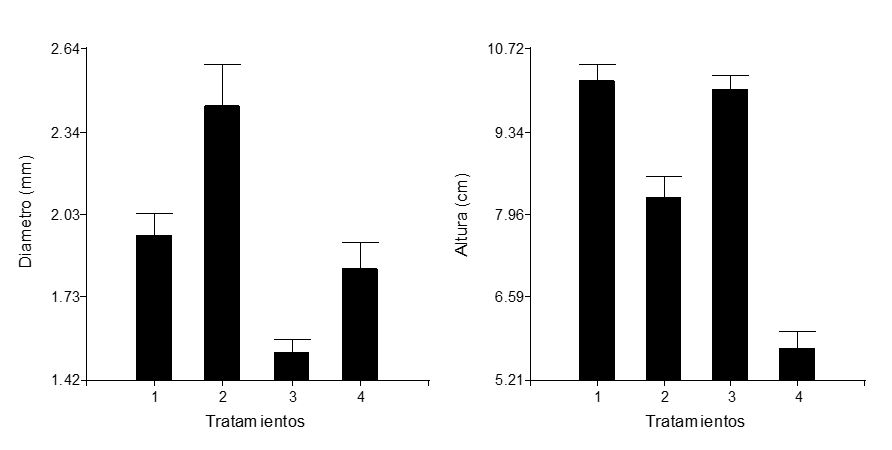
La fertilización de las plántulas en vivero mostró diferencias estadísticas entre tratamientos y testigo en el incremento de la altura (p < 0.0001) y el diámetro de tallo (p < 0.0001). En el caso de la altura, el tratamiento que presentó el mayor promedio al final de las mediciones (10.18 cm ± 2.5 cm) fue T1 (2 g de 17-17-17); sin embargo, no presentó diferencias estadísticas con el T3 (2 g de 18-46-00) (10.04 cm ± 2.3 cm), mientras que el tratamiento que presentó el menor valor fue el testigo (5.74 cm ± 2.2 cm). Con respecto al diámetro, el mayor promedio (2.43 mm ± 0.58 mm) se obtuvo en el tratamiento con 2 g de 46-00-00, siendo el testigo el que mostró el menor diámetro (1.83 mm ± 0.78 mm) (Figura 3 y Tabla 3).
Fuente: Elaboración propia.
Figura 3 Altura y diámetro de plántulas de Piscidia piscipula con 84 días desde la siembra de las semillas, con diferentes tratamientos de fertilización en vivero. T1: 2 g de NPK:17-17-17; T2: 2 g de urea (NPK:46-00-00); T3: 2 g de NPK:18-46-00; T4: Testigo.
Tabla 3 Análisis de Kruskal Wallis para las variables de diámetro y altura de plántulas de Piscidia piscipula (edad: 84 días desde la siembra de las semillas) tratados con diferentes fertilizantes. T1: 2 g de NPK17-17-17; T2: 2 g de NPK46-00-00; T3: 2 g de NPK18-46-00; T4: Testigo.
| Variable | Tratamientos | N | Medias | D.E. | Medianas | H | p |
| Altura (cm) | 1 | 76 | 10.18 a | 2.5 | 10.3 | 125 | < 0.0001 |
| Altura (cm) | 2 | 14 | 8.24 b | 1.3 | 8.25 | ||
| Altura (cm) | 3 | 95 | 10.04 a | 2.3 | 10.2 | ||
| Altura (cm) | 4 | 66 | 5.74 c | 2.2 | 6.25 | ||
| Variable | Tratamientos | N | Medias | D.E. | Medianas | H | p |
| Diámetro (mm) | 1 | 76 | 1.96 b | 0.69 | 1.98 | 38.1 | <0.0001 |
| Diámetro (mm) | 2 | 14 | 2.43 a | 0.58 | 2.21 | ||
| Diámetro (mm) | 3 | 95 | 1.53 c | 0.47 | 1.53 | ||
| Diámetro (mm) | 4 | 66 | 1.83 b | 0.78 | 1.98 |
Nota. Medias con una letra común no son significativamente diferentes (p > 0.05). Fuente: Elaboración propia.
Discusión
La emergencia de plántulas fue mayor en el tratamiento donde se colocaron las semillas en agua a 100 °C durante tres minutos; sin embargo, no se encontraron diferencias estadísticas con los otros tratamientos de escarificación. Aun así, en un trabajo con especies leguminosas donde se aplicaron como tratamientos agua caliente (62 °C- 67 °C) por dos minutos, agua caliente por 10 minutos, ácido sulfúrico concentrado por dos minutos y ácido sulfúrico por 10 minutos, existieron diferencias significativas entre tratamientos, dada esta diferencia por el mayor peso estadístico del testigo y menor por los tratamientos. Lo anterior deja claro que la escarificación aumenta el porcentaje de germinación, ambos tratamientos (agua caliente y ácido sulfúrico) pueden participar en el ablandamiento mecánico de la testa, permitiendo que el agua penetre o, bien, favoreciendo un incremento en la temperatura de las semillas que pueda romper la latencia (Acuña & Garwood, 1987).
A pesar de resultados obtenidos en trabajos de investigación sobre escarificación en especies de la familia de las Fabáceas, existe la necesidad de realizar nuevas pruebas para verificar la consistencia de estos resultados. Por otro lado, se ha encontrado que el uso de sombra en vivero, como se manejó en este experimento, es un factor que disminuye el tiempo a la emergencia de las plántulas de esta especie (Dzib-Castillo, van der Wal, Chanatásig-Vaca, Macario & Pat, 2012), lo cual puede ser una opción viable para la obtención de plántulas en P. piscipula bajo condiciones de vivero en la región donde se realizó este estudio.
No se encontraron trabajos de investigación rigurosos y publicados en los que presenten resultados confiables sobre el crecimiento de P. piscipula, aunque esta es una especie con potencial para la producción de madera en su área de distribución natural. Esto indica que la generación de información sobre esta especie es requerida, como fundamento técnico y científico para establecer, con mayor posibilidad de éxito, plantaciones comerciales en Campeche y otras zonas del sureste de México.
En el crecimiento de las plántulas en vivero de P. piscipula se observaron diferencias significativas debidas al efecto de los fertilizantes. Por un lado, la fertilización con dos gramos de 17-17-17 o dos gramos de 18-46-00 presentaron mayor efecto en el incremento de la altura de las plántulas de P. piscipula. Por otro lado, la fórmula 46-00-00 presentó el mayor incremento en el diámetro del tallo, tomando en cuenta que las plántulas tenían una edad de 84 días, fertilizadas a los 30 días después de la emergencia en condiciones de vivero. Estos resultados pueden servir como guía para preparar un esquema de fertilización para plántulas de P. piscipula en vivero, con lo cual se podrían lograr plántulas con diámetros del tallo mayores a un centímetro y alturas entre 30 cm y 40 cm, ya que es lo recomendado para plántulas en proyectos de reforestación o plantaciones comerciales.
Conclusiones
Aunque estadísticamente no se hayan obtenido diferencias respecto a los tratamientos de escarificación de las semillas, la mayor efectividad en acelerar la emergencia y obtener la mayor cantidad de plántulas fue en la inmersión de las semillas en agua a 100 °C durante tres minutos. Este resultado es útil para la reproducción de esta especie, ya que es barata y accesible para los productores. En el caso de la fertilización, se observó que la altura y el diámetro incrementaron significativamente bajo los efectos diferenciados de las fórmulas de NPK. En la altura se observó que las fórmulas 17-17-17 y 18-46-00 fueron los que presentaron los mejores resultados, mientras que para el diámetro la fórmula 46-00-00 presentó el mejor resultado, por lo cual se puede recomendar el uso de estos fertilizantes en mezcla u otros esquemas de combinación para mejorar el crecimiento de las plántulas de P. piscipula en vivero. No obstante, es necesario realizar más experimentos para corroborar estos resultados así como para probar otras fórmulas de NPK.











 nueva página del texto (beta)
nueva página del texto (beta)


