Introducción
El girasol (Helianthus annuus L.) es la cuarta oleaginosa más importante a nivel mundial por su volumen de producción anual, seguida de la soya, la canola y el cacahuate. Además, el girasol destaca por sus características agronómicas, su tolerancia a factores adversos, como sequía y heladas, así como por el alto contenido de aceite en la almendra. Asimismo, su calidad se conforma por el contenido de ácidos grasos como oleico (omega 9) y linoleico (omega 6), los cuales tienen una influencia directa en el metabolismo del colesterol. Aunado a esto, contiene un alto contenido de proteína en la pasta residual que va del 25% al 35% (Dagustu, 2018). México importa el 95% de la demanda a pesar de que la producción de oleaginosas se ha incrementado en la última década; en 2016 solo cubrió un bajo porcentaje de los requerimientos para la producción de aceite de canola (3.67%), de girasol (7.49%), de soya (16.93%) y de cártamo (50.5%), representando el 0.62% del producto interno bruto (PIB) nacional. Sin embargo, México ocupa el séptimo lugar en extracción de aceite y cuenta con aproximadamente 50 plantas para la extracción y refinación de este producto (Secretaría de Agricultura y Desarrollo Rural [Sagarpa], 2017).
En el mejoramiento genético del girasol, las especies silvestres son una fuente significativa para la incorporación de genes de rusticidad, adaptación a condiciones adversas (factores abióticos), resistencia a insectos plaga y fitopatógenos, los cuales se pueden transferir mediante cruzamiento a variedades cultivadas y con retrocruzas (BC, por sus siglas en inglés) hacia cultivado. Además, las especies silvestres ayudan a recuperar los caracteres favorables de la variedad cultivada que están involucrados con los componentes del rendimiento, tales como peso de aquenio y contenido y calidad de aceite (Seiler, Qi & Marek, 2017). Así mismo, Robles (1986) consigna que, dentro del mejoramiento genético de girasol, es importante la incorporación de genes silvestres como fuente de resistencia a la principal plaga, la palomilla del girasol (Homeosoma ellectellum). Adicionalmente, en el proceso de autofecundación para la formación de híbridos, la obtención de líneas avanzadas (S5 o S6) está limitada por factores genéticos como la autoincompatibilidad, el cual es un factor limitante para la obtención de líneas con alto grado de endogamia debido a que, conforme esta avanza, la probabilidad de encuentro de genes incompatibles se incrementa de manera significativa, lo que reduce la obtención de semilla viable en el capítulo. Esto último propicia que los híbridos se obtengan de cruzas simples utilizando líneas tempranas (S2 o S3) (Robles, 1986).
El cultivo de anteras y microsporas para la obtención de plantas haploides reduce significativamente el tiempo requerido para el mejoramiento de variedades, proveyendo haploides y dobles haploides en un corto tiempo (Dagustu, 2018). Las bases para la obtención de haploides se fundamentan en establecer las microsporas (granos de polen) en un medio de cultivo apropiado para inducir a la formación de células vegetativas, cambiando el patrón sexual normal (gametofito) a un patrón vegetativo (esporofito) y que, en lugar de tener polen con capacidad para producir gametos y un tubo polínico, la microspora sea capaz de producir preembriones o callos haploides (androgénesis); por el contrario, si es la célula huevo la que está contenida dentro del saco embriogénico, se le denomina ginogénesis (Todorova, Dahlhoff & Friedt, 1993).
Germanà (2011) señala que los haploides dentro de los programas de mejoramiento genético se basan en duplicar el genoma mediante el uso de colchicina, obteniendo una planta homocigótica, la cual se reproduce mediante autofecundación, lo que representa una endogamia profunda y rápida, evitando así la autofecundación forzada. Además, dentro de las ventajas que tiene la obtención de haploides están: 1) el acortamiento de las generaciones requeridas para el desarrollo de nuevas variedades; 2) que se pueden fijar caracteres agronómicos deseables de genes recesivos; y 3) que en la haploidía se favorece la inducción de mutantes. Por otra parte, Dodds & Roberts (1982) reportan que el estado de desarrollo de las anteras y del polen al momento de la siembra es un factor muy importante para la producción de callo, por lo que la mejor respuesta se tiene cuando las anteras se encuentran en estado medio o tardío (uninucleado), esto incrementa el porcentaje de inducción. De igual modo, Augé et al. (1986) reportan que, en el desarrollo, el cual abarca desde las células iniciales hasta las microsporas uninucleadas, solo estas últimas tienen la capacidad de producir callo, debido a que se facilitan las divisiones embriogénicas, callogénicas y organogénicas.
El objetivo de la presente investigación fue establecer un protocolo para la obtención de callo haploide de girasol (Helianthus annuus L.) a partir del cultivo de anteras in vitro en germoplasma segregante BC3 y determinar el estado de ploidía de los callos mediante observaciones citológicas.
Materiales y métodos
Material biológico
Se utilizaron anteras de girasol en estado mono nucleado procedentes de un germoplasma segregante BC3 proveniente de la cruza de girasol cultivado (Helianthus annuus L.), variedad Peredovik por girasol silvestre (Helianthus annuus L.). A partir de la F1 se hicieron tres retrocruzas hacia el progenitor cultivado para recuperar los caracteres favorables. En la F1 y en las dos primeras retrocruzas, todas las plantas presentaron ramificación, siendo hasta la tercera retrocruza (BC3) cuando aparecieron las primeras plantas con un solo capítulo que corresponde al carácter cultivado. Se seleccionaron plantas de un solo capítulo y aquenio negro (presencia de fitomelanina) como indicador de la presencia de genes silvestres. Se sembró en un lote de polinización libre y se hicieron tres ciclos de selección masal modificada, dando origen a la variedad TECMON-2. El germoplasma se cultivó en los ciclos de primavera-verano (P-V) y otoño-invierno (O-I) en el Campo Agrícola Experimental del Centro Universitario de Ciencias Biológicas y Agropecuarias de la Universidad de Guadalajara, y el cultivo in vitro se llevó a cabo en el laboratorio de cultivo de tejidos vegetales del Departamento de Botánica y Zoología.
Bioensayos
Reguladores del crecimiento
Se utilizó como fuente de auxina el ácido 2,4-Diclorofenoxiacético (2,4-D) y benciladenina (BA) como fuente de citocinina en concentraciones en μM L-1 (Tabla 1). En el primer bioensayo se consideró un tratamiento testigo y cuatro concentraciones tanto de 2,4-D como de BA en todas sus combinaciones (5 × 5), obteniendo 25 tratamientos (Tabla 1). En el bioensayo II se establecieron cinco concentraciones, descartando el tratamiento testigo del bioensayo I al no inducir callo, empleando combinaciones simples e iniciando con 1.36 μM L-1 y 1.33 μM L-1 de 2,4-D y 0.3 mg L-1 de BA, e incrementándose en forma constante hasta 6.8 μM L-1 y 6.6 μM L-1 de 2,4-D y BA, respectivamente, como se muestra en la Tabla 1.
Tabla 1 Combinación de cinco concentraciones de auxina y citocinina 670 (5 x 5) para el bioensayo I y cinco combinaciones para el bioensayo II en el cultivo in vitro de anteras de girasol (Helianthus annuus L.).
| Bioensayo I | Bioensayo II | ||
| 2,4-D | BA | 2,4-D | BA |
| μM | |||
| 0.0 | 0.0 | 1.36 | 1.33 |
| 2.26 | 2.22 | 2.72 | 2.66 |
| 9.05 | 8.88 | 4.08 | 3.99 |
| 22.62 | 22.19 | 5.44 | 5.32 |
| 45.25 | 44.39 | 6.80 | 6.65 |
Fuente: Elaboración propia.
Preparación del medio de cultivo
Se seleccionó el medio de cultivo MS suplementado con tiamina (1.0 mg L-1), ácido nicotínico (0.5 mg L-1), piridoxina-HCl (0.5 mg L-1), Mio-inositol (25 mg L-1), Fe-EDTA (2.78 mg L-1), Na2-EDTA (3.73 mg L-1), glicina (2.0 mg L-1), 30 g L-1 de sacarosa como fuente de carbono y 10 g L-1 de agar como agente gelificante. Posterior a la adición de las dosis correspondientes de auxina y citosina (Tabla 1), se ajustó el pH a 5.7 ± 0.1. Se agregó el agar, y el medio fundido se transfirió a tubos de ensaye de 25 mm × 120 mm a razón de 10 mL por tubo. El medio se esterilizó en autoclave a una presión de 1.4 kg/cm2 (20 lb/pulg2), a una temperatura de 121 °C durante 15 minutos.
Colecta de anteras en campo
En los dos ciclos se siguió el mismo procedimiento para la obtención de las anteras para el establecimiento de los bioensayos I y II: se seleccionaron capítulos de plantas sanas cuando aparecieron los botones florales previos a su apertura y se cubrieron con bolsas de papel para evitar la incidencia de insectos y de polen de otras plantas. Durante el periodo de antesis en cada siembra (P-V y O-I) en las primeras horas de la mañana (7 AM), se hizo la colecta de las anteras seleccionando aquellas que estaban compactas y previo a la dehiscencia. Se separaron con pinzas, extrayéndolas de la parte inferior y se colocaron en cajas de Petri con papel secante humedecido para evitar la deshidratación y la dehiscencia. Las cajas de Petri se esterilizaron en autoclave a una presión de 1.4 kg/cm2, a una temperatura de 121 °C por 15 minutos. Las cajas de Petri con las anteras se llevaron al laboratorio para su desinfestación y siembra en el medio de cultivo.
Desinfestación de las anteras
En la cámara de flujo laminar (VECO, U.S.A.), bajo condiciones de asepsia, se procedió al tratamiento de desinfestación. Las anteras se colocaron en alcohol etílico al 70% por un minuto y luego se sumergieron en solución de hipoclorito de sodio al 6% diluido en agua destilada esterilizada en volumen (1/1) durante seis minutos y, posteriormente, se aplicó triple enjuague con agua destilada esterilizada. Se colocaron en cajas de Petri que fueron previamente esterilizadas en autoclave por 15 minutos a una presión de 1.4 kg/cm2, a una temperatura de 121 °C. En el bioensayo II se siguió el mismo procedimiento en la selección y desinfestación de las anteras.
Siembra de las anteras
Bioensayo I. La siembra se realizó colocando una antera en cada tubo de ensaye de manera invertida, con el polen haciendo contacto con el medio de cultivo. La unidad experimental consistió en dos anteras por concentración, obteniendo 12 tubos por tratamiento, con 25 tratamientos de la combinación de cinco niveles de 2,4-D y BA, dando un total de 300 en el experimento (ver diseño experimental y Tabla 1). Los tubos se sellaron, se rotularon y se transfirieron a la cámara de incubación a una temperatura de 27 °C ± 1 °C. De cada tratamiento (12 tubos), seis se mantuvieron en oscuridad y seis con un fotoperiodo de 16 horas de luz y ocho horas de oscuridad.
Mantenimiento de callo
Los primeros callos que se obtuvieron en el bioensayo I se seccionaron en tres partes. La primera se trasplantó en medio MS con una concentración de 2.3 μM de 2,4-D y 2.2 μM de BA, que correspondió a la concentración donde se presentó la inducción de callo a los 25 días. La segunda se sembró en un medio en el que se mantuvo la concentración de 2,4-D en 2.3 μM, y se incrementó la concentración de BA a 44.4 μM con el objeto de inducir brotes adventicios. La tercera se destinó para hacer las inclusiones en parafina y obtener cortes finos de 10 micras, teñidos con safranina-verde fijo para observar la anatomía del callo mediante una secuencia de cortes.
Bioensayo II. Tomando en cuenta que las concentraciones de 2,4-D y BA que se utilizaron para el segundo bioensayo se basaron en la dosis del primer bioensayo en el que se presentó la inducción de callo a los 25 días posteriores a la siembra de las anteras, se consideró iniciar con una concentración de 1.36 μM de 2,4-D (0.3 mg L-1) y 1.33 μM de BA (0.3 mg L-1), incrementando en 1.36 μM y 1.33 μM (0.3 mg L-1) de 2,4-D y BA, respectivamente, hasta la concentración de 6.80 μM de 2,4-D (1.5 mg L-1) y 6.65 μM de BA (1.5 mg L-1) (Tabla 1). La unidad experimental constó de dos anteras por concentración, obteniendo 10 tubos por tratamiento y un total de 50 en el experimento (ver diseño experimental y Tabla 1). La selección de las anteras en campo, el proceso de preparación y desinfestación en laboratorio, así como la preparación del medio de cultivo, la adición de las hormonas (auxina y citocinina) y el proceso de esterilización, se llevó a cabo siguiendo la metodología del bioensayo I. Se descartó el uso de tratamientos de oscuridad al no manifestar diferencias con los tratamientos con luz, y se mantuvieron las condiciones de incubación (temperatura y fotoperiodo).
Observaciones citológicas
Preparación de las muestras
Los cortes se fijaron en Farmer por 24 horas (Baker, 1950; Roth, 1964). Posteriormente, se lavó el tejido con alcohol etílico al 50%, y las muestras se colocaron en recipientes permeables en los que permanecieron fijas, se encapsularon y se introdujeron a un cambiador automático de tejidos con 12 concentraciones de alcoholes y xileno. Por último, se introdujeron en parafina donde permanecieron por 24 horas.
Los tejidos se colocaron en recipientes de aluminio delgado, bañándolos con parafina líquida (60 °C), se dejaron enfriar, y las muestras se cortaron en pequeños cuadros para luego colocarlos en soportes de madera para realizar los cortes en el micrótomo. Previo a los cortes, se hicieron observaciones al microscopio para orientarlos en el mejor sentido. Se hicieron cortes cada 10 μm, obteniendo un corte secuenciado. La tira de cortes se colocó de manera ordenada en los portaobjetos, agregando goma para que se adhiriera al tejido; además, se agregó aldehído y se calentó ligeramente para que se extendiera uniformemente en el tejido. Se quitó el exceso y se dejaron secar por 24 horas.
Para el desparafinado se pasaron los portaobjetos por tres concentraciones de xilol, alcohol absoluto y alcohol etílico al 96%, 70% y 50%, manteniéndolos en cada concentración por tres minutos. Para colorear el tejido, se sumergieron los portaobjetos en safranina por una hora, a una temperatura de 28 °C, y se transfirieron a concentraciones de 50%, 70%, 96% y 100% de alcohol etílico. Se agregaron unas gotas de verde fijo por tres minutos, moviendo los portaobjetos para asegurar que penetrara bien en los tejidos y, finalmente, se pasó por isopropil y xileno durante 10 segundos. En cada paso se adicionó una gota de resina en cada preparación y estas se colocaron en el cubreobjetos y se dejó secar por 48 horas. Se realizaron observaciones anatómicas en los tejidos, y se llevó a cabo un conteo cromosómico en los cortes secuenciados.
Análisis estadístico y variables evaluadas
Diseño experimental
Para el bioensayo I se diseñó un experimento simple con 25 tratamientos de la combinación de cinco concentraciones de auxina (2,4-D) y cinco de citocinina (BA), con una distribución completamente al azar y seis repeticiones, como se presenta en la Tabla 1 (Reyes, 1978). En el diseño experimental del bioensayo II se eliminó el tratamiento testigo y se montó en base al mejor tratamiento del bioensayo I, tanto en días a inducción como en desarrollo de callo (peso fresco), partiendo de una concentración menor e incrementándose en intervalos constantes (1.36 μM de 2,4-D y 1.33 μM de BA), obteniendo cinco tratamientos con cinco repeticiones y una distribución completamente al azar, como se presenta en la Tabla 1. Los resultados se procesaron por análisis de varianza (prueba de f < 5%) utilizando el paquete estadístico MINITAB 14, y la diferencia entre tratamientos se comparó mediante la prueba de Tukey.
Variables evaluadas
Inducción de callo. Se registraron los días en que apareció la iniciación de callo en los tratamientos que respondieron positivamente en los dos bioensayos.
Desarrollo de callo. Se registró el peso fresco de callo (mg) a los 14 y 21 días posteriores a la inducción en cada tratamiento en los dos bioensayos.
Observaciones citológicas. Se hicieron cortes en los callos del bioensayo I. Se fijaron los callos en parafina, se hicieron observaciones al microscopio a 100X, 400X y 1000X en cortes finos secuenciales de 10 μ; además, se hizo un conteo cromosómico.
Resultados
Bioensayo I
Inducción de callo
De los 25 tratamientos establecidos (Tabla 1), en 22 (73%) no hubo respuesta de las anteras a la inducción de callo debido a que el medio de cultivo adquirió una coloración café oscuro que representó un indicio de oxidación, y las anteras perdieron su turgencia, manteniendo su color gris oscuro o negro, característica de la presencia de genes silvestres (fitomelanina). El 15% se contaminaron por hongos y bacterias que no se eliminaron en el tratamiento de desinfestación previo a la siembra de las anteras, mientras que solo en tres tratamientos (12%) hubo respuesta a la inducción y desarrollo de callo, por lo que, en lugar de tener 25 tratamientos, el análisis de varianza y la prueba de Tukey se realizaron considerando solo seis tratamientos (tres en oscuridad y tres con luz) con seis repeticiones. Las respuestas de las tres concentraciones a la inducción se asignaron como A, B y C, y los subíndices L y O se utilizaron para identificar cuando estuvieron con luz o en oscuridad durante el periodo de incubación. Los resultados se presentan en la Tabla 2.
Tabla 2 Días a inducción de callo y valores promedio de peso de callo en el cultivo in vitro de anteras de girasol (Helianthus annuus L.), bioensayo I.
| Concentración | Incubación | Días a inducción |
Peso (mg) 14 DPIC** |
Peso (mg) 21 DPIC** |
Peso*** % | ||
| 2,4-D μM | BA μM | ||||||
| AL | 2.3 | 2.2 | Luz | *25 a | 215 a | 248 a | 28.6 |
| AO | 2.3 | 2.2 | Oscuridad | 25 a | 188 b | 218 b | 25.1 |
| BL | 22.6 | 2.2 | Luz | 35 b | 112 c | 121 c | 13.9 |
| BO | 22.6 | 2.2 | Oscuridad | 35 b | 90 d | 97 d | 11.2 |
| CL | 45.2 | 22.2 | Luz | 40 c | 94 d | 101 d | 11.6 |
| CO | 45.2 | 22.2 | Oscuridad | 40 c | 75 e | 82 e | 9.5 |
*Tratamientos con la misma letra no difieren estadísticamente; Tukey (p > 5%)
**Días de cultivo posteriores a la inducción de callo
***Proporción de callo obtenido en relación con el total de los seis tratamientos
Fuente: Elaboración propia.
La inducción de callo se presentó a los 25 días después de la siembra en el tratamiento A (2.3 μM de 2,4-D y 2.2 μM de BA), 35 días en el B (22.6 μM 2,4-D y 2.2 μM de BA) y 40 días en el C (45.2 μM de 2,4-D y 22.2 μM de BA). El tratamiento testigo no presentó inducción de callo, lo que demuestra que se requiere de la adición de una fuente de auxina en combinación con una citocinina para que esta se presente.
Desarrollo de callo haploide
Se evaluó el desarrollo de callo a los 14 y 21 días posteriores a la inducción de cada tratamiento. El análisis de varianza mostró diferencia altamente significativa (p < 1%) entre las concentraciones en las dos mediciones que se hicieron, como se presenta en la Tabla 2. Al comparar los promedios (Tukey p < 5%), se obtuvo que el peso fresco de callo fue significativamente mayor en la concentración del tratamiento A (2.3 μM de 2,4-D y 2.2 μM de BA), donde la inducción se presentó a los 25 días, en comparación a los tratamientos B (22.6 μM de 2,4-D y 2.2 μM de BA) y C (45.2 μM de 2,4-D y 22.2 μM de BA), donde la inducción se presentó a los 35 y 40 días, respectivamente. Por lo tanto, hay una relación entre los días a inducción (Tabla 2) y el peso fresco de callo una vez que esta se ha presentado (Figura 1).
Multiplicación de callo
Los callos se seccionaron y se trasplantaron a los 47 días de cultivo utilizando el medio MS con dos concentraciones de hormonas: la primera con 2.26 μM de 2,4-D y 2.22 μM de BA para su multiplicación, mientras que en la segunda se mantuvo la concentración de 2,4-D en 2.26 μM y se incrementó la concentración de BA a 44.4 μM para propiciar la inducción de brotes y la diferenciación de plántulas, la cual no se obtuvo. Chaturvedi, Razdan & Bhojwani (2003), trabajando con anteras de neem (Azadirachta indica A. Juss.), reportan que la interacción entre 2,4-D y kinetina (Kin) demostró ser eficiente para la multiplicación de callo en medio MS suplementado con 1 μM de 2,4-D y 10 μM de Kin, obteniendo que el 95% mostró una proliferación sostenida y masiva de callos, dado que el origen del callo a menudo afecta la frecuencia de regeneración.
Bioensayo II
Inducción y desarrollo de callo
De los 50 tubos sembrados, el 46% se contaminó, por lo que el análisis de varianza se hizo con repeticiones incompletas, como lo sugiere Reyes (1978), ya que en todas las concentraciones hubo pérdida de unidades experimentales. En las cinco concentraciones hubo respuesta a la inducción y desarrollo de callo, obteniendo los valores promedio como se muestra en la Tabla 3.
Tabla 3 Días a inducción de callo y valores promedio de peso de callo en el cultivo in vitro de anteras de girasol (Helianthus annuus L.), bioensayo II.
| Concentración | Días a inducción |
Peso (mg) 14 DI* |
Peso (mg) 21 DI* |
Peso*** | |
| 2,4-D μM | BA μM | % | |||
| 1.36 | 1.33 | 20 a | 122 c | 148 c | 11.7 |
| 2.72 | 2.66 | 21 a | 180 b | 232 b | 18.29 |
| 4.10 | 3.99 | 20 a | 282 a | 360 a | 28.39 |
| 5.44 | 5.32 | 20 a | 286 a | 378 a | 29.81 |
| 6.80 | 6.65 | 23 a | 126 c | 150 c | 11.82 |
*Tratamientos con la misma letra no difieren estadísticamente; Tukey (p > 5%)
**Días de cultivo posteriores a la inducción de callo
*** Proporción de callo obtenido en relación con el total de los seis tratamientos
Fuente: Elaboración propia.
Discusión
Bioensayo I
Inducción de callo
El análisis de varianza mostró diferencia significativa al 1% de probabilidad en los días a inducción de callo. Al comparar los promedios, la prueba de Tukey mostró diferencia significativa (p < 5%) entre las concentraciones, por lo que la respuesta a la inducción se retrasó conforme la concentración de auxina se incrementó (Tabla 2), tomando en cuenta que en los tratamientos A y B hubo una diferencia de 10 días y de 15 días con el tratamiento C (Figura 1a). Alam, Haque, Hossain, Sarker & Afroz (2009) obtuvieron la inducción de callo de los 26 a los 29 días después de la siembra cultivando anteras in vitro de cinco variedades de Brassica en medio MS con 1 mg L-1, 2 mg L-1 y 4 mg L-1 de 2,4-D y 1 mg L-1 de benzil amino purina.
Por otra parte, hay dos factores que intervinieron en la respuesta a la inducción de callo. El primero está relacionado con la concentración de la auxina y la citocinina, ya que a medida que estas se incrementaron, la respuesta se retrasó de 10 a 15 días. Garkusha et al. (2017) sembraron anteras in vitro de girasol, obteniendo la inducción de callo en concentraciones de 0.5 mg L-1 a 1.0 mg L-1 de 6-BAP y de 0.5 mg L-1 a 1.0 mg L-1 de ácido naftalén acético, disminuyendo cuando se incrementó la dosis a 2 mg L-1 de las dos fitohormonas, por lo que el éxito en el cultivo de anteras y la respuesta a la inducción de callo depende de las diferentes combinaciones de auxina y citocinina así como de las condiciones de incubación. El segundo involucra el estado de la antera, tomando en cuenta que el periodo de antesis en el girasol es helicoidal y se inicia de la parte exterior hacia el centro del capítulo, lo cual permite seleccionar anteras en estado uninucleado.
Así mismo, Mahmood, Binti, Surya, Susanto & Ariffulah (2014) afirman que para la inducción de microsporas para la inducción y formación de callo se deben considerar múltiples factores como el estado de desarrollo de la célula sexual, el medio de cultivo empleado, las condiciones de incubación, el estado fisiológico de la planta donadora, el genotipo y los reguladores del crecimiento. Por otra parte, Pacheco-Sánchez, Lozoya-Saldaña & Colinas-León (2003), al trabajar con anteras de Solanum iopetalum, reportan que la integridad de la antera es importante para la respuesta morfogenética, además de que las capas de las paredes de la antera son un amortiguador fisiológico al almacenar nutrimentos, lo que permite al grano de polen germinar. De igual manera, Seguí-Simarro & Nuez (2007), trabajando en Lycopersicum esculentum, reportan que un factor que afecta seriamente el cultivo de anteras son las condiciones del grano de polen, el cual debe estar en estado uninucleado, por lo que, conforme avanza el inicio de floración, la inducción de callo disminuye, aunado al tiempo de incubación. Además, Dodds & Roberts (1982) confirman que el estado de desarrollo de las anteras y del polen al momento de la siembra es un factor muy importante para la producción de callo, por lo que la mejor respuesta se tiene cuando las anteras se encuentran en estado medio o tardío (uninucleado), lo cual incrementa el porcentaje de inducción.
Por otra parte, el que las anteras hayan estado en presencia de luz u oscuridad durante el periodo de incubación no tuvo un efecto significativo en la inducción de callo debido a que esta se presentó simultáneamente en cada concentración, independiente de la presencia o ausencia de luz en los tratamientos A, B y C (25, 35 y 40 días, respectivamente; Figura 1a). Asimismo, la diferencia estadística ocurrió entre las concentraciones, considerando que todos los tratamientos estuvieron bajo las mismas condiciones de temperatura e incubación durante el periodo de cultivo. Shon, Kim, Acquah & Lee (2004), trabajando en tres genotipos de Bupleurum falcatum en la siembra de anteras in vitro, en oscuridad y en presencia de luz, reportan que la inducción de callo fue de 30% cuando las anteras estuvieron en oscuridad y 3.7% cuando estuvieron en luz, por lo que la respuesta a la inducción de callo a partir del cultivo de anteras varía de una especie a otra sin que haya un patrón definido en la respuesta a la luz u obscuridad.
Desarrollo de callo haploide
Este comportamiento indica que, a dosis bajas de 2,4-D y BA (tratamiento A), hay una mayor respuesta en el crecimiento de callo en comparación a los tratamientos B y C (Tabla 2), por lo que, conforme se incrementa la concentración de auxina y citocinina, el peso fresco de callo disminuye (Figura 1b); ya que considerando el peso fresco de los tres tratamientos, el 53.74% se obtuvo en el tratamiento A, mientras que en los tratamientos B y C el peso fresco correspondió al 25.17% y 21.1%, respectivamente. Resultados similares son reportados por Dayan & Arda (2016), quienes obtuvieron una respuesta positiva en la inducción y crecimiento de callo utilizando una combinación de ANA y BA en dosis de 0.5 mg L-1 a 2.0 mg L-1, obteniendo el mayor desarrollo de callo (mg) en dosis menores a 2.0 mg L-1 de las dos hormonas.
Por otra parte, en los tratamientos donde las anteras estuvieron en oscuridad o en presencia de luz se presentaron dos comportamientos. El primero está relacionado con los días a inducción, ya que no hubo diferencia significativa (p < 5%) en las tres concentraciones, presentándose a los 25, 35 y 40 días bajo las dos condiciones (luz y oscuridad). En cambio, el peso de callo fue significativamente mayor a los 14 y 21 días después de la inducción (Tukey < 5%), cuando las anteras estuvieron con un fotoperiodo de 16 horas de luz y ocho de oscuridad (Tabla 2) en las tres concentraciones. Entre las causas posibles que originaron la diferencia del peso fresco se encuentran la condición de los callos y los días a inducción, ya que en el tratamiento esta se presentó a los 25 días posteriores a la siembra. Los callos tuvieron una consistencia compacta y una coloración cremosa, mientras que en los otros dos tratamientos en que la inducción se presentó a los 35 y 40 días posteriores a la siembra, los callos además de presentar un menor volumen y peso fresco, tuvieron una consistencia traslúcida e hiperhídrica, ocasionada por el agotamiento de los nutrientes del medio de cultivo debido al retraso en la inducción con una diferencia de 10 y 15 días en referencia al tratamiento A (inducción a los 25 días).
Se obtuvo una correlación negativa (-0.95) y significativa al 1% de probabilidad entre los días a inducción y el peso de callo a los 21 días posteriores a la inducción (Figura 2), lo que demuestra que el peso de callo disminuye conforme los días a inducción se incrementan. Así mismo, el coeficiente de determinación indica que el 91.96% de la disminución del peso de callo se debe al incremento en los días a inducción, y el 8% se debe a otros factores, como el medio de cultivo y las condiciones de incubación. Este comportamiento se debe a que, conforme la inducción se retrasa, los nutrientes del medio de cultivo se agotan, y las reacciones químicas entre los nutrientes producen compuestos fenólicos en cuya reacción está involucrada la enzima polifenol oxidasa, la cual oxida a los fenoles, lo que limita la inducción y el desarrollo de los callos (Bidwell, 1979; Street, 1977). Además, el incremento del peso de callo de los 14 a los 21 días de incubación fue 13% mayor en la concentración donde la inducción se presentó a los 25 días, en comparación a las concentraciones donde la inducción se presentó a los 35 y 40 días, un incremento del 7% en el lapso de siete días.

Fuente: Elaboración propia.
Figura 2 Correlación y regresión lineal entre los días a inducción de callo haploide y el peso de callo (mg) a los 21 días de incubación.
En los callos donde se incrementó la concentración de benciladenina (44.4 μM) se obtuvo un mayor desarrollo de callo; sin embargo, no hubo respuesta a la inducción de brotes después de 60 días de incubación, aunque fueron significativamente de mayor tamaño en relación con los callos que se trasplantaron con baja concentración de citocinina (2.2 μM). Además, se observó que los callos presentaron cambios en la coloración de verde amarillento a café rojizo debido al agotamiento de los nutrientes y la oxidación de compuestos fenólicos.
Bioensayo II
Inducción y desarrollo de callo
La inducción de callo se presentó entre los 20 y 23 días posteriores a la siembra de las anteras en las cinco concentraciones; estadísticamente la diferencia no fue significativa (Tabla 3). Resultados similares fueron reportados por Mahmood et al. (2014) en Hibiscus cannabinus, obteniendo que la inducción de callo se presentó después de la segunda semana y hasta la cuarta semana de incubación con una alta frecuencia de callo en medio MS adicionado con 3.0 mg L-1 de ANA y 2 mg L-1 de BAP (16.11 μM y 9.69 μM), por lo que, a bajas dosis de auxina y citocinina, la inducción de callo se presenta entre la segunda y tercera semana de incubación. Por su parte, Vijaya et al. (2003), cultivando anteras en estado uninucleado en tres especies de girasol (Helianthus spp), reportan que las auxinas endógenas disponibles en la antera pueden no ser suficientes para la inducción de callo, teniendo la máxima inducción en el tratamiento que contenían bajas cantidades de ANA y BAP (0.1 mg L-1 y 0.2 mg L-1; 0.54 μM y 0.96 μM), mismas que manifestaron alta inducción de callo para la mayoría de los genotipos evaluados, además requirieron pocos días para la iniciación en comparación a otros tratamientos. Los investigadores, al aumentar las concentraciones de ANA y BAP, no observaron una contribución significativa en la producción de callo.
El peso de callo fresco presentó diferencia significativa (p < 1%) entre tratamientos en las mediciones que se hicieron a los 14 y 21 días posteriores a la inducción, obteniendo el mayor peso en las concentraciones de 4.10 μM y 5.44 μM de 2,4-D con 3.99 μM y 5.32 μM de BA, respectivamente (0.9 mg L-1 y 1.2 mg L-1 de 2,4-D y BA). Estas concentraciones no difirieron estadísticamente, pero tuvieron un comportamiento superior al resto de los tratamientos (Tukey > 5%), como se presenta en la Tabla 3. Además, como se observa en la Figura 3b, el menor peso de callo se presentó en las dosis menor y mayor (1.4 μM y 6.8 μM de 2,4-D con 1.3 μM y 6.7 μM de BA), respectivamente, que corresponden a 0.3 mg L-1 y 1.5 mg L-1 de 2,4-D y BA, sin que haya diferencia estadística entre estas.
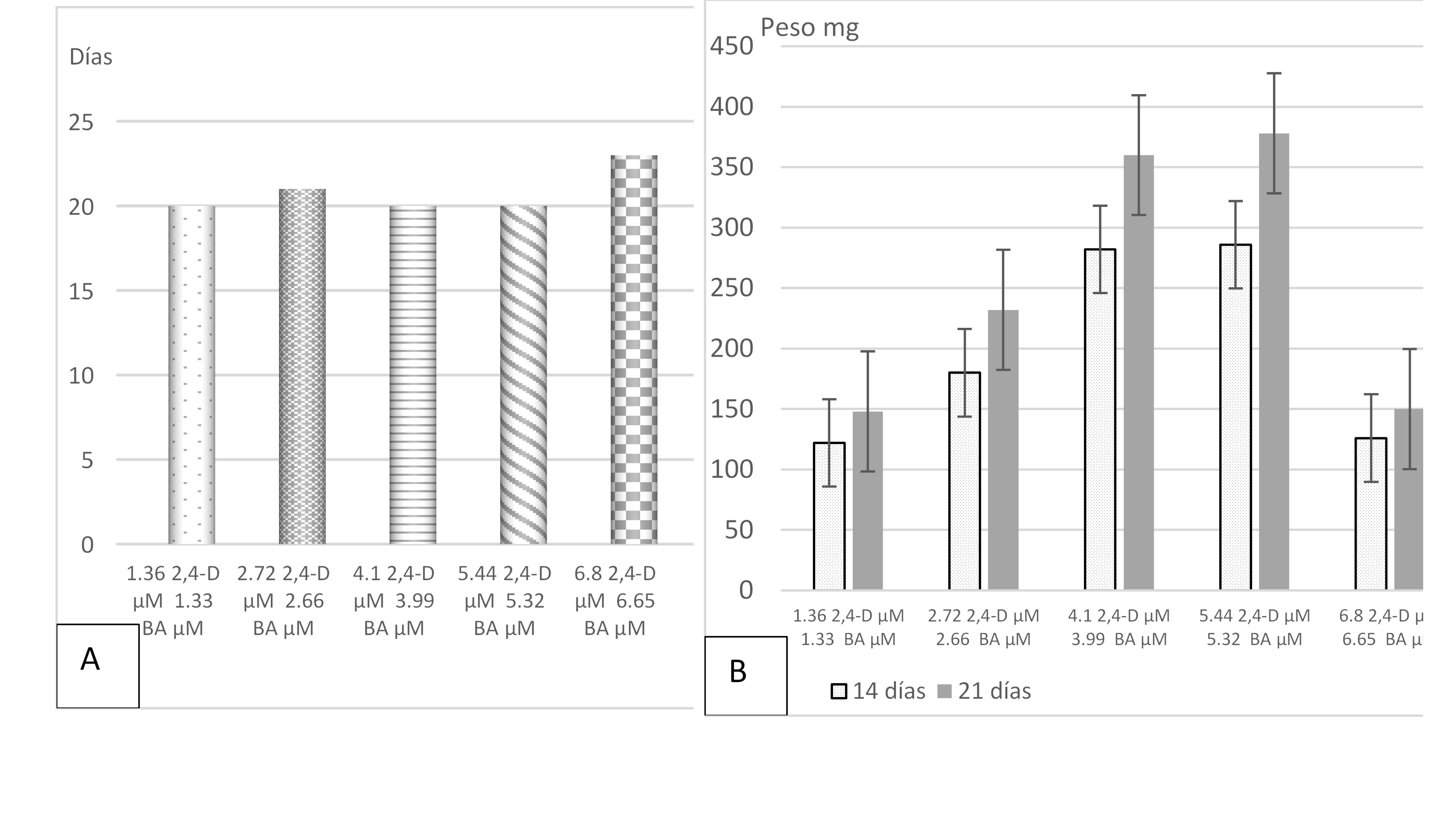
Fuente: Elaboración propia.
Figura 3 A) Días a inducción de callo haploide en cinco concentraciones de 2,4-D y BA. B) Peso fresco promedio de callo haploide (mg) en cinco tratamientos de 2,4-D y BA a los 14 y 21 posteriores a la inducción.
Este bioensayo se enfocó en obtener la combinación óptima entre las fuentes de auxina y citocinina, tomando en cuenta que la investigación se planteó con el establecimiento de dos bioensayos, el primero con 25 tratamientos para explorar rangos amplios en las concentraciones, así como todas las combinaciones posibles que pudiesen dar una respuesta positiva en el amplio rango considerado y que, debido a la contaminación propiciada principalmente en el proceso de desinfestación de las anteras, solo en tres tratamientos se presentó la inducción de callo (Tabla 1 bioensayo I). En base a esas concentraciones, se diseñó el segundo bioensayo, disminuyendo el rango de las dos hormonas, por lo que solo se establecieron cinco tratamientos dentro de un rango de 1.36 μM a 6.8 μM de 2,4-Diclorofenoxiacético y de 1.33 μM a 6.65 μM de Bencil Adenina. El resultado de este bioensayo confirma que hay una respuesta positiva a la inducción y desarrollo de callo al adicionar bajas dosis de las dos hormonas.
Observaciones citológicas:
En las preparaciones fijas de callo procedente de anteras, que se observaron a 400X y 1000X en cortes secuenciados, se determinó la presencia de granos de polen uninucleados con un surco (Figura 4a) y capa externa (exina) en forma de picos irregulares y conspicuos, de uno a tres poros, característica de la tribu Helianteae (Priya, Sassikumar, Sudhagar & Gopalan, 2003). Los granos de polen se encontraban en el estado I, descrito por Suderland & Donwell (1973), en el que las esporas contienen las tétradas y acaban de completar la primera división meiótica (profase I) provenientes de las esporogonias, y en este estado es donde se obtiene el mayor porcentaje de respuesta. Además, se observaron abundantes granos de polen germinados cuyo tubo polínico originaba una masa celular multinucleada, de acuerdo con el seguimiento que se dio en cinco cortes secuenciales. Resultados similares fueron reportados por Todorova et al. (1993), quienes, al cultivar anteras y granos de polen de ocho líneas y tres híbridos de girasol en medio MS adicionado con 0.5 mg L-1 de AIA, obtuvieron un mejoramiento en la reacción de las esporas dentro de los primeros cuatro días de cultivo, observando un incremento en el volumen del citoplasma y secciones vacuolares.
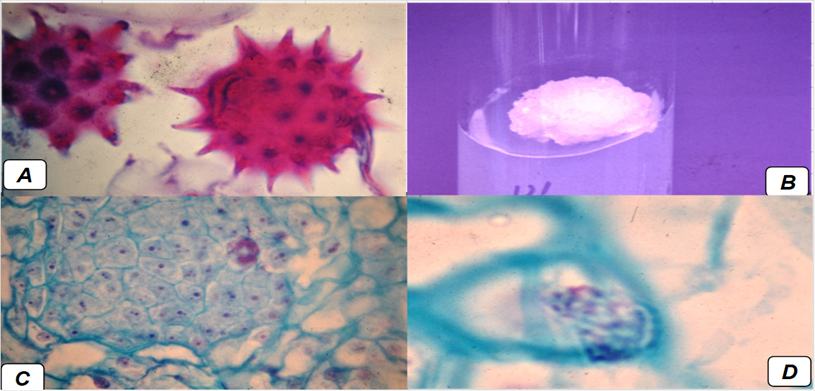
Fuente: Elaboración propia.
Figura 4 A) Granos de polen en estado uninucleado (400 X). B) Callo a los 28 días posteriores a la inducción. C) Callo haploide con células nucleadas (400 X). D) Célula de callo haploide en división (1000 X). Microscopio Zeiss Modelo Primostar Binocular 40x - 1000x.
En los callos se distinguieron varias zonas de proliferación, en las cuales, conforme el desarrollo avanzaba, se incrementaban las paredes celulares, aumentando el número y tamaño de las células, de acuerdo con la secuencia que se dio en 11 cortes observados. Esta descripción demuestra que los callos se desarrollaron a partir de la ruta descrita por Vasil (1980) y Suderland & Donwell (1993), donde la primera división es desigual y forma dos núcleos, el vegetativo y el generativo, que difieren en tamaño y estabilidad.
El núcleo vegetativo mediante divisiones secuenciales forma el callo, mientras que el vegetativo se degenera, lo que es frecuente en diferentes especies y es benéfica para la obtención de plantas haploides. Por otra parte, Augé et al. (1986) reportan que es necesaria una división desigual, produciendo dos núcleos hijos similares, siendo esta una condición previa para la evolución del polen hacia la formación de callo o de tipo embriogénico (Figura 4b). Asimismo, Luna (1987) reporta que el núcleo generativo es el más importante, ya que a partir de este se desarrolla el tubo polínico, el cual sobre un medio apropiado forma callo. Germanà (2011) consigna que el núcleo generativo funciona como embrión, puesto que hay evidencias de que la transcripción es un prerrequisito para la división hacia un camino embriogénico.
De los callos obtenidos, se seleccionaron células en las que se distinguieron los cromosomas observando sus filamentos (Figura 4c) y se realizó el conteo, obteniendo que, dentro de estas, el número cromosómico osciló entre 14 y 20 cromosomas, lo que concuerda en promedio con el genoma del girasol, que es n = 17 como se presenta en la Figura 4D. Esto confirmó la obtención de callo haploide. Por otra parte, por el lado posterior de la antera hubo proliferación de otro tipo de células parenquimatosas, de vacuolas abundantes y de apariencia desorganizada que dio origen a una masa amorfa irrigada por tejido vascular, por lo que se dedujo que este otro tipo de callo es diploide por provenir de tejido somático de la antera. Las principales diferencias que se observaron entre la masa de callo haploide y el diploide fue el tamaño de las células parenquimatosas, con vacuolas abundantes y un sistema de irrigación bien diferenciado en el tejido somático, mientras que las células haploides fueron de menor tamaño, de citoplasma denso con varios núcleos y nucleolos y las paredes poco definidas al inicio de la formación del callo haploide.
Conclusiones
La siembra de anteras con polen en estado uninucleado favoreció la inducción de callo haploide con dosis bajas de auxina y citocinina en los dos bioensayos. No hubo diferencia significativa en la inducción en los tratamientos de luz y oscuridad en el bioensayo I.
La presencia de luz no tuvo un efecto significativo en la inducción de callo, pero sí en el crecimiento, obteniendo el mayor peso en la dosis de 5.4 μM de 2,4-D y 5.3 μM de BA, por lo cual se considera el mejor tratamiento. En los cortes histológicos se observó callo haploide y somático en diferentes proporciones. Al incrementar la concentración de benciladenina no se presentaron brotes adventicios, por lo que no se obtuvo la conversión en plántula.











 nueva página del texto (beta)
nueva página del texto (beta)



