Introducción
México es centro de origen y diversificación del género Agave con el 75% de las 210 especies conocidas. Se reportan 251 especies dentro de los dos subgéneros reconocidos (Littaea y Agave), de las cuales 119 son endémicas (García-Mendoza, 2004; 2011). El cultivo de agave tequilero (Agave tequilana Weber var. Azul) tiene gran importancia económica debido a que sus piñas (tallos) acumulan gran cantidad de carbohidratos en forma de fructanos o agavinas (Mancilla-Margalli & López, 2006), de los que, después de un proceso de fermentación y destilación, se produce la bebida alcohólica distintiva de México conocida como tequila. Para abastecer esta industria actualmente existen poco más de 535 millones de plantas de Agave tequilana Weber variedad azul, registradas en el CRT, mismas que están establecidas en 172 000 hectáreas cultivadas dentro del territorio protegido por la Denominación de Origen Tequila (DOT) que cubre los estados de Jalisco, Guanajuato, Michoacán, Nayarit y Tamaulipas, según la Norma Oficial Mexicana NOM-006-SCFI-1994 (Pérez et al., 2016). El estado de Jalisco es el que cuenta con un mayor número de plantas establecidas, más de 250 millones (Consejo Regulador del Tequila, 2017).
Aun cuando el agave tequilero ha sido cultivado durante más de dos siglos, continúan las metodologías de cultivo poco tecnificadas para mejorar la producción. Además, la propagación asexual realizada durante largos periodos de tiempo ha ocasionado un incremento en la clonación de los pocos genotipos seleccionados, disminuyendo la variación dentro de las plantaciones, lo que genera un incremento en la incidencia y proliferación de enfermedades (Gil-Vega, González-Chavira, Martínez, Simpson & Vandemark, 2001). Por otra parte, el mejoramiento genético convencional en el agave azul tequilero se dificulta debido a que presenta un ciclo de vida largo (8 a 10 años). Por lo anterior, resulta útil la adaptación de nuevas tecnologías de mejoramiento como la inducción de mutantes mediante radiaciones ionizantes, el cultivo in vitro y la caracterización molecular, lo cual permite explotar la variabilidad genética inducida mediante la selección de individuos con mejores características agronómicas como la concentración de azúcares, con el fin de obtener cultivos adecuados para la industria alimentaria (Rodríguez-Garay, Gutiérrez-Mora & Acosta-Dueñas, 1996).
El Agave tequilana, al igual que otros agaves, presenta mecanismos de adaptación morfológicos y fisiológicos importantes como la presencia de hojas suculentas, metabolismo ácido de las crasuláceas (MAC), donde cerca del 87% de la fijación de CO2 ocurre en la noche y está acompañada por un incremento en la acidificación de los tejidos (Pimienta-Barrios, Zañudo-Hernández, Nobel & García-Galindo, 2007) y la acumulación de fructanos como el principal producto fotosintético, los cuales se acumulan principalmente en el tallo (López, Mancilla-Margalli & Mendoza-Diaz, 2003). La acumulación de estos azúcares también ocurre en respuesta al estrés abiótico y biótico como la sequía, el frío, la salinidad y el incremento de la resistencia a fitopatógenos (Suárez-González et al., 2016). Los fructanos son polímeros de fructosa sintetizados como carbohidratos de reserva en aproximadamente el 15% de las plantas con flores (Mancilla-Margalli & López, 2006). En Agave tequilana pueden alcanzar hasta el 80% en peso seco y es el principal constituyente en la elaboración del tequila (Montañez-Soto, Venegas-González, Vivar-Vera & Ramos-Ramírez, 2011). Los fructanos son sintetizados a partir de la sacarosa, contienen una glucosa terminal en su estructura química y se clasifican de acuerdo al enlace glucosídico presente de la siguiente manera (Mancilla-Margalli & López, 2006): (1) inulinas de cadena lineal con enlaces β(2,1), (2) levanos con enlaces β(2,6), (3) graminanos con dos tipos de enlaces β(2,1) y β(2,6), (4) inulina neoserie, la cual contiene una glucosa entre dos unidades fructosilo extendidas por enlaces β(2,1), (5) levanos neoserie, formados por enlaces β(2,6) en cualquiera de los dos extremos de la molécula de sacarosa y en el caso de Agave tequilana son llamadas (6) agavinas categorizados como graminanos y neo-fructanos ramificados con enlaces β(2,1) y β(2,6) (Banguela & Hernández, 2006; Mancilla-Margalli & López, 2006).
En la actualidad, las bases del mejoramiento de las plantas está fundada en crear variación genética, selección, evaluación, identificación y clonación de los nuevos genotipos (Tiessen, 2012). Por consiguiente, la combinación entre las técnicas de inducción de mutantes y el cultivo in vitro pueden ofrecer varias ventajas tales como la selección de variedades promisorias, la capacidad de generar grandes poblaciones en poco tiempo y la posibilidad de obtener clonas a partir de un brote (Fuchs, González, Castroni, Díaz & Castro, 2002). Siendo las dosis de radiación el factor clave para inducir mutaciones en tejido somático y en el caso de las plantas cultivadas in vitro, solo se requiere irradiar algunos miligramos de tejido a bajas dosis (Ahloowalia & Maluszynski, 2001). El objetivo del presente trabajo fue generar variantes en plantas de Agave tequilana Weber var. Azul irradiadas con Co60 y su caracterización empleando marcadores moleculares Inter Simple Sequence Repeat (ISSR), así como el efecto en el perfil de carbohidratos en las líneas clonales de plántulas simple y doblemente irradiadas.
Materiales y métodos
Material biológico
Se utilizaron plántulas de Agave tequilana obtenidas a partir de yemas axilares micropropagadas in vitro en medio Murashigue y Skoog (MS) (Murashige & Skoog, 1962) suplementado con 10 mg/L de BAP y 0.25 mg/L de 2,4-D. Una vez que alcanzaron un porte de 10 cm a 12 cm con seis hojas y contaban con raíz fueron irradiadas con rayos gamma Co60 en diversas dosis.
Irradiación de plantas in vitro con rayos gamma Co60
Para aplicar los tratamientos de irradiación con Co60, se utilizó la metodología descrita por Ángeles-Espino et al. (2013), basándose en la dosis letal media (DL50) que es donde se incrementa la probabilidad de que se presenten mutaciones favorables (Robles, 1986). Se consideraron cinco plántulas por tratamiento y tres repeticiones. En el Instituto Nacional de Investigaciones Nucleares (ININ), se irradiaron plántulas de Agave tequilana utilizando un irradiador Gammacell Modelo 220 a una dosis de 13.7 Gy min-1 hasta alcanzar las siguientes dosis: 10 Gy, 15 Gy, 20 Gy y 25 Gy más el control (0 Gy), obteniendo la generación M1V1. De las plántulas irradiadas se obtuvieron embriones somáticos siguiendo la metodología descrita por Ángeles-Espino, Sánchez-Mendoza, Dimas-Estrada, Ramírez-Alvarado & Gómez-Leyva (2018), obteniendo plántulas mutantes pertenecientes a la generación M1V2, por lo que son mutantes estables con las características fenotípicas de Agave tequilana. Para la segunda radiación se tomó una muestra de cinco plántulas de esta generación (M1V2) y se irradiaron con las mismas dosis, obteniendo la generación M2V1 (10 Gy-10 Gy, 10 Gy-15 Gy, 10 Gy-20 Gy, 10 Gy-25 Gy, 20 Gy-10 Gy, 20 Gy-15 Gy, 20 Gy-20 Gy y 20 Gy-25 Gy), donde el primer número corresponde a la dosis de la generación M1. De estas plántulas se obtuvieron embriones somáticos siguiendo la misma metodología de embriogénesis somática de la generación M1V1, obteniendo plántulas que corresponden a la generación M2V2. El total de los tratamientos obtenidos fueron 13; cuatro para las mutantes de la primera generación (10 M1V2, 15 M1V2, 20 M1V2 y 25 M1V2) y ocho mutantes para las que se irradiaron dos veces (M2V2), y el grupo control sin irradiar. Las plántulas obtenidas mediante embriogénesis somática de las dos generaciones mutantes fueron utilizadas para la caracterización molecular y cuantificación de monosacáridos y disacáridos mediante cromatografía líquida de alta resolución (HPLC, por sus siglas en inglés) y fructooligosacáridos (FOS) empleando cromatografía en capa fina de alta resolución (HPTLC, por sus siglas en inglés).
Extracción de DNA genómico
El DNA genómico de las plántulas de Agave tequilana se extrajo siguiendo la metodología descrita por Doyle & Doyle (1989). Para ello se utilizaron 100 mg de tejido de hoja de tres plantas por tratamiento, el tejido fue congelado en nitrógeno líquido y macerado hasta obtener un polvo fino; después, se transfirió a un microtubo con 500 (L de buffer de extracción precalentado (CTAB 3%, 2-mercaptoetanol 0.2%). Las muestras fueron incubadas a 65 °C durante 60 min y se homogenizaron utilizando 950 (L de cloroformo: alcohol isoamílico (24:1, v/v), las muestras se centrifugaron a 10 000 rpm durante 10 min. Se recuperó el sobrenadante y el DNA fue precipitado con un volumen igual de isopropanol frío incubando en hielo por 5 min. Posteriormente, el tubo se centrifugó durante 5 min a 8000 rpm y el sobrenadante fue eliminado por decantación. La pastilla de DNA se lavó con etanol 70%, seguido de un paso de centrifugación por 5 min a 8000 rpm, descartando el sobrenadante. El DNA fue resuspendido en 50 μL de agua Milli Q estéril.
Marcadores moleculares mediante PCR-ISSR
Para la amplificación de marcadores moleculares ISSR se evaluaron 15 oligonucleótidos (marca Sigma) y, una vez obtenidos los perfiles de amplificación, se eligieron tres de ellos para continuar el análisis de polimorfismo. Las reacciones fueron preparadas en un volumen final de 25 μL que contenían: Buffer 1X (10 mM Tris-HCl (pH 8.8), 50 mM KCl, 0.08% (v/v) Nonidet P40), 0.2 mM dNTP, 2 mM MgCl2, 1.25 U de Taq DNA Polimerasa (Thermo Scientific ®), 10 pM de cada oligonucleótido y 20 ng de DNA. La amplificación se realizó en un termociclador (Techne®) comenzando con una desnaturalización a 94 °C durante cuatro minutos, seguida por 35 ciclos de 94 °C durante 30 s, un minuto a la temperatura de alineamiento correspondiente a cada oligonucleótido; 49 °C, (GACA)3 YR; 53 °C, (CA)8 RT y 44 °C para (AG)8 YC, y 2 min a 72 °C, finalizando con un ciclo de 7 min a 72 °C. Los productos de PCR fueron observados mediante electroforesis en amortiguador SB (Borato de Sodio 10 mM), empleando un gel de agarosa de 15 cm × 20 cm al 2% (p/v), teñidos con bromuro de etidio y visualizados en luz UV.
Separación y cuantificación de carbohidratos mediante HPLC y HPTLC
La extracción de carbohidratos se realizó a partir de 100 mg de tejido obtenidos de la parte central del tallo de plántulas de Agave tequilana; se maceró el tejido y se suspendió en agua destilada (1:10 p/v). Las muestras se mantuvieron a 70 °C por 15 min; posteriormente, se centrifugaron a 12 000 rpm durante 15 min y el sobrenadante obtenido se empleó para el análisis de carbohidratos y FOS. La glucosa, fructosa y sacarosa se cuantificaron mediante HPLC. Se inyectaron 20 (L de muestra en un cromatógrafo de líquidos marca Varian, con bomba binaria, auto muestreador, horno de columna y detector evaporativo de dispersión de luz (ELSD, por sus siglas en inglés), empleando una columna Unison UK-amino a 40 °C. La fase móvil consistió en un gradiente isocrático de acetonitrilo:agua 70:30 (v/v) a un flujo de 1 mL/min. Para la cuantificación, se realizaron curvas de calibración basadas en el área bajo la curva de estándares de glucosa, fructosa y sacarosa a diferentes concentraciones en el rango de 5 (g/mL a 150 (g/mL.
Por otra parte, se aplicó 1 (L de extracto en una placa de sílica Gel 60 (Whatman) de alta resolución empleando una fase móvil con butanol/propanol/agua (2:1:1 v/v/v). La placa de HPTLC se corrió hasta un centímetro antes del final y fue asperjada con el revelador (anilina 2% (v/v), difenilamina 2% (w/v), ácido fosfórico 15% (v/v), en acetona) para obtener la visualización de los carbohidratos (Suárez-González et al., 2016). Los estándares empleados fueron los monosacáridos: fructosa (Sigma) y glucosa (Sigma), el disacárido: sacarosa (DP2), y oligosacáridos; 1-kestosa (DP3, Megazyme), 1,1-kestotetraosa (DP4, Megazyme), 1,1,1- kestopentosa (DP5, Megazyme). La cuantificación se realizó con base en una interpolación en un rango de concentración de 1.5 mg/mL de cada carbohidrato estándar. El análisis densitométrico se elaboró empleando del programa UTSCH Image Tool V3.0 (The University of Texas Health Science Center in San Antonio), en el cual se utilizó la imagen digitalizada del cromatograma para obtener los valores de unidades relativas de intensidad de cada carbohidrato.
Análisis de datos
Para el análisis de la diversidad genética mostrada en el PCR-ISSR, se obtuvo una matriz con los fragmentos de amplificación obtenidos (bandas) que fueron codificados de acuerdo con un marcador dominante, donde: 1 = producto presente y 0 = producto ausente. Los datos moleculares resultantes se utilizaron para generar un análisis de agrupamiento de los agaves mutantes y control. La similitud genética se calculó utilizando el coeficiente de similitud Jaccard con el software NTSYSpc ver. 2.2 (Applied Biostatistics, Inc.). La agrupación se llevó a cabo empleando el algoritmo UPGMA (Método de grupo de pares no ponderados usando promedio aritmético). El análisis de componentes principales (ACP) para ubicar los grupos de mutantes se ejecutó con base a la matriz de correlaciones generada a partir de las frecuencias alélicas, usando el programa Statgraphics Centurion XVI v16.1.11 (Statpoint Technologies, 2009). Para el contenido de carbohidratos se realizó un análisis de varianza y, posteriormente, una comparación de medias de Tukey con un nivel de confianza del 95%.
Resultados y Discusión
Generación de mutantes de Agave tequilana
En agave, existen pocos reportes para especies irradiadas con rayos gamma. Por ejemplo, González et al. (2007) determinaron para henequén (Agave fourcroydes) la dosis letal media (DL50) en 20 Gy, con lo cual los explantes incrementaron su masa fresca en relación con el control en un 49.6%, mientras que en Agave tequilanaÁngeles-Espino et al. (2013) determinaron la dosis letal media (DL50) entre 15 Gy y 25 Gy para inducir la obtención de mutantes favorables, disminuyendo significativamente la viabilidad de las plántulas con dosis mayores a estas. Cabe mencionar que ningún mutante de Agave tequilana obtenido por esta vía había sido caracterizado hasta el presente trabajo.
Los mutágenos físicos como la irradiación gamma (10 nm) causan daño directo al DNA, ya que se generan radicales reactivos de hidroxilo debido a la interacción que tienen con el agua (Esnault, Legue & Chenal, 2010). Estos radicales pueden dañar o modificar componentes importantes de las células vegetales y cambiar la morfología, anatomía, bioquímica y fisiología de las plantas (Kovalchuk, Molinier, Yao, Arkhipov & Kovalchuk, 2007). En plantas de frijol (Phaseolus vulgaris L.), Ulukapi & Ozmen (2018) determinaron que la irradiación gamma a dosis bajas estimulaba tanto el peso fresco y seco del tallo y la raíz, mientras que al incrementar la dosis de irradiación disminuye considerablemente el porcentaje de germinación, lo que podría ser el resultado en una reducción en la cantidad de reguladores de crecimiento interno.
Análisis ISSR-PCR de agaves irradiados
La diversidad genética de las líneas clonales de agaves irradiados en una primera y segunda ronda de exposición fue evaluada con los marcadores ISSR. Se generaron un promedio de 28 fragmentos por oligonucleótido, con un porcentaje de polimorfismo del 96%. El tamaño de los productos amplificados se presentó en un intervalo de 200 pb a 2000 pb (datos no mostrados). Con el resultado anterior, se realizó un análisis de componentes principales (ACP) basado en los ISSR. La Figura 1 muestra que las líneas irradiadas se separaron en tres grupos representativos y dos de ellos con mayor diversidad: Rhus sp. (control externo) y M1-25 Gy. El primer grupo estuvo conformado por aquellas plántulas que recibieron las dosis de M1-10 Gy, M2-20-20 Gy y M2-20-25 Gy; el segundo agrupa las plántulas que recibieron las dosis de M2-10-10 Gy, M2-10-25 Gy, M2-20-10 Gy y M2-20-15 Gy; y el tercer grupo estuvo conformado por las dosis M1-20 Gy, M2-10-15 Gy y M2-10-20 Gy. El porcentaje de polimorfismo indicó que las dosis de radiación ionizante recibida por el tejido en cada tratamiento indujo mutaciones; esto explica el 72.1% de la varianza en el ACP, lo cual indica que las diferentes dosis de radiación ionizante recibida por el tejido en cada tratamiento indujo mutaciones.
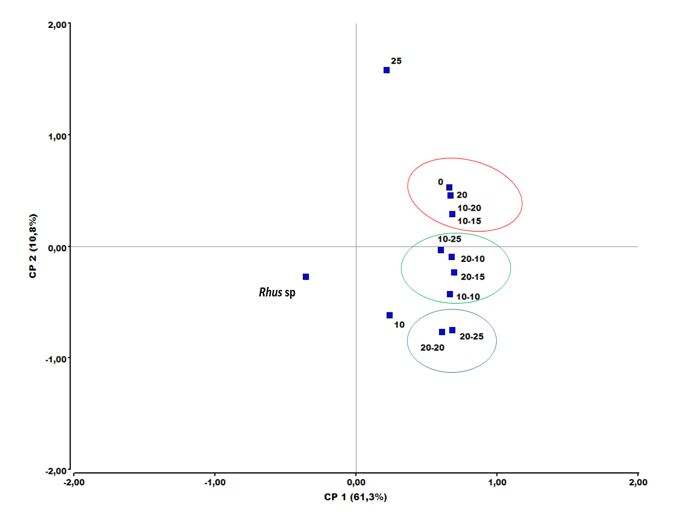
Fuente: Elaboración propia.
Figura 1 Análisis de componentes principales (ACP) derivado de tres oligonucleótidos ISSR en poblaciones de A. tequilana irradiadas con rayos gamma de Co60 a diferentes dosis. Los números indican la dosis en Grey (Gy) simple y doblemente irradiadas.
Se ha reportado que la tasa de variabilidad genética de agave establecido en campo es baja. Gil-Vega et al. (2001) reportaron estudios que demuestran que entre 40 selecciones de Agave tequilana var. Azul hechas en campo, 1 de 124 individuos (0.8 %) fue polimórfico y 39 de 40 fueron completamente isogénicos; siendo uno de los niveles de polimorfismo más bajos detectado en un cultivo. En las especies de reproducción asexual y de ciclo de vida muy largo (como el agave), la inducción de mutaciones mediante la exposición de tejido somático a irradiación ionizante a bajas dosis ocasiona cambios en el DNA de las células como una posible fuente significativa para la obtención de variabilidad genética (Robles, 1986). El conocimiento del nivel de variabilidad genética obtenida por las mutaciones inducidas coadyuva a la definición de estrategias para la selección de individuos élite en el establecimiento de plantaciones, como los resultados obtenidos por Sen & Alikamanoglu (2012) en el que obtuvieron hijuelos de remolacha azucarera (Beta vulgaris L.) tolerantes a sequía en cultivo de tejidos mediante la inducción de mutantes con dosis de 15 Gy y 20 Gy de rayos gamma. La utilización de marcadores ISSR y PAGE en los hijuelos de remolacha mostraron las distancias genéticas entre las plantas mutantes y plantas control en estado temprano de desarrollo, demostrando el potencial de este tipo de análisis.
Efectos de la irradiación con Co60 en la acumulación de carbohidratos
A pesar de que existen trabajos en los que someten diversos cultivos a la inducción de mutaciones por rayos gamma, en ellos solo se reporta la dosis letal (DL50), incremento en la tasa de germinación y cambios en la morfología de las plantas (Ángeles-Espino et al., 2013; González & Nakayama., 2015; Harding, Johnson, Taylor, Dixon & Turay, 2012). Los resultados encontrados en este estudio muestran que las mutaciones también tienen efecto en la acumulación de monosacáridos y disacáridos como glucosa, fructosa y sacarosa. El análisis por HPLC de los carbohidratos de tallo en las diferentes líneas (Figura 2) demuestra que plántulas sometidas al tratamiento con M2-20-20 Gy presentaron el mayor contenido de glucosa, seguido de M1-25 Gy y de la dosis M2-20-10 Gy, superando al tratamiento control en 107%, 84% y 57%, respectivamente (Tabla 1 y Figura 1). Las dosis de radiación simple aplicada mostraron una correlación positiva para la concentración de fructosa y sacarosa con una r2 de 0.70 y 0.72, respectivamente, siendo irregular para las dobles irradiadas, ya que no se observó una tendencia definida, debido a que en unas dosis el contenido de estos carbohidratos se incrementó y en otras disminuyó. Esto explica, por una parte, la significancia estadística de la interacción entre las generaciones mutantes y las dosis de radiación, así como la aleatoriedad de las mutaciones y, por otra parte, que estas no siguen un patrón establecido, produciendo cambios positivos o negativos de acuerdo al genotipo que recibe la radiación ionizante (Fuchs, González, Castroni, Díaz & Castro, 2002). Este comportamiento sugiere que en los tratamientos evaluados se indujeron cambios en el DNA que de manera aleatoria afectaron la vía metabólica de síntesis y degradación de los carbohidratos.

Fuente: Elaboración propia.
Figura 2 Perfil cromatográfico por HPLC de carbohidratos encontrados en tallos de Agave tequilana control (0 Gy) y las mutantes 20 Gy, 20-20 Gy y 20-25 Gy. Fructosa (Fru), Glucosa (Glu), Sacarosa (Suc). neoKestosa (FGF), 1-Kestosa (GF2), Nistosa (GF3).
Tabla 1 Valores promedio en el contenido de glucosa, fructosa y sacarosa en tallos de plántulas mutantes de Agave tequilana inducidas por irradiadas con radiación gamma de Co60 a diferentes dosis.
| Generación | Dosis | Glucosa | Fructosa | Sacarosa | |||
| Co60(Gy) | mg/mL | %§ | mg/mL | %§ | mg/mL | %§ | |
| (Control) | 0 | 311.3de* | 100 | 230.3 cd | 100 | 222.6 bc | 100 |
| M1 | 10 | 320.7de | 103 | 261.3 cd | 113 | 168.7 dc | 76 |
| M1 | 15 | 268.6 de | 86 | 272.0 cd | 118 | 191.6 cd | 86 |
| M1 | 20 | 246.6 de | 79 | 278.0 cd | 121 | 390.3 ab | 175 |
| M1 | 25 | 572.3 ab | 184 | 372.6 b | 162 | 337.3 ab | 151 |
| M2-10 | 10-10 | 286.6 de | 92 | 226.6 cd | 98 | 298.6 ab | 134 |
| M2-10 | 10-15 | 296.0 de | 95 | 298.0 bc | 129 | 219.0 bc | 98 |
| M2-10 | 10-20 | 216.3 de | 69 | 204.6 de | 89 | 194.6 cd | 87 |
| M2-10 | 10-25 | 363.0 cd | 117 | 300.3 bc | 130 | 308.6 bc | 139 |
| M2-20 | 20-10 | 490.3 bc | 157 | 325.6 bc | 141 | 316.0 ab | 142 |
| M2-20 | 20-15 | 280.0 de | 90 | 275.6 cd | 120 | 273.6 bc | 123 |
| M2-20 | 20-20 | 645.6ª | 207 | 542.6 a | 236 | 417.0 a | 187 |
| M2-20 | 20-25 | 435.0 cd | 140 | 368.0 b | 160 | 294.0 ab | 132 |
*Tratamientos con misma letra no difieren estadísticamente por Tukey a p ≤ 0.05.
§ Porcentaje de azúcares con relación al tratamiento control sin irradiar = 100%.
Fuente: Elaboración propia.
Así mismo los resultados mostraron que las dosis de radiación aplicadas indujeron mutaciones en las plantas in vitro de Agave tequilana que afectaron la acumulación de los fructooligosacaridos en los tallos de las generaciones mutantes evaluadas. Al realizar el análisis por HPTLC, se observó que la concentración de glucosa disminuyó en las dosis de 10 Gy, 15 Gy y 20 Gy en plántulas correspondientes a las generaciones M1 y M2-10, aumentando a los 25 Gy, alcanzando en la M1 un incremento significativo y estadísticamente igual a la dosis M2-20-20 (Figura 3), mientras que esta generación tuvo un incremento en la concentración de fructosa, diferenciándose estadísticamente del resto de las dosis evaluadas. Por otra parte, en la generación M1 el incremento no fue significativo respecto al tratamiento control en las dosis de 10 Gy, 15 Gy y 20 Gy; y para la generación M2-10 Gy no hubo diferencia estadística en las dosis de radiación y el testigo. En la concentración de sacarosa se presentó un comportamiento similar en las dosis de 20 Gy en las generaciones M1 y M2-20. En general se observó que las plantas de Agave tequilana irradiadas a 20 Gy y posteriormente sometidas a una segunda dosis de 10 Gy a 25 Gy fueron las más sobresalientes al acumular en un intervalo aproximado de una a dos veces más glucosa, 1.4 a 2.6 veces más fructosa y 1.4 a 1.9 veces más sacarosa, lo cual se aprecia en el perfil de separación por HPTLC, coincidente con los valores de la tabla 1. No se descarta el incremento en alguna invertasa, de la actividad de la sacarosa sintasa, incluso una fructanohidrolasa para justificar el incremento en estos carbohidratos, por lo que se requieren futuros estudios detallados en las diferentes actividades enzimáticas en el metabolismo de los carbohidratos para estas mutantes. La síntesis de fructanos comienza con las enzimas fructosiltransferasas (FT). La enzima sacarasa: sacarosa 1-fructosiltransferasa (1-SST) transfiere una unidad de fructosa de una molécula de sacarosa a otra, sintetizando la 1-kestosa (DP3: G-F-F). Posteriormente, la fructano:fructano 1-fructosiltransferasa (1-FFT) es capaz de incorporar una fructosa para incrementar el grado de polimerización. Enseguida, la enzima fructano:fructano 6G-fructosiltransferasa (6G-FFT) es la enzima clave para la síntesis de la neoserie de fructanos produciendo neokestosa (DP3: F-G-F), característica de las agavinas y que se observan claramente en la separación de FOS mediante HPLTC de la doble mutante M2-20-20 (Figura 4), lo que sugiere una elevada actividad de las enzimas FT, siendo esto altamente deseable para la industria. La línea clonal doblemente irradiada con 20 Gy (M2 20-20) fue el único lote de plantas que presentó una acumulación sobresaliente de FOS, además de mayor contenido de glucosa, fructosa y sacarosa (Figura 4), observando los isómeros de la neoserie en los grados de polimerización GP: 3, 4 y 5 previamente identificados por nuestro grupo de trabajo para Agave tequilana (Suárez-González et al., 2016).
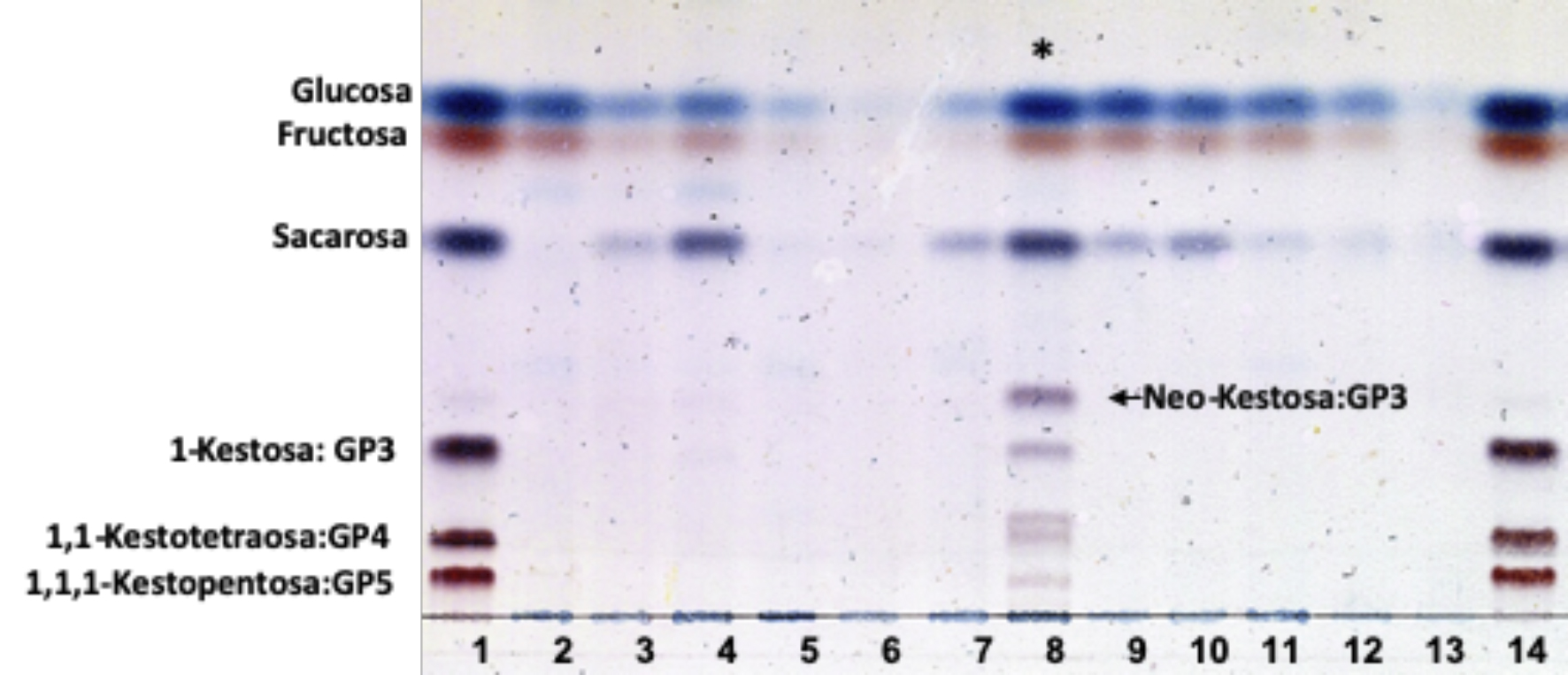
Fuente: Elaboración propia.
Figura 3 Separación de carbohidratos mediante cromatografía en capa fina de alta resolución (HPTLC) de las diferentes líneas clonales M20 de Agave tequilana sometidas a segunda ronda de radiación de rayos gamma de Co60 a diferentes dosis. Carriles 1 y 14, estándares; 2, control planta sin irradiar; 3 y 4, 20-10 Gy; 5, 6 y 7, 20-15 Gy; 8, 9 y 10, 20-20 Gy; 11, 12 y 13, 20-25 Gy. *Línea clonal doble mutante 20-20 Gy, altamente acumuladora de fructooligosacáridos.

Fuente: Elaboración propia.
Figura 4 Análisis del perfil de carbohidratos en tallo de Agave tequilana, a partir de la separación mediante HPTLC. A) control sin irradiar (0 Gy). B) doble mutante (M2 20-20 Gy). C) Mezcla de estándares: Glucosa (G), Fructosa (F), Sacarosa (S), 1-Kestosa (GP3), 1,1-Kestotetraosa (GP4) y 1,1,1-Kestopentosa (GP5).
Conclusiones
La inducción de mutantes mediante la aplicación de dosis bajas de rayos gamma Co60 en plantas in vitro de Agave tequilana representa una alternativa viable para inducir variabilidad genética y estimular la síntesis de fructooligosacáridos. Los estudios realizados en este trabajo permitieron la identificación de mutantes empleando marcadores moleculares ISSR y su relación con el perfil de fructooligosacáridos. El fenómeno de doble irradiación originó mutaciones que incrementaron la acumulación de glucosa, fructosa y sacarosa, considerando la doble irradiación a 20-20 Gy como óptima para incrementar la acumulación de carbohidratos. El presente trabajo aporta por primera vez un modelo prometedor para el estudio del metabolismo de carbohidratos en Agave tequilana y la posibilidad de establecer cultivares élite para plantaciones comerciales.











 nova página do texto(beta)
nova página do texto(beta)


