Introducción
El agua proveniente del subsuelo es a nivel mundial el principal aporte para uso y consumo humano. El agua de origen subterráneo se encuentra en espacios porosos, fracturas y fisuras interconectadas de las rocas y materiales geológicos que dan forma a los acuíferos. El agua en contacto con estos materiales, dependiendo de su composición, puede disolver ciertos elementos y provocar una contaminación natural. En nuestro país, más del 75% del agua utilizada en la urbe proviene del subsuelo. El consumo vital cotidiano y las actividades productivas de nuestra nación están sustentados en el agua subterránea (Price, 1984).
Actualmente, el arsénico es el contaminante de agua de consumo más estudiado a nivel mundial. En Bangladesh, este afecta a cerca de 30 millones de habitantes con concentraciones de 50 μg/L hasta 3200 μg/L, así como los principales efectos observados del arsénico en humanos a nivel mundial (Smedley & Kinniburgh, 2002). En México, las más altas concentraciones se han encontrado en Zimapán, Hgo., con un intervalo de 14 μg/L a 1000 μg/L. En municipios de Sonora, como en Hermosillo, Etchojoa, Magdalena y Caborca, se han encontrado concentraciones de 2 μg/L a 305 μg/L (Wyatt, Fimbres, Romo, Méndez & Grijalva, 1998). En localidades del noreste de Chihuahua existen también acuíferos con concentraciones altas de arsénico. Otros lugares son la Comarca Lagunera y los estados de San Luis Potosí, Zacatecas y Guanajuato (Alvarado, 2001). En la capital del estado de Guanajuato se han encontrado varios pozos y manantiales con presencia de arsénico, como en el caso de la comunidad de Tajo de Adjuntas. Lamentablemente, falta por evaluar la concentración de arsénico en gran cantidad de pozos del territorio nacional, en las zonas de alto riesgo de contaminación hidrogeológica.
Está demostrado que el arsénico favorece daños en el desarrollo, enfermedad vascular periférica, hipertensión arterial, diabetes mellitus, anemia, leucopenia y trombocitopenia, isquemia al miocardio, infarto cerebral y ateroesclerosis (Rahman, Ng & Naidu, 2009). Además, se ha asociado con un aumento en la incidencia de diversos tipos de cáncer, principalmente de piel, hígado, vejiga, riñón y pulmón, aun cuando los mecanismos moleculares responsables de estas asociaciones no se han elucidado por completo (Coronado-González, Del Razo, García-Vargas, Sanmiguel-Salazar & Escobedo-de la Peña 2007; Hamadeh, Trouba, Amin, Afshari & Germolec, 2002; Rahman et al., 2009). Especies de arsénico como el arsenito inducen un incremento simultáneo de expresión de genes de estrés oxidativo y disminuye los niveles de enzimas de reparación del ADN (Hamadeh et al., 2002). Se estudia cada vez más la relación entre la ingesta crónica del arsénico por agua de consumo, con un incremento en la prevalencia de la diabetes (Del Razo et al., 2011; Kim & Lee, 2011). Además, se ha reportado que la disminución del coeficiente intelectual en los niños (Dong & Su, 2009), en países en desarrollo, más de la tercera parte de las enfermedades tienen su origen en problemáticas ambientales; la OMS estima que cerca de tres millones de niños mueren anualmente por causas relacionadas con el ambiente (Prüss-Üstün & Corvalán, 2006).
Ya que los instrumentos de gestión pública respecto a la calidad del agua son insuficientes para solventar el problema que muchas comunidades en el país enfrentan, se requieren alternativas accesibles, eficaces y económicas para el tratamiento personalizado del agua en los sitios donde se requiera.
Los materiales mesoporosos tipo HT, también conocidos como hidróxidos dobles laminares (HDL), tienen un área superficial relativamente grande y una alta capacidad de intercambio aniónico. Los HDL obedecen generalmente a la fórmula: [MII (1−X)MIII X(OH)2, X+AZ− X/Z•yH2O], donde MII y MIII son cationes metálicos divalentes y trivalentes, y AZ− es un anión que compensa la carga entre las capas con número y de moléculas de agua (Yang et al., 2006). Estos materiales cuentan con capas de sitios octaédricos que pueden ser ocupados por iones trivalentes como Al3+ o Fe3+. Estos generan una carga positiva que es compensada por la inclusión de aniones AZ− en el espacio interlaminar.
Dadas las características observadas de los materiales mesoporosos tipo HT para la retención de iones en sus espacios interlaminares, para este trabajo se eligió a estos para la remoción de arsénico del agua de manantial destinada al consumo humano.
Ya que el arsénico tiene alta afinidad de ser adsorbido por óxidos de fierro, como se observa a menudo en un ambiente natural (Nishida, Takesoe, Yamasaki & Nakahira, 2004), se empleó un sólido sintético tipo HT con el sistema Mg2+/Fe3+ como material adsorbente. Türk & Deveci (2009) han trabajado en la eliminación de arseniato por adsorción, empleando un hidróxido doble laminar Mg2+/Fe3+ con el que han logrado reducir la concentración de 330 μg/l a <10 μg/l. Por otro lado, Caporale et al. (2013) han empleado también un hidróxido doble laminar Mg2+/Fe3+ para la adsorción de arsenito, logrando remover el arsenito de la solución sobre todo en sistemas ácidos, y observaron cómo es que hay otros ligandos que afectan la adsorción del arsenito.
Materiales y Métodos
Síntesis del sólido tipo HT Mg2+/Fe3+
La síntesis de la HT con relación Mg/Fe = 3 se llevó a cabo por el método de coprecipitación, mezclando sales precursoras de Mg2+ y Fe3+, 0.25 mol Fe(NO3)3•9H2O y 0.75 mol Mg(NO3)2•6H2O, en una solución de agua desionizada. Esta solución es mezclada para la coprecipitación con otra solución de NaOH y Na2CO3 en constante agitación. El pH se controla agregando HCl o NaOH, manteniéndolo a 11.5. La muestra es reposada por 20 h y luego lavada hasta alcanzar un pH de 8.0. Finalmente, el precipitado es secado a 60 oC por 24 h.
Para el tratamiento térmico se utilizó una mufla Arsa AR-340. Se calcinó por 4 h y con una rampa de calentamiento de 10 oC/min, el sólido fue calcinado a 100 oC y 350 oC, obteniendo los materiales HT100 y HT350, respectivamente.
Caracterización del material adsorbente
La caracterización por DRX se llevó a cabo con un difractómetro INEL EQUINOX con un tubo de rayos-X con ánodo de cobre, utilizando radiación monocromática CuKα operado a 30 Kv y 20 mA, donde las muestras son evaluadas en un intervalo de 5° a 80° de 2θ. Para la calorimetría diferencial de barrido y el análisis termo-gravimetrico se empleó un termoanalizador Modelo SDT Q600, Simultaneous TGA/DSC, marca TA Instruments, con intervalo de temperatura de temperatura ambiente hasta 1500 °C; sensibilidad de la balanza 0.1 ug; sensibilidad de DTA: 0.001 °C; precisión calorimétrica: ± 2% (basado en estándares metálicos); velocidad de calentamiento de temperatura ambiente a 1000 °C de 0.1 °C a 100 °C/min y de temperatura ambiente a 1500 °C: de 0.1 °C a 25 °C/min; enfriamiento de la mufla por aire comprimido de 1500 °C a 50 °C en < 30 min y de 1000 °C a 50 °C en < 20 min; tipo de mufla: Bifilar Wound; diseño horizontal; termocoples de platino/platino-rodio (tipo R); calibración de temperatura mediante punto Curie o Estándares Metálicos (de 1 a 5 puntos); tipo de porta muestras: Platino Alúmina; controlador de flujo másico con cambio automático de gases. La velocidad de calentamiento o rampa fue de 10 oC/min en atmósfera de aire con una velocidad de 100 mL/min. El material de referencia que se usó fue α-alumina.
Muestreo
Para la obtención de muestras de agua contaminada con arsénico se realizó una campaña de muestreo en la comunidad Tajo De Adjuntas Guanajuato, Gto., en un pequeño arroyo que presenta un flujo constante inclusive en temporada de sequía. Este arroyo contribuye al suministro de agua de los vecinos de la comunidad y desemboca en la presa de Santa Ana. Esta corriente recibe dos aportaciones de minas abandonadas, escurrimientos y flujos de medios fracturados. Se establecieron cuatro puntos de muestreo a los que se les denominó: surgencia (SUR), mezcla de la surgencia (MSUR), socavón (SA) y manantial (MAN). El muestreo se realizó en frascos de polietileno. Los frascos se lavaron, reposaron por 24 horas en HNO3 al 10% y se enjuagaron con agua destilada. Las muestras obtenidas se caracterizaron en el sitio y se acidificaron para su transporte y almacenamiento a 4 oC.
Prueba de remoción de arsénico
La prueba de adsorción se realizó por lotes con técnica de contacto al equilibrio a temperatura ambiente con agitación 47 rpm por 24 h en un mezclador rotatorio para tubos de 15 ml (ATG RKVSD). La cantidad de material adsorbente empleado en los contactos fue de aproximadamente 0.0025 g por tubo y 10 ml de patrón de referencia de arsénico en diferentes concentraciones o 10 ml de muestra de agua contaminada con arsénico. El patrón de referencia se preparó a partir de la sal de NaAsO2 grado reactivo marca J.T.Baker. Las concentraciones utilizadas fueron: 500 ppm, 200 ppm, 100 ppm, 50 ppm, 1000 ppb, 500 ppb, 100 ppb, 50 ppb y 10 ppb.
Se evaluó el desempeño de los dos materiales HT100 y HT350 en contacto con el agua de los cuatro puntos de muestreo: SUR, MSUR, SA y MAN.
Al término de todos los experimentos de contacto, se separó por filtración el sólido de la solución y a esta junto con un control de la concentración inicial se les determinó la concentración remanente de arsénico. La determinación de la concentración de arsénico total remanente se realizó por triplicado por espectroscopia de absorción atómica con generador de hidruros. Se empleó un Perkin Elmer AAnalyst 200 Atomic Absortion Specrometer, con una lámpara de descarga sin electrodos la cual siempre es precalentada de 25 min a 30 min, longitud de onda analítica de 193.7 nm y flama de acetileno. Se realiza una limpieza optométrica de rutina con una solución de Cu y siempre se elabora una curva de calibración con un estándar de arsénico grado absorción atómica, con concentraciones de 1 ppb, 3 ppb y 5 ppb.
Una vez obtenida la concentración de arsénico remanente en los experimentos, se determinó la cantidad de soluto adsorbido por unidad en peso de material adsorbente q mediante la isoterma de adsorción:
donde q es la capacidad de adsorción del material en mg de adsorbato por g de adsorbente, C0 es la concentración inicial de la solución de arsénico en mg/l, Ce es la concentración en el equilibrio en mg/l, V es el volumen de la solución en l y M es la cantidad de material adsorbente en g.
Resultados
Caracterización
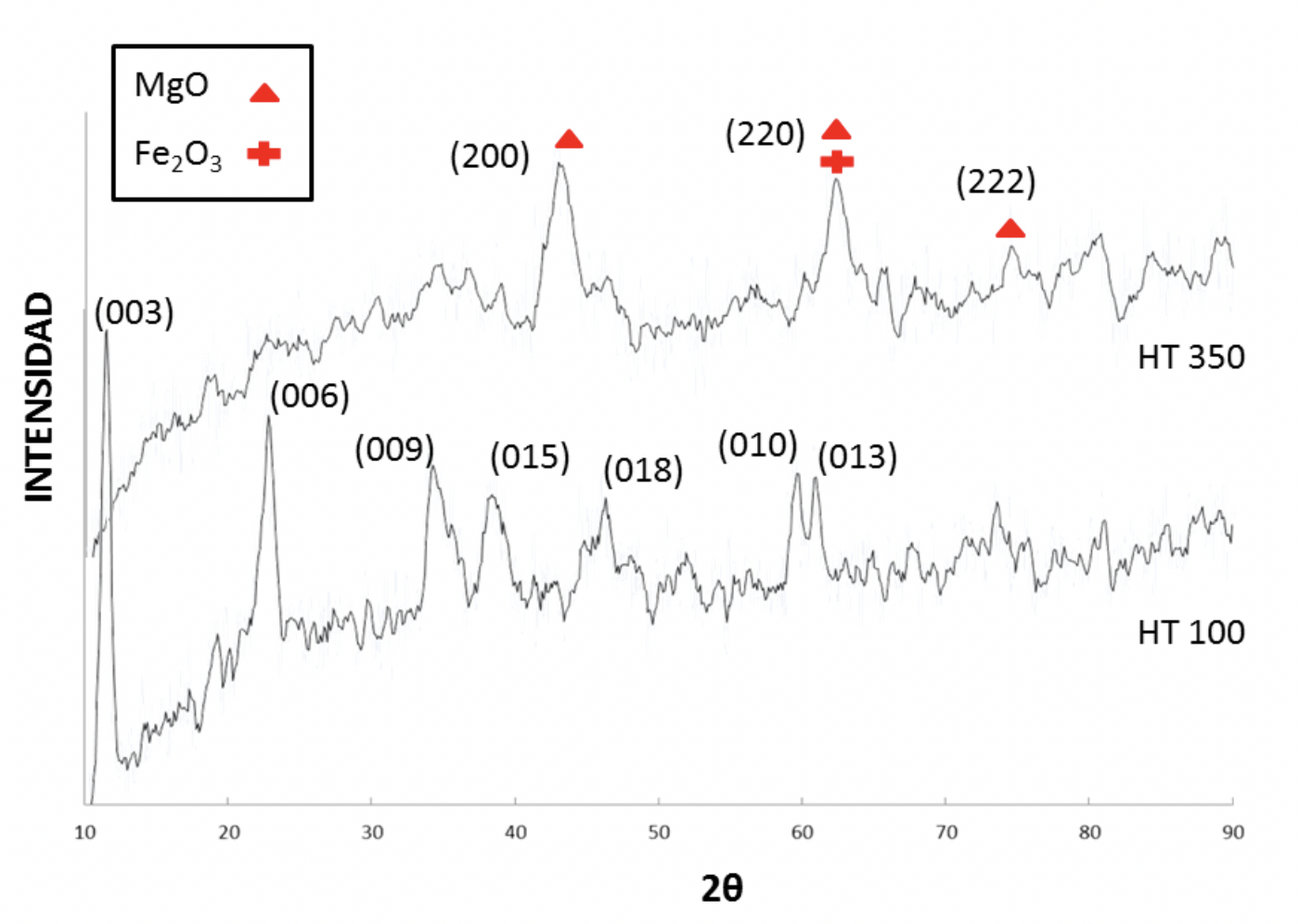
El patrón obtenido por difracción de rayos X del material calcinado a 100 oC (HT100) muestra picos agudos y altos en intensidad a valores bajos de 2θ y menos intensos y más abiertos a altos valores de 2θ (figura 1). La gran cantidad de ruido en la señal es debido a la fuerte fluorescencia del Fe causada por la radiación de la lámpara de Cu y también a que la muestra presenta una baja cristalinidad. Con los valores de 2θ para los picos más significativos se compara con la tarjeta de referencia para hidrotalcita 22-0700 de la Joint Committee Powder Diffraction Standards (JCPDS)(Mokhtar, Inayat, Ofili & Schwieger, 2010) . Es apreciable que el sólido HT100 presenta los picos característicos de un compuesto tipo hidrotalcita (003), (006), (009), (015), (018), (010) y (013), con lo cual se verifica la obtención de dicho compuesto. El material calcinado a 350 oC (HT350) exhibe claramente los picos característicos de la periclasa MgO (200), (220), (222) y maghemita Fe2O3 (220), haciendo una comparación con las tarjetas JCPDS 00-004-0829 y JCPDS 00-039-1346 (Fahami, A., Nasiri-Tabrizi, B. 2013; Hu, Percheron, Chaumont, Brachais, 2011), respectivamente (Figura 1).
Fuente: Elaboración propia.
Figura 1 Difracción de rayos X del material calcinado a 100 oC (HT100) y material calcinado a 350 oC (HT350).
La Figura 2 muestra el análisis del material sintetizado por calorimetría diferencial de barrido y la descomposición termogravimétrica (DSC-TGA, por sus siglas en ingles). El análisis térmico diferencial muestra dos picos endotérmicos centrados en 180 oC y 340 oC que coinciden; el primero con la deshidroxilación parcial de las láminas y la pérdida de agua interlaminar y el segundo con la descomposición del anión interlaminar, el colapso de la estructura doble laminar y la formación parcial de óxidos y óxidos mixtos. La pérdida de masa es un reflejo del colapso de la estructura primaria del compuesto tipo hidrotalcita.

Fuente: Elaboración propia.
Figura 2 Calorimetría diferencial de barrido y análisis termo-gravimétrico DSC-TGA.
El análisis termogravimétrico (Figura 2) muestra una pendiente constante de los 0 °C hasta los 180 °C, con una pérdida del 10% en peso atribuible a la pérdida de agua fisisorbida. De los 180 °C a los 250 oC se observa una relativa estabilidad que se rompe abruptamente entre los 300 °C y 350 oC con una pérdida cerca de 25% en peso y un pico endotérmico que nos indica la pérdida de agua interlaminar, una descarboxilación y deshidroxilación parcial que generan una fase de oxi-hidróxido de Mg/Fe. Una vez alcanzados los 650 oC, se ha perdido un 40% en peso y el compuesto se ha transformado en óxido. Las reacciones asociadas al proceso de descomposición térmica de un compuesto tipo hidrotalcita Mg/Fe son las siguientes:
Prueba de remoción de arsénico
Para cada contacto se pesó y registró minuciosamente la cantidad de material adsorbente que varió entre 0.0028 g y 0.0022 g. Las concentraciones iniciales de arsénico se determinaron por espectroscopia de adsorción atómica y se encontró variación con respecto a las concentraciones iniciales teóricas propuestas. Para elaborar las isotermas de adsorción para cada material, se calculó q a partir de las concentraciones en el equilibrio Ce de cada contacto obtenidas. En la Tabla 1 se muestran algunos de los valores más representativos empleados para elaborar la isoterma.
Tabla 1 Valores representativos de los contactos para las diferentes concentraciones iniciales de arsénico.
| Valores representativos de los contactos para las diferentes concentraciones iniciales de arsénico. | |||||
| Los valores mostrados en la tabla corresponden a: el nombre del material, la cantidad de material empleado, la concentración inicial, la concentración en el equilibrio, la capacidad de remoción del material y el porcentaje de remoción. | |||||
| Material adsorbente |
Cant. Material adsorbente M (g) |
Concentración inicial C0 (μg/L) |
Concentración en el equilibrio Ce (μg/L) |
Capacidad de adsorción q (μg/g) |
%
de remoción (1-(Ce /C0))*100 |
| HT100 | 0.0027 | 14.0 | 1.9 | 45.0 | 86.44 |
| HT100 | 0.0027 | 55.8 | 3.6 | 193.3 | 93.54 |
| HT100 | 0.0025 | 128.6 | 1.5 | 508.1 | 98.80 |
| HT100 | 0.0025 | 617.9 | 15.0 | 2411.6 | 97.58 |
| HT100 | 0.0026 | 1176.1 | 54.1 | 4315.7 | 95.40 |
| HT100 | 0.0022 | 65 201.5 | 50 042.2 | 68 905.5 | 23.25 |
| HT100 | 0.0025 | 148 480.1 | 115 030.2 | 133 799.6 | 22.53 |
| HT100 | 0.0022 | 262 917.3 | 205 928.0 | 259 042.2 | 21.68 |
| HT100 | 0.0025 | 553 495.8 | 461 828.8 | 366 667.8 | 16.56 |
| HT350 | 0.0023 | 14.0 | 2.0 | 52.3 | 85.71 |
| HT350 | 0.0027 | 55.8 | 3.4 | 194.1 | 93.91 |
| HT350 | 0.0023 | 128.6 | 2.0 | 550.2 | 98.42 |
| HT350 | 0.0022 | 617.9 | 12.5 | 2751.4 | 97.97 |
| HT350 | 0.0022 | 1068.0 | 18.7 | 4769.3 | 98.25 |
| HT350 | 0.0025 | 65 201.5 | 32 747.9 | 129 814.1 | 49.77 |
| HT350 | 0.0025 | 148 480.1 | 101 365.5 | 188 458.2 | 31.73 |
| HT350 | 0.0025 | 274 755.1 | 193 336.6 | 325 673.9 | 29.63 |
| HT350 | 0.0022 | 553 495.8 | 454 996.5 | 447 724.0 | 17.80 |
Fuente: Elaboración propia.
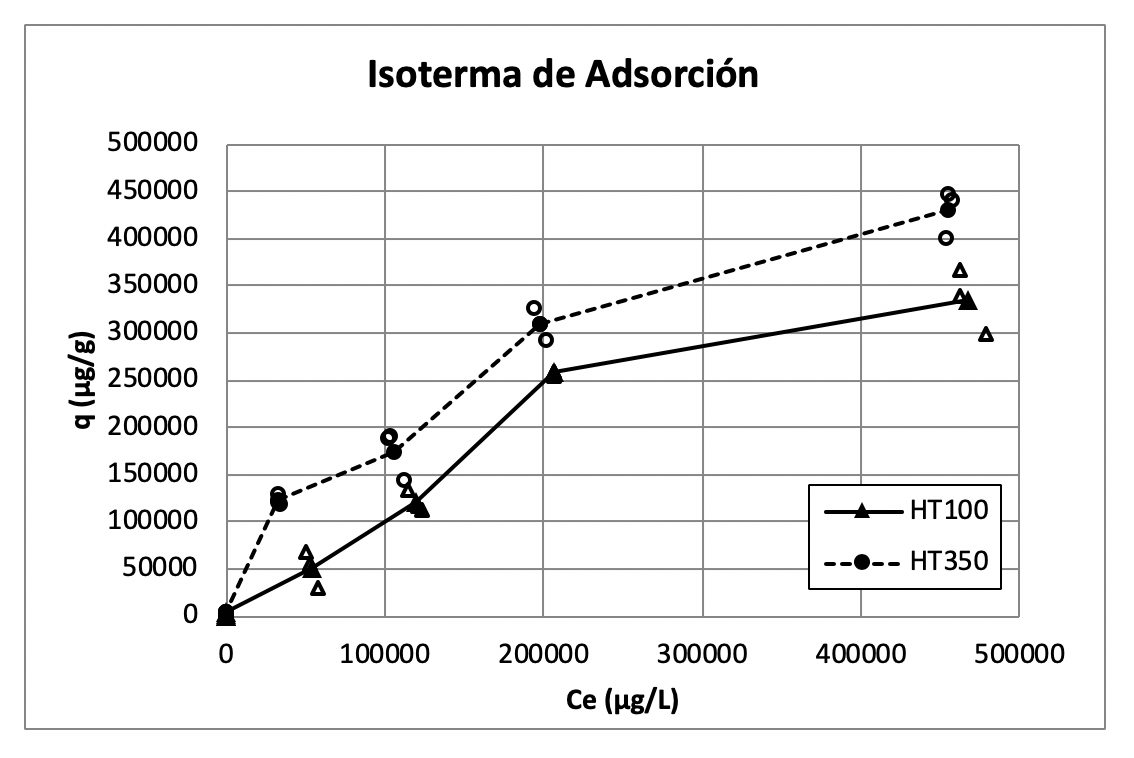
Para los contactos con concentraciones iniciales de arsénico en el intervalo de 65 ppm a 553 ppm se registran remociones entre 11% a 23% con el material HT 100, mostrando el valor más alto de q en 366.6 mg/g. Para el material HT 350 los porcentajes de remoción en este intervalo de concentraciones iniciales están entre 17% a 49%, con el valor más alto de q en 447.7 mg/g. En la Figura 3 se observan las isotermas de los materiales HT 100 y HT 350 de los contactos para estas concentraciones iniciales. Debido al porcentaje de remoción, la concentración en el equilibrio Ce se acerca mucho a la concentración inicial C0.
Fuente: Elaboración propia.
Figura 3 Isotermas de los materiales HT 100 y HT 350 en el intervalo de 65 ppm a 553 ppm.
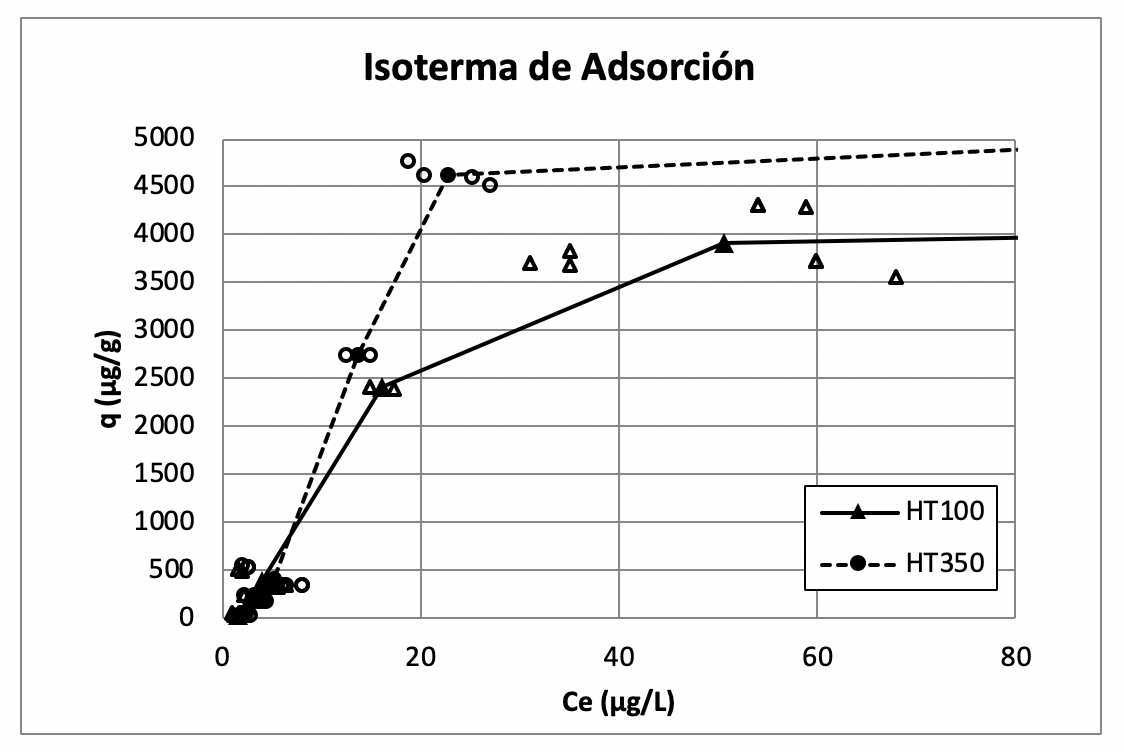
Los contactos que se hicieron con concentraciones iniciales de arsénico en el intervalo de 14 ppb a 1176 ppb mostraron porcentajes de remoción entre 86.4% a 98.8% para el material HT 100 y el valor más alto de q en este intervalo es de 4.315 mg/g. El material HT 350 presenta para este intervalo de concentraciones iniciales porcentajes de remoción entre 84% a 98.42%, y el valor más alto de q es de 4.769 mg/g. En la Figura 4 se observan las isotermas para estos contactos a menor concentración inicial, donde se puede observar que, debido al alto porcentaje de remoción los valores de la Ce, son mucho menores que los de la C0.
Contacto con muestras naturales
Para el contacto con las muestras naturales se emplearon las mismas condiciones que con las soluciones sintéticas. En la Tabla 2 se muestran los resultados de dichas mediciones así como el cálculo de q para cada caso.
Tabla 2 Resultados de contacto con las muestras naturales.
| Datos de concentración, masa, q y origen del agua. | |||||
| Origen del agua | Material Ad. | Ce (μg/L) | C0 (μg/L) | M (g) | q (μg/g) |
| Surgencia | HT100 | 0.90 | 31.64 | 0.0026 | 118.214 |
| HT350 | 0.23 | 31.64 | 0.0026 | 120.784 | |
| Mezcla surgencia | HT100 | 1.54 | 12.51 | 0.0025 | 43.888 |
| HT350 | 0.76 | 12.51 | 0.0023 | 51.068 | |
| Socavón Arsenical | HT100 | 77.64 | 116.85 | 0.0024 | 163.378 |
| HT350 | 28.72 | 116.85 | 0.0023 | 383.164 | |
| Manantial | HT100 | 6.70 | 31.29 | 0.0027 | 91.043 |
| HT350 | 5.79 | 31.29 | 0.0024 | 106.233 | |
Fuente: Elaboración propia.
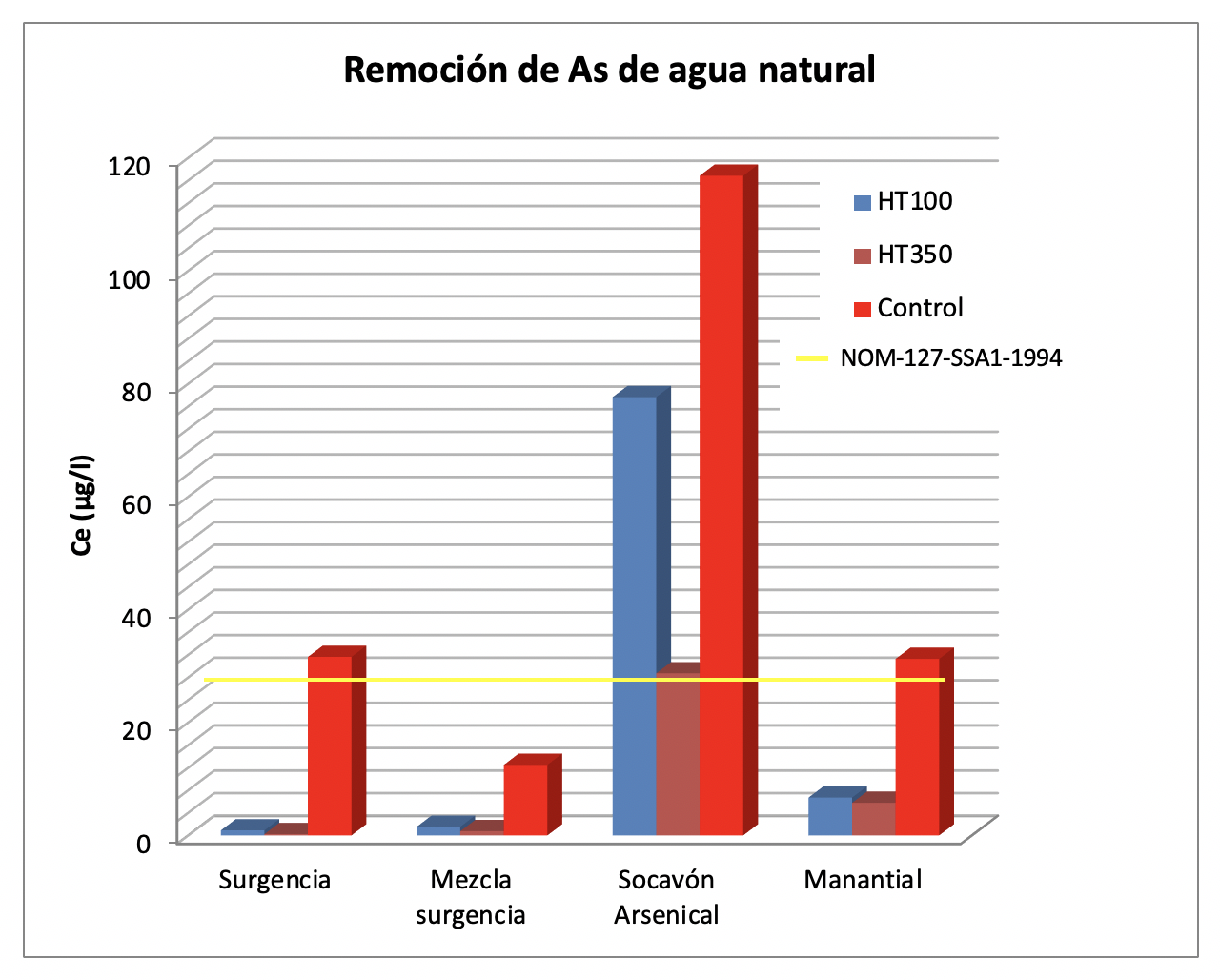
Para las muestras de surgencia y manantial la concentración inicial de arsénico es de 31 μg/L. Para estas muestras, los dos materiales lograron reducir la concentración inicial a una concentración por debajo de la norma oficial mexicana NOM-127-SSA1-1994 (Diario Oficial de la Federación [DOF], 2000), siendo el material HT350 el que mejor resultado mostró para surgencia y para el manantial. Para la muestra de socavón arsenical la concentración inicial de arsénico es bastante alta: 116 μg/L y el material HT350 es el que mayor remoción mostró, reduciéndola a 28.72 μg/L, muy cerca de la norma oficial mexicana como se muestra en la Figura 5. También, es este mismo material el que presenta mayor valor en q, con 383.164 μg/g, como se aprecia en la Figura 6.
Discusión
Caracterización
Como se aprecia en la Figura 1, se puede constatar debido a la aparición de los picos característicos de un compuesto tipo HT que la síntesis del compuesto ha sido exitosa, aunque es apreciable que debido a la gran cantidad de ruido en la señal HT100 se trata de un compuesto con una baja cristalinidad. En el caso del material HT350 tratado térmicamente, se aprecia que se pierde esa estructura laminar y el material se torna más amorfo. El análisis térmico diferencial y el termogravimétrico nos muestran que aun el material HT350 sigue siendo un hidróxido doble, el cual en este caso ya comienza a perder sus aniones interlaminares a diferencia del material HT100, que solo ha perdido el agua físisorbida o superficial.
Prueba de remoción de arsénico
En general, ambos materiales tienen una capacidad de adsorción muy similar especialmente a bajas concentraciones de arsénico; sin embargo, puede observarse en las isotermas que el material HT350 tiene mejor desempeño. Hay que aclarar que, aunque la tendencia de los datos de las isotermas es consistente, la dispersión de los datos obtenidos aumenta considerablemente conforme aumenta la concentración en el equilibrio. Esto se debe a que la técnica para leer altas concentraciones es hacer más de una dilución, lo que acarrea mucha variabilidad. Aun así, los resultados obtenidos son muy útiles en el sentido en que determinan con claridad la superioridad del material HT350 sobre el material HT100.
Contacto con muestras naturales
El experimento de contacto con muestras naturales contaminadas con arsénico pone de manifiesto la aplicabilidad de los materiales adsorbentes. Se observó una remoción favorable de arsénico a niveles por debajo de la norma oficial mexicana NOM-127-SSA1-1994 (DOF, 2000) en la mayoría de los casos. Es evidente la reducción de la capacidad de remoción q en estos experimentos con respecto a los contactos con las soluciones sintéticas, debido a la interacción del material adsorbente con diversos iones existentes en la muestra de agua, especialmente carbonatos.
Conclusiones
Es apreciable que ambos materiales, HT100 y HT350, tienen un desempeño similar a bajas concentraciones de arsénico, mostrándose ligeramente superior el material HT350, el cual es mejor en todos los casos. La evaluación de la capacidad de adsorción de arsénico muestra que el material HT350 tiene el mejor desempeño de manera general, mostrando un valor de q de 447.7 mg/g para 0.0022 g de material a una concentración inicial de 553.4958 mg/L, con 17.8% de remoción. Para las pruebas con bajas concentraciones en el intervalo de 10 ppb a 1000 ppb mostró el mismo material el mayor valor q de 4.7693 mg/g, con 98.25% de remoción. Derivado de los experimentos con muestras naturales, se plantea el potencial que poseen estos materiales como alternativa para ser integrados en un proceso de tratamiento de agua contaminada con arsénico con resultados favorables.











 text new page (beta)
text new page (beta)