Introducción
El sistema inmunológico consta de varios grupos celulares, los cuales en conjunto ayudan a proteger al organismo de infecciones. Estos grupos celulares pueden variar en cuanto a isotipo y número durante el proceso de maduración del individuo, así como con el contacto que se pudiera llegar a tener con distintos agentes infecciosos (Lin et al., 2016). Estas diferencias son importantes y hay que determinarlas, ya que ayudan a establecerse como valores de referencia, pueden servir en la práctica clínica y ser usados para un correcto diagnóstico o para la detección de algún proceso patológico en los pacientes pediátricos.
Entre los diferentes tipos celulares se encuentran los linfocitos TCRCD3+CD4+CD8- y TCRCD3+CD4-CD8+ (Golubovskaya & Wu, 2016; Kotfis, Biernawska, Zegan-Barańska & Żukowski, 2015). Estas subpoblaciones presentan el antígeno de superficie CD45, también conocido como antígeno leucocitario común, una glicoproteína de membrana que se presenta en diferentes isoformas: por ejemplo, la proteína CD45RA, que es característica de células vírgenes, es decir, células que no han tenido contacto con algún agente infeccioso; y el marcador CD45RO presente en las células de memoria o activadas, el cual se relaciona con linfocitos que ya tuvieron contacto con algún agente infeccioso (Golubovskaya et al., 2016).
Adicionalmente, los linfocitos T también expresan otros fenotipos relacionados con funciones efectoras, que se pueden reconocer con los marcadores de superficie CD28 y el CD62L (L-selectina). La pérdida de estos marcadores resulta en la diferenciación a células CD28- o CD62L- (Nájera, González, Cortés, Toledo & Ortiz, 2007). Las células CD4+CD62L- con funciones ayudadoras migran hacia los sitios de inflamación y daño, donde ponen en evidencia sus funciones efectoras con la producción de citocinas dependiendo del tipo de respuesta Th1 (IL-2, TNF-ɣ e IFN-ɣ) o Th2 (IL-4, IL-5, IL-6) (Moore et al., 2011). Las células CD8+CD28- tienen funciones citotóxicas y son productoras de perforinas y granzimas, las cuales propician la eliminación de células blanco, así como de citocinas, principalmente IFN-γ y TNF-α. A este tipo celular se le ha relacionado con la eliminación de bacterias intracelulares, así como con la respuesta de tipo T1 (Prezzemolo et al., 2014).
El objetivo del presente estudio fue evaluar la proporción de leucocitos y linfocitos de memoria y efectores en sangre periférica de niños en edad preescolar para establecerlos como valores de referencia.
Materiales y Métodos
Pacientes y obtención de muestras de sangre
Se obtuvieron muestras de sangre periférica (3 ml) de niños preescolares, de ambos sexos, sin algún proceso infeccioso, que fueron hospitalizados para realizarles cirugías ambulatorias, principalmente por procesos de fimosis fisiológica y las niñas por la presentación de hernias, en el Hospital Materno-Pediátrico Xochimilco del Gobierno del Distrito Federal (GDF). Para ingresar a quirófano, se realizan biometrías hemáticas como estudio preoperatorio por parte del hospital, datos que fueron proporcionados, con los cuales se obtuvo el promedio de hemoglobina, leucocitos, linfocitos y neutrófilos. Los criterios de exclusión fueron niños que presentaban algún tipo de proceso infeccioso, enfermedades congénitas, autoinmunes, complicaciones en el parto, enfermedades cardiacas, prematuros, con transfusiones o individuos en cuyas muestras no mostraron datos. Todos los niños tenían de 6 a 60 meses, con el peso y la talla esperados para su edad cronológica de acuerdo con los valores establecidos para niños por la Organización Mundial de la Salud (OMS, 2008). Se formaron tres grupos de niños por edad para el análisis de los datos, de acuerdo a trabajos previos y en relación a su clasificación en lactantes, preescolar y mayores de cuatro años: Grupo A: 6 a 24 meses (n = 41), Grupo B: 25 a 48 meses (n = 31) y Grupo C: 49 a 60 meses (n = 22). Dependiendo de la subpoblación a evaluar, fue el número de individuos analizados, debido a que se eliminaron algunos por lo mencionado anteriormente en el apartado de criterios de exclusión (Tabla 1).
Tabla 1 Características de los pacientes pediátricos.
| Grupo | Edad (Intervalo) |
| A
(n = 49) M-36 F-13 |
(6m - 24m) |
| B (n = 31) M-22 F-9 |
(25m -48m) |
| C
(n = 22) M-13 F-9 |
(49m - 60m) |
n: número de muestras, m: meses, M: masculino, F: femenino
Grupo A: Niños lactantes; Grupos B: Niños preescolares <4 años y Grupo C: Niños preescolares >4 años.
Fuente: Elaboración propia.
El estudio fue aprobado por el Comité Médico de Ética de la Dirección General de Servicios Médicos del GDF, Ciudad de México, Oficio No. DEI/70553/09.
Tinción de células
La sangre fue colectada en tubos con anticoagulante EDTA (ácido etilendiaminotetraacético) (Becton Dickinson Vacutainer Systems, Franklin Lakes, N.J.) y procesada el mismo día de su obtención. La combinación de anticuerpos conjugados utilizados fueron: FITC-anti-CD45/PE-anti-CD14; FITC-anti-CD3/PE-anti-CD16+CD56/PerCP-anti-CD19; FITC-anti-CD45RA/PE-anti-CD45RO/PerCP-anti-CD3/APC-anti-CD4; FITC-anti-CD45RA/PE-anti-CD45RO/PerCP-anti-CD3/APC-anti-CD8; FITC-anti-CD4/PE-anti-CD62/PerCP-anti-CD3; y FITC-anti-CD8/PE-anti-CD28/PerCP-anti-CD3 (Becton Dickinson, San José, CA). Cada combinación de anticuerpos (20 µL) se incubó con 100 µL de sangre completa durante 20 minutos en obscuridad a temperatura ambiente. Posteriormente, a los tubos se les agregó solución de lisis para eliminar los eritrocitos, y las células fueron lavadas con solución salina amortiguada por fosfatos (PBS). Las células fueron fijadas con paraformaldehído al 1%.
Análisis por medio de citometría de flujo
Los datos se obtuvieron y analizaron con el programa CellQuest II en el citómetro de flujo modelo FACSCalibur (BD Immunocytometry Systems, San José, CA), el cual fue previamente calibrado con perlas CaliBRITE. En cada evento se analizaron 10 000 células. La evaluación de la proporción de leucocitos y diferentes subpoblaciones de linfocitos se llevó a cabo mediante forward-scatter y FL-1, FL-3 y FL-4, dependiendo de la subpoblación que se deseaba examinar. Los datos fueron analizados usando gráficos de puntos con dos fluorescencias (FL-1 vs. FL-2) (Figura 1).
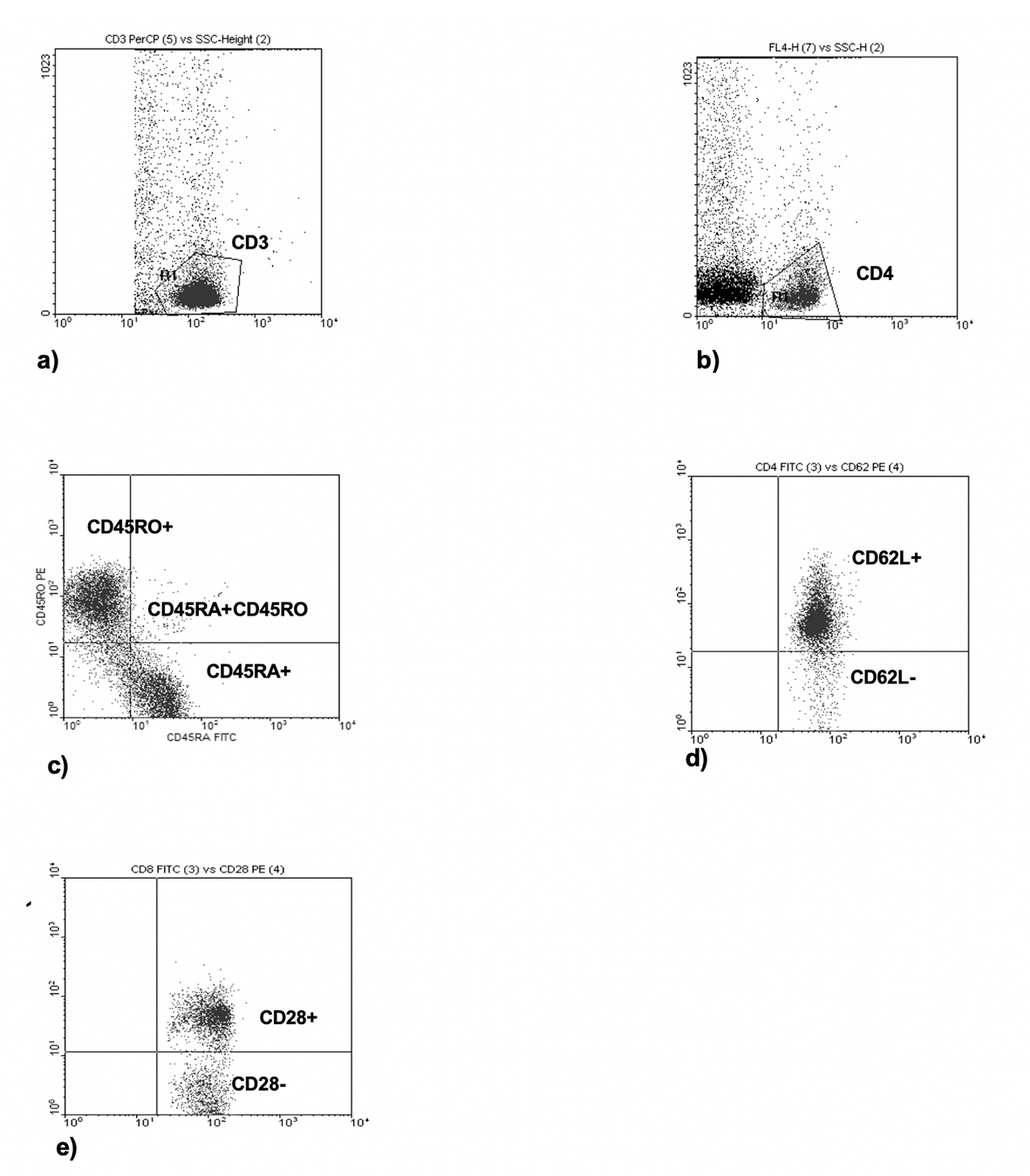
Fuente: Elaboración propia.
Figura 1 Regionalización y gráficas de puntos. a) y b) Regiones en FL-3-SSC, y FL-4-SSC para las subpoblaciones CD4+ o CD8+; c) Dot Plot FL-1-FL-2 para definir células vírgenes y de memoria (CD45RA+ y CD45RO+); d) Dot Plot FL-1-FL-2 para definir células ayudadoras (CD4+CD62L-); e) Dot Plot FL-1-FL-2 para definir células citotóxicas (CD8+CD28-).
Los números absolutos de células en las diferentes poblaciones se calcularon multiplicando el porcentaje de la subpoblación seleccionada/100 por el recuento total de linfocitos de la biometría hemática/100 por el número de leucocitos de la biometría hemática de cada paciente.
Análisis estadístico
Se determinaron por grupo de estudio los porcentajes promedio, la media de números absolutos y el error estándar de cada subpoblación celular estudiada utilizando el programa estadístico de JMP versión 12.0 (Instituto SAS, Carolina del Norte, USA, 2010). La significancia estadística entre los grupos relacionados fue determinada usando la “t” de student y se consideró significativo cuando p < 0.05.
Resultados
Se analizaron 102 muestras sanguíneas de niños preescolares, de los cuales 74 fueron niños (69.6%) y 28 fueron niñas (30.4%). De acuerdo con la biometría hemática (BH) practicada a los niños en el hospital, se encontró un porcentaje promedio de 13.1 g/dL±1.7 g/dL de hemoglobina (Hb); 8.1±2.5×106 células/dL de leucocitos, de los cuales el 50.3%±14% fueron linfocitos y 36%±13% de neutrófilos.
Subpoblaciones linfocitarias
El análisis con citometría de flujo de los distintos tipos de leucocitos mostró que el porcentaje promedio de los linfocitos totales fue mayor en el grupo de niños de 25 a 48 meses (59.1%±1.4%, p < 0.02) en comparación con los niños de 6 a 24 meses de edad (54.5%±1.2%) y sin diferencias con los niños de 49 a 60 meses (56.8%±1.7%). En los granulocitos y monocitos fue a la inversa, los porcentajes menores se observaron en los niños de 25 a 48 meses (32.2%±1.3% y 4.9%±0.7%, respetivamente), con relación a los niños de 6 a 24 meses (35.7%±1.1% y 6.8%±0.5%, respectivamente, p < 0.04), sin diferencias con los niños de 49 a 60 meses (33.6%±1.5% y 6.3%±0.8%, respectivamente) (Tabla 2). No se encontraron diferencias en los números absolutos.
Tabla 2 Porcentajes y números absolutos en sangre periférica de leucocitos y subpoblaciones linfocitarias de pacientes pediátricos por grupo de estudio.
| Tipo celular | Grupo A n = 49 | Grupo B n = 31 | Grupo C n = 22 |
| Linfocitos
(CD45+) |
54.5 ± 1.2*
2696.5 ± 225.8 |
59.1 ± 1.4 2924.0 ± 263.5 |
56.8 ± 1.7 2810.3 ± 320.0 |
| Granulocitos (CD45+) |
35.7 ± 1.1* 1645.0 ± 123.3 |
32.2 ± 1.3 1483.8 ± 145.8 |
33.6 ± 1.5 1548.3 ± 168.2 |
| Monocitos (CD14+) |
6.8 ± 0.5* 300.4 ± 38.2 |
4.9 ± 0.7 216.4 ± 53.4 |
6.3 ± 0.8 278.3 ± 61.1 |
| Linfocitos T (CD3+) |
56.0 ± 2.4
2403.1 ± 239.7 |
50.7 ± 3.2
2175.6 ± 319.6 |
60.7 ± 3.7* 2604.7 ± 369.5 |
| Linfocitos B
(CD19+) |
15.6 ± 0.9*
760.4 ± 74.4 |
11.3 ± 1.3
550.8 ± 107.4 |
14.8 ± 1.5
721.4 ± 123.9 |
| NK (CD16+CD56+) |
14.7 ± 1.3* 810.5 ± 105.5 |
19.5 ± 1.7 1075.1 ± 137.9 |
13.6 ± 2.1*
749.8 ± 170.3 |
Números absolutos (106/L) indicados en negritas
Datos expresados como media ± error estándar
n: número de niños
* Significa diferencia estadística con el grupo 25 a 48 meses en los porcentajes de: linfocitos totales, p < 0.02; granulocitos, p < 0.04; monocitos,
p < 0.04; linfocitos T, p < 0.04; linfocitos B, p < 0.01; NK, p < 0.03.
Fuente: Elaboración propia.
El porcentaje de linfocitos T (CD3+) fue más alto entre los niños de 49 a 60 meses (60.7%±3.7%), en comparación con los niños de 25 a 48 meses (50.7%±3.2%, p < 0.04), y sin diferencias con los niños de 6 a 24 meses (56.0±2.4%). En linfocitos B (CD19), los que exhibieron los porcentajes más altos fueron los niños de 6 a 24 meses (15.6%±0.9%), con relación a los niños de 25 a 48 meses (11.3%±1.3%, p < 0.01), sin diferencias con los niños de 49 a 60 meses (14.8%±1.5%). En las células NK, el grupo de los niños de 25 a 48 mostraron los porcentajes más altos (19.5%±1.7%), con relación a los niños de 6 a 24 meses (14.7%±1.3% y 13.6%±2.1%, respectivamente, p < 0.03) (Tabla 2).
Células de memoria
En el análisis de los linfocitos T vírgenes (CD3+CD45RA+, CD4+CD45RA+ y CD8+CD45RA+) se observó que estos disminuyeron en los niños de 49 a 60 meses (63.7%±2.5%, 57.3%±2.9% y 60.4%±3.0%; p < 0.03, p < 0.006 y p < 0.007, respectivamente) con relación al grupo de niños de entre 6 y 24 meses (69.0%±1.7%, 71.2%±2.0% y 69.5%±2.1%, respectivamente), y se observaron también diferencia con los niños de 25 a 48 meses en las células CD3+CD45RA+ (69.0%±2.3%, p < 0.03) y CD4+CD45RA+ (67.5%±2.6%, p < 0.006) (tabla 3). No se encontraron diferencias en los números absolutos.
Con respecto a las células de memoria, se encontró un mayor porcentaje en los niños de 49 a 60 meses en las células CD3+CD45RO+ (20.6%±1.6%, p < 0.05) y CD4+CD45RO+ (23.1%±2.3%, p < 0.02), comparado con los niños de 6 a 24 meses (15.8%±1.1% y 16.6%±1.4%, respectivamente). Respecto a las células CD8+CD45RO+, el aumento se observó en los niños de 25 a 48 meses (19.8%±2.4%) con respecto a los niños de 6 a 24 meses (15.2%±1.7%, p < 0.04). No se encontraron diferencias en los números absolutos (Tabla 3).
Tabla 3 Porcentajes y números absolutos en sangre periférica de células vírgenes (CD45RA+) y de memoria (CD45RO+) en pacientes pediátricos por grupo de estudio.
| Tipo celular | Grupo A n = 45 | Grupo B n = 27 | Grupo C n = 20 |
| CD3+ | 48.0 ± 3.7 2344.8 ± 338.4 |
52.0 ± 4.8
2540.2 ± 439.0 |
55.8 ± 5.6
2725.8 ± 512.1 |
| CD3+CD45RA+ | 69.0 ± 1.7*
3561.9 ± 281.7 |
69.0 ± 2.3
3561.9 ± 381.1 |
63.7 ± 2.5 3288.3± 414.2 |
| CD3+CD45RO+ | 15.8 ±
1.1# 736.2 ± 85.3 |
18.5 ± 1.5 862.0 ± 116.3 |
20.6 ± 1.6
959.8 ± 124.0 |
| CD3+CD45RA+CD45RO+ | 9.5 ± 0.8
441.6 ± 70.4 |
9.5 ± 1.1
441.6 ± 96.8 |
11.11 ± 1.2
516.4 ± 105.6 |
| CD4+ | 29.7 ± 2.5
1365.9 ± 235.4 |
33.4 ± 3.2 1536.0 ± 301.3 |
31.8 ± 3.6 1462.4 ± 338.9 |
| CD4+CD45RA+ | 71.2 ± 2.0*
3313.3 ± 294.6 |
67.5 ± 2.6*
3141.1 ± 382.9 |
57.3 ± 2.9
2666.4 ± 427 |
| CD4+CD45RO+ | 16.6 ± 1.4#
722.0 ± 113.3 |
20.6 ± 1.9 895.9 ± 153.7 |
23.1 ± 2.3
1004.6 ± 186.0 |
| CD4+CD45RA+CD45RO+ | 7.5 ±
1.0# 435.0 ± 82.0 |
12.3 ± 1.3
713.4 ± 155.8 |
9.9 ± 1.4
574.2 ± 167.7 |
| CD8+ | 17.6 ± 1.2
794.6 ± 123.9 |
17.7 ± 1.6
799.1 ± 165.2 |
19.8 ± 1.8
893.9 ± 185.8 |
| CD8+CD45RA+ | 69.5 ± 2.1*
3015.9 ± 291.9 |
66.5 ± 3.0
2885.7 ± 417 |
60.4 ± 3.0 2620.9 ± 417 |
| CD8+CD45RO+ | 15.2 ±
1.7# 726.5 ± 132.4 |
19.8 ± 2.4 1045.1 ± 170.9 |
16.0 ± 2.4
764.7 ± 186.9 |
| CD8+CD45RA+CD45RO+ | 9.9 ±1.8#
565.4 ± 114.5 |
17.4 ± 2.4
839.5 ± 152.6 |
15.6 ± 2.4
752.6 ± 152.6 |
Números absolutos (106/L) indicados en negritas
Datos expresados como media ± error estándar
n: número de niños
* Significa diferencia estadística con el grupo 49 a 60 meses en los porcentajes de: CD3+CD45RA+, p < 0.03; CD4+CD45RA+, p < 0.006, y CD8+CD45RA+, p < 0.007; CD3+CD45RO+, p < 0.05 y CD4+CD45RO+, p < 0.02.
# Significa diferencia estadística con el grupo >2 a 4 años en los porcentajes de: CD8+CD45RO+, p < 0.04; CD4+CD45RA+CD45RO+, p < 0.02; y CD8+CD45RA+CD45RO+, p < 0.03.
Fuente: Elaboración propia.
Las células dobles positivas CD4+CD45RA+CD45RO+ y CD8+CD45RA+ CD45RO+ aumentaron en el grupo de 25 a 48 meses (12.3%±1.3% y 17.4%±2.4%; p < 0.02 y p < 0.03, respectivamente) a diferencia del grupo de seis a 24 meses (7.5%±1.0% y 9.9%±1.8%) (Tabla 3). No se encontraron diferencias en los números absolutos.
Células efectoras
Se encontraron diferencias significativas en las células CD8+ en el grupo de niños de 49 a 60 meses de edad, en comparación con los otros dos grupos (18.3±1.8 vs. 14.4±1.1 y 10.4±1.4, respectivamente, p < 0.004). Respecto a las células citotóxicas (CD8+CD28-), se presentó una disminución en estas células conforme fue aumentando la edad (32.4%±2.7%, 23.9%±3.7%, y 18.1%±5.0%, respectivamente), encontrando diferencia estadística entre los niños de 49 a 60 meses y los de 6 a 24 meses (p < 0.02) (Tabla 4). No se encontraron diferencias en los números absolutos.
Tabla 4 Porcentajes y números absolutos en sangre periférica de células ayudadoras (CD4+CD62L-) y citotóxicas (CD8+CD28-) de pacientes pediátricos por grupo de estudio.
| Tipo celular | Grupo A n = 46 | Grupo B n = 27 | Grupo C n = 18 |
| CD4+ | 24.4 ± 2.2
1255.5 ± 195.6 |
23.8 ± 3.0
1224.6 ± 266.7 |
22.6 ± 4.2
1162.8 ± 373.8 |
| CD4+CD62L- | 14.9 ± 2.0 902.2 ± 208.0 |
14.2 ± 2.8 859.8 ± 291.2 |
13.1 ± 4.1 575.7 ± 426.4 |
| CD8+ | 14.4 ± 1.1*
1516.0 ± 205.9 |
10.4 ± 1.4*
1094.8 ± 262.0 |
18.3 ± 1.8
1926.4 ± 336.8 |
| CD8+CD28- | 32.4 ± 2.7
714.2 ± 98.5 |
23.9 ± 3.7 526.8 ± 134.9 |
18.1 ± 5.0* 398.9 ± 182.2 |
Números absolutos (106/L) indicados en negritas
Datos expresados como media ± error estándar
n: número de niños
* Significa diferencia estadística con el grupo de 49 a 60 meses: CD8+ p < 0.004; # Significa diferencia estadística con el grupo de seis a 24 meses: CD8+CD28- p < 0.02.
Fuente: Elaboración propia.
Discusión
A lo largo de la historia de la inmunología en diferentes lugares del mundo, se han determinado por medio de citometría de flujo los valores de diferentes poblaciones leucocitarias y subpoblaciones linfocíticas en la población infantil (Tosato et al., 2015). Actualmente en México, el conocimiento de esta área es necesaria, ya que existen pocos estudios sobre los valores normales de los diferentes inmunofenotipos en pacientes pediátricos.
La evaluación de las subpoblaciones leucocitarias y linfocitarias periféricas en población pediátrica es de suma relevancia, ya que permite visualizar el movimiento que estas células realizan a través de la niñez, que se relaciona con el encuentro con los diferentes agentes infecciosos, su madurez y su capacidad de respuesta (Torres et al., 2017), por lo que se consideró importante realizar la valoración de estas células en niños sin infecciones de diferentes edades y así poder establecerlos como rangos de referencia.
Los procesos de maduración de las células linfoides están acompañados por cambios en la expresión de marcadores de superficie celulares, así como marcadores intracelulares (Piątosa et al., 2010). Un ejemplo de esto son las células activadas o con funciones efectoras.
Otro proceso es los cambios en la proporción que estas células exhiben en la sangre. Se observó que los leucocitos (granulocitos y monocitos) de los niños entre 25 y 48 meses mostraban los porcentajes más bajos que los dos grupos restantes, lo cual no concuerda con los resultados reportados por Idigbe et al. (2010) en un estudio realizado con niños nigerianos, mostrando esos pacientes una disminución de células blancas conforme fue aumentando la edad. Por otro lado, Sagnia et al. (2011) encontró una disminución de leucocitos de casi el 30% entre niños de 1 a 11 meses y 36 a 60 meses; estos datos se apegan más a lo que se reporta en este trabajo.
En el caso de las células Natural Killer, los niños de 25 a 48 meses exhibieron los porcentajes más altos que los otros grupos de niños, probablemente debido a la exposición a agentes patógenos durante esta etapa de la vida. Las células citotóxicas naturales (NK) representan una población de linfocitos que son el componente fundamental en la respuesta inmunitaria innata contra una gran variedad de microorganismos patógenos y células tumorales. Los mecanismos que pueden mediar la lisis celular por medio de las NK son diversos; entre los más importantes se encuentra la vía de citotoxicidad dependiente de gránulos como perforinas y granzimas que dañan la membrana y el DNA o la vía de CD95/CD95L. Estas células NK no son solo citotóxicas, sino que tienen la capacidad de secretar citocinas como IFN-γ, TNF-α y GM-CSF, así como quimiocinas (MIP-1β y RANTES) (Mandal & Viswanath, 2015).
Respecto a los porcentajes encontrados en las células vírgenes y de memoria, se observó en general una disminución en las subpoblaciones vírgenes (CD3+CD45RA+, CD4+CD45RA+ y CD8+CD45RA+) y un aumento en las subpoblaciones de memoria (CD3+CD45RO+, CD4+CD45RO+), lo cual concuerda con varios trabajos realizados, que muestran esa misma tendencia conforme va aumentando la edad (Fülöp, Larbi & Pawelec, 2013; Pulko et al., 2016; Saule et al., 2010), esto se relaciona con el encuentro de los linfocitos con antígenos, por la susceptibilidad de los niños menores a contraer enfermedades, que se relaciona a la inmadurez inmunológica y a la formación del agrupamiento de células que se va formando para la defensa del organismo.
Por otra parte, en un estudio realizado en China por Ding et al. (2018) se observa que en niños de 13 a 48 meses existe un incremento en células NK y células de memoria a diferencia de los niños de 6 a 24 meses.
La respuesta mediada por células CD4+ y CD8+ de memoria es más rápida y específica, además de que pueden controlar infecciones secundarias eliminando de forma más eficiente y totalmente al agente patógeno (Kaech, Wherry & Ahmed, 2002). Los linfocitos T CD4+ de memoria tienen la facultad de fortalecer la respuesta inmunológica, esto al tener la capacidad de activar y reclutar las células de la inmunidad innata (macrófagos, células dendríticas y NK) y adaptativa (linfocitos T y B), que en conjunto potencializan la eliminación de agentes infecciosos como bacterias y virus (Booth et al., 2010).
Se ha señalado que, en otros países en vías de desarrollo como los que pertenecen al continente africano, no hay datos que describan variaciones con la edad en subpoblaciones de linfocitos activados, vírgenes y de memoria, probablemente debido a la malnutrición (Sagnia et al., 2011).
La diferenciación de células T CD8+ vírgenes hacia células efectoras está altamente relacionada con la expansión clonal, ya que las células vírgenes están programadas para expandirse y diferenciarse a células citotóxicas después del contacto con el antígeno y de recibir las señales de las moléculas coestimuladoras y citocinas. Sin embargo, las propiedades de células efectoras son adquiridas de 2 a 24 horas después de la estimulación; este desarrollo consta de varias ventajas, ya que evita que las células citotóxicas queden atrapadas en los órganos linfoides y puedan migrar hacia el sitio de infección y/o inflamación, eliminando a las células infectadas (Mertens et al., 2009). En el presente trabajo no se encontraron diferencias en las células efectoras CD4+CD62L- en los grupos de estudio; pero, en las células CD8+CD28-, los niños de seis a 24 meses presentaron los porcentajes más altos que los niños de 49 a 60 meses. Cabe destacar que todos los niños en el momento del estudio estaban sanos y que estas células aumentan con la presencia de infecciones (Nájera et al., 2007) o de alguna otra patología como asma (Eusebio, Kraszulą, Kupczyk, Kuna & Pietrucz, 2013; Lourenço, Fonseca & Taborda-Barata, 2016). El haber encontrado estas células aumentadas en los niños más pequeños se puede relacionar con que esta es la época en que entran en contacto con los antígenos.
A pesar de que existen varios trabajos de valores de referencia de subpoblaciones linfocitarias a nivel mundial, pocos se han realizado en niños mexicanos que se encuentran en el rango de edad de 6 a 60 meses en buen estado de salud (Nájera et al., 2003). La mayoría de las investigaciones en México que se han llevado a cabo son con infantes que presentan alguna patología o, bien, en adolescentes y adultos. Los resultados de este trabajo coinciden con lo ya reportado en otros países que sugieren que existen cambios de isotipo y maduración inmunológica por el contacto con diversos agentes etiológicos, así como cambios en la proporción de diferentes células con el paso del tiempo.
Conclusiones
De acuerdo con estos resultados, se concluye que las poblaciones de leucocitos y de subpoblaciones de linfocitos muestran un cambio en sus porcentajes conforme a la edad de los niños, ya que existen varios factores ambientales que pueden influenciar los inmunofenotipos.
El conocer los valores normales de estas poblaciones y subpoblaciones, así como las variaciones por edad, podría contribuir a entender mejor el desarrollo del sistema inmunológico en los primeros años de vida, además de ser referencia para futuros estudios en niños que se encuentren en la etapa preescolar y poder diferenciar de un estado homeostático a un estado patológico en los pacientes pediátricos.











 nueva página del texto (beta)
nueva página del texto (beta)


