Introducción
En el tostado de granos de cacao se llevan a cabo simultaneamente procesos de transferencia de masa y energía que involucran reacciones químicas, que en conjunto representan un sistema complejo y heterogéneo. Los cambios se manifiestan en las propiedades físicas, químicas y sensoriales. Durante el tostado de granos de cacao, reacciones químicas como Maillard, caramelización de los azúcares, degradación de proteínas, formación de compuestos volátiles y la síntesis de compuestos azufrados están presentes (Cros, 1998; Luna, Crouzillat, Cirou & Bucheli, 2002; Sacchetti et al., 2016). Este tipo de reacciones permite los cambios en color, sabor y aroma desde el punto de vista sensorial, que serán apreciados en un producto final como el chocolate, la cocoa o la manteca. La disminución o incremento en estas características dependen de los compuestos de origen, el tipo de cultivar, las condiciones edafoclimáticas, el tratamiento poscosecha y el tostado (Saltini, Akkerman & Frosch, 2013).
El cotiledón de los granos de cacao sin fermentar contienen un alto contenido de grasa, fibra y agua, así como de carbohidratos, proteínas, polifenoles, purinas y minerales (da Silva, Fonseca, Spínola & da Silva, 2011). Estos compuestos serán modificados durante el proceso de fermentación mediante actividad microbiana en el mucílago y enzimática en el cotiledón, con intercambio de transporte de compuestos entre ambas regiones (Schwan & Wheals, 2004). En el mucílago, lo deseable es que los azúcares asimilables se transformen en alcohol y posteriormente en ácido acético mediante la acción de levaduras y bacterias acéticas, respectivamente. Sin embargo, la fermentación no es un proceso biológico con cultivos homogéneos es un proceso por contaminación endógena, por lo que existe la presencia de grupos de levaduras, bacterias lácticas, bacterias acéticas y bacilos. Lo anterior conlleva a la formación de una gran cantidad de compuestos volátiles (ácidos, alcoholes, ésteres, aldehídos). Simultáneamente, en el cotiledón los cambios incluyen la degradación de proteínas por proteasas, generando péptidos y aminoácidos; además de cambios en los azúcares reductores, estas sustancias serán la base para las reacciones de Maillard durante los procesos de deshidratación (secado y tostado) (Hashim, Selamat, Kharidah & Ali, 1998). El contenido de compuestos fenólicos disminuyen ampliamente durante los días de fermentación, además migran del interior del cotiledón hacia el mucílago, pasando a través de la testa; simultáneamente, las purinas (Teobromina y cafeína) son eliminadas por exudación (Timbie, Sechrisf & Keeney, 1978).
En el tostado de los granos de cacao se llevan a cabo cambios de naturaleza química y estos dependen de la forma en que ocurren los procesos de transferencia de calor y de variables como temperatura y tiempo. Se ha detectado la presencia de más de 600 compuestos volátiles como pirazinas, aldehídos, ésteres, tiazoles, fenoles, cetonas, alcoholes y furanos en los granos de cacao. Las pirazinas y aldehídos son los principales compuestos formados durante el tostado (Huang & Barringer, 2011).
El mecanismo de transferencia de calor más utilizado durante el tostado de los granos de cacao es el tostado convectivo (tostado por aire caliente), mediante el cual los granos son sometidos a temperaturas dentro del intervalo 150 °C - 250 °C por tiempos de 30 min a 120 min (Zzaman & Yang, 2013). Los cambios físicos y químicos que ocurren durante el proceso son sumamente complejos, de tal forma que los métodos instrumentales usados para la determinación de los compuestos que se forman o desaparecen durante esta etapa requieren de diversas técnicas instrumentales de separación (Rivera, Velasco & Rincón, 2013). Por lo tanto, se ha reportado que el uso de la espectroscopía en el infrarrojo mediano ha demostrado ser una herramienta útil para el análisis cualitativo y cuantitativo de muestras complejas, sin la necesidad de etapas previas de separación, proporcionando un mapeo de la composición química y estructural de los mismos. Además, es un detector casi ideal para ser acoplado a sistemas con flujo (Fareez, Noor & Bong, 2015; Gallignani, Torres, Ayala & Brunetto, 2008).
El objetivo de la presente investigación fue estudiar el efecto del tiempo de tostado siguiendo los cambios vibracionales que ocurren en los grupos funcionales característicos de granos de cacao (Theobroma cacao L.) medidos mediante espectroscopia de infrarroja por transformada de Fourier.
Materiales y Métodos
Material experimental
Se utilizaron granos de cacao (Theobroma cacao L.) limpios, libres de impurezas físicas, fermentados y secos, los cuales se obtuvieron de la comercializadora Intercambio Mexicano de Comercio (IMCO), S. A. de C. V., ubicada en la carretera Cárdenas-Comalcalco S/N, en la ciudad de Cárdenas, en el estado de Tabasco, México. Los granos de cacao que comercializa IMCO son una mezcla de cultivares de cacao de una región conocida con el nombre de la Chontalpa en el estado de Tabasco. Esta mezcla corresponde a una cruza natural del cacao criollo (T. Cacao ssp. cacao) y del cacao forastero (T. Cacao ssp. Sphaerocarpum) que recibe el nombre de Trinitario. Predominan principalmente las formas del fruto amelonado y calabacillo (López, Delgado & Azpeitia, 1996).
Tostado de cacao
Para cada experimento se utilizaron 2.5 kg de granos de cacao. El proceso de tostado se realizó en un sistema rotatorio marca 100%MEX (www.mye100mex.com.mx). El equipo consiste en un horno rotatorio con capacidad para 3 kg de cacao. El horno cuenta con dos sistemas de medición de temperatura, los cuales registran la temperatura en la superficie y en el seno este. Cuenta con una unidad de extracción de aire y una unidad de enfriamiento justo a la salida del tambor. A través de la extracción de aire se permite el enfriamiento homogéneo de las partículas. Las pruebas de tostado se realizaron a 100 °C, 140 °C y 180 °C; el muestreo se realizó en los tiempos de 0 min, 21 min y 50 min de tostado.
Caracterización por Espectroscopía de Infrarrojo por Transformada de Fourier (FT-IR)
Todos los espectros se obtuvieron de polvos de granos de cacao tostado con y sin grasa a temperatura ambiente. Para ello, las muestras de cacao tostadas fueron separadas de la cascarilla y los cotiledones fueron molidos y tamizados a través de una malla estándar # 20 (850 µm, Montinox “Manufacturado por Montiel inoxidable México”).
Las muestras se desgrasaron mediante el método de Soxhlet utilizando como medio de extracción éter de petróleo de acuerdo con la NMX-F-615-NORMEX-2004 (Diario Oficial de la Federación [DOF], 2004).
En la caracterización por FT-IR se utilizó un equipo Perkin Elmer (modelo Spectrum One), empleando un ATR de diamante controlado con software para Windows©. Las muestras de polvo de cacao con y sin grasa fueron analizadas en la región de 4000 cm-1 - 400 cm-1, con 16 scans por espectro y resolución de 4 cm-1. Los datos de los espectros fueron exportados en formato ASCII y se analizaron utilizando Originpro 8.
Resultados y Discusión
Cambios espectrales durante el tostado de cacao
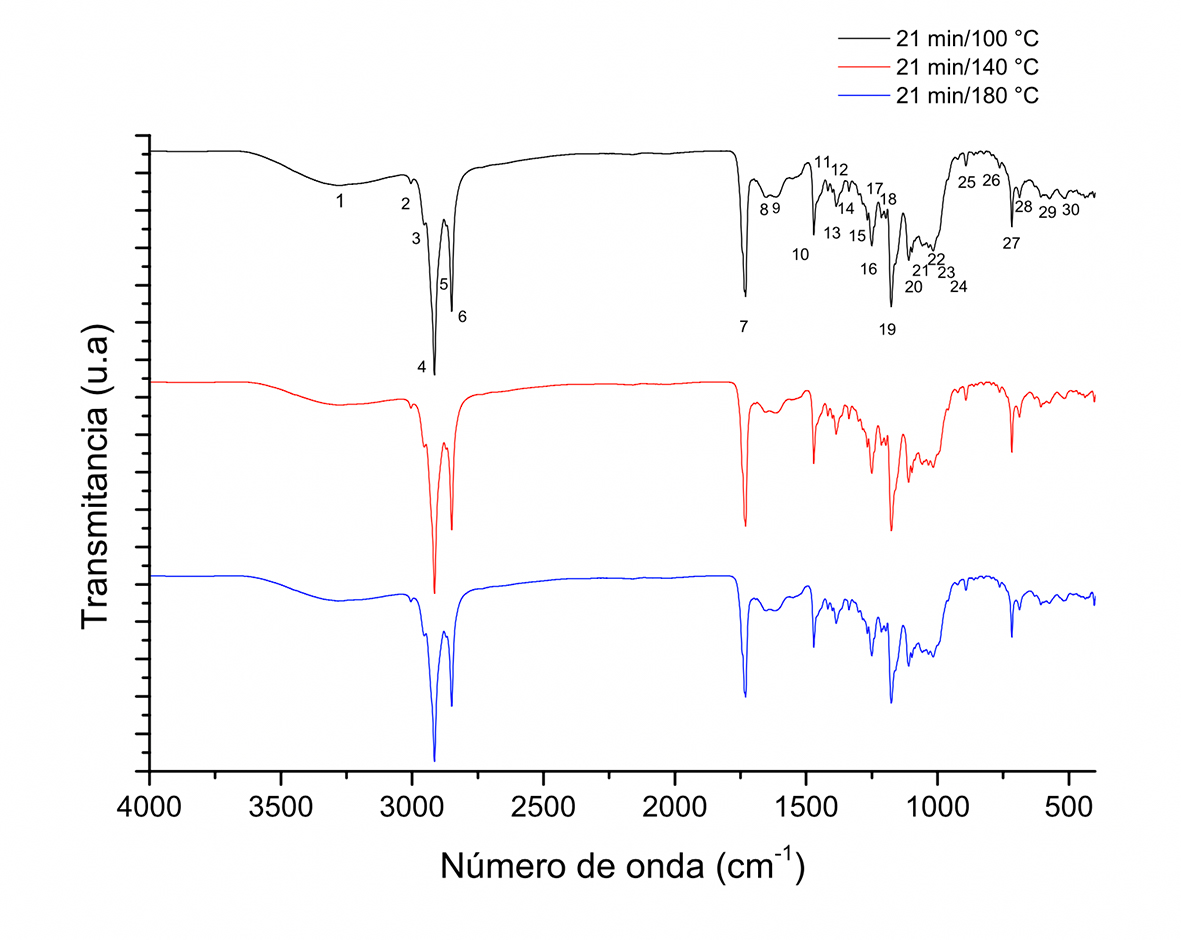
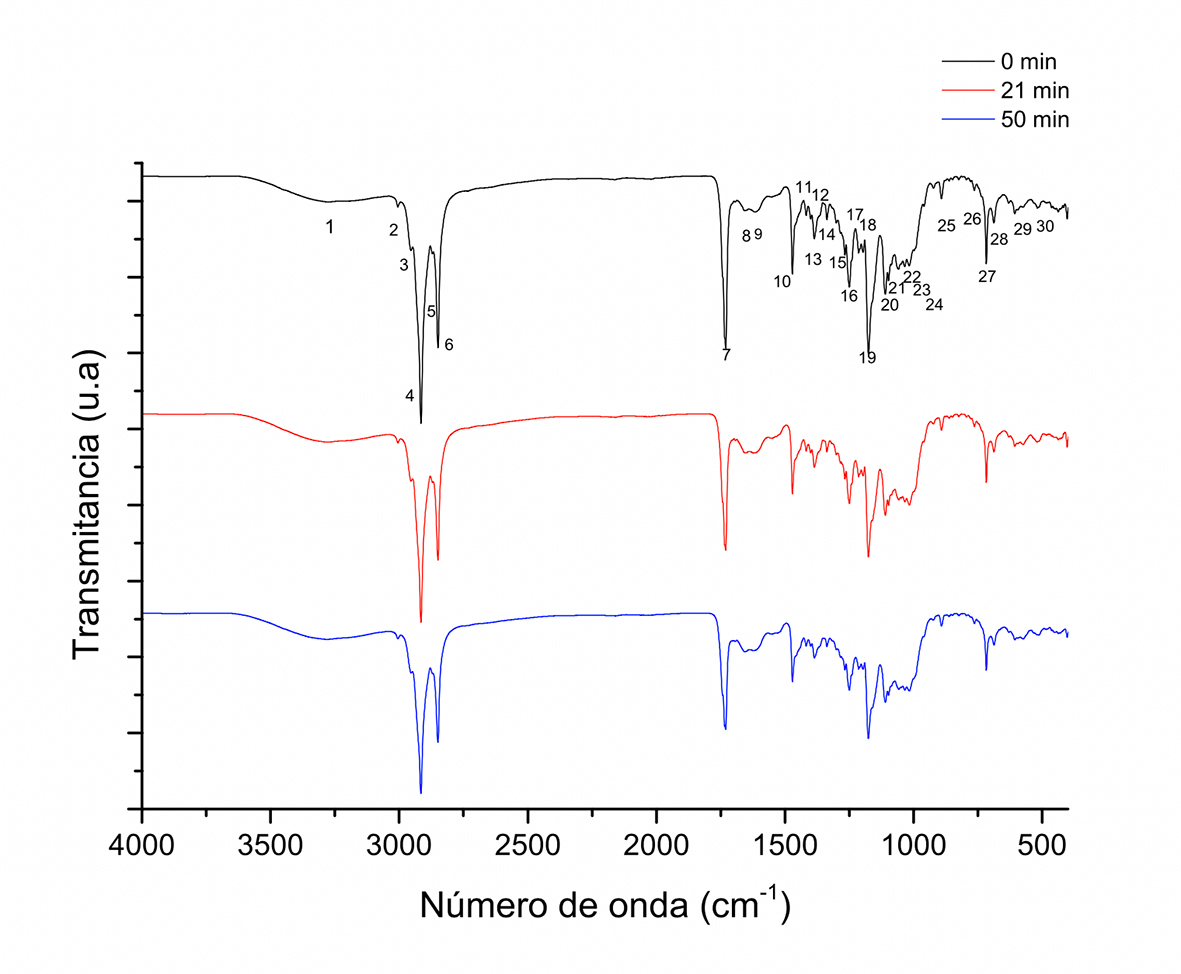
Los cambios en las características espectrales se estudiaron en función del tiempo y temperatura de tostado de granos de cacao en el tambor rotatorio. La Figura 1 y 2 muestran los espectros a diferente temperatura y tiempo de tostado comparándolos entre sí. La Figura 1 compara los diferentes espectros a los 21 min de tostado en la búsqueda de cambios en las señales, encontrando que no existen cambios significativos. En la Figura 2 se consideró la temperatura de 180 ºC en tres diferentes tiempos, buscando encontrar diferencias con respecto al tiempo cero que indica cacao sin tostar. Las señales mostraron similitud en la posición de los picos obtenidos entre los espectros a diferentes temperaturas y tiempos, indicando que idénticos compuestos están presentes durante el tostado. La diferencia se presentó en la intensidad de los picos. Estos resultados evidenciaron cambios en los porcentajes de transmitancia durante el presente estudio; un comportamiento similar se ha reportado en el tostado en almendras (Ng, Lasekan, Muhammad, Sulaiman & Hussain, 2014). Durante el proceso de tostado de cacao, el tratamiento térmico aplicado da inicio a reacciones entre azúcares reductores y aminoácidos o péptidos de cadena corta, lo que reduce la concentración de estos compuestos (Frauendorfer & Schieberle, 2008); sin embargo, los cambios en el contenido son pequeños, comparados con la concentración de otros componentes como el de lípidos. También se presenta liberación de ácidos volátiles de bajo peso molecular. En la Tabla 1 se muestran las frecuencias y asignaciones correspondientes al espectro de la Figura 1 identificadas con números consecutivos (1 - 29) para el tiempo cero; señales del mismo tipo se observan en las muestras a 21 min a 100 ºC, por lo que los análisis reportados se toman a partir de los cambios observados como función del tiempo.
Fuente: Elaboración propia.
Figura 1 Espectros FT-IR de muestras de granos de cacao obtenidas a 21 min a diferentes temperaturas durante el tostado en sistema de tambor rotatorio.
Fuente: Elaboración propia.
Figura 2 Espectros FT-IR de muestras de granos de cacao obtenidas a diferentes tiempos durante el tostado a 180 ºC en tambor rotatorio.
Tabla 1 Asignación de modo vibracional y atribución a la frecuencia de muestras de granos de cacao obtenidas durante el tostado.
| ID | (cm-1) | Modo vibracional | Atribución principal |
| 1 | 3285 | ν(OH) | Alcohol, Fenol, Flavonoide |
| 2 | 3002 | νS(=CH) | |
| 3 | 2952 | νAS(CH3) | |
| 4 | 2919 | νAS(CH2) | Lípidos |
| 5 | 2872 | νS(CH3) | |
| 6 | 2848 | νS(CH2) | Lípidos, aldehídos |
| 7 | 1730 | ν(C=O) | Éster, lípidos, aldehídos |
| 8 | 1657 | ν(C=O) | Amida I, aldehídos, cetonas |
| 9 | 1613 | ν(C=O), ν(CC) | Flavonoides |
| 10 | 1471 | ρ(CH2) | Lípidos |
| 11 | 1416 | ρS(CH3), νS(COO-) | Flavonoides |
| 12 | 1399 | δS(CH3), | Proteínas |
| 13 | 1382 | ν(C=O), ρ(CH), ρ(NH), ρ(CH3) | Proteínas |
| 14 | 1339 | ν(CH), ν(CH2) | Polifenoles, lípidos, cetonas |
| 15 | 1302 | ν(CN), ρ(NH) | Amida III |
| 16 | 1265 | ρAS(CCO), ρ(OH) | Flavonoides |
| 17 | 1252 | ν(C-O), ν(C-N), | Amida III |
| 18 | 1215 | ν(CCOC), ν(CCOC), | Cetonas |
| 19 | 1195 | νAS(OC=C) | Ésteres, pirazinas |
| 20 | 1178 | ν(CC), ν(CN), ν(CO), | Proteínas, cetonas |
| 21 | 1112 | νS(COC) | Éster aromático; polifenoles |
| 22 | 1095 | ν(CO) | Éster |
| 23 | 1058 | ν(CC), ν(=COC), ρ(CO) | Alcohol primario; flavonoides; |
| 24 | 1031 | ν(CC), ν(CN), ν(CO) | Doble anillo ciclohexano |
| 25 | 1014 | ν(CC), ν(CN), ν(CO) | Alcoholes secundarios |
| 26 | 892 | ν(CH), ν(CC) | Mono y disacárido |
| 27 | 760 | ν(CH) | |
| 28 | 713 | ν(CH) | |
| 29 | 686 | ν(CH) |
ν: extensión, ρ: flexión, δ: tijereo, S: simétrico, AS: asimétrico
Fuente: Elaboración propia.
En la región de vibración de extensión X-H (4000 cm-1-2500 cm-1), vibraciones de extensión de enlaces C-H características se identificaron en el presente estudio a 3285 cm-1 y 2848 cm-1 (1-6), las cuales identifican una gran variedad de grupos funcionales, entre ellos alcoholes, aminas, lípidos y compuestos fenólicos, así como compuestos hetero-aromáticos como piridinas, pirazinas, pirroles, furanos y tiofenos (Silverstein, Xebster & Kiemle, 2005). De acuerdo con Aprotosoaie, Luca & Miron (2016) y Silwar (1988), entre 500 y 600 compuestos volátiles se han identificado durante el tostado de los granos de cacao, de los cuales, 120 de estos compuestos están relacionados con el aroma de cacao, donde los grupos químicos más comunes son glúcidos, aldehídos, alcoholes, cetonas, ácidos, ésteres, furanos, pirroles, y pirazinas. Lo anterior confirma que los seis modos vibracionales identificados en la región de extensión no son independientes, sino que están acoplados a grupos adyacentes y confirman la complejidad del material (Hu et al., 2016; Silverstein et al., 2005).
Las vibraciones de extensión simétricas y asimétricas de los enlaces H-O-H se localizan aproximadamente entre 3490 cm-1 -3280 cm-1, vibraciones correspondientes al enlace o grupo N-H (Amida A y B) están incluidas en la misma región, lo que hace difícil su identificación (Castorena-García, Rojas-López, Delgado-Macuil & Robles-de la Torre, 2011). Las bandas centradas a 2919 cm-1 y 2848 cm-1 son asignadas a vibraciones asimétricas y simétricas de extensión del grupo C-H de los lípidos (Hu et al., 2016; Ng et al., 2014; Veselá et al., 2007).
En la región del doble enlace (2000 cm-1-1550 cm-1) se identifica un pico a 1730 cm-1 (7), que identifica la presencia del grupo carbonilo C=O asociado al éster de los triglicéridos, la cual es característica de aceites o grasas (Hu et al., 2016; Liu et al., 2012; Ng et al., 2014). Dependiendo de qué más esté unido al grupo carbonilo, existirán otros picos que se puedan buscar para diferenciar entre aldehídos, cetonas y ácidos grasos. Los lípidos son los compuestos que se encuentran en mayor proporción en los granos de cacao con un porcentaje entre 47% - 55% en base seca de cotiledón (Lehrian & Patterson, 1983; Wood & Lass, 1987). Los granos de cacao tienen tres clases de triglicéridos (saturados, monoinsaturados y poli-insaturados), con aproximadamente un 25% de ácido palmítico, 35% de ácido oléico y 35% de ácido esteárico (Torres-Moreno, Torrescasana, Salas-Salvadó & Blanch, 2015), por lo que señales asociadas a alcanos y alquenos están presentes. Por lo anterior, las señales de mayor intensidad (4, 6, 7, 19) en la Figura 2 están asociadas a los ácidos y ésteres de los lípidos presentes en el cacao. Los aldehídos en el cacao están presentes desde antes del proceso de tostado y contienen principalmente 3 metil-butanal (Frauendorfer & Schieberle, 2008), por lo que las señales 6 y 7 pueden también definir a los grupos funcionales de aldehídos y cetonas. Dos picos de menor intensidad a 1657 cm-1 y 1613 cm-1 (8 y 9) identifican amida I y flavonoides, respectivamente (Hu et al., 2016; Liu et al., 2012; Schulz & Baranska, 2007; Veselá et al., 2007), así también al grupo funcional de los aldehídos a 1657 cm-1.
Las amidas muestran una banda de absorción del grupo carbonilo conocida como banda de la amida I. Las amidas primarias y secundarias muestran una banda o varias bandas en la región 1650 cm-1-1515 cm-1 causado por el grupo NH2. En el caso de sólidos, la región de absorción es aproximadamente en los 1650 cm-1 (Silverstein et al., 2005). En el presente estudio, el pico a 1657 cm-1, de acuerdo con Schulz & Baranska (2007) y Movasaghi, Rehman & Ur Rehman (2008), corresponde a una estructura helicoidal de amida I. Por otro lado, el pico a 1613 cm-1 identifica a una estructura de anillo C-C del grupo fenil (Hu et al., 2016; Movasaghi et al., 2008). Los compuestos fenólicos constituyen uno de los compuestos de mayor interés en el cacao debido a su función como antioxidantes y constituyen alrededor del 12% - 18% de la composición química en granos de cacao sin fermentar. El contenido principal son flavan-3-ol y flavan-3-ols (catequina y epicatequina), compuestos monoméricos de polifenoles. Durante el tratamiento poscosecha se presentan cambios bioquímicos que disminuyen su contenido; y durante el tostado, alrededor del 70% de estos compuestos son degradados debido al prolongado calentamiento (Zzaman & Yang, 2013). Los flavonoides tienen una estructura común de difenilpropanos (C6-C3-C6) que consiste en dos anillos aromáticos ligados a través de tres carbonos que forman usualmente un heterociclo oxigenado (Wollgast & Anklam, 2000). Por lo anterior, el pico a 3285 cm-1 y 1613 cm-1 se conjugan identificando estructuras de los compuestos fenólicos.
En la región de huella dactilar (1500 cm-1-600 cm-1), el espectro es complejo y difícil de interpretar, diversos grupos funcionales absorben en esta región, pero esta singularidad permite la identificación como huella dactilar. En el espectro en esta región se pueden identificar al menos 20 picos, sin embargo, existen señales ocultas o traslapadas, por lo que fue necesario para su identificación aplicar la segunda derivada del espectro infrarrojo.
El pico a 1471 cm-1 (10) es característico a la flexión de la cadena del metileno en lípidos, así como a 1095 cm-1 (22), y se atribuye a la extensión C-O del grupo éster presente en la molécula de los triglicéridos (Rivera et al., 2013), mientras que a 1399 cm-1 y 1382 cm-1 (12 y 13) se asigna un modo de flexión simétrico de tijereo y balanceo de los grupos metil de las proteínas (Movasaghi et al., 2008), así como el grupo amida III a 1302 cm-1 y 1252 cm-1 (15 y 17), el cual incluye extensión C-N y flexión en el plano N-H. Hu et al. (2016) reportan la presencia de proteínas a 1178 cm-1 en chocolates, encontrándose la misma banda (20) en el presente estudio.
De acuerdo con de Brito et al. (2001), los niveles de proteína se mantienen constantes durante el secado y tostado de cacao, no así los grupos amino terminales y aminoácidos libres totales, los cuales disminuyen durante el tostado. Los aminoácidos libres, péptidos de bajo peso molecular y azúcares reductores son precursores del aroma y se producen durante el tratamiento poscosecha, y es durante el tostado, debido a las condiciones de temperatura y niveles de humedad reducidos, que se llevan a cabo reacciones de Maillard y degradación tipo Strecker (Caligiani, Cirlini, Palla, Ravablia & Arlorio, 2007; Cros, 1998). Paralelamente, se produce racemización de compuestos quirales de aminoácidos y polifenoles. Lo anterior permite la formación de compuesto como pirazinas, alcoholes, ésteres, aldehídos, cetonas, furanos tiazoles, pironas, ácidos, iminas aminas, oxazoles, pirroles y éteres. El grupo carbonilo derivado de la reacción de Maillard reacciona con los aminos ácidos libres durante la degradación de Strecker, por lo que cada amino acido específico producirá un único aldehído con un único aroma (Jinap, Wan Ishak, Rahman & Nordin, 1998; Kongor et al., 2016).
A 1471 cm-1 y 1416 cm-1 (10 y 11) se identifican señales atribuibles a polifenoles. De acuerdo a Gorinstein et al. (2010), la región de polifenoles muestra bandas ligeramente diferentes con respecto a los estándares, indicando los casos particulares de catequina y ácido gálico. El espectro de catequina muestra picos a 831 cm-1, 1040 cm-1, 1112 cm-1, 1144 cm-1, 1285 cm-1, 1478 cm-1, 1512 cm-1 and 1611 cm-1, asignados a -C-H alquenos, -C-O alcoholes, C-O-H alcoholes, -OH aromáticos, C-O alcoholes, C-H alcanos, C=C anillos aromáticos y C=C alquenos, respectivamente. El ácido gálico muestra bandas de absorción a 866 cm-1, 1026 cm-1, 1237 cm-1, 1451 cm-1, 1542 cm-1 y 1619 cm-1. En las muestras del estudio las bandas asignadas a polifenoles estarían asociadas a 1471 cm-1, 1416 cm-1, 1339 cm-1, 1265 cm-1, 1112 cm-1 y 1058 cm-1 (Liu et al., 2012; Movasaghi et al., 2008). De acuerdo con Caligiani et al. (2007), la cantidad de (+)-catequina incrementa significativamente durante el proceso de tostado como consecuencia de la isomerización de (-)-epicatequina, mientras que Payne, Hurst, Miller, Rank & Stuart (2010) encontraron que el incremento es mayor a 600%. Las señales asignadas a polifenoles antes señaladas no permiten observar el incremento debido, principalmente, a la presencia de los lípidos. En el análisis posterior de la segunda derivada y en muestras desgrasadas que se presentan en las Figuras subsecuentes se aclara este incremento.
La banda de O-C-C de ésteres de alcoholes secundarios se presenta alrededor de 1100 cm-1, mientras los ésteres aromáticos de alcoholes primarios muestran absorción en aproximadamente a 1111 cm-1, por lo que el pico encontrado a 1112 cm-1 (21) corresponde a este tipo de grupos funcionales.
La absorción para el grupo de cetonas (C-C-C extensión, C-C-(=O)-C flexión en el grupo C-C-C) dan origen a múltiples bandas en el espectro de IR. Las cetonas alifáticas absorben en el intervalo de 1230 cm-1-1100 cm-1. En nuestras muestras la señal a 1215 cm-1 (18) y 1195 cm-1 (19) se identifican como modos vibracionales de extensión y flexión correspondientes al grupo de cetonas que presentan picos débiles y estrechos (Movasaghi et al., 2008; Ng et al., 2014; Silverstein et al., 2005). En el intervalo de frecuencias entre 900 cm-1-750 cm-1 se encuentran presentes gran variedad de picos con baja intensidad y resulta difícil poder efectuar una asignación de los grupos funcionales, debido a bandas correspondientes a movimientos de las macromoléculas.
Los principales cambios observados fueron detectados como porcentaje de transmitancia y se presentan en aldehídos, ésteres, ácidos carboxílicos y aminas. El incremento fue observado en aldehídos, ésteres y amida III (2840 cm-1, 1730 cm-1, 1252 cm-1 y 1112 cm-1), mientras que hubo una disminución en la señal de 1657 cm-1 asignadas a amida I, aldehídos y cetonas. Estos cambios son función de los compuestos involucrados en el sabor y aroma de origen térmico, tal como menciona Frauendorfer & Schieberle (2008), quienes enfatizan que durante el tostado existen cambios cuantitativos más que cualitativos en la composición química de un pequeño conjunto de compuestos clave en el aroma. Entre estos compuestos se encuentran principalmente los aldehídos, furanos y pirazinas, formados de precursores durante el tostado. Por otro lado, Ng et al. (2014) establecen que la disminución o incremento de los ésteres están asociados al desarrollo de componentes de aromas ácidos y almendrados, así como a la liberación de volátiles. La disminución de aminas primarias se encuentra asociada a reacciones de Maillard con la formación de color y aroma.
Análisis de la segunda derivada del espectro infrarrojo
Los espectros correspondientes a la segunda derivada de las muestras se presentan en las Figuras 3, 4 y 5. Al aplicar la segunda derivada, diversas señales ocultas o traslapadas se encontraron en el intervalo de 600 cm-1-1800 cm-1 y, de forma particular, en la región denominada de huella dactilar, los cuales difieren de los identificados previamente en el espectro IR.
Fuente: Elaboración propia.
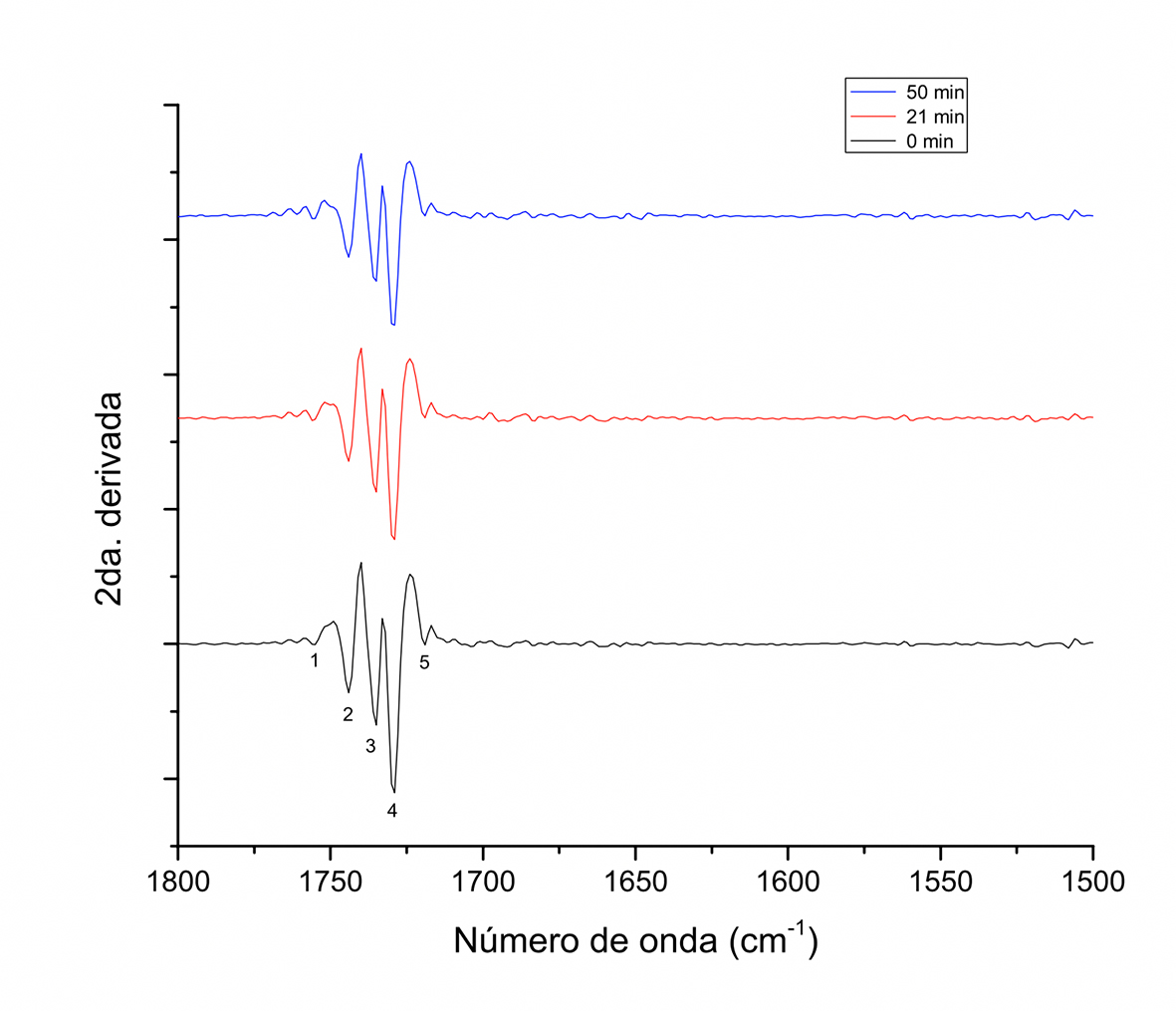
Figura 3 Segunda derivada del espectro FT-IR de muestras de granos de cacao obtenidas a diferentes tiempos durante el tostado a 180 ºC en sistema de tambor rotatorio, en el intervalo de 1800 cm-1-1500 cm-1.
Fuente: Elaboración propia.
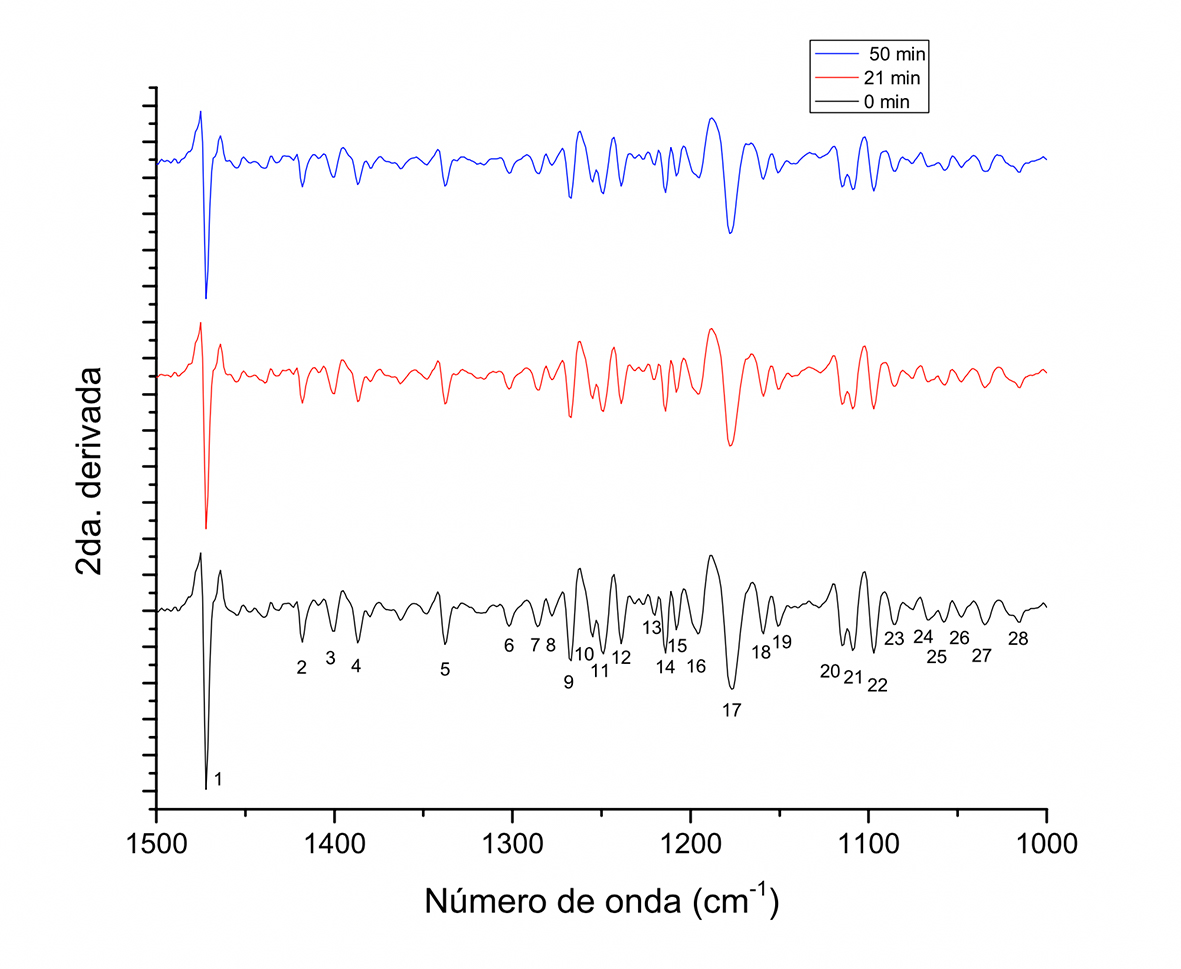
Figura 4 Segunda derivada del espectro FT-IR de muestras de granos de cacao obtenidas a diferentes tiempos durante el tostado a 180 ºC en sistema de tambor rotatorio, en el intervalo de 1500 cm-1-1000 cm-1.
Fuente: Elaboración propia.
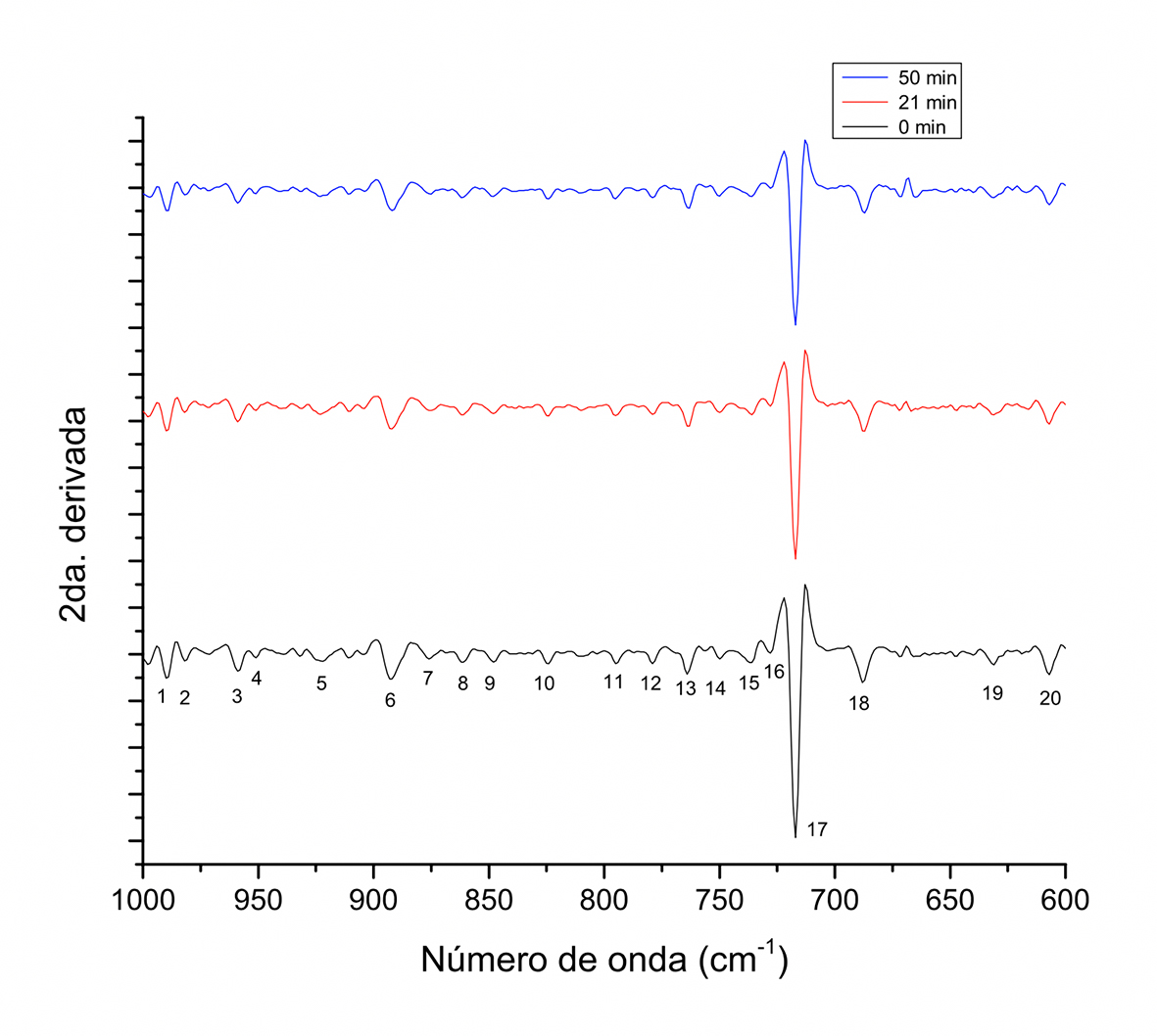
Figura 5 Segunda derivada del espectro FT-IR de muestras de granos de cacao obtenidas a diferentes tiempos durante el tostado a 180 ºC en sistema de tambor rotatorio, en el intervalo de 1000 cm-1-600 cm-1.
En la Figura 3, en el intervalo de absorción de 1800 cm-1-1500 cm-1 se asignan cinco picos, destacando por su intensidad a 1744 cm-1, 1735 cm-1 y 1730 cm-1 (2, 3 y 4), confirmando la presencia del grupo carbonilo y el doble enlace C=C, así como la banda de absorción de ésteres de ácidos grasos (Frauendorfer & Schieberle, 2008). A los tres tiempos de tostado se ubican las mismas señales, diferenciándose en la intensidad de los picos, siendo estas de mayor a menor intensidad en los tiempos de 0 min, 21 min y 51 min, respectivamente. Adicionalmente, en el intervalo de 1500 cm-1-1000 cm-1 (Figura 3) varios picos traslapados fueron definidos dando origen a dos o más señales, identificándose 28 señales de vibración con respecto a las 16 asignadas en el espectro de la Figura 2 (Tabla 1). De las nuevas asignaciones, 13 coincidieron con aquellas asignadas en el espectro normal. La señal a 1472 cm-1-1471 cm-1 asignada a vibración de flexión de balance de grupos metil-metileno claramente se aprecia como el pico de mayor intensidad, identificado con el número 7 en la Figura 2 y con el número 1 en la Figura 4.
Las diferencias entre las muestras en el tiempo de tostado siguen siendo la intensidad de los picos de mayor a menor: 0 min > 21 min > 51 min.
Para las señales en el intervalo de 1000 cm-1 - 600 cm-1 (Figura 5) se lograron identificar alrededor de 20 picos, con respecto de los cuatro identificados en el espectro normal, confirmándose estos mismos picos en la segunda derivada. El pico a 717 cm-1 mostró la mayor intensidad de todas las señales y, de acuerdo con Hansen & Spanget-Larsen (2003), bandas observadas en la región 760 cm-1 -700 cm-1 son asignadas a modos vibracionales de flexión OH, correspondientes a compuestos fenólicos con enlaces de hidrógeno intramolecular. Por otro lado, Liu et al. (2012) señalan que la intensidad relativa de los picos cercanos a 1150 cm-1, 1080 cm-1, 1029 cm-1, 1010 cm-1, 917 cm-1 y 716 cm-1 permiten diferenciar el contenido de carbohidratos. Redgwell, Trovato & Curti (2003) evaluaron los cambios en los carbohidratos y polisacáridos de pared celular durante el tostado, estableciendo que los azúcares reductores como glucosa y fructosa disminuyen durante el tostado, no así los no reductores. Los primeros disminuyen como función de la interacción con aminoácidos durante las reacciones de Maillard, por lo que los cambios apreciables en el intervalo antes descrito pueden atribuirse a los cambios en los azúcares reductores durante el tostado. En el presente estudio se asignaron señales a 1150 cm-1, 1086 cm-1, 1035 cm-1, 1015 cm-1, 922 cm-1 y 717 cm-1 que corresponderían a la presencia de carbohidratos y cuya intensidad en la segunda derivada corresponden de mayor a menor en las muestras: 0 min > 21 min > 51 min.
Análisis de muestras desgrasadas de las pruebas de tostado
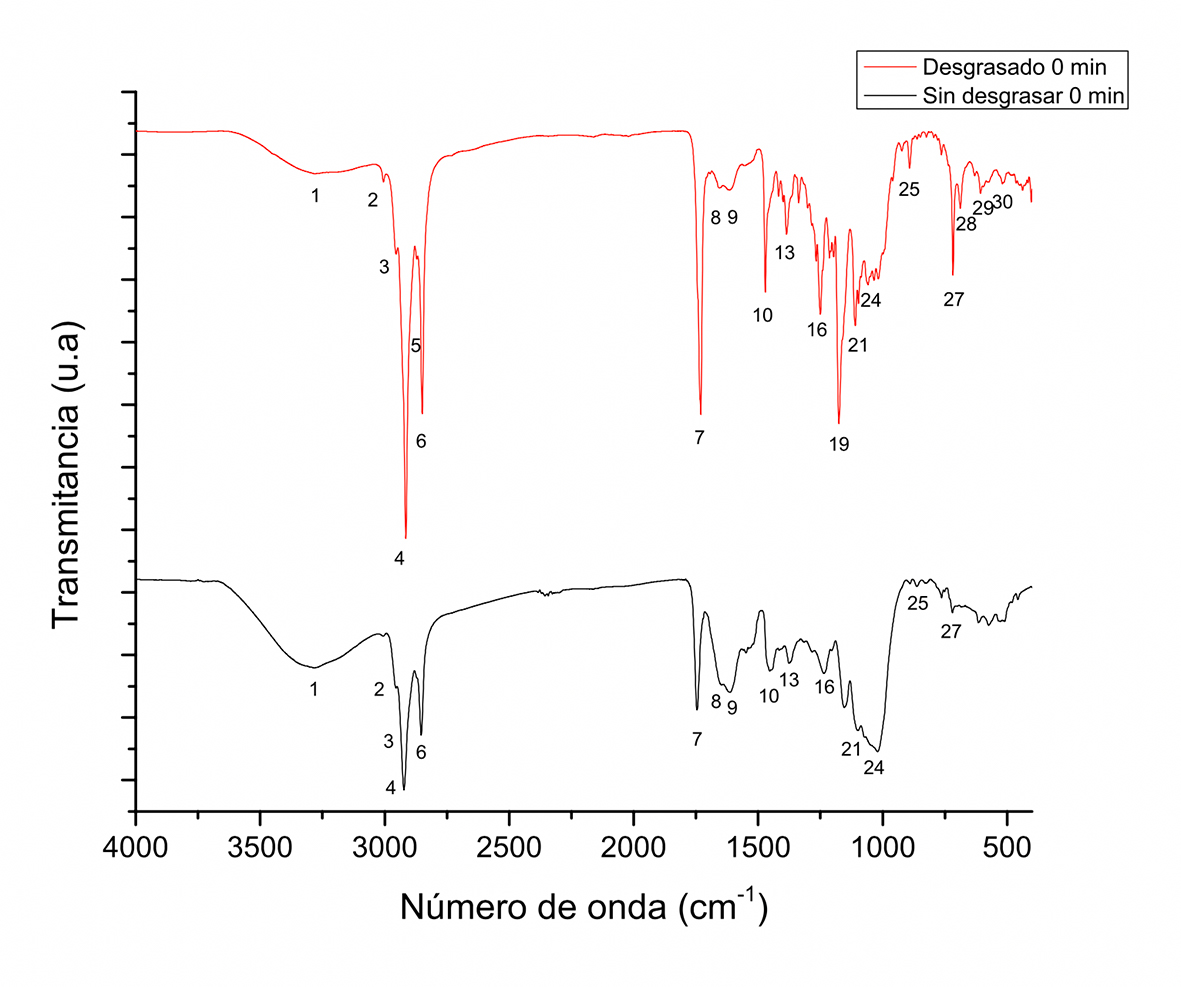
En la Figura 6 se aprecian las bandas espectrales entre el tiempo inicial sin desgrasar y desgrasado. Se identifican los picos que permanecen antes y después del desgrasado con los números asignados previamente. Una reducción de señal en los picos 4, 6, 7, 10, 16 y 27 se aprecia adecuadamente, los cuales corresponden en su mayoría a la asignación de lípidos (Tabla 1). Aunque el proceso de desgrasado fue llevado a cabo (método Soxhlet), se confirma aún la presencia de grupos asignados a los lípidos. La eficiencia de extracción con solvente ha sido evaluada por Roiaini, Seyed, Jinap & Norhayati (2016), quienes demostraron que existen otros métodos alternativos para una extracción eficiente de la grasa en granos de cacao, de allí que aún estén presentes señales de lípidos. En las señales encontradas en la Figura 6, la señal a 3285 cm-1 designada con el valor 1 se incrementa, asociada con el grupo OH y atribuidas principalmente a los compuestos fenólicos presentes en el polvo de cotiledón de cacao. Diferentes picos presentes antes de desgrasar no aparecen y en el intervalo de la región 1800 cm-1-600 cm-1 se presentan los principales cambios con la presencia de nuevos picos y otros posiblemente traslapados. En esta región, conocida como huella dactilar, están presentes una gran cantidad de señales que estarían asociadas a los compuestos presentes en el cacao. De acuerdo con Lopez & Dimick (1995), después de la grasa, los componentes en mayor composición son las proteínas (8%-10%), los polifenoles (5%-6%), almidón (4%-6%) y pentosas (4%-6%); sin embargo, como se ha descrito previamente, existen una gran cantidad de compuestos en pequeñas concentraciones en distintas clases químicas.
Fuente: Elaboración propia.
Figura 6 Espectros de FT-IR de muestra de granos de cacao desgrasadas y sin desgrasar.
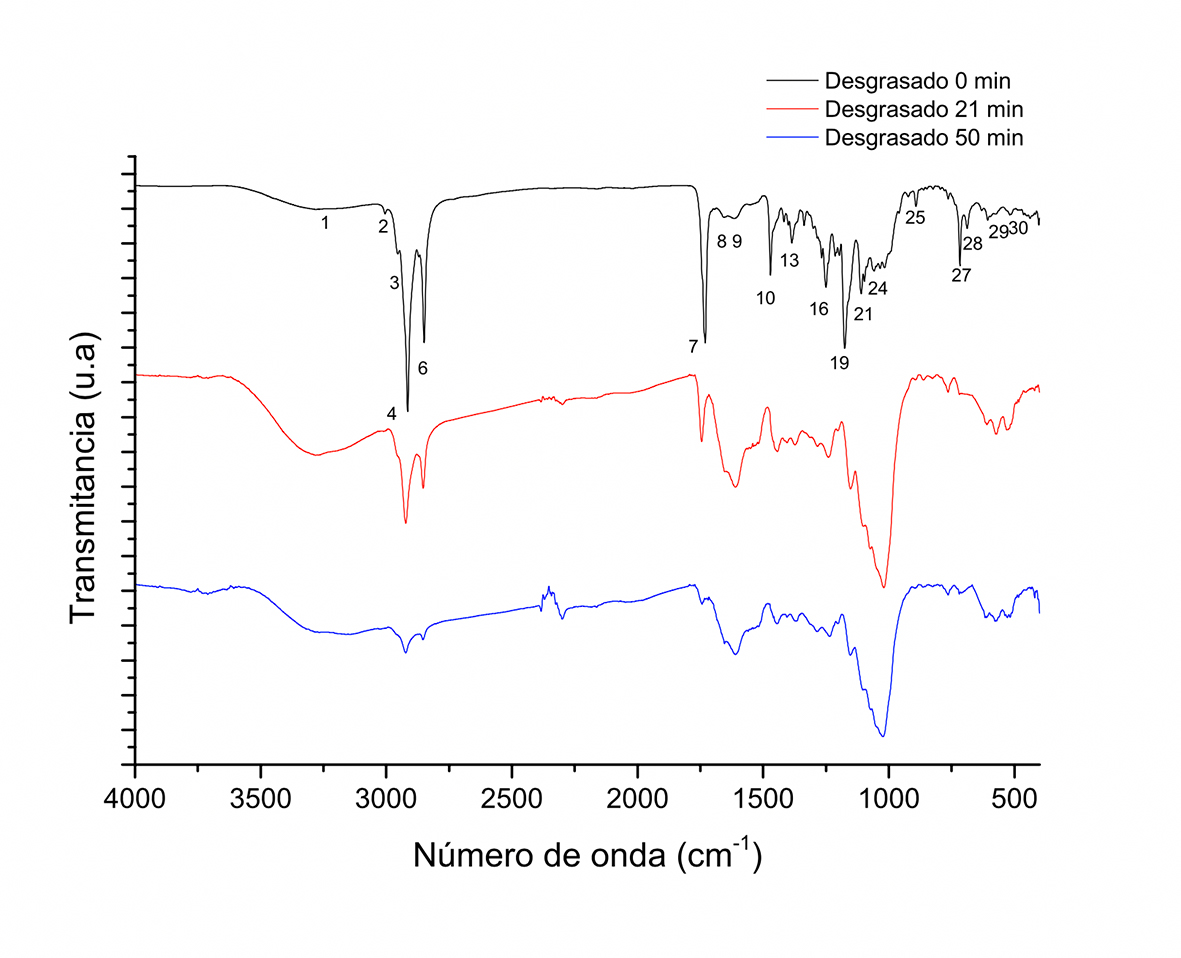
En la Figura 7 se aprecia la reducción en las intensidades de los picos asociados a los grupos funcionales metil y metileno 4, 6, 7 y 10 (2919 cm-1, 2848 cm-1, 1730 cm-1 y 1471 cm-1) de los ácidos grasos de los lípidos como función del tiempo de tostado. El proceso de tostado promueve la liberación de los lípidos de la matriz sólida, lo que indica la facilidad de extracción de la materia grasa después del tostado para la obtención del licor de cacao. Otro de los aspectos importantes entre el tiempo inicial de las muestras, con y sin grasa, es el aumento en la intensidad de la señal que se identifica como un hombro definido por la región de vibración de extensión O-H correspondiente al pico 1 cm-1 a 3285 cm-1. Así también, se muestra el incremento en la región comprendida entre 1058 cm-1, que corresponde a una de las señales que complementa a las catequinas. El incremento estaría asociado a la reacción previamente comentada y señalada por Caligiani et al. (2007). La deformación en el intervalo comprendido entre 1750 cm-1 a 1000 cm-1 indica la complejidad de los sistemas de reacción, no solamente entre la isomerización de los compuestos fenólicos sino también con respecto a su capacidad para reaccionar e interactuar con las proteínas y formar estructuras complejas que definen los atributos sensoriales (Abecia‐Soria, Pezoa‐García & Amaya‐Farfan, 2005). En función de tal complejidad, diversas investigaciones han establecido los métodos espectroscópicos en la infrarrojo medio y cercano para la discriminación rápida, confiable y precisa con el uso de técnicas estadísticas de análisis multivariable para diferenciar entre los cultivares y su origen geográfico (Teye et al., 2015; Teye, Huang, Dai & Chen, 2013), como función de las posiciones, intensidad relativa y forma de los picos (Liu et al., 2012). Por lo tanto, en este estudio se puede comprobar que el FT-IR es viable para evidenciar cambios a través del proceso de tostado, como se ha demostrado en secado de pimiento rojo (Castañeda-Pérez, Osorio-Revilla, Gallardo-Velázquez & Proal-Nájera, 2013) y en tostado de café (Fernandes, de Souza, Da-Wen, Nixdor & Hirooka, 2014).
Fuente: Elaboración propia.
Figura 7 Espectros de FT-IR de muestras de granos de cacao desgrasadas obtenidas a diferentes tiempos durante el tostado a 180ºC en sistema de tambor rotatorio.
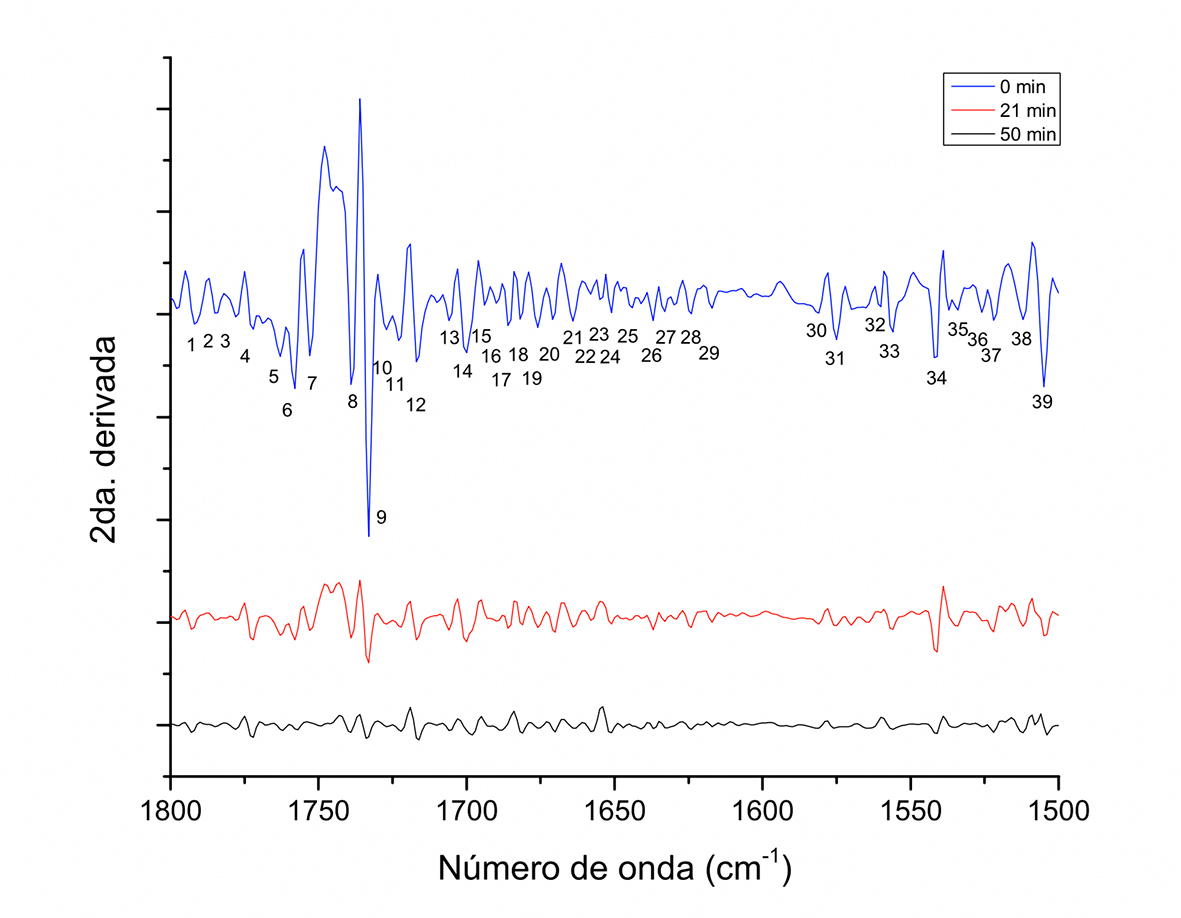
El espectro correspondiente a la segunda derivada de cacao tostado y desgrasado es mostrado en la Figura 8. Se puede observar dentro del intervalo de 1800 cm-1-1500 cm-1 la asignación de más de 35 picos, que supera ampliamente las cinco asignaciones mostradas en la Figura 2 y el reflejo de una composición química compleja. Los picos reflejados a tiempo 0 min también están presentes a los 21 min y 50 min, aunque la intensidad disminuye en función del tiempo de tostado. Los picos que resaltan identificados con 6, 7, 8 y 9 en el intervalo 1758 cm-1-1733 cm-1 nuevamente confirman la presencia del grupo carbonilo y el doble enlace C=C, que previamente fueron asignados en la Figura 3 y la banda de absorción de ésteres de ácidos grasos a 1700 cm-1. El pico identificado a 1717 cm-1(12) y aquellos de 1686 cm-1-1671 cm-1(17-20) corresponden a vibración de extensión (C=O) de la amida I, mientras que asignaciones en el intervalo 1542 cm-1-1522 cm-1 son asignadas a vibración de extensión (C=N) y (C=C) de amida II. En las señales de A 1512 cm-1 y 1505 cm-1 se asignó a vibración de flexión en el plano de anillos fenólicos (CH), reportándose también vibración de extensión (C=C) de pigmentos celulares (Movasaghi et al., 2008).
Fuente: Elaboración propia.
Figura 8 Segunda derivada del espectro FT-IR de muestras de granos de cacao desgrasadas obtenidas a diferentes tiempos durante el tostado a 180 ºC en sistema de tambor rotatorio, en el intervalo de 1800 cm-1-1500 cm-1.
En la región de 1800 cm-1-1500 cm-1 se presentan cambios similares a los reportados durante el tostado de café (Rivera et al., 2013), enfatizando el efecto en el pico a 1650 cm-1 entre café verde y tostado, asignado a la presencia de cafeína. De igual manera, el cacao posee cafeína y en mayor proporción teobromina, localizándose un pico a 1651 cm-1 (21) que está asociado a la cafeína y dos picos a 1690 cm-1 y 1664 cm-1 (21 y 16) a la teobromina, de acuerdo con Johnson, Prakash, Prathiba, Raghunathan & Malathi (2012), donde los tres picos disminuyen como función del tiempo de tostado. Estas metilxantinas estructuralmente contienen dos grupos vibracionales carbonilos en la posición meta, por lo que bandas de 1651 cm-1, 1690 cm-1 y 1664 cm-1 están asociadas a este tipo de grupos y son del tipo de estiramiento asimétrica y simétricas. La teobromina es la principal metilxantina asociada al sabor amargo en los granos de cacao (Pickenhagen et al., 1975), la cual se diferencia de la cafeína químicamente en un solo grupo metil, por lo que también presentarán una señal entre 2919 cm-1 y 2848 cm-1, como se ve en las Figuras 1 y 7.
Conclusiones
La técnica de espectroscopía de infrarrojo por transformada de Fourier (FT-IR) permitió identificar una gran cantidad de compuestos durante el tostado de granos de cacao que evidenciaron más cambios cuantitativos que cualitativos. Las bandas asignadas en el espectro normal ocultan señales presentes en las muestras de cacao por la presencia de vibraciones espectrales de los lípidos. La aplicación de la segunda derivada permitió identificar una mayor cantidad de picos en la región de 1800 cm-1 -1500 cm-1, de forma particular en muestras desgrasadas. Las diferencias encontradas en el porcentaje de transmitancia están asociadas a grupos de ésteres, aldehídos, ácidos carboxílicos y aminas, las cuales evidencian cambios que se generan por reacciones tipo Maillard a partir de la interacción entre aminoácidos libres, azúcares reductores y polifenoles.











 nueva página del texto (beta)
nueva página del texto (beta)


