Introducción
Dentro de las infecciones de la cavidad bucal, las de mayor prevalencia son las de origen odontogénico (De la Teja-Ángeles, Cadena-Galdós, Téllez-Rodríguez & Durán-Gutiérrez, 2007). La caries es la patología bacteriana crónica más común en el mundo y está presente en un 60%-90% de los niños en edad escolar. El seguimiento de los procesos cariogénicos en la edad pediátrica se ha convertido en un asunto de salud pública, puesto que la presencia o ausencia de caries en este periodo de la vida es predictivo de la salud bucal que el individuo presentará en su vida adulta. Existen varios factores etiológicos que participan en el desarrollo de caries y cada uno contribuye en diferente grado para su aparición (Matsui & Cvitkovitch, 2010; Subramaniam, Babu Ki & Nagarathna, 2012; Wang et al., 2012). Estos factores etiológicos se encuentran agrupados en tres hipótesis principales: la hipótesis de la placa específica, la hipótesis de la placa no específica, y la hipótesis de la placa ecológica (Aas et al., 2008).
En la actualidad se plantea que la etiopatogenia de esta enfermedad es multifactorial, en la que existe interacción de tres factores principales: el huésped (higiene bucal, la saliva y los dientes), la microbiota (infecciones bacterianas) y el sustrato (dieta cariogénica) (González-Rodríguez, Pedroso-Ramos, Rivero-Villalón & Reyes-Suárez, 2015). Para que se forme una caries es necesario que las condiciones de cada factor sean favorables, es decir, un huésped susceptible, un microbiota oral cariogénica y un sustrato apropiado que deberá estar presente durante un período determinado (Fortich-Mesa, 2018; Molina-Frechero, Durán-Merino, Castañeda-Castaneira & Juárez-López, 2015).
Los microorganismos implicados son complejos y variables y no se conocen en su totalidad, pero ya se han reconocido los microorganismos asociados al progreso de la caries (Badet & Thebaud, 2008). Los agentes causales reconocidos de esta enfermedad son Streptoccocus ssp, principalmente S. mutans y S. sobrinus; y Lactobacillus ssp; aunque la literatura reporta otras bacterias asociadas a procesos cariogénicos en dentición infantil, que incluyen Veillonella spp, Actinomyces spp, Bifidobacterium spp y Lactobacillus fermentum (Aas et al., 2008; Kanasi et al., 2010). Estas bacterias son acidogénicas y acidúricas e interaccionan en la biopelícula formada sobre la superficie dental (Ramalingam, Amaechi, Ralph & Lee, 2012). Las biopelículas son comunidades microscópicas que consisten primariamente de bacterias (Maddi & Scannapieco, 2013) y representan un problema para la salud pública por su fácil formación en válvulas cardiacas, catéteres venosos, dispositivos intrauterinos y superficies dentales. Para lograr la prevención de la caries, se han realizado numerosos estudios epidemiológicos enfocados a comprender los agentes etiológicos, su comportamiento dentro de la biopelícula y los mecanismos de patogenicidad, así como conocer su interacción con los factores ambientales y genéticos (Subramaniam, Babu ki & Nagarathna, 2012).
Estos estudios han determinado que el procedimiento más eficaz en la prevención de la caries es la eliminación mecánica de la placa dental a través del cepillado; lamentablemente es escaso el número de personas que realiza este procedimiento eficazmente. Es por esto que los estudios actuales se han enfocado en la búsqueda de compuestos anticariogénicos que puedan incluirse en productos dentales para reducir la formación de biopelícula y, con ello, disminuir la incidencia de caries. Se ha reportado la eficacia de antibióticos y otros agentes antimicrobianos como la ampicilina, la clorhexidina, el metronidazol y desinfectantes, como aquellos de sales de amonio cuaternario en la prevención de la caries dental, pero estos presentan efectos adversos tales como la tinción de los dientes, aumento de la formación de cálculo dental, así como desajustes de la microbiota oral e intestinal (Porto et al., 2009). Se ha destacado la importancia de otras alternativas de prevención y tratamiento mediante el uso de los productos naturales, como son el uso de extractos de plantas (Extracto de la Viguiera arenaria) y sales metálicas (como el Cu2SO4) como agentes antibacterianos naturales en productos de cuidado oral (Porto et al., 2009).
La actividad antimicrobiana del Cu2+ ha motivado el desarrollo de estudios tendientes a conocer los beneficios de aplicaciones de este metal y sus derivados en la terapéutica y control de enfermedades infecciosas, locual, proyectado a la odontología, podría tener un uso clínico positivo en la prevención de la caries. El Cu2SO4 al 0.5% o al 2%, por ejemplo, es recomendado como un astringente en casos de gingivitis crónica, sobre todo de tipo edematosa (Lima-Álvarez, Reigada-Martínez & Vara-Delgado, 2000). La Asociación Internacional de Cobre (ICA, por sus siglas en inglés), que se dedica a la investigación del cobre para su aplicación en las distintas ramas de la medicina, recomienda el uso del Cu2+ en forma de Cu2SO4 para evitar contaminación cruzada e infecciones intrahospitalarias (Espírito-Santo, Vasconcelos-Morais & Grass, 2010) y para hacer curación de heridas o desinfectar el agua de consumo humano (Ren et al., 2009). Entre sus propuestas a futuro se encuentran el uso de óxido de cobre en ropa, cepillos dentales y pañales, entre otras (Grass, Rensing & Solioz, 2011).
En la actualidad existe una tendencia en la búsqueda de compuestos naturales con propiedades medicinales. Los terpenos son compuestos hidrofóbicos, principalmente de origen vegetal, que participan en casi todas las interacciones biológicas: plantas y microorganismos o entre las mismas plantas, actuando como fitoalexinas, antialimentarios de insectos o agentes de defensa (Wagner & Elmadfa, 2003). Los terpenos tienen amplia actividad antibacteriana, antifúngica y antiprotozoaria (Knezevic et al., 2016; Trombetta et al., 2005). Estos compuestos son los responsables de dar el aroma característico de las plantas; el geraniol, por ejemplo, se encuentra en la mayoría de los cítricos, al igual que el limoneno (Da Silva, 2015). Ambos corresponden a los aromas característicos de naranja y limón respectivamente. El mentol es el responsable de darle el aroma característico a las plantas del género Mentha (Vacca-Molina, 2015).
El presente artículo tiene como objetivo evaluar y comparar la actividad antimicrobiana del sulfato de cobre (Cu2SO4) sobre Streptoccocus mutans y Lactobacillus acidophilus, solo y en asociación con compuestos terpénicos, así como evaluar su capacidad de inhibir la formación de biopelículas.
Materiales y Métodos
Se realizó un estudio experimental para evaluar la propiedad antimicrobiana del sulfato de cobre (Cu2SO4) sobre cepas de Lactobacillus acidophilus y Streptococcus mutans, tanto en estado planctónico como en biopelícula. Además, se evaluaron las propiedades antimicrobianas del Cu2SO4 en sinergia con las moléculas terpénicas geraniol, limoneno y mentol (Sigma-Aldrich; St. Louis, MI, USA).
Obtención y caracterización de las cepas
Las cepas se obtuvieron a partir de 47 pacientes infantes de sexo indistinto que acudieron a la Facultad de Odontología de la Universidad Autónoma de Chihuahua por complicaciones de caries en segunda etapa. Para la obtención de las cepas se utilizó la prueba de CRT bacteriaMR (CRT. ® bacteria Vivadent Ivoclar), técnica utilizada en odontología para determinar la susceptibilidad a la caries que utiliza medios de cultivo selectivos Mitis-Salivarius para Streptococus mutans y agar de Rogosa para Lactobacillus acidophilus. Utilizando esta técnica se aislaron dos cepas de S. mutans y 15 de L. acidophilus.
Evaluación de la actividad antimicrobiana
El sulfato de cobre (Cu2SO4) y tres moléculas terpénicas (geraniol, limoneno y mentol) fueron evaluadas contra cepas de Lactobacillus acidophilus y Streptococus mutans. La concentración mínima inhibitoria (CMI) fue determinada por medio de la técnica de Azul de Alamar (Acosta, León & Leal, 2004) utilizando placas de 96 pozos estériles.
Para la determinación de la concentración mínima bactericida (CMB) se tomó una alícuota de 10 µl de cada pozo del ensayo anterior antes de agregar la resazurina. La alícuota se pasó a una caja petri con agar nutritivo en donde se extendió con estría cerrada, incubándose por 24 horas a 37° C en microaerofilia. Pasado dicho tiempo, se observaron las placas de agar para verificar crecimiento. La CMB se determinó como la mínima concentración en la que no hubo crecimiento bacteriano.
Efectos sinérgicos entre el sulfato de cobre y moléculas terpénicas
Los estudios de interacción se realizaron basándose en la técnica de Azul de Alamar en la que los compuestos se distribuyen de acuerdo con el método de prueba de tablero de ajedrez (Caleffi-Ferracioli, Maltempe, Siqueira & Cardoso, 2013). Usando el método de tablero de ajedrez de microdilución de caldo se obtuvo el índice de concentración inhibitoria fraccionada (CFI): CFI = (Ac/Aa) + (Bc/Ba), donde Ac y Bc son la concentración inhibitoria mínima (CMI) de los compuestos en combinación, y Aa y Ba son los MIC de los compuestos puros (Caleffi-Ferracioli et al., 2013; Mataraci & Dosler, 2012). El sinergismo por el método del tablero de ajedrez se define como un índice CFI de ≤ 0.5, el efecto aditivo se define como un índice CFI de > 0.5 y ≤ 1, el efecto indiferencia se define como un índice CFI de> 1 y ≤ 2 y el efecto antagonista se define como un índice CFI > 4 (Silva, 2014).
Actividad antibiopelícula del sulfato de cobre sobre piezas dentales
La actividad del CusSO4 sobre las biopelículas de Lactobacillus acidophilus y Streptococcus mutans en nueve órganos dentales se realizó mediante cuenta de unidades formadoras de colonias (UFC). Para tal efecto, a nueve tubos se le adicionaron 15 mL de caldo Man, Rogosa y Sharpe (MRS); posteriormente, se agregó un órgano dental por tubo, estos fueron previamente limpiados y esterilizados con luz ultravioleta durante 10 minutos. Después se adicionó a cada tubo 1 mL de solución fisiológica, con una cepa de Lactobacillus acidophillus o Streptococcus mutans, ajustada al estándar de 1% de Mc Farland y se incubaron a 37 ºC.
Al séptimo día de incubación, tiempo en que se forma la biopelícula sobre la superficie del diente, los dientes son retirados y se colocaron de forma individual durante 5 min en siete tratamientos diferentes: (1) tres dientes se colocaron en tres tubos con 15 mL de solución fisiológica; (2) tres dientes se colocan en tres tubos con 15 mL de solución de clorhexidina a 1000 μg/mL; (3) tres dientes se colocaron en tres tubos con 15 mL de solución de Cu2SO4 a 500 μg/mL; (4) tres dientes se colocaron en tres tubos con 15 mL de solución de geraniol a 500 μg/mL; (5) tres dientes se colocaron en tres tubos con 15 mL de solución de Cu2SO4/geraniol a 500 μg/mL (1:1); (6) tres dientes se colocaron en tres tubos con 15 mL de solución de limoneno a 500 μg/mL; (7) tres dientes se colocaron en tres tubos con 15 mL de solución de Cu2SO4/limoneno a 500 μg/mL (1:1).
Transcurridos los 5 min de tratamiento, los dientes son retirados y se colocaron cada uno de forma individual en 15 mL de solución fisiológica para luego desprender la biopelícula por agitación en Vortex durante 1 min. Posteriormente los dientes se retiraron y se tomó 1 mL de la solución de la biopelícula desintegrada y se depositó en otro tubo con 9 mL de solución fisiológica, esta disolución se mezcló durante 30 seg. El procedimiento se repitió hasta tener cinco tubos por tratamiento.
De cada uno de los tubos obtenidos se tomaron tres gotas de 10 μL cada una, y se colocaron en una caja de agar MRS debidamente etiquetada. Las cajas se incubaron a 37 ºC durante 24 hrs con CO2 al 10%. Una vez pasado el tiempo de incubación, se llevó a cabo el conteo de UFC.
Análisis estadístico
Para la evaluación de la diferencia en la actividad antimicrobiana, los datos de CMI y CMB se analizaron por un análisis de varianza y, en los casos en que el análisis demostró diferencia significativa entre los tratamientos, se utilizó la prueba de análisis de medias de Tukey con un nivel de confianza del 95%, para describir diferencias en agrupación. Los datos se realizaron utilizando el programa de computación Minitab (Minitab 17, Minitab Inc. State College, PA, USA). De la misma forma, la disminución del crecimiento de microorganismos en biopelículas por la presencia de terpenos también se realizó por análisis de varianza y una posterior evaluación de medias por Tukey.
Resultados
Los resultados demuestran que el Cu2SO4 posee actividad antimicrobiana relevante, específicamente en un rango de 50 μg/mL a 100 μg/mL para el L. acidophilus (Tabla 1). Esto equivale a soluciones al 0.005% a 0.010%, perfectamente compatibles con el ser humano si se toma en cuenta que la dosis de ingesta diaria recomendada para un lactante es el equivale a 0.02% (Cruz et al., 2017; Espírito-Santo et al., 2010). S. mutans resultó ser más resistente, con valores de CMI y CMB de 100 μg/mL y 250 μg/mL, respectivamente.
Tabla 1 Actividad antimicrobiana del Cu2SO4 y monoterpenos sobre cepas de Lactobacillus acidophilus (L) y de Streptococcus mutans (S). Concentraciones evaluadas a μg/mL. Cada valor es la media de un ensayo realizado por triplicado.
| Sulfato de Cobre | Geraniol | Limoneno | Mentol | |||||
| Cepas | CMI | CMB | CMI | CMB | CMI | CMB | CMI | CMB |
| L1 | 33.3 ± 14.4 | 250.0 ± 0.0 | 66.6 ± 14.4 | 250.0 ± 0.0 | 175.0 ± 25.0 | 500.0 ± 0.0 | 200.0 ± 25.0 | 416.6 ± 144.3 |
| L2 | 41.6 ± 14.4 | 250.0 ± 0.0 | 58.3 ± 14.4 | 250.0 ± 0.0 | 158.3 ± 14.4 | 500.0 ± 0.0 | 200.0 ± 43.3 | 583.3 ± 144.3 |
| L3 | 41.6 ± 14.4 | 250.0 ± 144.3 | 58.3 ± 14.4 | 250.0 ± 0.0 | 125.0 ± 25.0 | 500.0 ± 0.0 | 200.0 ± 25.0 | 583.3 ± 144.3 |
| L4 | 58.3 ± 14.4 | 250.0 ± 0.0 | 83.3 ± 14.4 | 250.0 ± 0.0 | 125.0 ± 25.0 | 583.3 ± 144.3 | 225.0 ± 43.3 | 500.0 ± 0.0 |
| L5 | 66.6 ± 14.4 | 250.0 ± 144.3 | 58.3 ± 14.4 | 266.6 ± 28.8 | 141.6 ± 14.4 | 500.0 ± 0.0 | 216.6 ± 43.3 | 500.0 ± 0.0 |
| L6 | 41.6 ± 14.4 | 333.3 ± 144.3 | 75.0 ± 0.0 | 250.0 ± 0.0 | 166.6 ± 38.1 | 500.0 ± 0.0 | 183.3 ± 14.4 | 500.0 ± 0.0 |
| L7 | 66.6 ± 14.4 | 250.0 ± 0.0 | 83.3 ± 14.4 | 333.3 ± 144.3 | 158.3 ± 14.4 | 500.0 ± 0.0 | 200.0 ± 25.0 | 500.0 ± 0.0 |
| L8 | 41.6 ± 14.4 | 250.0 ± 144.3 | 75.0 ± 25.0 | 266.6 ± 28.8 | 133.3 ± 14.4 | 500.0 ± 0.0 | 183.3 ± 38.1 | 500.0 ± 0.0 |
| L9 | 50.0 ± 0.0 | 250.0 ± 0.0 | 66.6 ± 14.4 | 250.0 ± 0.0 | 158.3 ± 14.4 | 583.3 ± 144.3 | 258.3 ± 14.4 | 500.0 ± 0.0 |
| L10 | 50.0 ± 0.0 | 250.0 ± 144.3 | 58.3 ± 14.4 | 333.3 ± 144.3 | 116.6 ± 14.4 | 500.0 ± 0.0 | 183.3 ± 14.4 | 500.0 ± 0.0 |
| L11 | 58.3 ± 14.4 | 250.0 ± 144.3 | 58.3 ± 14.4 | 250.0 ± 0.0 | 141.6 ± 14.4 | 500.0 ± 0.0 | 200.0 ± 25.0 | 500.0 ± 0.0 |
| L12 | 50.0 ± 0.0 | 250.0 ± 0.0 | 66.6 ± 14.4 | 250.0 ± 0.0 | 166.6 ± 38.1 | 500.0 ± 0.0 | 200.0 ± 43.3 | 500.0 ± 0.0 |
| L13 | 91.6 ± 14.4 | 250.0 ± 144.3 | 91.6 ± 14.4 | 250.0 ± 0.0 | 175.0 ± 25.0 | 500.0 ± 0.0 | 200.0 ± 25.0 | 500.0 ± 0.0 |
| L14 | 91.6 ± 14.4 | 200.0 ± 144.3 | 66.6 ± 14.4 | 250.0 ± 0.0 | 158.3 ± 14.4 | 500.0 ± 0.0 | 216.6 ± 38.1 | 500.0 ± 0.0 |
| L15 | 41.6 ± 14.4 | 250.0 ± 0.0 | 83.3 ± 14.4 | 250.0 ± 0.0 | 108.3 ± 14.4 | 583.3 ± 144.3 | 216.6 ± 38.1 | 500.0 ± 0.0 |
| S1 | 91.6 ± 10.2 | 250.0 ± 0.0 | 116.6 ± 28.8 | 241.6 ± 38.1 | 233.3 ± 28.8 | 500.0 ± 0.00 | 266.6 ± 28.8 | 500.0 ± 0.0 |
| S2 | 100.0 ± 0.0 | 250.0 ± 0.0 | 91.6 ± 14.4 | 258.3 ± 14.4 | 275.0 ± 25.0 | 583.3 ± 144.3 | 283.3 ± 14.4 | 500.0 ± 0.00 |
Fuente: Elaboración propia.
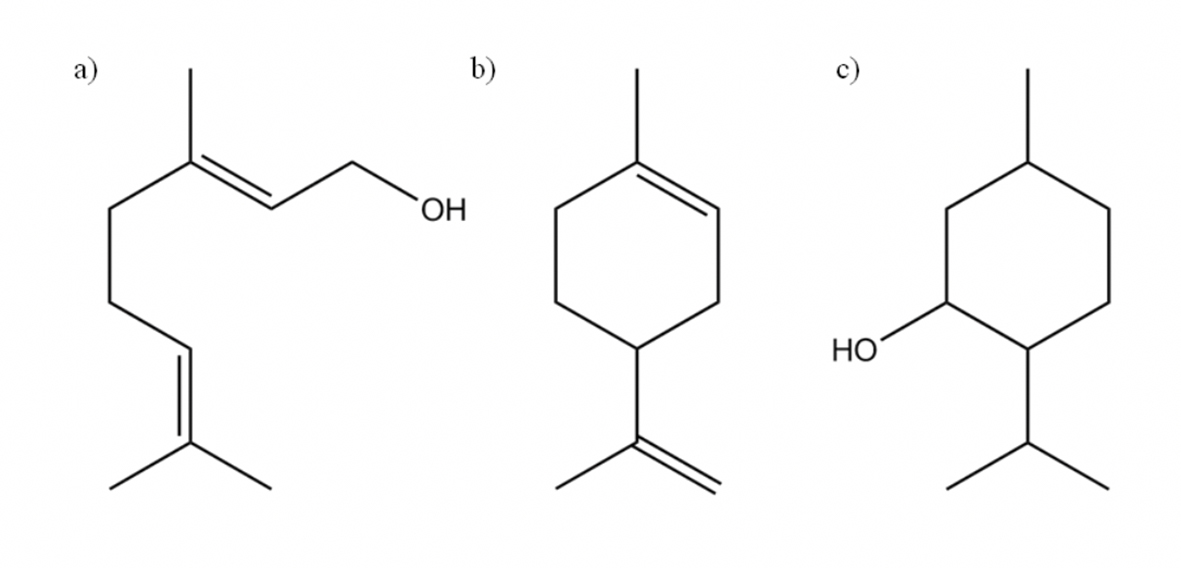
El presente trabajo, además de evaluar la actividad antimicrobiana del Cu2+ en forma de Cu2SO4, tiene como objetivo encontrar efectos antimicrobianos en asociación con productos naturales. Para tal efecto también fue evaluada la actividad antimicrobiana del geraniol, limoneno y mentol, tres monoterpenos encontrados en diversos aceites esenciales (Figura 1).
Fuente: Elaboración propia.
Figura 1 Estructura química de los monoterpenos evaluados. a) Geraniol, b) Limoneno, c) Mentol.
Los valores de CMI y CMB de estos compuestos se encuentran en la Tabla 1. Los resultados demuestran la actividad bacteriostática y bactericida de estos compuestos, siendo el geraniol el de mayor actividad contra todas las cepas de L. acidophilus y S. mutans.
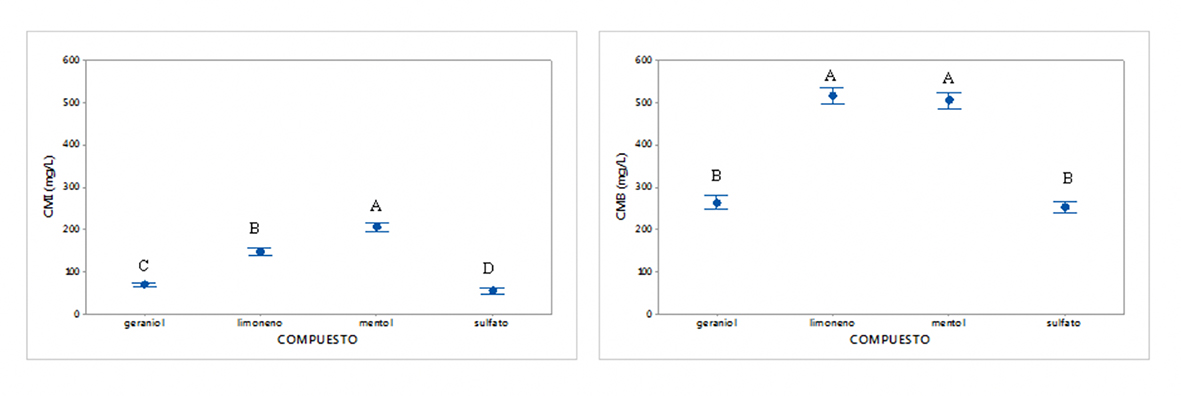
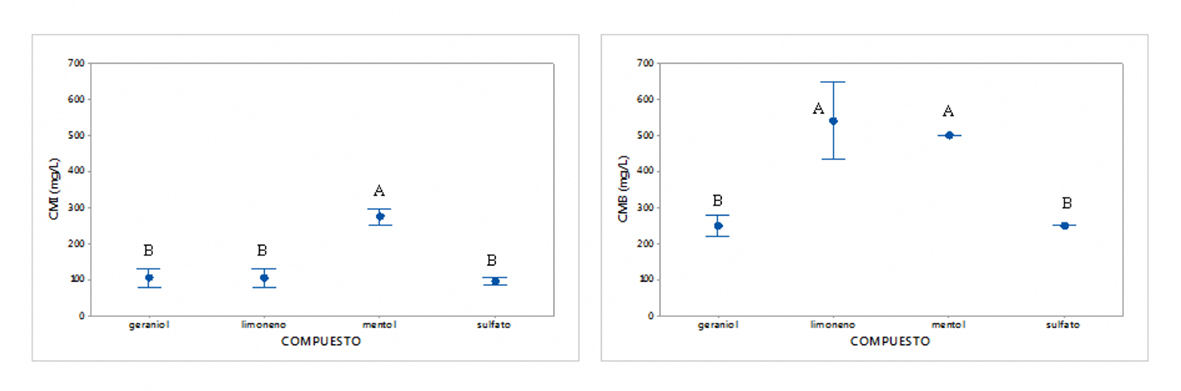
El análisis de varianzas demostró que existen diferencias significativas entre los tratamientos. Para el caso de L. acidophilus, el Cu2SO4 es el de mayor actividad con una media de CMI de 55 μg/mL, mientras que el mentol tuvo menor actividad con una media de CMI de 205.55 μg/mL. El análisis agrupó a la CMB en dos, uno con semejanzas entre las actividades del limoneno y el mentol y otro grupo con el geraniol y el Cu2SO4 (Figura 2). El estudio reveló también que la cepa L13 presenta diferencia significativa respecto a todas las demás con una media de CMI de 139.58 μg/mL, por lo que esta cepa es la más resistente a los tratamientos. Las cepas de S. mutans no presentaron diferencias significativas entre ellas, mientras que los tratamientos se agruparon en dos grupos, siendo nuevamente el mentol el de menor actividad y el Cu2SO4 el de mayor actividad (Figura 3).
Fuente: Elaboración propia.
Figura 2 Diferencias entre los tratamientos de la Concentración Mínima Inhibitoria (CMI) y la Concentración Mínima Bactericida (CMB) entre los tratamientos evaluados contra L. acidophilus. Los superíndices corresponden a agrupaciones por similitud realizadas por un análisis de medias de Tukey (p < 0.05).
Fuente: Elaboración propia.
Figura 3 Diferencias entre los tratamientos de la Concentración Mínima Inhibitoria (CMI) y la Concentración Mínima Bactericida (CMB) entre los tratamientos evaluados contra S. mutans. Los superíndices corresponden a agrupaciones por similitud realizadas por un análisis de medias de Tukey (p < 0.05).
La asociación de agentes antimicrobianos es ampliamente utilizada en la farmacéutica, con la finalidad de encontrar terapias que en sinergismo favorezcan y promuevan una mayor actividad bacteriostática-bactericida con una menor dosis. En el presente estudio se utilizó la técnica de tablero de ajedrez y el indicador de resazurina para determinar los efectos en la asociación del Cu2SO4 con las moléculas terpénicas. En este estudio se utilizaron las cepas L13 de L. acidophilus y la cepa S2 S. mutans, por presentar mayor resistencia a los compuestos antimicrobianos analizados. Los resultados demuestran que el Cu2SO4 a concentraciones de 100 μg/mL, 75 μg/mL, 50 μg/mL y 25 μg/mL tiene efectos sinérgicos en asociación con el geraniol a concentraciones de 50 μg/mL y 25 μg/mL contra ambas cepas (Tabla 2). Esta asociación (Cu2SO4/Geraniol) logra inhibir a L. acidophilus a una concentración de 18.36 μg/mL y a S. mutans a 48.33 μg/mL, concentraciones muy por debajo de la CMI de los compuestos por separado. La asociación del Cu2SO4 con los otros dos terpenos no presentó efectos sinérgicos.
Tabla 2 Distribución de los efectos in vitro observados con la asociación entre el sulfato de cobre y las moléculas monoterpénicas sobre la cepa L13 de L. acidophilus y la cepa S2 de S. mutans.
| Mezclas | L. acidophilus (L13) | S. mutans (S2) | ||
| Sulfato de Cobre (100 μg/mL) | CIF | Efecto | CIF | Efecto |
| Geraniol (50 μg/mL) | 0.35 | Sinergismo | 0.41 | Sinergismo |
| Limoneno (150 μg/mL) | 0.83 | Aditivo | 0.96 | Aditivo |
| Mentol (200 μg/mL) | 1.17 | Aditivo | 1.02 | Aditivo |
| Sulfato de Cobre (75 μg/mL) | CIF | Efecto | CIF | Efecto |
| Geraniol (25 μg/mL) | 0.28 | Sinergismo | 0.41 | Sinergismo |
| Limoneno (150 μg/mL) | 0.92 | Aditivo | 1.12 | Aditivo |
| Mentol (200 μg/mL) | 1.28 | Aditivo | 1.23 | Aditivo |
| Sulfato de Cobre (50 μg/mL) | CIF | Efecto | CIF | Efecto |
| Geraniol (25 μg/mL) | 0.28 | Sinergismo | 0.41 | Sinergismo |
| Limoneno (100 μg/mL) | 1.72 | Indiferencia | 1.26 | Aditivo |
| Mentol (200 μg/mL) | 1.83 | Indiferencia | 1.66 | Indiferencia |
| Sulfato de Cobre (25 μg/mL) | CIF | Efecto | CIF | Efecto |
| Geraniol (25 μg/mL) | 0.28 | Sinergismo | 0.41 | Sinergismo |
| Limoneno (100 μg/mL) | 1.83 | Indiferencia | 1.67 | Indiferencia |
| Mentol (200 μg/mL) | 1.53 | Indiferencia | 1.72 | Indiferencia |
Fuente: Elaboración propia.
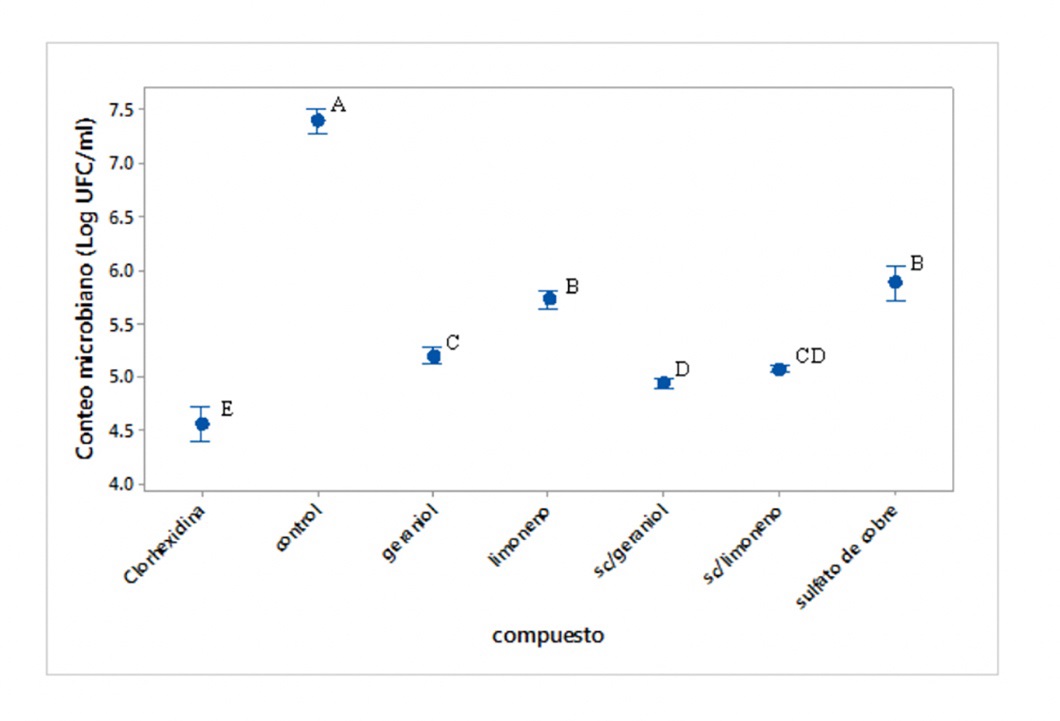
Una vez demostrada la actividad antimicrobiana del Cu2SO4 y de los compuestos terpénicos se procedió a determinar las propiedades de inhibición de la formación de biopelícula sobre órganos dentales, evaluando la reducción del número de células viables (UFC). Este estudio se realizó únicamente sobre la cepa L13 de L. acidophilus, debido a que las cepas de S. mutans no fueron capaces de formar biopelícula. Debido a su baja actividad antimicrobiana, el mentol fue excluido del experimento. Se utilizó clorhexidina como control.
Las propiedades antibiopelícula del Cu2SO4, el geraniol y el limoneno, así como su asociación, fueron demostradas en el presente trabajo, teniendo reducción significativa en el número del conteo microbiano (Figura 4). El control (solución fisiológica) presentó 7.39 logUFC/mL; en comparación, el Cu2SO4 individualmente logró reducir un ciclo logarítmico y medio de crecimiento, presentando 5.88 logUFC/mL. El Cu2SO4 en asociación con geraniol presentó mayor actividad, reduciendo más de dos ciclos logarítmicos de crecimiento bacteriano, una reducción mayor que el geraniol por sí solo, demostrándose los efectos sinérgicos entre estos dos compuestos. El tratamiento control elegido fue la clorhexidina, siendo esta la de mayor actividad (4.55 logUFC/mL).
Discusión
La caries dental es el resultado de un proceso infeccioso generalmente lento, iniciado por la concentración de agentes bacterianos (principalmente Streptococcus mutans y Lactobacillus acidophilus) que se adhieren al diente gracias a una matriz constituida por proteínas salivares (placa bacteriana) (Hillson, 2001; Menéndez & Zela, 2017). La caries dental es la enfermedad que padece aproximadamente 90% de la población en América Latina, siendo el principal problema de salud pública, respecto a enfermedades bucodentales (Flores-Tenechahua, Villavicencio-Caparó & Corral-Peñafiel, 2017). Debido a su alta incidencia, la implementación de nuevos métodos para disminuir la prevalencia e incidencia de esta enfermedad son necesarios. Por otro lado, el uso indiscriminado de antibióticos ha generado alta resistencia bacteriana a los antibacterianos, por lo que es preciso tener alternativas preventivas y terapéuticas (Salazar, Medina, Donoso, Barrientos & Sanhuesa, 2009).
En los últimos años se han realizado investigaciones científicas que han permitido documentar las propiedades antimicrobianas del cobre y fomentar su uso en la práctica médica (Prado, Vidal & Durán, 2012).
Experimentos con cepas de Pseudomonas aeruginosa han mostrado un efecto sinérgico entre cationes de cobre (Cu2+) y desinfectantes de amonio cuaternario, para ejercer acción bactericida sobre este patógeno, que tiene especial habilidad para sobrevivir en ambientes con baja concentración de nutrientes y un mínimo de humedad, por lo cual coloniza con frecuencia a catéteres y diversos equipos médicos (Harrison et al., 2008). Otros estudios han demostrado, utilizando los criterios exigidos por la Agencia de Protección Ambiental de los Estados Unidos (EPA, por sus siglas en inglés), que superficies de cobre o sus aleaciones son capaces de eliminar en horas 99.9% de bacterias patógenas (Faúndez, Troncoso, Navarrete & FIgueroa, 2004; Grass et al., 2011). El cobre en forma de Cu2SO4 ha sido utilizado para evitar contaminación cruzada e infecciones intrahospitalarias (Espírito-Santo et al., 2010)
El presente estudio confirma que el cobre es un agente antimicrobiano eficaz y que es posible utilizarlo en forma de Cu2SO4 para el control y la eliminación de los microorganismos causantes de la caries, tal y como lo reporta Foley & Blackwell (2003). El intervalo encontrado en este estudio, entre la dosis bacteriostática y dosis bactericida, del Cu2SO4 es de 50 μg/mL a 500 μg/mL, respectivamente, y concuerda con lo reportado por Afseth et al. (1984), quienes utilizaron 65 μg/mL de Cu en el agua potable y con ello redujo el desarrollo de caries en ratas.
La ingesta dietética de referencia 2001 para Cu para adultos de 19 años en adelante es de 0.9 mg/día (Trumpo et al., 2001). La Organización Mundial de la Salud (1993) ha establecido requisitos mínimos estimados para el Cu a 0.6 mg/día para las mujeres y 0.7 mg/día para los hombres. La dosis letal estimada de Cu en un adulto es de aproximadamente 10/20 g (Gaetke & Chow, 2003). Debido a que la mayoría de los seres humanos y animales pueden controlar las cantidades excesivas de Cu en el cuerpo, ya sea por disminución de la absorción o aumento de la excreción, la toxicidad de Cu aguda y crónica es relativamente rara (Gaetke & Chow, 2003).
Existen varios estudios que han demostrado los mecanismos de acción que puede ejercer el cobre sobre distintos microorganismos; en resumen, los cuatro mecanismos asociados al cobre son: (1) daño de la membrana bacteriana; (2) daño oxidativo por las especies reactivas de oxígeno (ROS); (3) inhibición de enzimas esenciales; y (4) degradación del ácido desoxirribonucleico (ADN) (Hans, Mathews, Mücklich & Solioz, 2016).
Además de evaluar la actividad antimicrobiana del Cu2SO4 sobre cepas de Streptococcus mutans y Lactobacillus acidophilus, el presente trabajo también evaluó la actividad de tres monoterpenos contra estos microorganismos. El geraniol, el limoneno y el mentol presentan diversas actividades antimicrobianas (Aperce et al., 2016; Martinelli et al., 2017; Umagiliyage, Becerra-Mora, Kohli, Fisher & Choudhary, 2017) y sus características fisicoquímicas, específicamente las asociadas con su olor y sabor, son predilectas para su uso en asociación con agentes antimicrobianos como el Cu2SO4.
El mecanismo de acción de los compuestos terpénicos no se encuentra del todo descrito, y lo más probable es que su actividad antimicrobiana no sea debido a un modo de acción específico (Knezevic et al., 2016). Los efectos tóxicos sobre la estructura y función de las membranas y paredes celulares generalmente se han usado para explicar la acción antimicrobiana de este tipo de compuestos. Algunos estudios han demostrado que los monoterpenos son capaces de interactuar con las membranas fosfolipídicas, de manera que los monoterpenos actúan como impurezas intersticiales en la estructura ordenada de la bicapa lipídica (Sharifi-Rad et al., 2017; Trombetta et al., 2005), lo anterior como resultado de su carácter lipofílico, resultando preferencialmente atraídos a las estructuras de la membrana (Idris et al., 2017; Sikkema, De Bont & Poolman, 1994; 1995).
El atractivo principal de los aceites esenciales y de sus componentes para ser empleados como potenciales agentes farmacéuticos es la baja toxicidad hacia mamíferos. Algunos de los compuestos puros de aceites presentan una muy baja o nula toxicidad, con valores de toxicidad aguda oral en ratas de LD50 de 2 g/kg -5 g/kg (anís, eucalipto, clavo, canela, etc.). Este último valor es el límite superior de toxicidad aguda requerido por la EPA (Isman, 2006). Un estudio evaluó el potencial citotóxico y genotóxico de los monoterpenoides citral y geraniol sobre linfocitos humanos. Los resultados demostraron que estos compuestos inducen citotoxicidad y genotoxicidad a concentraciones mayores de 1000 µg/mL (Sinha et al., 2011). Por otro lado, Da Silva, Figueiredo & Yano (2007) evaluaron la actividad citotóxica de los compuestos terpénicos mirceno, pineno y linalol. Sus resultados demostraron que los compuestos tienen actividad citotóxica a 600 µg/mL sobre macrófagos de ratón y células Vero.
Los resultados demuestran que el Cu2SO4 presenta mayor actividad bacteriostática y bactericida contra Streptococcus mutans y Lactobacillus acidophilus que los terpenos evaluados (geraniol, limoneno, mentol) (Tabla 1). Sin embargo, en asociación, el Cu2SO4 presenta efectos sinérgicos con el geraniol, obteniendo concentraciones bacteriostáticas por debajo de las CMI de los compuestos puros.
Respecto a la actividad antiadherente, pueden observarse algunos datos interesantes. A pesar de que la actividad bacteriostática y bactericida del Cu2SO4 supera a la de los compuestos terpénicos, son estos últimos quienes poseen mayor actividad antiadherente (Figura 4). Los efectos sinérgicos en asociación Cu2SO4/Geraniol siguen observándose al evaluar las propiedades antiadherentes, este mismo efecto se observa en la actividad antiadherente en la asociación Cu2SO4/Limoneno, un efecto no detectado en los estudios in vitro por medio de la técnica de ajedrez.
Los efectos antibacteriano y antibiopelícula del geraniol han sido evaluados contra otros microorganismos como Escherichia coli, Staphylococcus aureus o Candida albicans (Kannappan et al., 2018; Millezi, Piccoli, Oliveira & Pereira, 2016; Mirza, Hasan, Seidel & Yu, 2018; Singh, Fatima & Hameed, 2016). Los efectos sinérgicos en la asociación entre el Cu2SO4 y los compuestos terpénicos puede deberse a la propiedad de los terpenos para acceder a espacios lipofílicos de la matriz de la biopelícula, efecto que posteriormente podría permitir el acceso del Cu2SO4 y ejercer su actividad antimicrobiana. Esta hipótesis podría dar respuesta a la baja actividad antibiopelícula del Cu2SO4 a pesar de su alta actividad antimicrobiana; sin embargo, deben realizarse estudios posteriores para demostrarlo.
Conclusiones
El sulfato de cobre presenta actividades antimicrobianas relevantes sobre microorganismos que han sido reconocidos como responsables del progreso de la caries. Así mismo, el presente estudio demuestra que su asociación con compuestos terpénicos representa una alternativa muy eficaz para el control de estos agentes etiológicos. Sin embargo, otros estudios deben ser realizados con la finalidad de determinar su absoluta biocompatibilidad en su uso como coadyuvantes en la higiene oral.











 text new page (beta)
text new page (beta)