Introducción
Las especies animales sociables toman decisiones en grupo a través de consensos (Couzin et al., 2011). Las decisiones por consenso ocurren en función de la elección que hacen los individuos que integran un grupo, pero con base en lo que los otros integrantes del grupo hagan (Sumpter & Pratt, 2009). Como una estrategia de supervivencia, las decisiones por consenso buscan mantener la cohesión del grupo (Conradt & Roper, 2000; Doya, 2008; Sueur et al., 2011). La cohesión grupal se alcanza a través del intercambio de información (Bateson & Kacelnic, 1998; Dall, Luc-Alain, Olsson, McNamara & Stephens, 2005). Es la velocidad y la precisión del intercambio de información proporcionada entre los vecinos lo que determina la duración de la toma de decisiones (Chittka, Skorupski & Raine, 2009; Conradt & Roper, 2005). Entonces, el tamaño del grupo es importante para el intercambio de información, ya que únicamente se requiere de una pequeña proporción de individuos informados para tomar decisiones consensuadas, de tal forma que entre menos integrantes tenga el grupo, más integrantes informados habrá (Couzin, Krause, Franks & Levin, 2005).
El comportamiento social en las especies del Orden Crocodylia es sutil y complejo (Garrick & Lang, 1977). Se comunican por señales acústicas y son capaces de generar diferentes tipos de vocalizaciones para transmitir información, sin que exista un órgano fonador anatómicamente definido (Britton, 2000; Lang, 1987). Los Crocodylia emiten sonidos en todas sus etapas de desarrollo y las primeras interacciones sociales ocurren durante la etapa final como embrión (Mathevon, Aubin & Vergne, 2013).
La eclosión en grupo de los Crocodylia es dinámica. Los embriones emiten sonidos, conocidos como llamados preeclosionales, desde el interior del huevo para abandonar el nido en grupo (Britton, 2000; Garrick & Lang, 1977; Lang, 1992). Se considera que los llamados preeclosionales cumplen dos propósitos: sincronizar la eclosión y atraer la atención de la madre (Álvarez, 1974; Britton, 2000; Garrick & Lang, 1977; Herzog, 1975; Johnstone, 1997; Lang, 1992; Vergne & Mathevon, 2008). Debido a que los embriones cuentan con todas sus estructuras anatómicas a los setenta días de incubación, es posible que ya produzcan sonidos para eclosionar (Ferguson, 1985). La duración de la eclosión grupal es el tiempo que transcurre desde que es emitido el primer llamado preeclosional hasta que toda la nidada emerge (Ardila-Robayo, Barahona-Buitrago, Bonilla-Centeno & Cárdenas-Rojas, 1999; Magnusson, 1980). En condiciones de incubación artificial, el inicio de los llamados preeclosionales es espontáneo (Mandujano & Hénaut, 2014). Se ha observado en los Crocodylia que los embriones de nidadas in situ raramente emiten llamados preeclosionales espontáneamente antes de eclosionar (Allsteadt, 1994; Kushlan & Kushlan, 1980; Magnusson, 1980).
El tiempo en tomar decisiones en grupo puede variar debido a las diferencias de opinión entre individuos, ya que en el individuo siempre influye lo que otros integrantes del grupo hacen (Alcock, 1993). El tiempo en tomar una decisión estará en función del número de miembros del grupo que sean reclutados (Conradt & Roper, 2005). Un reclutamiento es la formación de un grupo a través de una interacción social, donde el comportamiento de un individuo atrae la atención de otro y se replica (Bousquet, Sumpter & Manser, 2011).
Los animales reclutan seguidores atrayendo su atención a través de diferentes señales de comunicación, por ejemplo, la emisión de señales acústicas (Ramseyer, Petit & Thierry, 2008). Esto parece ocurrir con los llamados preeclosionales de los Crocodylia, ya que durante el proceso de eclosión los integrantes de la nidada emiten sonidos, mientras que los otros compañeros de nidada refuerzan con el mismo sonido al otro individuo que lo emitió (Ferguson, 1985; Garrick & Lang, 1977; Mathevon et al., 2013). La dinámica interacción vocal entre los embriones en eclosión contiene información biológica importante y es capaz de provocar eclosiones prematuras (Mandujano-Camacho, Camas-Robles & Alvarado-Pérez, 2015).
Se desconoce si el tipo de vocalización de los llamados preeclosionales, aquellas emitidas al inicio o al final del proceso de eclosión, y la tasa de repetición vocal como referencia de la dinámica de intercambio de información de manera rápida o lenta, tienen un efecto tanto en la duración de las eclosiones como en el número de individuos que eclosionan juntos en la misma nidada. Es posible que la duración del proceso de eclosión de una nidada y el número de individuos que eclosionan juntos en el mismo intervalo de tiempo puedan ser indicadores de como el tipo de vocalización y la velocidad de repetición de los llamados preeclosionales son importantes en las eclosiones.
El playback es una técnica empleada para investigar el uso de las señales acústicas en los sistemas de comunicación animal e implica grabar previamente el sonido de interés para que, posteriormente, en condiciones adecuadas de experimentación se reproduzca y se pueda observar la respuesta de los animales (McGregor et al., 1992). Esta técnica ha sido ampliamente utilizada en investigaciones con aves (Tubaro, 1999). En especies del Orden Crocodylia se ha probado que responden bien a las grabaciones (Magnusson, 1980); por ejemplo, los individuos adultos de Alligator mississippiensis responden agresivamente a las grabaciones de rugidos de conespecíficos (Beach, 1944), mientras que las hembras de Crocodylus niloticus responden rascando la tierra cuando escuchan grabaciones de neonatos vocalizando (Vergne & Mathevon, 2008). Entonces, el uso de la técnica de playback podría ayudar a comprender mejor aquellos comportamientos crípticos inmersos en la comunicación acústica de los Crocodylia, por ejemplo, si los llamados preeclosionales influyen en la eclosión.
Crocodylus moreletii es una especie nativa de México, Guatemala y Belice (Álvarez, 1974). Como todos los Crocodylia, esta especie juega un rol importante en los ecosistemas acuáticos que ocupa, por ejemplo, en la regulación de poblaciones por su condición de depredador (Cedillo-Leal, Martínez-González, Briones-Encinia, Cienfuegos-Rivas & García-Grajales, 2007; Dudgeon et al., 2006; Gans, 1989). La especie construye sus nidos cerca de los ríos, lagunas y pantanos donde suele habitar (Escobedo-Galván, Casas-Andreu, Barrios-Quiroz, Sustaita-Rodríguez & López-Luna, 2011); desova típicamente alrededor de 30 huevos, los cuales son incubados durante un periodo de 90 días, a una temperatura de 28 °C a 32 °C (Casas-Andreu, Barrios-Quiroz & Macip-Ríos, 2011). La piel de C. moreletii es de alta calidad y usada en la industria peletera; su carne también es consumida, por lo cual guarda una importancia económica relevante a escala internacional (Caldwell, 2017; United Nations Conference on Trade and Development[UNCTAD], 2014).
No existen registros sobre cómo los llamados preeclosionales pueden afectar la dinámica y el número de las eclosiones que se producen. Estos puntos son de importancia, no solo por la necesidad de entender la biología reproductiva de los cocodrilos, sino también por los aspectos económicos ligados a la especie de cocodrilo considerada como clave para tener éxito en su reproducción artificial y en la reproducción de cocodrilos de especies en peligro para su reintroducción. Por lo tanto, se plantean las siguientes preguntas:
a) ¿Afectan la duración de las eclosiones los playbacks con diferente tasa de repetición vocal, rápida o lenta, y tipo de vocalización, inicial o final?
b) ¿Tienen los llamados preeclosionales de diferente tasa de repetición vocal y tipo de vocalización algún efecto sobre el número de individuos que eclosionan juntos en la nidada?
Materiales y Métodos
El trabajo se desarrolló en la Unidad de Manejo para la Conservación de la Vida Silvestre (UMA) “Aj Jut’s K’n Pacam”, ubicada en la ranchería Buena Vista en Tabasco, México en las coordenadas 18°08’28.7”N y 92°44’59.54”O. La distribución natural C. moreletii abarca el estado de Tabasco, México, lo que ofrece las condiciones ambientales favorables para el manejo reproductivo de la especie (Álvarez, 1974; Escobedo-Galván & González-Salazar, 2011).
La investigación se desarrolló en el periodo comprendido de mayo a septiembre, meses durante los cuales se presentan las puestas, incubación y eclosiones de C. moreletii (Casas-Andreu et al., 2011). Se emplearon en total 378 huevos provenientes de 18 nidadas almacenadas en la incubadora de la UMA, etiquetadas para este estudio con la fecha de puesta, fecha de colecta y número de huevos colectados. Las nidadas permanecieron en incubación artificial en dos etapas. La primera etapa se desarrolló en la incubadora de la UMA, donde permanecieron entre 60 y 69 días. Se registró la temperatura de incubación con un termómetro digital a las 08:15 h y esta permaneció en promedio (± DE) a 30.3 °C ± 0.5 °C. La segunda etapa se desarrolló en el laboratorio, donde se mantuvieron en las Cajas de Playback de 12 a 19 días de incubación, considerando que a esa edad los embriones de Alligator mississippiensis (Ferguson, 1985) y de C. johnstoni ya han completado su formación embrionaria y pueden emitir sonidos (Whitehead, Webb & Seymoir, 1990). De tal forma que la duración de la incubación artificial fue entre 79 y 81 días.
En el proceso de incubación de las nidadas en el laboratorio se emplearon contenedores de plástico rígido de color negro (70 cm de largo × 45 cm de ancho × 35 cm de profundidad), denominadas Cajas de Playback. En cada una de estas se instaló como fuente de calor un depósito de agua de latón donde se colocó un termostato para peceras de la marca Vanguardia Acuarista de 50 W, con rango de temperatura de 20 °C a 34 °C. Esto, además de proveer calor, también contribuyó con la humedad relativa por el efecto de la evaporación. La temperatura y humedad relativa dentro de las Cajas de Playback fue monitorizada a través de termómetros-higrómetros digitales de la marca Steren, modelo TER-100, instalados en su interior. La temperatura dentro de las Cajas de Playback permaneció en promedio (±DE) a 31.6 °C ± 0.38 °C. En tanto que la humedad relativa permaneció en promedio (±DE) a 94% ± 1.00%.
Las Cajas de Playback se distribuyeron en un espacio de 12.0 m2 y la separación entre ellas fue de 1.5 m. En cada repetición del experimento, a cada posición le fue asignado un tipo de playback al azar. Para evitar que los sonidos emitidos por los embriones en proceso de eclosión pudieran influir sobre sus congéneres en incubación, ya sea de su propia Caja de Playback o vecinos, cuando se detectaron las primeras vocalizaciones de un embrión en proceso de eclosión, se excluyó de la Caja de Playback.
En uno de los extremos al interior de las Cajas de Playback se instaló un par de bocinas de la marca Logitech® modelo S120 con repuesta de frecuencia de 50 Hz a 20 kHz. Las bocinas se conectaron por cable a una computadora instalada afuera del laboratorio, desde la cual se reprodujeron las pistas de playback. Se empleó el programa de cómputo Syrinx-PC para reproducir las pistas, y los cambios se realizaron de forma manual tanto en el número de pista en la computadora como en el cambio de cable que alimentaba las bocinas de la Caja de Playback en turno. Las pistas se reprodujeron de forma sistemática y en orden progresivo, con respecto al número asignado a cada Caja de Playback por su posición y a la asignación aleatoria en cada repetición. Por conveniencia logística, se establecieron dos sesiones de playback por día, uno de 05:00 h a 12:00 h y otro de 17:00 h a 24:00 h.
Con base en una grabación del proceso de eclosión de C. moreletii obtenida en la temporada reproductiva 2009, se produjeron siete pistas de playbacks con duración de 60 min cada una. Se utilizó el primer sonido grabado que emitió un embrión, al cual se le denominó vocalización inicial, y el último sonido grabado que emitió un embrión antes de romper el cascarón, al cual se le llamó vocalización final, ambos son sonidos audibles a simple oído. A través del programa de cómputo Audacity se manipuló la tasa de repetición vocal por unidad de tiempo; una fue definida como tasa de repetición rápida, la cual consistió en 60 vocalizaciones por minuto, y otra fue definida como tasa de repetición lenta, que consistió en seis vocalizaciones por minuto.
Con la finalidad de contar un sonido ajeno al proceso de eclosión de C. moreletii, pero propio de los Crocodylia, se produjeron dos pistas de playback de la vocalización denominada llamado de alarma (distress call, en inglés), con las respectivas variaciones en la tasa de repetición vocal (rápida y lenta). Este tipo de vocalización es la más conspicua en especies del Orden Crocodylia y la emplean para comunicarse en contextos conductuales de peligro, pero no durante la eclosión (Britton, 2000). Los llamados de alarma fueron grabados de un ejemplar de la especie Caiman crocodilus de 543 mm de longitud total, cautivo en el zoológico regional Miguel Álvarez del Toro en la ciudad Tuxtla Gutiérrez, Chiapas, México. La especie grabada no está presente en la UMA, ni comparte zona de distribución natural con C. moreletii en Tabasco (Álvarez, 1974). A esta grabación se le denominó Vocalización de Caiman crocodilus. Como grupo testigo se dejó una Caja de Playback a la cual no se le instalaron bocinas y se le denominó Caja de Playback de Silencio. La diferencia de la estructura espectro-temporal de los tres tipos de sonidos empleados en los playbacks se puede observar a simple vista en los espectrogramas de la Figura 1.
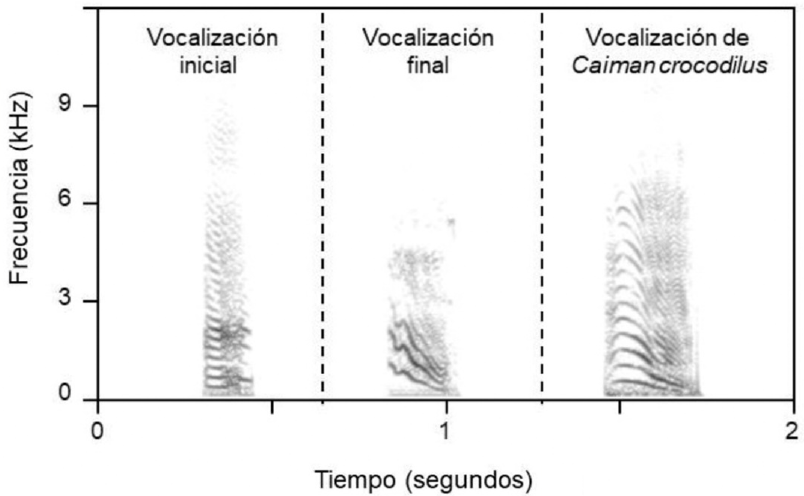
Fuente: Elaboración propia.
Figura 1 Diferenciación a simple vista de la estructura espectro-temporal de los tres tipos de sonidos empleados en los playbacks. El intervalo entre las vocalizaciones es artificial. De izquierda a derecha: vocalización preeclosional inicial de C. moreletii, vocalización preeclosional final de C. moreletii y vocalización (llamado de alarma) de Caiman crocodilus.
Las combinaciones entre el tipo de vocalización y la tasa de repetición vocal se codificaron para identificar las Cajas de Playback más fácilmente (Tabla 1). Los cambios de playbacks, el registro de temperatura y la humedad relativa, así como la monitorización de la actividad biológica dentro de cada Caja de Playback se realizó con la ayuda de una lámpara de led con luz de color rojo para evitar perturbación lumínica (Finley, 1959).
Tabla 1 Códigos de identificación de los tipos de playbacks a los que se sometieron nidadas de C. moreletii en condiciones controladas de incubación.
| Tipo de vocalización (Inicial o Final) y Tasa de Repetición (Lenta o Rápida) | Código |
|---|---|
| Vocalización Inicial Tasa de Repetición Lenta de C. moreletii | VITRL |
| Vocalización Inicial Tasa de Repetición Rápida de C. moreletii | VITRR |
| Vocalización Final Tasa de Repetición Lenta de C. moreletii | VFTRL |
| Vocalización Final Tasa de Repetición Rápida de C. moreletii | VFTRR |
| Vocalización de Caiman crocodilus Tasa de Repetición Lenta | VCcTRL |
| Vocalización de C. crocodilus Tasa de Repetición Rápida | VCcTRR |
| Ningún sonido | Silencio |
Fuente: Elaboración propia.
Para evitar que el sonido del playback en turno fuera escuchado al interior de una Caja de Playback vecina, se calibró la intensidad del sonido a la que se reprodujo cada pista. La calibración se realizó para todas las Cajas de Playback y se realizó por la noche, ya que el ruido ambiental es menor y los sonidos se perciben mejor. De tal forma que, el control de intensidad de sonido de las bocinas de las Cajas de Playback fue puesto al 50% de su capacidad. Seguido, el observador introdujo la cabeza a la Caja de Playback vecina y se cubrió con su respectiva tapa. En tanto, se reprodujo el playback correspondiente y desde la computadora se controló la intensidad del sonido incrementándolo progresivamente hasta que la persona con la cabeza dentro de la caja escuchaba el sonido. Entonces, se hacía el ajuste necesario hasta que no se escuchara ningún sonido.
La técnica de calibración de intensidad de reproducción del playback se realizó con base en el rango de audición del oído humano, que es más sensible que el oído de los cocodrilos. Wever (1971) sugirió que en los humanos el umbral auditivo es de 0 dB SPL a -4 dB SPL, mientras que en los Crocodylia es de -10 dB SPL a -14 dB SPL. De tal forma, si una persona no puede escuchar un sonido determinado, un cocodrilo tampoco puede escucharlo, aún si no estaban dentro del huevo.
Para las siete Cajas de Playback se realizaron seis repeticiones del experimento. Para cada repetición se seleccionaron tres nidadas almacenadas en la incubadora de la UMA, con al menos 21 huevos fértiles cada una y que tuviera 69 días o lo más próximo a este valor. En cada Caja de Playback se emplearon 9 huevos provenientes de 3 nidadas diferentes con fechas de puesta próximas entre sí ≤ 4 días, para evitar eclosiones prematuras (Mandujano & Hénaut, 2014). Los huevos fueron depositados en tapetes individuales de hule espuma a una distancia de 2.5 cm entre ellos.
Para conocer la posible diferencia en la duración de las eclosiones y las posibles diferencias entre el número de eclosiones por Caja de Playback se empleó una prueba no paramétrica de Kruskal-Wallis. Se estimó el éxito de eclosión en porcentaje. Para comprar la duración de las eclosiones entre las Cajas de Playback que emplearon más tiempo en eclosionar, se realizó una prueba de U de Mann Whitney. El número de eclosiones en grupos a partir de dos individuos y el número de huevos que no eclosionaron, pero que tuvieron que ser extraídos manualmente, se estimaron por adición y sustracción, respectivamente. Adicionalmente, se comparó el número de eclosiones que se presentaron en el horario matutino y vespertino, con base en el horario de monitorización y ejecución de playbacks, a través de una prueba estadística de G. Para realizar las pruebas estadísticas se empleó el programa de cómputo Paquete Estadístico para las Ciencias Sociales versión 20 (SPSS, por sus siglas en inglés).
Resultados
La duración en minutos de las eclosiones fue diferente entre los tipos de
playbacks, las nidadas de las Cajas de
Playback Silencio, tuvieron una duración de eclosión más
prolongada a las otras (Silencio,
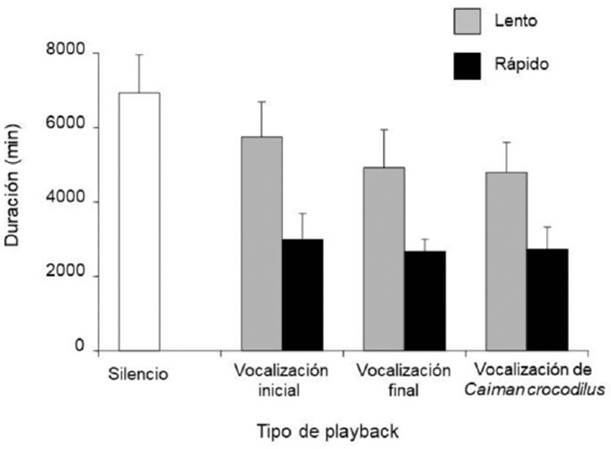
Fuente: Elaboración propia.
Figura 2 Duración promedio en minutos (± DE) de las eclosiones para los diferentes sonidos de playback.
Las eclosiones se presentaron tanto de manera individual como formando grupos a partir de dos individuos y hasta de cinco individuos. Los playbacks con tasa de repetición rápida, sin importar el tipo de vocalización (inicial o final), presentaron mayor número de eclosiones en grupo (Tipo de playback = Número de eclosiones en grupo, VFTRR = 10, VITRR = 8, VCcTRR = 6), mientras que con los playbacks con tasa de repetición lenta y Silencio se produjeron menor número de eclosiones en grupo (VITRL = 3, VCcTRL = 3, Silencio = 2). En la Caja de Playback de vocalización final con tasa de repetición lenta, no ocurrieron eclosiones en grupo (VFTRL = 0).
El éxito de eclosión entre las Cajas de Playback fue equivalente, independientemente del tipo de vocalización y la tasa de repetición vocal (Figura 3). En todas las Cajas de Playback eclosionaron de 6 a 8 huevos, lo que representa del 57% al 88% de éxito de eclosión. De tal forma que, no hay evidencia para afirmar que los playbacks influyen en el éxito de eclosión (Kruskal-Wallis: H = 6.98, P = 0.32).
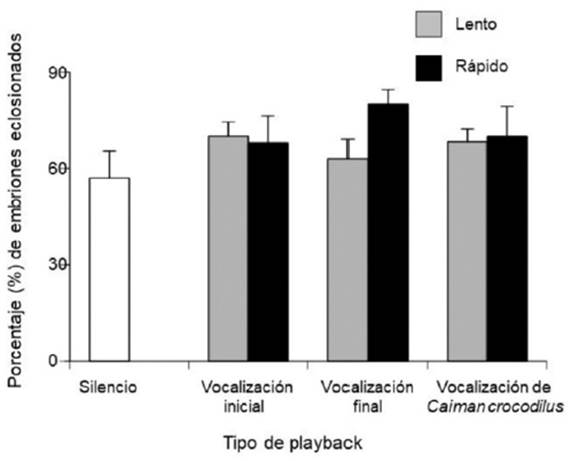
Fuente: Elaboración propia.
Figura 3 Porcentaje de embriones de C. moreletii eclosionados en los diferentes playbacks.
En las diferentes Cajas de Playback hubo huevos que no presentaron eclosión y cuyos embriones tuvieron que ser extraídos al final del periodo de incubación. Los playbacks que presentaron mayor número de huevos que no eclosionaron de forma natural fueron los de Silencio y los de vocalización final con tasa de repetición lenta, mientras que los playbacks en los que todos los huevos eclosionaron de forma natural fueron los de vocalización final con tasa de repetición rápida y los de vocalización de C. crocodilus con tasa de repetición rápida (playback = número de huevos extraídos a mano; Silencio = 8; VFTRL = 7; VCcTRL = 5; VITRL = 3; VITRR = 2; VFTRR = 0; VCcTRR = 0). Los embriones que fueron extraídos a mano no presentaron deformaciones; su cicatriz umbilical fue normal y emitieron vocalizaciones al momento en que fue roto su cascarón.
Como resultado adicional, las eclosiones ocurrieron tanto en la mañana como en la tarde, sin una tendencia marcada por ningún grupo, excepto los del playback de vocalización final con tasa de repetición rápida, los cuales eclosionaron más por la tarde-noche, con base en el horario de experimentación (G = 8.5, gl = 1, p = 0.003) (Figura 4).
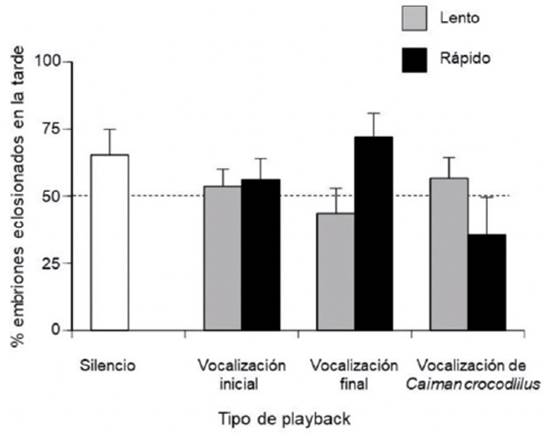
Fuente: Elaboración propia.
Figura 4 Porcentajes (%) de eclosiones en la tarde (17:00 h a 24:00 h), para los diferentes playbacks.
De manera general, las eclosiones duraron menos tiempo en las Cajas de Playback con tipo de vocalización final y de C. crocodilus, ambas con tasa de repetición rápida. La duración de las eclosiones se prolongó en las Cajas de Playback con vocalización inicial y tasa de repetición lenta, así como en las de Silencio. Se presentaron más eclosiones en grupo en los playbacks con tasa de repetición rápida y vocalización final de C. moreletii así como de C. crocodilus. En las Cajas de Playback con vocalización final y tasa de repetición lenta únicamente se presentaron eclosiones individuales.
Discusión
El momento en que se produce la vocalización del llamado preeclosional durante la eclosión, al inicio o final, así como la tasa de repetición vocal, lenta o rápida, influyen en la duración de la eclosión. El tipo de vocalización y la tasa de repetición vocal son dos parámetros del llamado preeclosional de los cuales los embriones de C. moreletii obtienen información para la eclosión en grupo. No todos los embriones de la nidada participan en la emisión de los llamados preeclosionales para reclutar congéneres (Obs. pers.). Sin embargo, es posible que sí utilicen como referencia para eclosionar los llamados de congéneres, ya que la comunicación no necesariamente es la respuesta vocal por la recepción de la señal, sino la alteración de la conducta como respuesta al mensaje y un simple oyente no está limitado a emplear la información contenida en el mensaje de un emisor; por lo tanto, es capaz de tomar la decisión de eclosionar (Seyfarth & Cheney, 2003). Entonces, estos resultados demostraron que los embriones de C. moreletii tienen la capacidad de comunicarse en un medio social usando la información contenida en los llamados preeclosionales y pueden ser capaces de tomar decisiones en el momento de la eclosión (Arganda, Pérez-Escudero & de Polavieja, 2012).
La velocidad del intercambio de información en el proceso de eclosión, manipulado a través de las variaciones en la tasa de repetición vocal (rápida o lenta) de los playbacks, tuvo un importante rol y se evidenció con la variación en la duración de las eclosiones. Las nidadas incubadas en Cajas de Playback con tasas de repetición vocal rápida tardaron menos tiempo en eclosionar que las incubadas en Cajas de Playback con tasas de repetición lenta, sin considerar el tipo de vocalización (inicial o final). La mayor duración del proceso de eclosión se observó en las Cajas de Playback Silencio y en las de tasa de repetición lenta, independientemente del tipo de vocalización. Además, presentaron menos eclosiones grupales y se extrajeron más embriones que no eclosionaron, pero que sí estaban vivos, su vientre estaba cerrado y vocalizaron al momento de la extracción. Esto implica que lograron adecuadamente su formación y demuestra que los llamados preeclosionales son un poderoso recurso sonoro para sincronizar la eclosión y abandonar el nido en grupo (Mathevon et al., 2013) y la velocidad con que se realiza el intercambio de información es un factor importante en la toma de decisiones (Chittka et al., 2009).
La vocalización final tasa de repetición rápida y la vocalización de C. crocodilus tasa de repetición rápida fueron los playbacks con los cuales se obtuvieron duraciones de eclosión más cortas y mayor número de eclosiones en grupo. Es posible que esto obedezca a que las diferencias estructurales espectro-temporales, importantes entre las llamadas de diferentes especies, no parecen ser relevantes para los Crocodylia (Vergne, Aubin, Martin & Mathevon, 2012). Es posible que exista un proceso ontogénico de los llamados preeclosionales y que los embriones perfeccionen sus vocalizaciones a través de la constante repetición en el transcurso de la eclosión, antes de tener la capacidad de comunicarse acústicamente (Wysocki & Ladich, 2001).
Los neonatos de C. niloticus menores de cuatro días de eclosión, no cuentan con una firma vocal y esto puede ser una característica interespecífica (Mathevon et al., 2013; Vergne, Avril, Martin & Mathevon, 2007). Entonces, es probable que los embriones de C. moreletii también carezcan de firma vocal y no puedan reconocer el sonido emitido por diferentes congéneres. Esto sugiere que la estrategia del individuo emisor de llamados preeclosionales es dinámica en respuesta a la manifestación de los congéneres (Rowell, Ellner & Reeve, 2006), lo que explica que una tasa de repetición vocal lenta produzca eclosiones con mayor duración que la tasa de repetición rápida.
La distancia entre los huevos, y el haberlos puesto en tapetes individuales de hule espuma dentro de las Cajas de Playback, quizá influyó en el proceso de eclosión, puesto que la energía contenida en los llamados preeclosionales puede percibirse como vibraciones intensas al sostener el huevo en la mano (Garrick & Lang, 1977; Somaweera & Shine, 2012). Es posible que las vibraciones producidas por llamados preeclosionales sea otro factor importante en el sistema de comunicación que los embriones emplean para sincronizar la eclosión. Sin embargo, como en todo sistema de comunicación, cuando hay interferencia en la señal del emisor, como por ejemplo la distancia entre los huevos en el experimento o problemas en la recepción del mensaje, los individuos podrían realizar ajustes para comunicarse (Rabin, McCowan, Hooper & Owings, 2003). Esto ocurre en varias especies de aves como en los pinzones cebra machos (Taeniopygia guttata) y en humanos, donde los emisores por consecuencia a las diferentes distancias de comunicación realizan ajustes a la amplitud vocal (Brumm & Slater, 2006).
El éxito de eclosión parece no haber recibido influencia por los llamados preeclosionales, a pesar de que el valor del éxito de eclosión obtenido con el playback de vocalización final y tasa de repetición rápida es mayor que el éxito de eclosión de la Caja de Playback Silencio. Los valores del éxito de eclosión observados en el estudio (de 57% a 88%) son altos con respecto a otras investigaciones realizadas en la misma UMA, por ejemplo: 40.74% (Casas-Andreu et al., 2011), 61.11% (Mandujano & Hénaut, 2014) y 33% (Mandujano-Camacho et al., 2015). Sin embargo, debido a que el éxito de eclosión observado en este trabajo es el resultado de un proceso de incubación artificial con huevos seleccionados para aumentar la certeza de fertilidad y eclosiones, estos no deben ser comparados con los de otros estudios, donde se han empleado las nidadas sin seleccionar los huevos potencialmente fértiles.
Se ha observado que en nidadas de C. moreletii incubadas artificialmente las eclosiones se presentan en diferentes momentos y eclosionan de manera individual o en grupos integrados con dos o más individuos (Mandujano-Camacho et al., 2015; Mandujano & Hénaut, 2014). En el estudio, independientemente del tipo de vocalización, las nidadas sometidas a playback con tasa de repetición rápida presentaron mayor cantidad de eclosiones en grupo, mientras que las nidadas sometidas a tasas de repetición lenta y Silencio presentaron menor cantidad de eclosiones en grupo.
Las condiciones de incubación adecuadas de temperatura y humedad relativa se reflejan en los periodos de incubación artificial obtenidos en este trabajo, similares a los reportados en otros trabajos desarrollados en el mismo sitio, con la misma especie e independientemente de haber cambiado de lugar las nidadas, lo que no afectó a la incubación (Casas-Andreu et al., 2011; Doya, 2008; Mandujano & Hénaut, 2014; Mandujano-Camacho et al., 2015).
Conclusiones
La duración del proceso de eclosión está fuertemente ligada a la tasa de repetición y tipo de vocalización de los llamados preeclosionales. Estos parámetros son importantes para el intercambio de información y toma de decisiones de los embriones. La tasa de repetición vocal rápida, independientemente del tipo de vocalización (inicial o final), parece tener mayor influencia en los embriones, ya que las eclosiones duran menos tiempo. Es posible que los embriones sean capaces de manipular su tasa de repetición vocal para poder reclutar a más congéneres a eclosionar en grupo. Quizá los embriones son incapaces de discriminar el tipo de vocalización o este factor no sea tan importante como puede ser la tasa de repetición vocal. La duración del proceso de eclosión, así como el número de individuos que eclosionan juntos, quizá sean importantes para desarrollar sus habilidades de interacción social en el futuro, como por ejemplo mantener la cohesión de grupo, conseguir pareja, incluso, pueden ser el reflejo de la condición de salud individual y grupal.











 text new page (beta)
text new page (beta)


