Introducción
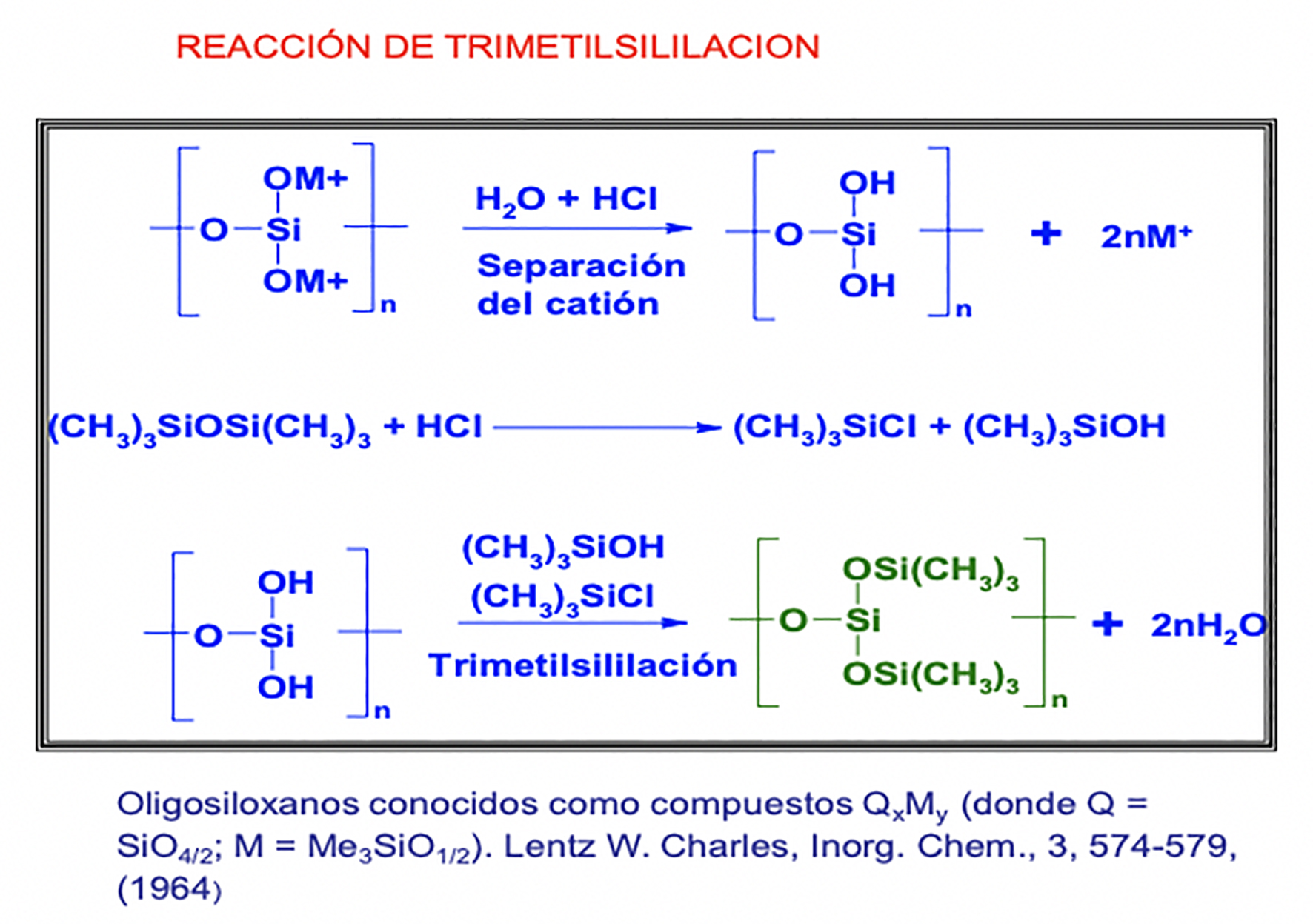
La reacción de trimetilsililación (TMS) fue propuesta por Charles W. Lentz en 1964. Lentz (1964) reportó que los silicatos olivino, hemimorfita, sodalita, natrolita, laumontita y silicato de sodio comercial pueden ser sililados con una mezcla de hexametildisiloxano, ácido clorhídrico, alcohol isopropílico y agua. La trimetilsililación de silicatos minerales implica la remoción de cationes metálicos, la formación de ácido silícico y la condensación de grupos trimetilsilanol.
Los aniones silicato se presentan en tamaños que van desde pequeñas moléculas que contienen un átomo de silicio hasta oligómeros. Los aniones de silicatos oligoméricos pueden ser cadenas individuales, cadenas dobles o estructuras irregulares. La trimetilsililación exitosa de todas estas matrices da lugar a oligosiloxanos compuestos, principalmente, de grupos monofuncionales (M) y las unidades de construcción tetra-funcionales (Q) (Currell Midgley, Montecinos & Parsonage, 1985).
El método emplea condiciones de reacción relativamente suaves en términos de temperatura y accesibilidad de reactivos. En términos generales, la reacción se describe en la Figura 1. Consta de dos etapas, la primera que es la formación del ácido silícico o poli-silícico mediante un tratamiento ácido de la fuente de silicato y, posteriormente, la adición del reactivo sililante. En la Figura 1 se ilustra el procedimiento para obtener cadenas de oligosiloxano del tipo QxMy (por ejemplo: QM4, Q2M6, entre otros), partiendo de fuentes diversas de silicatos.
La trimetilsililación de silicatos se ha estudiado con varios propósitos tales como la elucidación directa de las estructuras de silicato mediante la preparación de los derivados trimetilsililados de los silicatos (Kuroda & Kato, 1979a; 1979b). Los silicatos no pueden ser directamente disueltos en solución sin ruptura molecular y, por lo tanto, no pueden examinarse directamente en solución mediante las técnicas empleadas en física de polímeros; sin embargo, los derivados trimetilsililados pueden analizarse cuantitativamente por una variedad de técnicas, incluyendo la cromatografía líquida de alta presión (HPLC), cromatografía de gases (GC), espectrometría de masas (MS), resonancia magnética nuclear (RMN) y análisis térmico (DTG/DTA) (Currell et al., 1985). De igual manera, la TMS se ha propuesto para sintetizar nuevos polímeros u oligómeros de retención con una cadena principal de silicato, así como para obtener derivados volátiles de compuestos no volátiles (tales como esteroides y nucleósidos) para su análisis (Kuroda & Kato, 1979a; 1979b).
Otros reportes han considerado a la reacción de TMS en la que se han empleado diversos tipos de silicatos de la región de Guanajuato, México, así como residuos de los procesos de beneficio de la minería local de los que es posible obtener mezclas de oligosiloxanos del tipo QxMy. En esos estudios, se ha observado que silicatos con baja reactividad ante la TMS o, bien, residuos sólidos de la reacción son modificados en su superficie con los grupos trimetilsiloxi (Me3SiO-) (Caudillo, Sandoval & Cervantes, 2006; Cervantes et al., 2006; Cervantes et al., 2004).
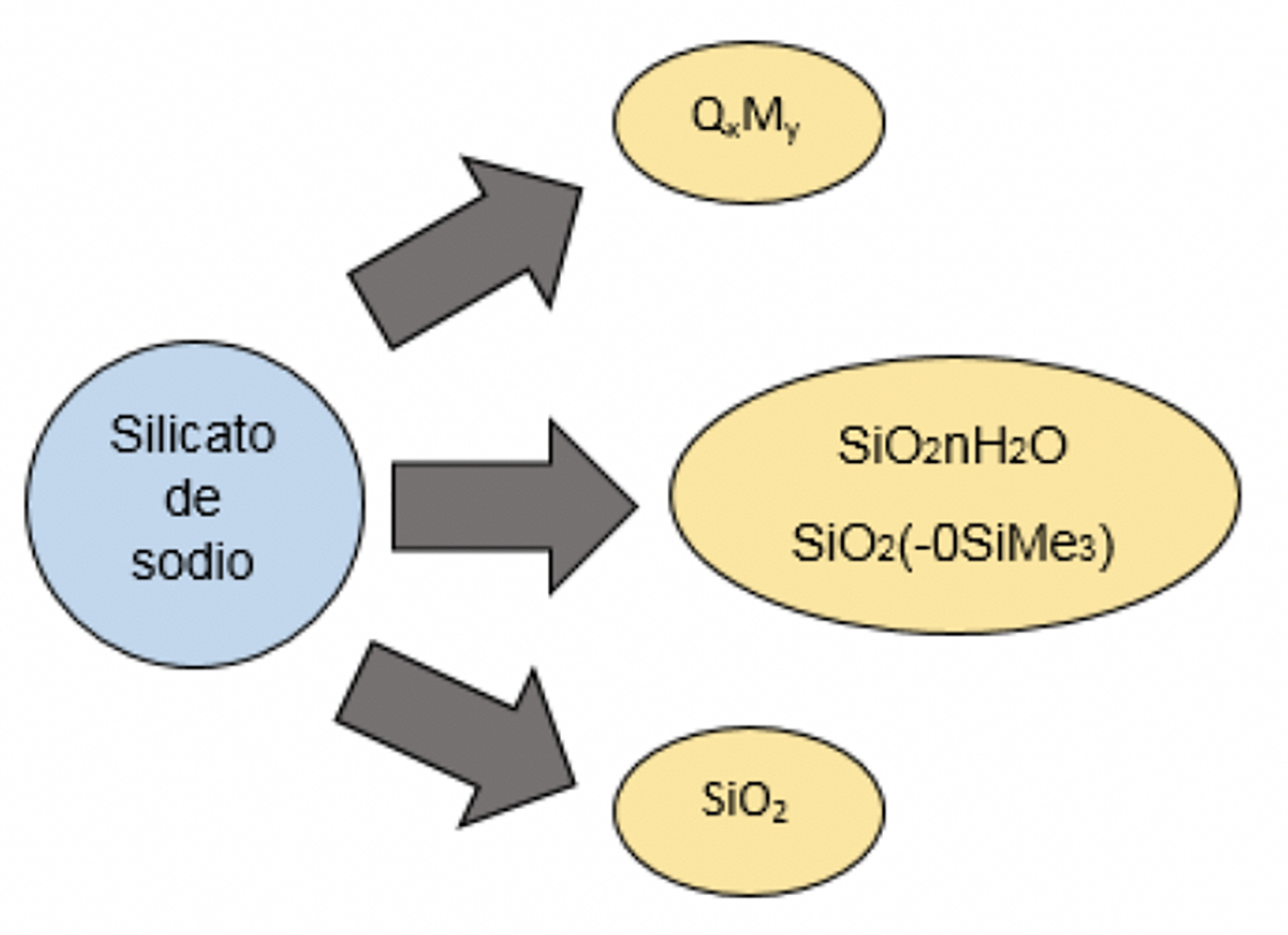
En función de lo anterior, y de acuerdo con la experiencia en la reacción, la ruta general de la TMS presenta varias alternativas si se modifican las condiciones de la reacción de manera tal que se puede sintetizar sílice (Si O2) o, bien, sílice modificada (R-Si O2), donde R es un grupo orgánico. Ello se esquematiza en la Figura 2. La modificación se realiza por etapas relativamente sencillas por la interacción de las partículas de sílice obtenidas in situ a partir de un silicato comercial económico (silicato de sodio) con el reactivo sililante, normalmente un clorosilano o un alcoxisilano que, al sufrir una hidrólisis, puede condensarse con los grupos silanoles (Si-OH) de la superficie de la sílice.
Fuente: Elaboración propia.
Figura 2 La reacción de TMS y sus alternativas que son función de las condiciones en que se lleve a cabo la reacción.
Es importante mencionar que la reacción de TMS, como su nombre lo indica, solamente es factible realizarla para la obtención de oligosiloxanos tipo QxMy, donde M se encuentra restringido a grupos Me3SiO-, siendo este aspecto una gran limitante, pues no es posible obtener oligosiloxanos con grupos funcionales diferentes. Sin embargo, si la idea es modificar la sílice, el método da cabida a que se puedan emplear como modificadores una variedad de organosilanos con diferentes grupos funcionales, siendo esta la principal contribución del estudio; ya que las condiciones de reacción son suaves (temperatura ambiente Por otro lado, de entre los contaminantes geogénicos, el arsénico ha generado la mayor preocupación mundial, ya que hasta el momento ha causado diversos efectos negativos para la salud humana (Chen et al., 2009; Organización Mundial de la Salud [OMS], 2012; Schwarzenbach, Egli, Hofstetter, von Gunten & Wehrli, 2010; Steinmaus et al., 2014) y son varios los sitios del planeta con altos niveles naturales de este elemento en aguas subterráneas, México entre ellos (Arreguín, Chávez & Soto, 2009; OMS, 2012).
El límite internacional recomendado de arsénico en el agua potable es de 0.01 mg/l (OMS, 2012). La Norma Oficial Mexicana (NOM-127-SSA1-199413) tiene como límite permisible 0.025 mg/l desde el 2005 (Diario Oficial de la Federación [DOF], 2005).
Los procesos de adsorción son eficaces y muy utilizados en las industrias de tratamiento de agua y aguas residuales para eliminar la contaminación orgánica e inorgánica y presentan varias ventajas (Chiban, Zerbet, Carja & Sinan,2012). Algunos adsorbentes utilizados en los últimos años para la remoción de arsénico en agua son: carbón activado (Bailey, Olin, Brika & Adrian, 1999), arcillas y zeolitas (Chiban et al., 2012), barro rojo (Altundoğan, Altundoğan, Tümen & Bildik, 2000), hidrogel de hidróxido de aluminio (Luján, 2001), óxidos metálicos naturales y sintéticos (Chang, Lee & Yang, 2009).
El uso de una matriz inorgánica, como es el caso de la sílice, en la que una variedad de grupos funcionales se puede inmovilizar químicamente, tiene ventajas sobre soportes orgánicos convencionales usados como adsorbente. Las ventajas incluyen un área de superficie más alta con la cual se puede aumentar la capacidad de adsorción y una mayor capacidad física y química para soportar una variedad de ambientes hostiles (Mohan & Pittman, 2007).
En este estudio se aplica el principio de la reacción de la TMS a fin de obtener sílicas modificadas que puedan ser de utilidad como adsorbentes económicos para la remoción de elementos químicos, cuya concentración se considere que son tóxicos en fuentes de agua, empleando como ejemplo soluciones estándar de arsénico) y los reactivos accesibles.
Materiales y Métodos
Preparación de sílice modificada con base en la reacción de trimetilsililación (TMS)
En un matraz balón de dos bocas se adicionaron 25 ml de HCl (36%, densidad = 1.18), 50 ml de alcohol isopropílico y 33 ml de 3-mercaptopropiltrimetoxisilano, los cuales fueron mezclados y sometidos a agitación a temperatura ambiente durante 1 h. Posteriormente, se añadió gota a gota a la mezcla una solución de silicato de sodio 1 M previamente preparada. Concluida la adición, se continuó la agitación durante 8-10 h a temperatura ambiente. La fase orgánica fue separada por decantación y se procedió a lavar varias veces con agua destilada el sólido que precipitó con el fin de disolver la sal formada, dejando que, en el último lavado, el sólido estuviera en agitación en contacto con el agua por 1 h. Se procedió a filtrar al vacío y el producto sólido fue secado en la estufa por 72 h a 150 °C.
El mismo procedimiento se utilizó para modificar sílica gel comercial (Aldrich, 200 mallas) empleada como referencia. La única diferencia fue que la mezcla de HCl, isopropanol y el silano fue adicionada a un matraz conteniendo la cantidad correspondiente de la sílica gel.
Caracterización de la sílice modificada
La caracterización de la sílice modificada se efectuó empleando diferentes técnicas de análisis tales como Infrarrojo (FTIR) realizado en un espectrofotómetro Perkin-Elmer con Transformada de Fourier modelo 100, en un rango de 400 cm-1-4000 cm-1, empleando pastilla de KBr. Para el análisis por RMN en estado sólido se usó la secuencia de pulsos CPMAS de 29Si y 13C en un espectrómetro Bruker Avance III HD de 400 MHz. Los espectros CPMAS de 29Si se obtuvieron a frecuencia de 79.49 Hz, con un tiempo de adquisición (at) de 0.0639 s, tiempo de retraso (d1) de 6 s y número de repeticiones (nt) de 8000. Para el caso de los espectros de CPMAS de 13C, las condiciones fueron a una frecuencia de 100.61 Hz, at de 0.0339 s, d1 de 3 s y nt de 1024. Las pruebas de textura por técnica de fisisorción de nitrógeno se realizaron en un equipo Micrometrics, modelo ASAP 2010 que trabaja mediante un software BET y BJH. El análisis térmico (DTA/TGA) se efectuó en un termoanalizador SDT Q600 Simultaneous TGA/DSC de TA Instruments. Se empleó una atmósfera dinámica de aire de ultra alta pureza a una velocidad de calentamiento de 10 °C/min. La concentración de arsénico se determinó en un espectrofotómetro de absorción atómica Perkin Elmer, modelo AAnalyst 100 por medio de la técnica de generación de hidruros.
Pruebas de adsorción de arsénico por lote
Se prepararon soluciones estándar de arsénico en un intervalo de 0.025 - 1 ppm, ajustando el valor a pH neutro mediante soluciones de NaOH y HCl. La sílice modificada fue molida y pasada por un tamiz malla 75 μm. Se agregaron 0.025 g de sílice modificada a viales de 50 ml, a los que se les añadió las soluciones estándar y se mantuvieron en un baño de agitación a 20 °C y 30 °C por un tiempo de 8 h durante el cual se tomaron varias muestras para el análisis de arsénico.
Resultados y Discusión
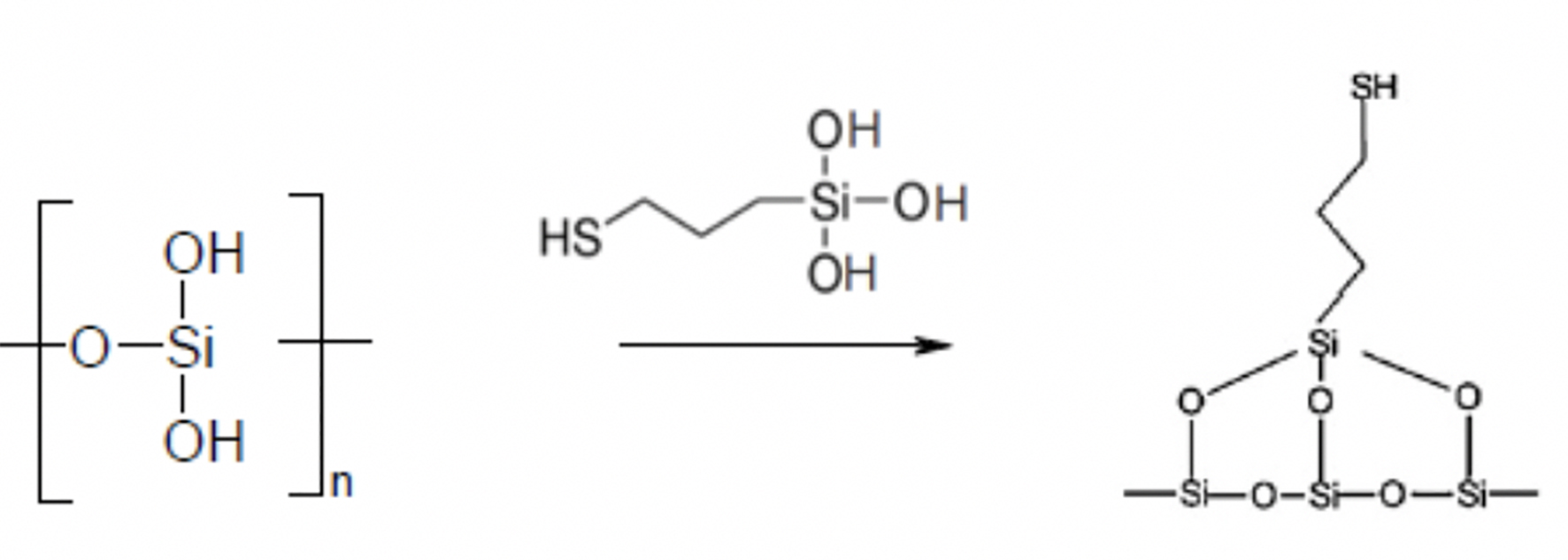
Los esquemas siguientes ilustran la secuencia de reacciones que conducen a la modificación de la sílice, basadas en el principio de la reacción de TMS. El silicato de sodio bajo las condiciones de hidrólisis ácida de la reacción forma ácido polisilícico y cloruro de sodio (reacción 1):
El reactivo de sililación, el 3-mercaptopropiltrimetoxisilano bajo las mismas condiciones forma el correspondiente silanol, por hidrólisis de los grupos trimetilsiloxi (reacción 2):
Finalmente, los silanoles del reactivo sililante o modificador se condensan con los silanoles de la superficie de la sílice que se forma en el medio de reacción, resultado de la precipitación del ácido polisilícico, dando como resultado la sílice modificada (reacción 3):
Caracterización por FT-IR
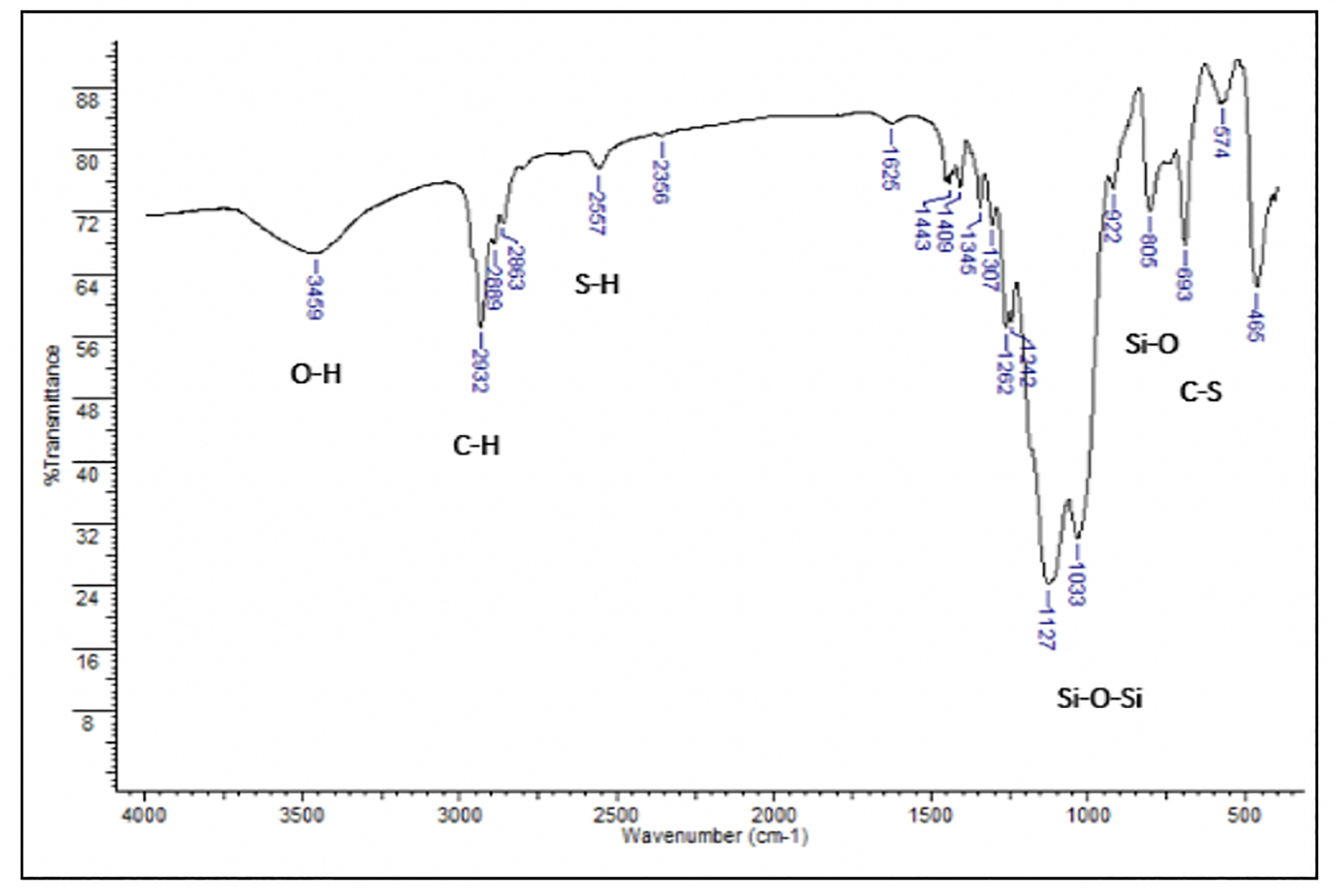
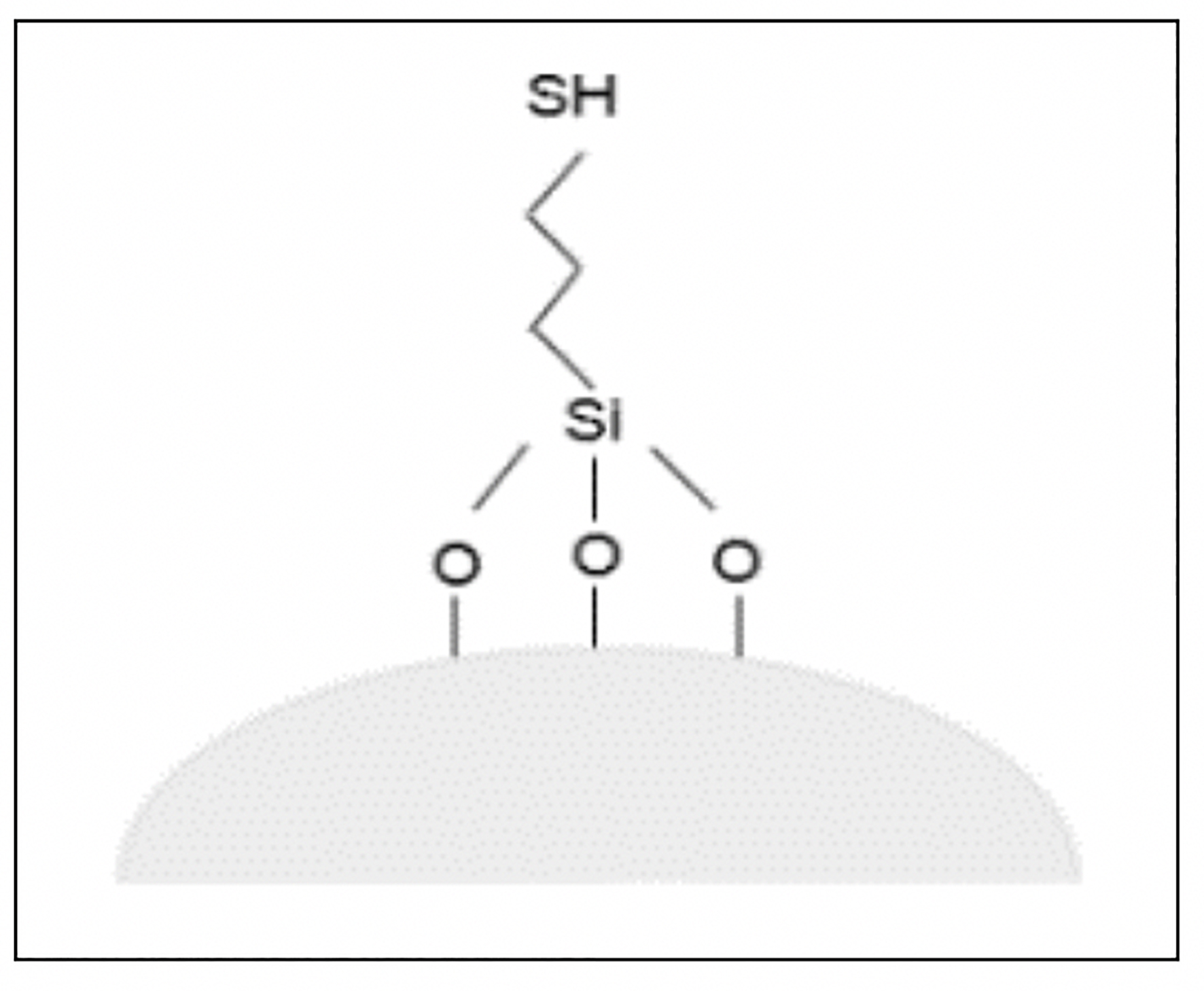
La banda ancha entre 3500 cm-1-3200 cm-1 se asocia a los grupos silanoles de la superficie de la sílice, así como a las moléculas de agua adsorbidas. La banda a 1100 cm-1 es característica del estiramiento Si-O-Si, mientras que la banda a 800 cm-1 caracteriza la presencia del enlace Si-OH. La banda a la frecuencia de 2950 cm-1 se asocia al estiramiento C-H de carbono tetraédrico, C-H. La banda que aparece a 685 cm-1-695 cm-1 corresponde al enlace C-S lo que confirma la presencia del grupo mercapto debida al enlace S-H alrededor de 2550 cm-1 (Najafi, Rostamian & Rafati, 2011). La Figura 3 muestra el espectro de FTIR de la sílice modificada mientras que la Figura 4 la idealización de la sílice en bulto modificada por el grupo 3-mercaptopropiltrimetoxi.
Caracterización por RMN en estado sólido de 13C y 29Si (CPMAS)
El espectro de CPMAS de 13C (Figura 5) muestra una señal para los dos carbonos más cercanos al grupo SH a un desplazamiento químico de 28 ppm y el tercero a 8 ppm, asociado al silicio anclado a la superficie de la sílice, información que concuerda con lo esperado de acuerdo con la base de datos Spectral Database for Organic Compounds (SDBS). El carbono unido al grupo trimetilsiloxi, se desplazó 12 ppm con respecto al espectro del silano usado como modificador.
En la Figura 6, se presenta el espectro CPMAS de 29Si con las señales a -56 ppm, -64 ppm, -99 ppm y -109 ppm que se asocian con estructuras del tipo T2 (Si[OH]CH3 [OSi] 2), T3 (SiCH3 [OSi] 3), Q3 (Si[OH]/OSi) 3, y Q4 (Si(OSi) 4), respectivamente; todas ellas consistentes con lo esperado; es decir, los grupos T debido al anclaje del grupo trimetilsiloxi a la superficie de la sílice (dos señales T debido a la presencia en una de ellas de grupos silanol) y los grupos Q (Q3 ambiente donde hay además de uniones Si-O también Si-OH y la Q4 con el ambiente químico de grupos Si-O del bulto).
Propiedades de textura
En la Tabla 1 se presentan datos representativos de las propiedades de textura de la sílica gel de referencia y de las sílices modificadas mediante la TMS. Como puede observarse, las propiedades de los tres materiales son muy similares, con la ventaja de que la sílice modificada a partir del silicato de sodio permitiría obtener un material adsorbente relativamente económico dado el costo del precursor.
Análisis térmico (DTG/DTA)
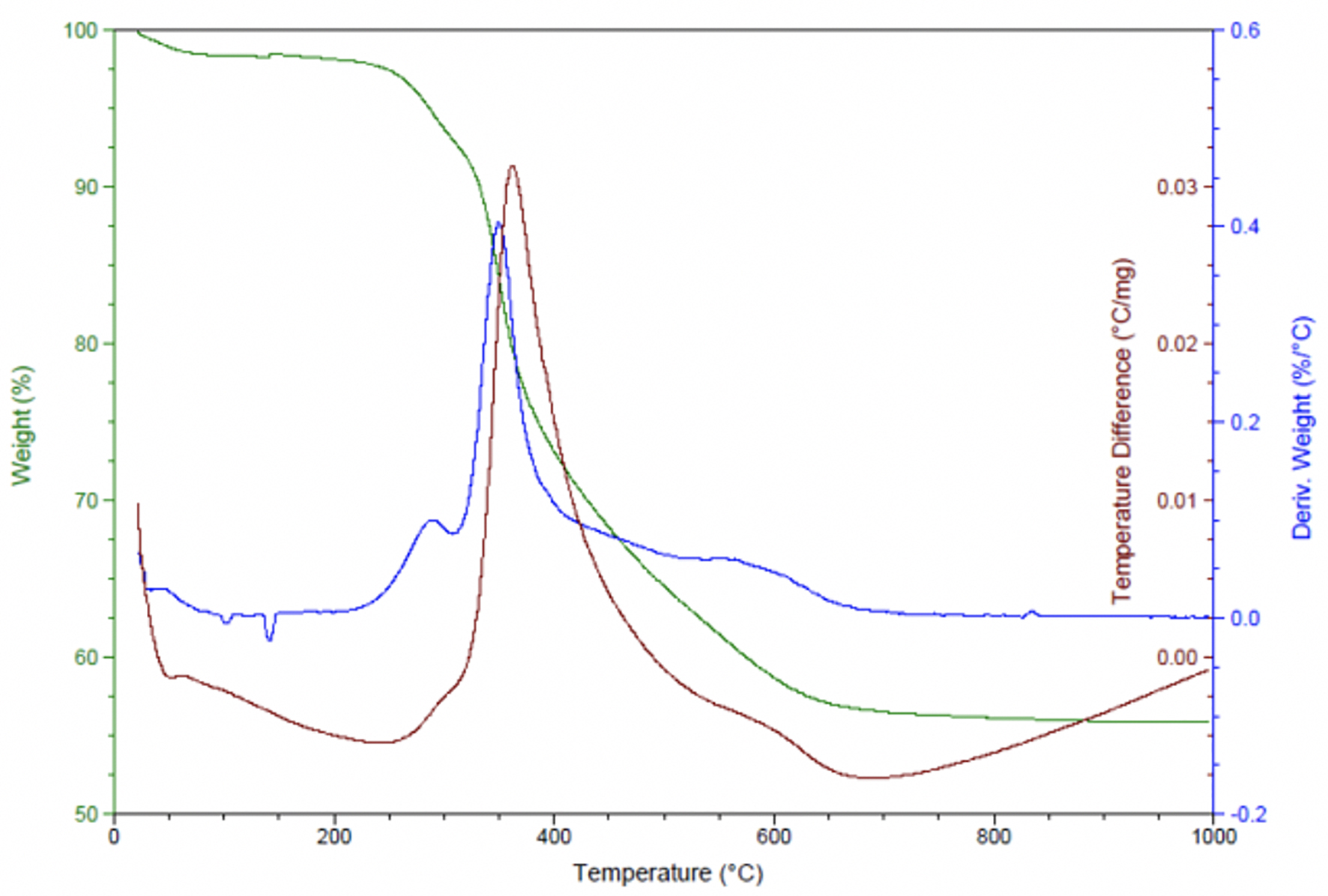
Se realizó el estudio de las sílices modificadas con el fin de estudiar la estabilidad térmica del grupo mercapto. En la Figura 7 se observa que el porcentaje principal de pérdida de peso que se manifiesta con el pico resultado de la reacción exotérmica que ocurre a temperaturas cercanas a los 400 °C y con pérdida de peso del 21% que ocurre a temperaturas cercanas a los 400 °C, lo que indica que el grupo mercapto se encuentra bien anclado a la superficie de la sílice.
Fuente: Elaboración propia.
Figura 7 TGA y DTA de sílice modificada obtenida de la reacción de TMS del silicato de sodio
Tabla 2 Resultados de TGA y DTA de sílice modificada con grupos mercapto obtenida de la reacción de TMS del silicato de sodio.
| Intervalo de temperatura (°C) |
Reacción | Valor Máx. DTA (°C) |
% de pérdida de peso |
|---|---|---|---|
| 22-210 | sin reacción | ---- | 1.8 |
| 210-310 | Leve exotérmica | 295 | 5.3 |
| 310-412 | Leve exotérmica | 363 | 21 |
| 412-700 | sin reacción | 596 | 15.2 |
| 700-1000 | Exotérmica | ---- | 0.7 |
Fuente: Elaboración propia.
Pruebas de adsorción por lote
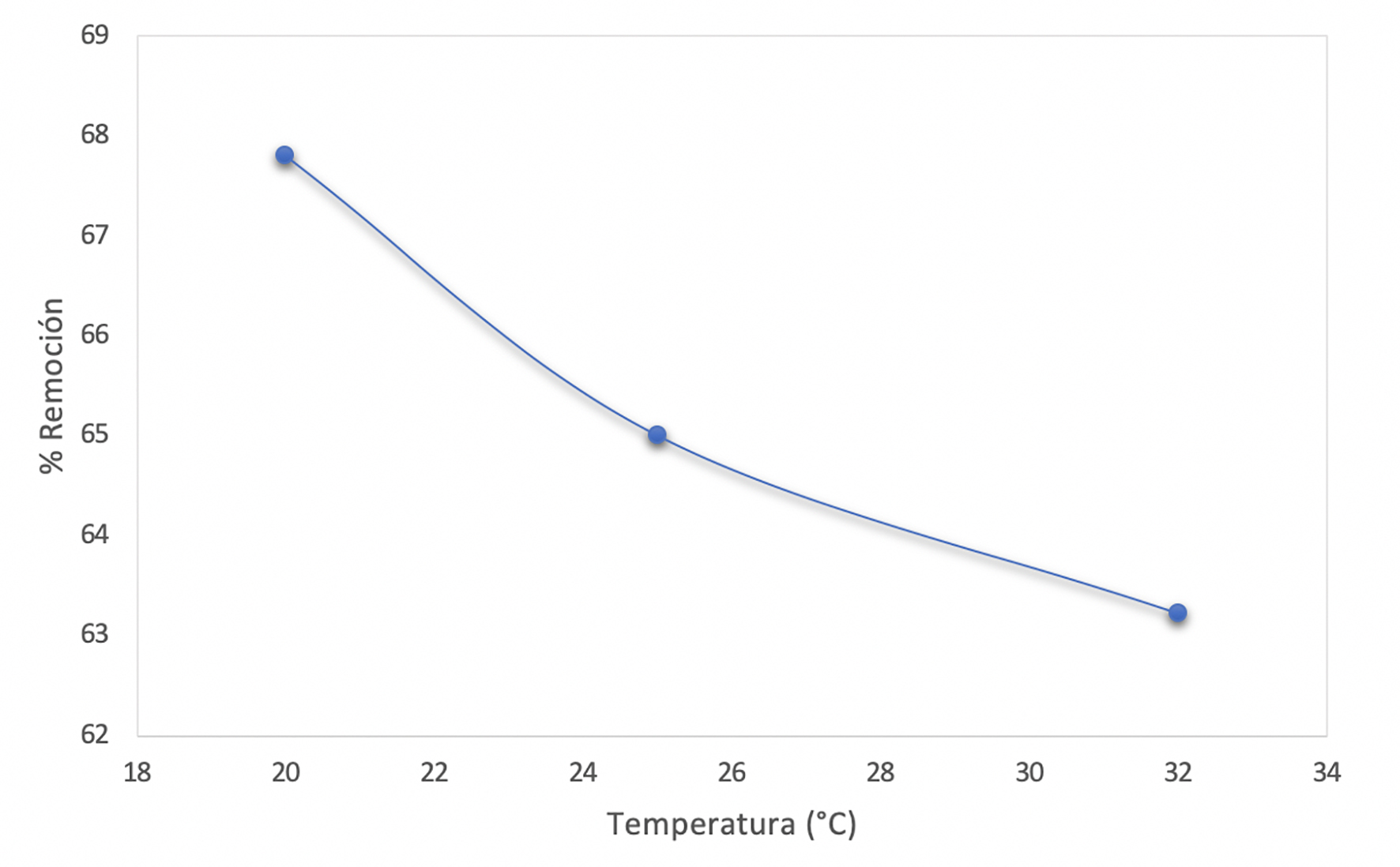
En las Figuras 8 y 9 se muestra que el porcentaje y la capacidad de remoción de arsénico son mayores a 20 °C, por lo cual se puede decir que la adsorción se favorece a temperaturas bajas.
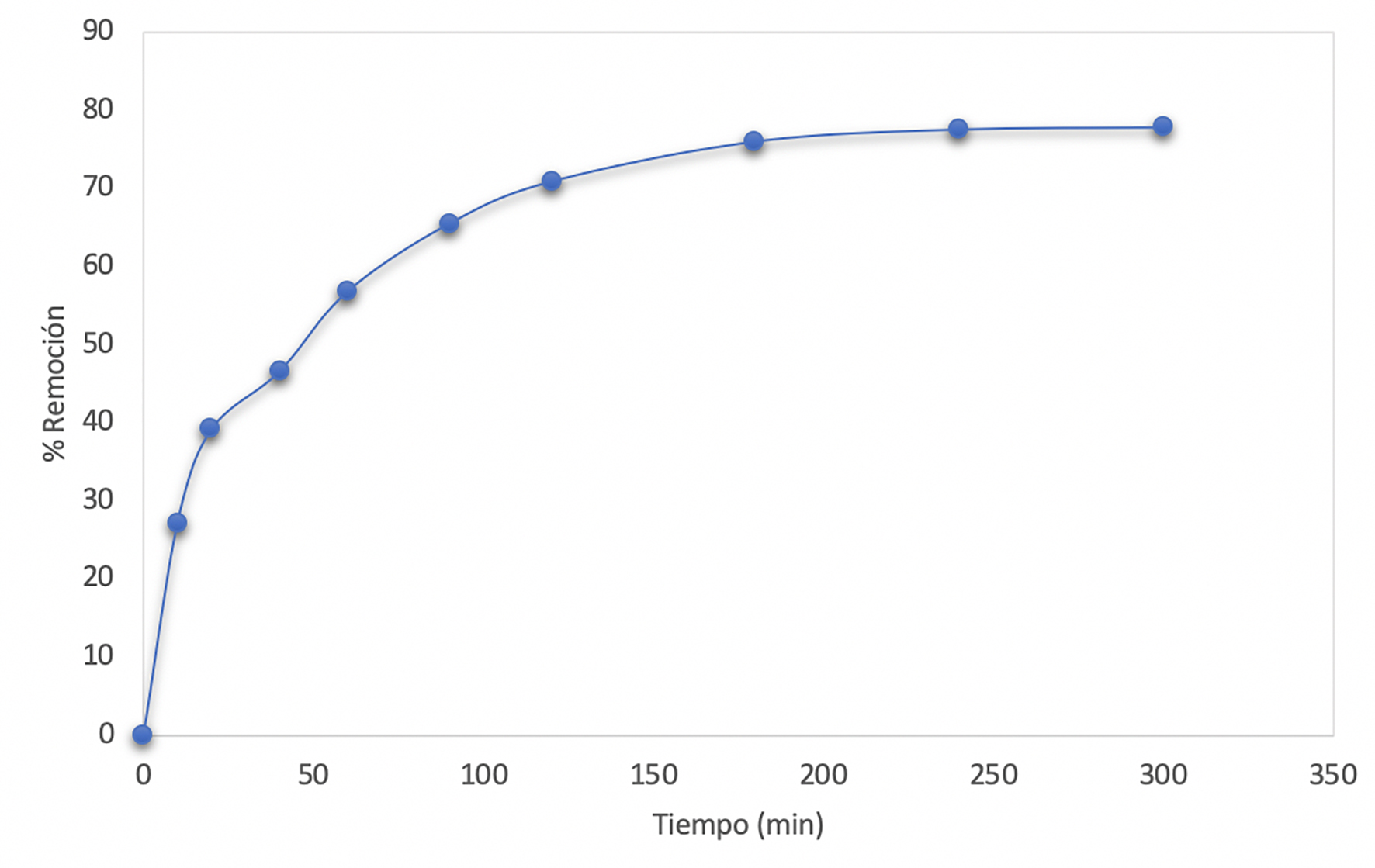
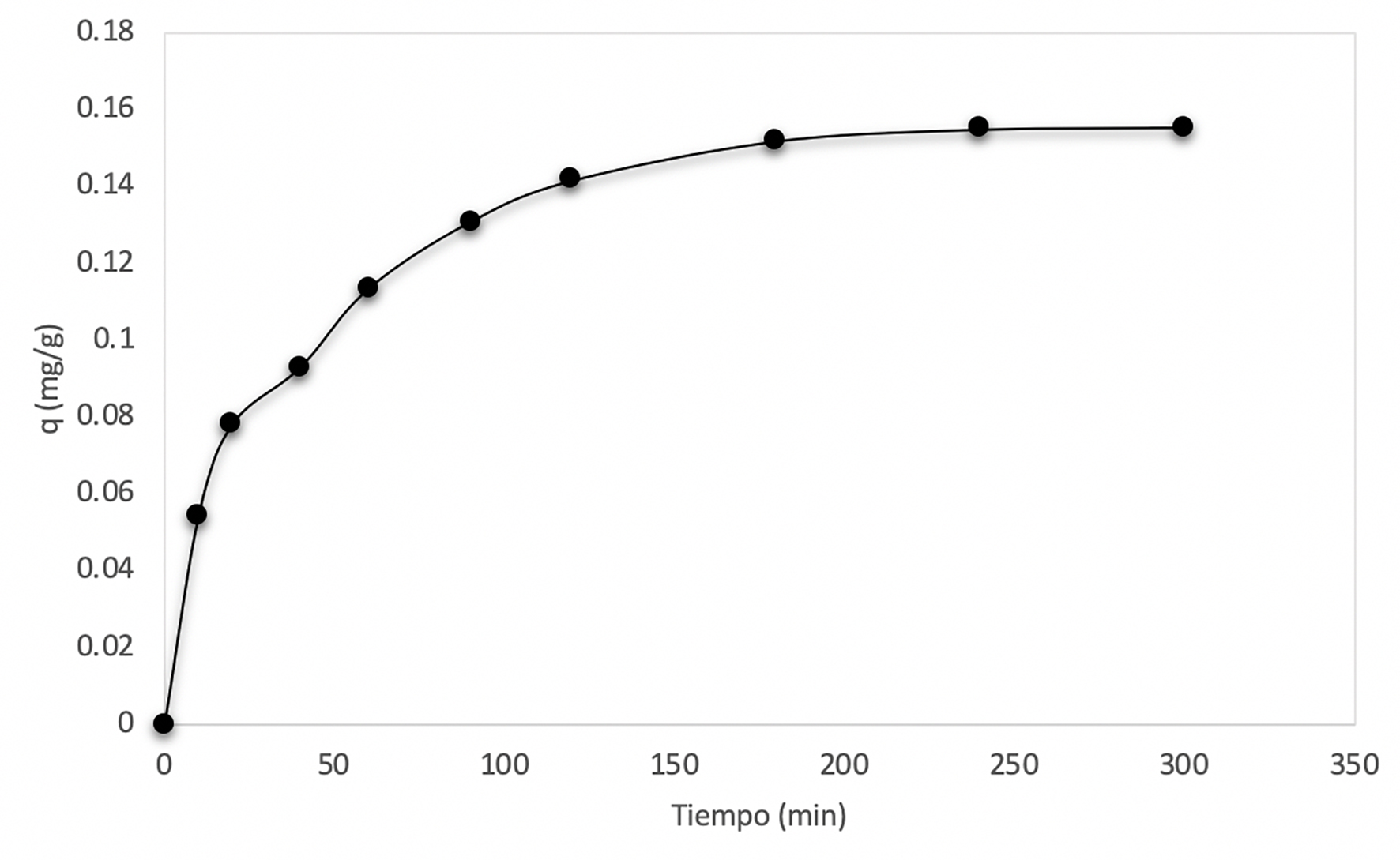
El porcentaje de remoción aumenta conforme el tiempo avanza (Figura 10). La remoción ocurre en su mayoría durante la primera hora; después de cuatro horas ya no hay adsorción. Por otro lado, la capacidad de adsorción también disminuye conforme pasa el tiempo hasta llegar a las cuatro horas donde la sílice pierde su capacidad de adsorción (Figura 11).
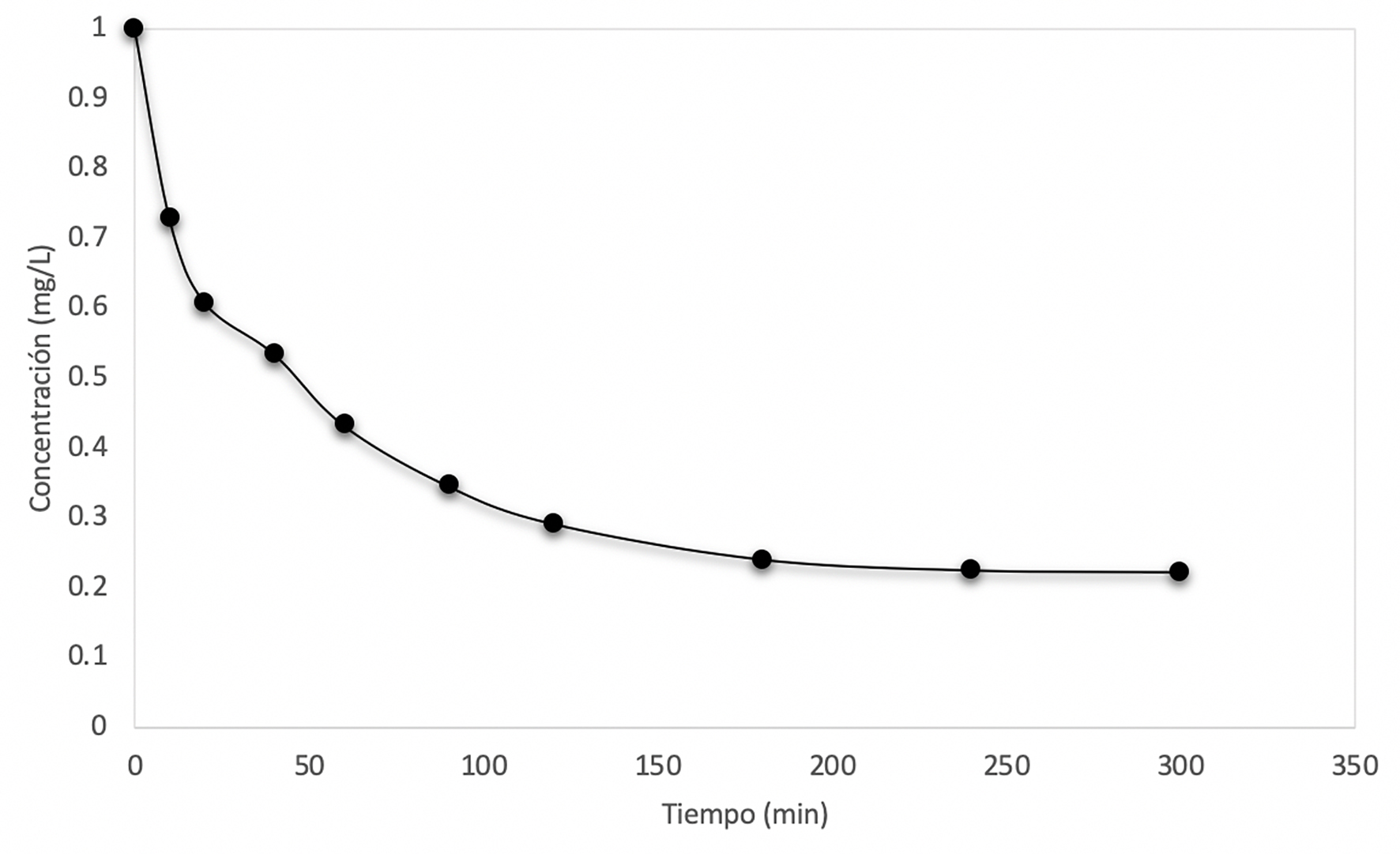
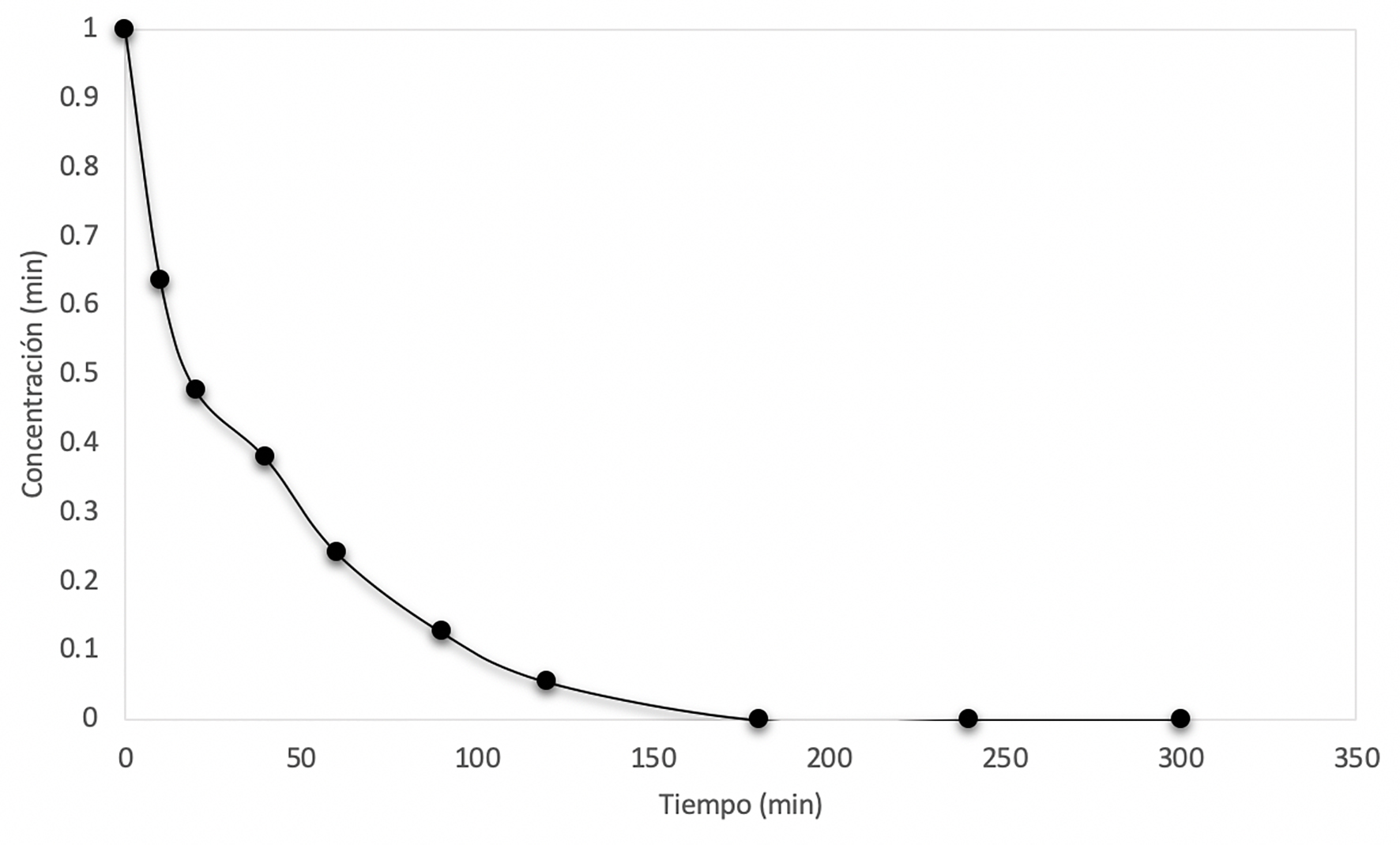
Las Figuras 12 a 14 muestran el decaimiento de la concentración de arsénico. A mayor concentración, mayor tiempo de adsorción de arsénico. Las curvas se vuelven asintóticas cuando la concentración de As en una solución es elevada, debido a que la sílice alcanza su adsorción máxima.
Fuente: Elaboración propia.
Figura 13 Curva de decaimiento de la concentración cuando Co = 0.75 mg/L
Los valores de remoción obtenidos por esta metodología por lotes son ilustrativos y a la vez similares a los reportados por otros autores (17, 21, 22). En un estudio posterior, se realizarán experimentos en una columna de adsorción de lecho fijo, cuyos resultados estarán más cercanos a una aplicación a mayor escala.
Conclusiones
El método de la TMS es una buena alternativa para lograr la preparación de sílice modificada. La sílice modificada obtenida por la ruta de TMS es apropiada para remover el arsénico existente en las muestras estándar de agua hasta un máximo de 1 ppm. Las pruebas en lote se llevaron al cabo de manera eficaz y eficiente. La obtención de esta sílice resulta ser económica, debido al bajo costo de los reactivos utilizados, donde el 3-mercaptopropiltrimetoxisilano es el de mayor costo, pero a su vez es el que se utiliza en menor cantidad. A la vez, en los experimentos de remoción de arsénico realizados, y estudiando el efecto de la temperatura en el intervalo entre 20 °C y 30 °C, se encontró que la remoción se favorece a la menor temperatura.











 nueva página del texto (beta)
nueva página del texto (beta)