Introducción
El pato mexicano o pato garbancero (Anas diazi), Ridgway 1886 (taxonomía sigue a Gill & Donsker, 2016), es una especie cuasiendémica a México. Su población global se estima alrededor de 55 500 individuos (Wetlands International, 2019), con alrededor del 98% en la región del Altiplano Central; las mayores concentraciones (85%-90%) ocurren en las colindancias de los estados de Guanajuato, Michoacán y Jalisco (Williams, 1980). Berlanga et al. (2010) lo consideran con vulnerabilidad moderada al cambio ambiental, aunque legalmente es considerado como amenazado (Diario Oficial de la Federación [DOF], 2010) y, entre los anseriformes, de la más alta prioridad para la conservación (Pérez-Arteaga, Jackson, Carrera & Gaston, 2005). No existe consenso en cuanto a su condición taxonómica, este aspecto es controversial y confuso (Leukering & Mlodinow, 2012). Ha sido tratado recientemente como subespecie del pato de collar (A. platyrhynchos diazi) (American Ornithologists’ Union [AOU], 1998; Chesser et al., 2016; Clements et al., 2018; del Hoyo, Elliott, Sargatal & Christie, 2013) y subespecie de pato texano (A. fulvigula diazi) (Del Hoyo, Collar, Christie, Elliott & Fishpool, 2014). Sin embargo, los estudios más recientes sugieren seguir considerándolo como A. diazi (González, Duttmann & Wink, 2009; Johnson & Sorenson, 1999; Kulikova et al., 2005; Lavretsky et al., 2015; McCracken, Johnson & Sheldon, 2001; Mitchell, Wood, Scofield, Llamas & Cooper, 2014), recomendación sostenida por la información generada últimamente (Baldassarre, 2014). Desafortunadamente, la falta de consenso sobre su estatus taxonómico (Semo & Faulkner, 2010) se ha visto reflejado en los esfuerzos de investigación aplicados sobre la especie; mientras que el pato de collar ha sido ampliamente estudiado en el continente (Drilling, Titman & McKinney, 2012), el pato mexicano es posiblemente el menos conocido de todos los anseriformes de Norteamérica (Baldassarre, 2014).
Esta escasez de información se vuelve crítica en términos de planeación para la conservación, ya que uno de los principales objetivos para los anseriformes en Norteamérica es el aumento del éxito reproductivo (Borgo & Conover, 2016), lo cual no puede ser logrado sin la información adecuada. No existe evidencia de migración, toda vez que se registran individuos reproductores e invernantes a lo largo de su distribución (Colón-Quezada, 2012; Pérez-Arteaga, Gaston & Kershaw, 2002). Sin embargo, la mayor parte de la información ha sido generada en el Altiplano Norte, donde se encuentra una proporción menor de la población (16% en el período 1961-2000, Pérez-Arteaga et al., 2002) con densidades más bajas (Williams, 1980). En esta región se ha reportado hibridación con pato de collar (Scott & Reynolds, 1984) y un cambio gradual en características fenotípicas desde las zonas de poblaciones puras en el centro del país (Hubbard, 1977; Scott & Reynolds, 1984). Solamente cuatro nidos y 19 nidadas (eBird, 2016; Williams, 1980) se conocen del Altiplano Central, donde se encuentra la gran mayoría de la población (86%) (Figura 1). Dado el conocimiento fragmentado sobre la especie, existe una necesidad significativa de generar información adicional, particularmente en el Altiplano Central, región agrícola altamente modificada y que constituye el bastión del pato mexicano (Baldassarre, 2014). Cualquier esquema de investigación y manejo que tenga a lugar en esta región tendrá potencialmente efectos significativos para la conservación de la especie (Medina-Torres, Marquez-Olivas & Garcia-Moya, 2007; Scott & Reynolds, 1984).
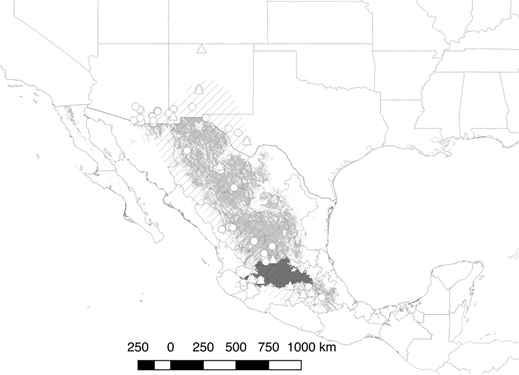
Fuente: Elaboración propia.
Figura 1 Distribución de pato mexicano (gris claro, Navarro-Sigüenza & Peterson, 2007; líneas diagonales, Baldassarre, 2014); principal área de distribución (Altiplano Central) en gris oscuro (Conabio, 1997). Registros existentes de nidos (triángulos) y nidadas (círculos); ver texto para fuentes.
Materiales y Métodos
Se buscaron nidos de pato mexicano en el municipio de Pénjamo, Guanajuato, México (20° 25’ 54’’ N, 101° 43’ 28’ O, elevación 1600 m a 1700 m), un sitio prioritario para la especie ubicado en la región del Altiplano Central (Pérez-Arteaga et al., 2002). Las temperaturas medias son 16 °C a 22 °C con clima semicálido, semihúmedo y lluvias de verano (700 mm a 900 mm anuales), con suelos predominantemente agrícolas (Comisión Nacional para el Conocimiento y Uso de la Biodiversidad [Conabio], 1997). El área está compuesta mayormente por zonas agrícolas planas (los cultivos de verano son sorgo, maíz y alfalfa; de invierno son trigo y cebada), con remanentes de bosque espinoso y bosque tropical subcaducifolio (Rzedowski, 2006). En un estudio sobre comportamiento de pato mexicano se observaron aves de 6:30 h a 12:00 h, de cuatro a cinco días a la semana, del 15 de mayo al 30 de septiembre del 2002 y 2003, usando telescopios y binoculares (ATS65 15-60X, SLC 8x42 and 10x42, Swarovski Optik, Austria) desde el techo de un vehículo. Oportunamente, cuando se observaba comportamiento de anidación (parejas volando en círculos, donde la hembra descendía en terreno seco y el macho descansaba en un área cercana [Williams, 1980]), la hembra se ahuyentaba en un radio de 30 m alrededor del sitio de descenso (Ringelman et al., 2016). También se efectuaron búsquedas a pie, donde los agricultores reportaban que habían encontrado nidos o que habían ahuyentado patos. Se identificaron los nidos de pato mexicano como tales cuando se ahuyentaba una hembra del sitio, o por la descripción de Williams (1980). En el área no se encuentra presente otra especie de pato anidante en tierra, así que la identificación errónea del nido era poco probable. La descripción de forma y tipo de nido se determinaron según Simon & Pacheco (2005). El número de huevos fue determinado por huevos completos o restos identificables de cascarones. Los huevos se manipularon mínimamente usando guantes de látex, evitando contacto con piel o ropa y fueron dejados en la misma posición que se encontraron. Al medir los nidos, se procuró no dañar los nidos para evitar riesgos de depredación o deserción posterior (Götmark, 1992). Cuando una nidada era observada, los patos se contaban y se anotaban las características generales del sitio.
Resultados
Se encontraron siete nidos (Figura 2); la mayoría fueron de tipo oval copa baja, todos ubicados en áreas con actividad agrícola e infraestructura (Tabla 1). La coordinación del tiempo del ciclo de anidación evidenció que el esfuerzo varió entre nidos; el tamaño de postura oscila de tres a nueve huevos por nido, incluyendo los huevos saqueados o abandonados. Se registraron seis nidadas (Tabla 2). Tres nidadas se registraron mientras se movían a través de canales de irrigación, dos de los cuales tenían agua corriente. Los canales presentaban bancos expuestos de alrededor de 1 m de altura, cubiertos con herbáceas compuestas, tramos de tule (Typha domingensis) y tulillo (Eleocharis sp.), con huizaches (Acacia sp.) y nopales (Opuntia sp.) en los márgenes. El canal de irrigación inactivo en el cual la nidada 2 fue encontrada también tenía bancos pronunciados con los márgenes densamente cubiertos por compuestas y arbustos de Acacia. Las nidadas 5 y 6 fueron encontradas en áreas dragadas dentro de humedales estacionales casi completamente cubiertos por chicura (Ambrosia sp.), excepto por las áreas más profundas aledañas al dique y las áreas dragadas. La nidada más grande (nueve patos), fue observada en un banco de lodo en un humedal estacional parcialmente seco, el cual estaba completamente desprovisto de vegetación. Todas las nidadas fueron observadas en compañía de una hembra adulta.

Fuente: Elaboración propia.
Figura 2 Nidos de pato mexicano (triángulos), nidadas (círculos), y sitios prioritarios (estrellas) según Pérez-Arteaga et al. (2002) en el Altiplano Central (área gris). Registros existentes en negro (eBird, 2016; Williams, 1980), registros reportados en este estudio en blanco.
Tabla 1 Principales características de nidos de pato mexicano encontrados en Pénjamo, Guanajuato, México.
| Nido | Tipoa | Material | Sitio | Vegetación | Altura de vegetación (cm) | Agua más cercana (m) | Distancia a cuerpo de agua léntico (m) | Medidas (cm) b | Número de huevosc | Condición | Coordenadas | Fecha |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | CB | Pata de trigo | Cultivo de maíz | Maíz | 100 | 230 | 430 | 45 × 33 × 13 (20 × 12) | 6 | Saqueado | 20° 16’ 0.29’’ N, 101° 53’ 11.97’’ O | 19/07/2002 |
| 2 | CB | Pata de trigo | Cultivo de sorgo | Sorgo | 130 | 800 | 1,200 | 41 × 36 × 12 (36 × 20) | 6 | Exitoso (eclosionado) | 20° 27’ 54.33’’ N, 101° 37’ 8.25’’ O | 24/07/2002 |
| 3 | CB | Bouteloua-sorgo | Corredor | Sorgo | 110 | 100 | 150 | 24 × 22 × 7 (17 × 13) | 4 | Viable | 20° 30’ 28.95’’ N, 101° 36’ 36.76’’ O | 24/07/2002 |
| 4 | PS | Bouteloua | Corredor | Bouteloua | 50 | 350 | 350 | 25 × 22 | 1 | Abandonado | 20° 27’ 54.35’’ N, 101° 37’ 39.23’’ O | 23/08/2002 |
| 5 | CB | Pata de trigo-Bouteloua | Canal inactivo | Bouteloua-Ambrosium-compuestas | 110 | 650 | 650 | 31 × 23 × 8 (20 × 17) | 6 | Viable | 20° 27’ 23.86’’ N, 101° 36’ 58.29’’ O | 24/08/2002 |
| 6 | CB | Pata de trigo | Canal inactivo | Bouteloua-Ambrosium-compuestas | 110 | 650 | 650 | 29 × 24 × 6 (17 × 14) | 3 | Depredado | 20° 27’ 23.89’’ N, 101° 36’ 58.22’’ O | 24/08/2002 |
| 7 | CB | Pata de trigo | Cultivo de sorgo | Bouteloua-sorgo | 65 | 250 | 250 | 25 × 20 × 7 (12 × 9) | 1 | Abandonado | 20° 28’ 1.40’’ N, 101° 37’ 43.83’’ O | 4/06/2003 |
aCB, Copa baja-lateral; PS, plataforma simple. b Ancho externo × longitud externa × altura externa; los paréntesis indican el ancho interno × longitud interna. Las medidas de plataforma simple son longitud × ancho de la plataforma de anidación. c Incluye huevos completos o restos de huevos únicos.
Fuente: Elaboración propia
Tabla 2 Nidadas de pato mexicano encontradas en Pénjamo, Guanajuato, México
| Nidada | Tamaño de nidada | Sitio | Distancia a cuerpo de agua léntico (m) | Coordenadas | Fecha |
|---|---|---|---|---|---|
| 1 | 4 | Canal de irrigación (activo) | 400 | 20° 16’ 0.29’’ N, 101° 53’ 11.97’’ W | 19/07/2002 |
| 2 | 4 | Canal de irrigación (inactivo) | 200 | 20° 27’ 54.33’’ N, 101° 37’ 8.25’’ W | 01/08/2002 |
| 3 | 9 | Humedal estacional | 0 | 20° 30’ 28.95’’ N, 101° 36’ 36.76’’ W | 13/06/2003 |
| 4 | 5 | Canal de irrigación (activo) | 300 | 20° 28’ 1.40’’ N, 101° 37’ 43.83’’ W | 18/07/2003 |
| 5 | 6 | Humedal estacional | 0 | 20° 27’ 23.86’’ N, 101° 36’ 58.29’’ W | 01/08/2003 |
| 6 | 3 | Humedal estacional | 0 | 20° 27’ 54.35’’ N, 101° 37’ 39.23’’ W | 3/08/2003 |
Fuente: Elaboración propia
Discusión
Existe un gran desconocimiento sobre las características de anidación de la especie, lo cual puede ser atribuido a que los nidos son muy difíciles de localizar; se encuentran generalmente bien ocultos y muy dispersos (1 nido:150 ha-300 ha [Williams, 1980]); probablemente, debido a su agresividad natural (Moctezuma-Malagón, de la Lanza-Espino, González-Rebeles & González-Esquivel, 2007) e intolerancia de otras parejas anidantes (Williams, 1980). Aun cuando la información presentada no fue generada recientemente (>10 años) es relevante, ya que contribuye a llenar los vacíos, toda vez que no se ha generado información posterior para la región (a excepción de los avistamientos de crías en eBird [2016]) y que las descripciones previas a los datos aquí reportados datan de hace casi 40 años (Figura 2) (Williams, 1980). La carencia de información es un indicativo de que se requieren más estudios de campo para determinar las características de anidación en el área.
En el paisaje agrícola que domina el área de distribución del pato mexicano, la vegetación más densa que provee cobertura potencial para anidación se presenta en canales de irrigación inactivos, corredores y campos de cultivo, en sustitución por los pastizales que constituían el hábitat original de la especie (Williams, 1980). Aun cuando existía cobertura vegetativa densa en la periferia de los humedales en la zona de estudio, no se encontraron nidos ni se observó comportamiento reproductivo en dichos sitios. Se ha descrito que el pato mexicano tiene baja tolerancia a la presencia humana (Lindsey, 1946; O’Brien, 1975; Palacio-Núñez, Verdú, Galante, Jiménez-García & Olmos-Oropeza, 2007; Williams, 1980). En la zona de estudio, aun cuando pastaban diariamente ganado bovino y caprino, los patos parecían evitar este disturbio al anidar lejos de los cuerpos de agua. Los nidos encontrados estaban localizados a distancias considerablemente mayores del agua de lo que se ha documentado anteriormente (68 m [Lindsey, 1946]; 197 m [Williams, 1980]; 242 m [González-Olvera, 1995]). No se encontraron nidos cerca (≤ 50 m) de los humedales estacionales y bordos ganaderos y, en el sitio de estudio, los patos anidan en áreas lejos del agua, probablemente evitando daño potencial producido por el ganado. El grado al cual las tasas de éxito reproductivo son afectadas por la distancia de los nidos al agua, debe ser examinado para generar una adecuada planeación de la conservación enfocada en promover el hábitat para anidación.
La cobertura de vegetación en los sitios de anidación era más densa que en los alrededores, tal como se encontró previamente (Mellink, 1994; Williams, 1980), de manera similar a otras especies de Anas (Baldassarre, 2014). Los patos utilizaron predominantemente pata de trigo (residuo de la cosecha del ciclo de invierno, constituido por tallos de trigo ya sea en pie o sobre el suelo [Bahena-Juárez & Velázquez-García, 2012]) y pasto como material de construcción de los nidos, tal como se observó en Jalisco (Williams, 1980). La mayoría de los nidos se ubicaban en corredores o canales de irrigación abandonados entre campos de cultivos, los cuales presentaban vegetación densa, ocultos, con domos o entradas en túnel y soportados lateralmente por los tallos de plantas circundantes, similar a nidos en otras regiones (González-Olvera, 1995; Lindsey, 1946; Williams, 1980). Williams (1980) reportó altura similar de la cobertura de anidación (116 cm) a la aquí encontrada, pero González-Olvera (1995) reportó cobertura de anidación de 53 cm de altura en vegetación emergente en un área protegida cerca de la Ciudad de México. Aunque se encontraron algunas plumas sueltas en los nidos, no se detectó evidencia de utilización de plumas como material térmico, a diferencia de nidos encontrados al norte de su distribución (Lindsey, 1946).
Conclusiones
Los resultados aquí presentados indican que el pato mexicano puede anidar exitosamente en sitios lejanos (≥ 150m) de las fuentes de agua disponibles. Aunque el tamaño de muestra es pequeño, la información presentada sugiere que el dejar áreas sin disturbio (corredores y canales de irrigación), aun cuando no estén adyacentes al agua, podría incrementar la disponibilidad de la cobertura de anidación para la especie. Estudios previos han documentado condiciones y características de nidos y nidadas en otras regiones; el presente estudio constituye el principal conjunto de datos al respecto en la zona más importante para la especie. Si es confirmado por un estudio con mayor tamaño de muestra, este conjunto de datos puede proveer la información base para generar una estrategia diseñada para incrementar el éxito reproductivo de la especie.











 text new page (beta)
text new page (beta)


