Introducción
Los arabinoxilanos (AX) son polisacáridos heterogéneos no amiláceos que se encuentran en varios tejidos de los granos de cereales (Izydorczyk & Biliaderis, 2007). Entre sus propiedades funcionales resalta su capacidad para formar geles covalentes en presencia de agentes oxidantes como la enzima lacasa. Los geles que forman los AX poseen propiedades que les permiten ser utilizados como matrices de liberación controlada para la industria alimentaria y biomédica (Berlanga-Reyes et al., 2009; Carvajal-Millan et al., 2007; Morales-Ortega et al., 2014; Paz-Samaniego et al., 2016, 2018). Estas propiedades dependen de las características del polisacárido, entre las que se encuentran el peso molecular (PM), contenido de ácido ferúlico (AF) y proporción arabinosa/xilosa (A/X) (Izydorczyk & Biliaderis, 2007), por lo que el conocimiento de su estructura es muy importante al momento de buscar nuevas alternativas para su aplicación. Una característica estructural que puede ser de importancia en la gelificación y no ha sido ampliamente estudiada es la proteína asociada al AX. Se ha demostrado la presencia de proteína residual asociada o fuertemente ligada al polisacárido que permanece aun después de utilizar ciertos métodos de purificación (Ebringerová, Hromádková & Berth, 1994; Saulnier, Marot, Chanliaud & Thibault, 1995a; Yadav, Johnston & Hicks, 2007b) . Es bien sabido que la proteína asociada al AX juega un papel muy importante en sus propiedades emulsificantes (Yadav, Nuñez & Hicks, 2011). Sin embargo, el efecto que podría tener la eliminación de dicha proteína en la gelificación y en las propiedades del gel aún no es claro.
Investigaciones previas sugieren que la asociación entre el AX y la proteína involucra un enlace de tipo covalente (Adams, Kroon, Williamson & Morris, 2003; Yadav et al., 2011). En ese sentido, se han propuesto dos vías por las cuales se sugiere que la proteína podría estar unida al polisacárido. Sin embargo, no se ha logrado determinar con precisión el tipo de enlace entre la asociación AX-proteína. Debido a que la capacidad gelificante de los AX depende de su composición y estructura, el conocimiento de sus características estructurales y su efecto en las propiedades del gel es esencial para la construcción de un conocimiento profundo acerca de la naturaleza de los geles y para el diseño de geles con diferentes características que pudieran tener nuevas aplicaciones. La presente revisión se enfoca en plasmar los estudios sobre cómo podría estar relacionada la fracción proteica con la capacidad gelificante del polisacárido y los tipos de enlace covalente propuestos entre el AX y la proteína.
Métodos y Discusión
Estructura química
La estructura de los AX consiste en una cadena de xilosas unidas entre sí por enlaces β-(1-4) y residuos de arabinosa unidos a la cadena principal. Los residuos de arabinosa pueden estar unidos a la cadena de xilosas en posiciones O-3 y/o O-2, lo que resulta en cuatro estructuras diferentes: monosustituida, disustituida y no sustituida (Figura 1). Aunque en promedio el 50%-60% de los residuos de xilosa de la cadena se presentan en la forma no sustituida, la cantidad y distribución de estas estructuras varía dependiendo de la fuente del polisacárido (Izydorczyk & Dexter, 2008). La estructura de los AX puede variar en cuanto a su complejidad de una fuente a otra. Los AX de salvado de maíz, sorgo y arroz son más complejos en comparación a los de trigo, cebada y centeno, ya que además de arabinosa contienen residuos de xilosa, galactosa y ácido glucurónico. En AX de maíz, los residuos de ácido glucurónico se unen a la posición O-2 de la xilosa y algunos residuos de galactosa y xilosa a la arabinosa ramificada (Saulnier et al., 1995a). Una característica única de estos polisacáridos es la presencia de ácidos hidroxicinámicos como el ferúlico y cumárico, que se encuentran esterificados a la arabinosa en posición O-5 (Smith & Hartley, 1983). Además, presentan residuos de ácido acético esterificados (3%-5%) directamente a la cadena de xilosas en las posiciones O-2 o O-3 (Agger, Viksø-Nielsen & Meyer, 2010).
Los AX poseen características estructurales que pueden variar y afectar así sus propiedades fisicoquímicas. Estas variaciones se ven reflejadas en el grado de polimerización (GP), proporción A/X, proporción y secuencia de enlaces glicosídicos, patrón de sustitución de arabinosas en la cadena y en la presencia de otros sustituyentes (Izydorczyk & Biliaderis, 2007). La proporción A/X se refiere al grado de ramificación o sustitución de los AX e indica el número de unidades de arabinosa unidas a la cadena principal de xilosas. Esta proporción puede variar de 0.3 a 1.1, dependiendo del origen del polisacárido (Izydorczyk & Biliaderis, 2007). En AX de pericarpio de maíz se han encontrado altos grados de sustitución que van desde 0.75 a 1.08 (Carvajal-Millan et al., 2007; Martínez-López et al., 2012; Méndez-Encinas et al., 2017; Van Laar, Tamminga, Williams, Verstegen & Schols, 2002; Yadav, Johnston & Hicks, 2009; 2007b). Esta relación no detalla las características estructurales de estos polímeros, pero está relacionada con la proporción de las cuatro estructuras moleculares en las cadenas de los AX (Izydorczyk & Biliaderis, 2007).
Los AX se clasifican como extraíbles y no extraíbles en agua (WE-AX y WU-AX, respectivamente) en base a su solubilidad (Niño-Medina et al., 2010). Estas diferencias en la solubilidad pueden estar relacionadas con los patrones de sustitución y el grado de entrecruzamiento. También pueden deberse a enlaces covalentes entre los grupos carboxilo de ácidos urónicos y los grupos hidroxilo de los AX, así como a la formación de puentes diferúlicos entre las cadenas adyacentes (Fincher & Stone, 1986; Gruppen, Marseille, Voragen & Hamer, 1990). En los granos de cereales, los WE-AX se localizan principalmente en el endospermo y los WU-AX en la capa de aleurona y cascarilla (Niño-Medina et al., 2010).
A pesar de que las características estructurales de los WU-AX han sido menos estudiadas, se ha demostrado que su estructura es similar a la de los WE-AX, pero con valores más altos de PM promedio y de proporción A/X (Izydorczyk & Biliaderis, 1995). A diferencia de los WE-AX, que pueden ser fácilmente extraídos con agua, los WU-AX requieren de métodos más específicos e incluso abrasivos para poder ser liberados de la pared celular en la que se encuentran embebidos. Estos se basan principalmente en el uso de álcalis y enzimas, así como de algunos tratamientos mecánicos (Zhang, Smith & Li, 2014). De esta manera, el método de extracción utilizado es otro de los factores que influye de manera importante en las características estructurales del polisacárido, repercutiendo principalmente en su PM y la proporción A/X (Zhang et al., 2014). En un estudio reciente se evaluó el efecto de dos métodos de extracción de AX de pericarpio de maíz (escala laboratorio y escala piloto) en la estructura (PM, proporción A/X, contenidos de ácidos fenólicos) y propiedad gelificante de polisacárido (Ayala-Soto, Campanella, Serna-Saldívar & Welti-Chanes, 2016). Los autores indicaron que la extracción a escala piloto no afectó el contenido de azúcares ni el PM del polisacárido, pero incrementó la proporción A/X y la concentración de AF libre y disminuyó la de AF esterificado. Esto resultados se relacionaron con la capacidad gelificante del polisacárido, observando que los AX extraídos a escala laboratorio formaron geles más fuertes comparados con los obtenidos con AX extraídos a escala piloto. Los hallazgos observados en este estudio demuestran que el método utilizado para extraer a los AX no solo afecta las características estructurales del polisacárido, sino que también repercute de manera importante en las propiedades funcionales del mismo.
Características físicoquímicas
Los AX presentan ciertas características fisicoquímicas que les confieren distintas propiedades funcionales. Estas propiedades dependen de la conformación, interacciones cadena-cadena, con otro polímero o el solvente (Izydorczyk & Biliaderis, 1995). El PM de los AX varía dependiendo del origen y el método que se utilice para su determinación. En WE-AX se han encontrado PM desde 10 kDa hasta 10 000 kDa, mientras que en WU-AX puede exceder los 10 000 kDa (Izydorczyk & Biliaderis, 1995). En los WU-AX se requiere de una extracción que puede propiciar la degradación de las cadenas poliméricas y afectar el PM de ellas. El PM de AX de pericarpio de maíz extraídos con tratamiento alcalino se encuentra entre 244 kDa a 491 kDa con un índice de polidispersidad (IP) de 1.35 a 2.5. En este caso, el PM es afectado por las condiciones de extracción (tiempo, pH y temperatura) (Chanliaud, Saulnier & Thibault, 1995; Yadav, Fishman, Chau, Johnston & Hicks, 2007a; Yadav et al., 2009).
La solubilidad en agua de los AX y de los polisacáridos generalmente depende de las interacciones entre cadena-cadena y cadena-solvente. Diversos factores como la longitud de la cadena, la presencia de grupos laterales, así como su distribución pueden modificar la solubilidad de los polímeros. En general, la presencia de ramificaciones impide la interacción entre cadenas favoreciendo la solubilidad de los polímeros (Saulnier, Guillon, Sado, Chateigner-Boutin & Rouau, 2013). Otro factor que influye en la solubilidad de los AX es la presencia de entrecruzamientos que estos pueden formar con otros componentes de la pared celular. Además de formar enlaces entre sus cadenas, los AX pueden encontrarse unidos a otros polímeros como β-glucanos, celulosa, lignina y proteínas mediante enlaces de tipo covalente y no covalente, disminuyendo su solubilidad en agua (Beaugrand et al., 2004; Saulnier, Sado, Branlard, Charmet & Guillon, 2007). Tal es el caso de los WU-AX que tienen mayor proporción de A/X que los WE-AX, lo cual debería reflejarse en una alta solubilidad, pero la presencia de enlaces covalentes de puentes diferúlicos entre cadenas afecta disminuyendo su solubilidad (Saulnier et al., 2013). Andrewartha, Phillips & Stone (1979) encontraron que conforme la proporción de A/X disminuye, la solubilidad de los AX se reduce considerablemente. El valor crítico de A/X que identificaron fue ~0.43, en el cual se observó que la solubilidad de los AX disminuyó abruptamente. Lo anterior indica que AX con bajos valores de A/X son menos solubles debido a la presencia de segmentos de residuos de xilosa no sustituidos en la cadena polimérica estabilizados por puentes de hidrógeno, lo cual favorece la formación de agregados intermoleculares (Zhang et al., 2014).
La viscosidad de una solución polimérica es un parámetro que se relaciona directamente con las propiedades de la molécula (conformación, PM, distribución de pesos moleculares) y la concentración del polímero (Lefebvre & Doublier, 2005). La viscosidad intrínseca ([η]) es una medida del volumen hidrodinámico que ocupa el polímero aislado en la solución y no debe confundirse con la viscosidad de la solución (Saulnier et al., 2007). Como resultado de los altos PM y rigidez local de las cadenas, los AX se caracterizan por presentar alta viscosidad en soluciones acuosas (Izydorczyk & Biliaderis, 2007). En WE-AX de trigo, la [η] se encuentra en el rango de 2 dL/g a 6 dL/g con un valor promedio de 4 dL/g (Rattan, Izydorczyk & Biliaderis, 1994; Saulnier, Peneau & Thibault, 1995b). Estos valores varían dependiendo del método de extracción, la variedad del cereal, así como del PM y/o conformación del polímero (Saulnier et al., 2007). Niño-Medina et al. (2009) reportaron una [η] de 1.83 dL/g en AX extraídos de nejayote. En AX extraídos de pericarpio de maíz se han encontrado valores de [η] entre 1.35 dL/gy 2.68 dL/g (Carvajal-Millan et al., 2007; Martínez-López et al., 2012; Yadav et al., 2007a; Yadav et al., 2009).
Capacidad gelificante
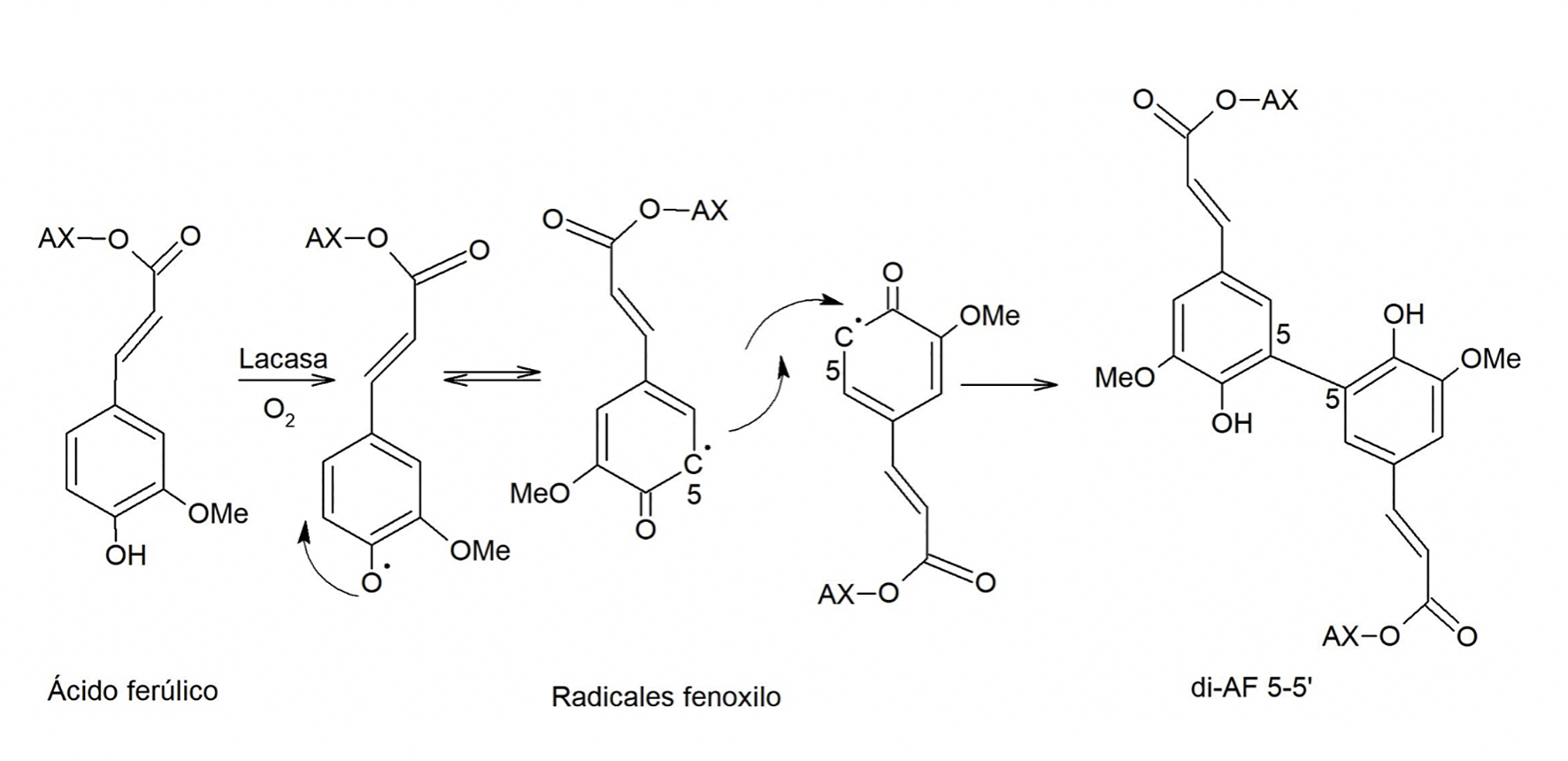
Los AX forman soluciones altamente viscosas e hidrogeles en presencia de agentes oxidantes, ya sea vía enzimática con peroxidasa/H2O2, lacasa/O2 y ácido linoleico/lipoxigenasa, o química con el persulfato de amonio y el cloruro férrico. Esta característica se debe al entrecruzamiento covalente de las cadenas de AX mediante la dimerización de AF (Izydorczyk & Biliaderis, 2007). El proceso de gelificación resulta de la formación de redes tridimensionales entre cadenas de AX entrecruzadas por los dímeros y trímeros de AF (di-AF, tri-AF) en las que la fase acuosa es retenida (Figura 2). La dimerización de AF se lleva a cabo en dos etapas: primero, el AF es oxidado por acción de un agente oxidante al atacar al átomo de H del grupo hidroxilo de su anillo fenólico, generando un radical fenoxilo. Este radical es estabilizado por resonancia dentro de la misma molécula y puede localizarse en posición O-4, C-5 o C-8. En el siguiente paso, se da el acoplamiento de dos radicales fenoxilo y la formación de enlaces covalentes que conectan fuertemente a las dos cadenas de AX (Ralph, Quideau, Grabber & Hatfield, 1994) (Figura 3). Así, la estructura de los di-AF formados depende de la distribución de los radicales libres (Saulnier et al., 2013).

Fuente: Elaboración propia.
Figura 2 Formación de la red tridimensional de AX por acción de la enzima lacasa.
Fuente: Elaboración propia.
Figura 3 Esquema representativo del mecanismo de dimerización del ácido ferúlico para la formación del di-AF 5-5’.
La desaparición de AF, así como la formación de di-AF y tri-AF derivados durante la primera etapa de la gelificación de los AX, demuestran la intervención de estos residuos durante el proceso (Carvajal-Millan, Guigliarelli, Belle, Rouau & Micard, 2005; Izydorczyk, Biliaderis & Bushuk, 1991). En geles de AX se han identificado cinco di-AF: 5-5’, 8-5’ benzo, 8-8’, 8-O-4’ y 8-5’, siendo los dos últimos los más abundantes (Saulnier et al., 2013). Por otro lado, Carvajal-Millan et al. (2005) reportaron la presencia de un di-AF (4-O-8’, 5-5’) en geles de AX de trigo inducidos por lacasa, pero en concentraciones menores que las de los di-AF. Actualmente, los tri-AF identificados y caracterizados estructuralmente en los AX son el 5-5’/8-O-4’, 8-O-4’/8-O-4’, 8-8’(cíclico)/8-O-4’, 8-O-4’/8-5’(no cíclico), y 5-5’/8-O-4’(H2O). En maíz, los tri-AF más abundantes son el 8-O-4/5-5, 8-O-4/8-O-4 y el 8-8/8-O-4 (Dobberstein & Bunzel, 2010). También se han identificado dos tetrámeros de AF en AX de pericarpio de maíz, el 4-O- 8’/5-5’/8-O-4’ y el 4-O- 8’/5-5’/8-5’(no cíclico) (Bunzel, 2010).
Los AX de pericarpio de maíz presentan un alto contenido de ácidos fenólicos (4%), siendo los principales el AF y sus di-AF. El AF se ha encontrado en concentraciones de 0.25-7.18 µg/mg de AX de pericarpio de maíz (Carvajal-Millan et al., 2007; Lapierre, Pollet, Ralet & Saulnier, 2001; Morales-Burgos et al., 2017). En el estudio de Carvajal-Millan et al. (2007) se detectaron contenidos de 0.34 µg/mg, 0.77 µg/mg y 0.39 µg/mg AX de AF, di-AF y tri-AF, respectivamente; con el di-AF 5-5’, como la estructura más abundante. Por su parte, Morales-Burgos et al. (2017) encontraron un contenido total de 7.18 µg/mg AX de AF en AX de pericarpio de maíz, así como un total de 0.44 µg/mg y 0.01 µg/mg AX de di-AF y tri-AF, respectivamente, predominando el di-AF 8-5’.
Una vez que se lleva a cabo la gelificación de los AX, el contenido de AF disminuye como consecuencia de su oxidación y es recuperado en forma de di-AF y el tri-AF. Sin embargo, el total de di-AF y tri-AF no logra compensar el total de AF oxidado después de la gelificación. Este comportamiento ha sido observado previamente por varios autores (Carvajal-Millan et al., 2007; Martínez-López et al., 2016; Morales-Burgos et al., 2017; Vansteenkiste, Babot, Rouau & Micard, 2004). En un estudio reciente se cuantificó el contenido de ácidos fenólicos en AX de pericarpio de maíz (2% p/v) antes y después de la gelificación (Morales-Burgos et al., 2017). Los autores encontraron que un 30% del AF inicial fue oxidado durante la formación del gel, mientras que solo un 61% fue recuperado como di-AF y tri-AF. Reportes previos sugieren que parte del AF oxidado podría estar formando parte de estructuras superiores de AF (tetrámeros, pentámeros de AF) que no han sido identificadas (Carvajal-Millan et al., 2005; Vansteenkiste et al., 2004). Considerando que la presencia de estructuras más complejas como tetrámeros de AF han sido previamente identificadas en la pared celular de maíz (Bunzel, Ralph, Bruning & Steinhart, 2006), podría también suponerse la formación de este tipo de estructuras en los geles de AX.
Como se ha mencionado, la capacidad gelificante de los AX está determinada en gran parte por sus características estructurales. Los entrecruzamientos entre las cadenas de AX dependen de la presencia de AF, por lo que su concentración y distribución puede influir en la gelificación. Aunque el rol del AF es muy importante durante la formación del gel, existen otras características estructurales de la molécula, tales como su PM, la proporción A/X, entre otras que pueden afectar de alguna manera el proceso de gelificación y por lo tanto deben ser consideradas. Recientemente, Márquez-Escalante et al. (2018) evaluaron el efecto de la modificación enzimática de la proporción A/X de AX de trigo en las características reológicas y microestructurales de los geles formados. Los resultados mostraron que una disminución de 0.68 a 0.51 en la A/X de los AX permite la obtención de geles más fuertes y con microestructuras mucho más compactas. Los autores atribuyen este comportamiento a que menores valores de A/X favorecen la agregación de las cadenas del polisacárido, resultando en un incremento en el contenido de entrecruzamientos y en la formación de geles con mejores características reológicas y microestructurales. Estos aspectos del polisacárido son los que le proporcionan las características viscoelásticas y estructurales al gel formado, las cuales a su vez le confieren distintas propiedades funcionales. Así, los geles de AX pueden tener diferentes aplicaciones dependiendo de las propiedades funcionales que estos presentan. El contenido de proteína asociada al AX es otra característica de los AX que influye en las propiedades funcionales del polisacárido, tales como su viscosidad y capacidad emulsificante (Yadav et al., 2007a). Sin embargo, el efecto que dicha fracción proteica podría tener en la capacidad gelificante de los AX y en las características de los geles que pudiesen formarse no ha sido investigado a profundidad.
Los geles de AX poseen sabor y olor neutro, una alta capacidad de absorción de agua y son resistentes a cambios en el pH o fuerza iónica debido a la naturaleza de sus enlaces covalentes (Izydorczyk & Biliaderis, 1995). Estos geles generalmente son fuertes, se forman rápidamente y son estables al calor (Carvajal-Millan et al., 2005). Su estructura meso y macroporosa, así como su naturaleza de fibra dietaria, les permite su aplicación potencial como matrices de liberación controlada de agentes bioactivos en distintos campos (Izydorczyk & Biliaderis, 1995). Estudios previos han demostrado la capacidad de los geles de AX para encapsular biomoléculas y células (Berlanga-Reyes et al., 2009; Morales-Ortega et al., 2013; Paz-Samaniego et al., 2016, 2018; Rascón-Chu et al., 2018). Además, estos geles pueden ser fermentados por la microbiota colónica (Hopkins et al., 2003; Martínez-López et al., 2016) y favorecen el crecimiento de probióticos como Bifidobacterium y Lactobacillus (Paz-Samaniego et al., 2018), lo cual los hace excelentes candidatos para su potencial aplicación en el diseño de sistemas de liberación de fármacos dirigidos a colon. Estas propiedades dependerán de la capacidad gelificante del polisacárido y de las características estructurales del gel. Sin embargo, hace falta más conocimiento sobre la relación entre las características estructurales del AX y la funcionalidad de los geles formados. Una de estas características que puede ser importante es su asociación con la proteína y el efecto que esta podría tener en el proceso de gelificación.
Asociación arabinoxilano-proteína
Los AX de maíz se obtienen mediante tratamientos que involucran una hidrólisis alcalina controlada. La composición de estos AX es: xilosa (50%-60%), arabinosa (31%-35%), galactosa (7%-8%) y ácido glucurónico (4%-5%). Además, se ha demostrado que presentan un porcentaje de proteína fuertemente asociada o ligada a su estructura que varía del 2% al 9% (p/p), dependiendo del origen y el método utilizado para su obtención (Whistler & Bemiller, 1956; Yadav et al., 2007b; Yadav et al., 2011).
La función que desempeña la proteína asociada al AX en las propiedades emulsificantes del polisacárido ha sido documentada previamente (Yadav, Johnston, Hotchkiss & Hicks, 2007c). Yadav et al. (2007c) demostraron que las propiedades emulsificantes de la goma de fibra de maíz dependen en gran medida de la cantidad de proteína presente en el polisacárido, observando una mejora en la capacidad emulsionante a mayores contenidos de proteína. Si bien se tiene conocimiento del papel que tiene la fracción proteica asociada al AX en su capacidad emulsificante, no se cuenta con información suficiente relacionada a la función de dicha proteína en otras propiedades funcionales del AX, particularmente en su capacidad gelificante.
Diversos estudios mencionan la presencia de cierto contenido de proteína remanente después de los procesos de extracción y purificación de los AX. En maíz, las extracciones secuenciales con proteasas y álcali han permitido obtener AX con un contenido de proteína del 0.4% al 5% (Saulnier et al., 1995a). Resultados similares se encontraron en centeno, donde el extracto purificado con pronasas y álcali presentó un contenido de proteína del 1.1% (Ebringerová et al., 1994). Asimismo, en AX de trigo se ha obtenido un contenido del 4.2%, después de hacer una purificación con pronasas (Morales-Ortega et al., 2013). Los estudios anteriores indican que aún después de utilizar métodos para purificar al extracto, cierto contenido de proteína permanece en el polisacárido.
Por otro lado, se han utilizado métodos que involucran extracciones acuosas para separar a los AX en base a su solubilidad en agua del resto de los componentes. En estos casos, el material proteico remanente puede extraerse con solventes no polares como el etanol acuoso. Esto permite reducir el contenido de proteína hasta 2%-0.6%, pero sin lograr una eliminación completa (Fincher & Stone, 1974; Yadav, Cooke, Johnston & Hicks, 2010). Cabe mencionar que, en trigo, la presencia de la proteína asociada al AX fue confirmada mediante estudios de microscopía de fuerza atómica. Los autores sugieren que la proteína está fuertemente ligada y posiblemente asociada de manera covalente al polisacárido (Adams et al., 2003). Sin embargo, aún no se ha establecido con certeza cómo es que esta fracción proteica se encuentra unida al polisacárido y qué tipo de enlace participa en dicha asociación.
Con base en los estudios anteriores, es claro que existe proteína que se encuentra asociada de alguna forma al polisacárido, la cual no es posible eliminar con los métodos de extracción y purificación utilizados comúnmente. Sin embargo, no se ha determinado hasta qué punto, podrían la aplicación de otros métodos más específicos (químicos y/o enzimáticos) ser capaces de lograr la eliminación de esta fracción proteica. La eliminación parcial o total de la proteína asociada al AX ayudaría a identificar el tipo de enlace entre dicha asociación, así como a establecer un método que permita modificar la estructura del polisacárido, mediante la eliminación de su fracción proteica. Este conocimiento podría aprovecharse para el diseño de AX con diferentes propiedades funcionales, ya sea con la finalidad de modificar su ya conocida capacidad emulsificante o incluso otras propiedades como su capacidad gelificante.
Yadav et al. (2011) lograron aislar e identificar a la proteína asociada a los AX de maíz, la cual presentó una secuencia de péptidos y PM (22 kDa) similares a la proteína hidrofóbica alfa-zeína del maíz. Además, indicaron que dicha proteína puede estar unida de manera covalente o física a la estructura de los AX, lo que les permite actuar como emulsionante. En este estudio, los AX se obtuvieron mediante una hidrólisis alcalina, seguida de una precipitación con etanol. Sin embargo, durante la extracción no se indicó el uso de enzimas proteolíticas para purificar el extracto, lo cual se vio reflejado en un alto contenido de proteína (8.5%). Debido a esto, es posible que la proteína aislada haya presentado residuos proteicos que no formaban parte integral del polisacárido y que tal vez no se eliminaron durante el proceso de extracción.
En cuanto a información relacionada con el perfil de aminoácidos de las proteínas asociadas a los AX, se tienen pocos estudios. Los aminoácidos más abundantes detectados en estas proteínas se muestran en la Tabla 1. Por ejemplo, la proteína identificada en AX de pericarpio de maíz ha presentado cantidades importantes de alanina (Ala), valina (Val), prolina (Pro), glicina (Gly), glutamina (Gln), leucina (Leu), treonina (Thr), tirosina (Tyr) e hidroxiprolina (Hyp) (Cirre, Al-Assaf, Phillips, Yadav & Hicks, 2014; Saulnier et al., 1995a; Yadav et al., 2011). Recientemente, Méndez-Encinas et al. (2017) determinaron el perfil de aminoácidos de la proteína asociada a los AX de granos secos de la destilería de maíz (DDGS), indicando a los aminoácidos histidina (His), treonina (Thr) y asparagina (Asn) como los mayoritarios. Cabe mencionar que en este estudio no se detectó la presencia de los aminoácidos Pro e Hyp en la proteína, lo cual resulta benéfico, considerando que las prolaminas de maíz (proteínas ricas en prolina) se han relacionado con inducir una respuesta inmune en personas celíacas (Ortiz-Sánchez, Cabrera-Chávez & Calderón de la Barca, 2013). Los autores sugieren que esta diferencia en la composición de aminoácidos podría estar relacionada con la fuente del polisacárido y el método de extracción utilizado. Por su parte, en la proteína de AX de centeno, se ha observado un menor contenido de Pro, pero rico en Gly y serina (Ser) (Ebringerová et al., 1994). Aunque se conocen los aminoácidos presentes en las proteínas asociadas a los AX, aún no ha sido posible determinar qué aminoácidos podrían estar participando en dicha asociación.
Tabla 1 Aminoácidos más abundantes en las proteínas asociadas a AX.
| Fuente de AX | Contenido de proteína (%) | Aminoácidos |
| Pericarpio de maízabce | 5-8.5 | Ala, Val,
Pro, Gly, Gln, Leu, Thr, Tyr, Hyp, Asn, His |
| Centenod | 1.1 | Gly, Ser, Ala, Arg |
a(Saulnier et al., 1995a); b(Yadav et al. 2011); c(Cirre et al. 2014); d(Ebringerova et al., 1994); (eMéndez-Encinas et al., 2017). Ala: Alanina, Pro: Prolina, Gly: Glicina, Hyp: Hidroxiprolina, Thr: Treonina, Ser: Serina, Arg: Arginina, Val: Valina, Gln: Glutamina, Leu: Leucina; Tyr: tirosina; Asn: Asparagina; His: Histidina.
Fuente: Elaboración propia.
Cirre et al. (2014) aplicaron un tratamiento con proteasas a fracciones de AX con la finalidad de investigar el tipo de enlace entre el AX y la proteína. Ellos encontraron que después de 24 h y 48 h de tratamiento, el PM del AX no se modificó. Lo anterior indicó que la proteína no fue digerida por la proteasa, resultado que usualmente se presenta en la goma arábiga al observar una reducción considerable en su PM. Esto sugiere que el enlace entre AX y proteína no parece ser similar al que se presenta en la goma arábiga, el cual se considera que es vía Hyp y posiblemente Ser.
Son escasos los estudios relacionados con la naturaleza del enlace en la asociación AX-proteína. Con base en ellos, se han propuesto dos vías mediante las cuales podría estarse dando la unión entre el AX y la proteína. Una de ellas involucra una posible interacción AF-aminoácido y la otra, una unión aminoácido-carbohidrato. En el primer caso, se sugiere la interacción entre el aminoácido Tyr de las proteínas y el residuo de AF de los AX, mediante la formación de un dímero (AF-Tyr) (Neukom & Markwalder, 1978) (Figura 4). Piber & Koehler (2005) detectaron este entrecruzamiento en harinas de trigo y centeno, así como en la masa y el pan elaborado con dichas harinas. Sin embargo, los autores no lograron identificar con precisión la estructura formada. Por ello, propusieron diferentes estructuras para el dímero formado, las cuales sugieren un enlace covalente entre el AF y la Tyr, predominando el de tipo éter. Considerando que los AX contienen AF y que las proteínas (gluten) de la harina tienen Tyr, los autores proponen que el dímero AF-Tyr podría estar relacionado con un entrecruzamiento covalente entre las proteínas y el AX en harina de cereales.

Fuente: Elaboración propia.
Figura 4 Mecanismo propuesto para la formación del enlace AF-Tyr en la asociación AX-proteína.
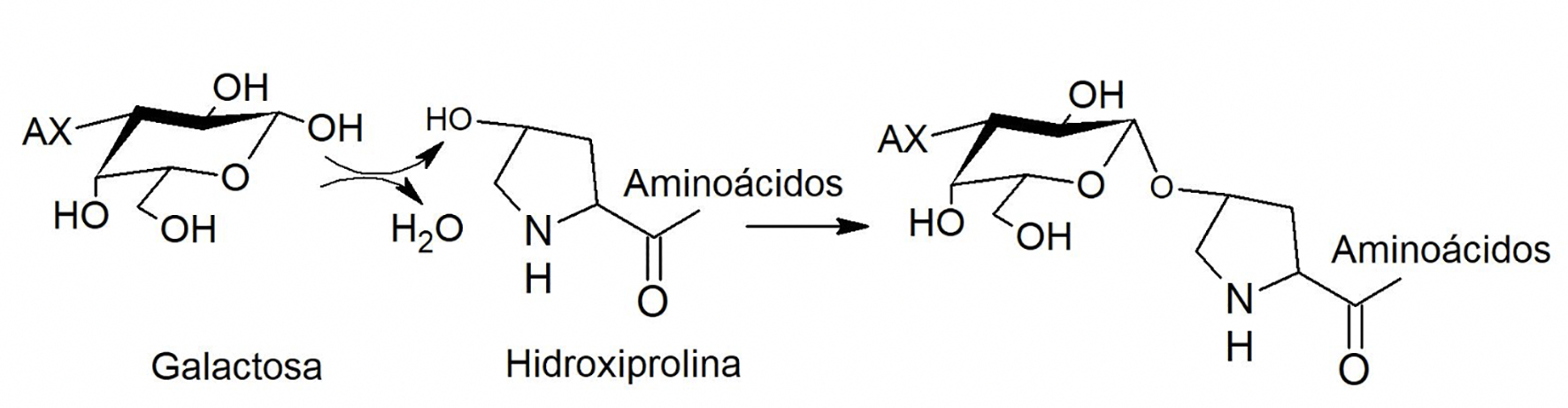
La otra posible interacción es la unión entre carbohidrato y aminoácido (Figura 5). En uno de los primeros estudios, se observó que la proteína asociada a los AX de pericarpio de maíz presentó un elevado contenido de Hyp y Pro. Debido a que las proteínas de la pared celular del pericarpio de maíz son ricas en estos aminoácidos, se sugirió que la proteína podría relacionarse con alguna de las glicoproteínas del maíz. Aunque se conoce que los enlaces glicosídicos a través de Hyp son resistentes a tratamientos alcalinos, no se ha determinado la naturaleza del enlace entre la proteína y el AX (Saulnier et al., 1995a). Esto lleva a sugerir la posibilidad de que la interacción entre la proteína y el AX sea mediante un enlace de tipo covalente que involucre la unión del polisacárido a la proteína a través de Hyp. Además, si este enlace se presentara en la asociación AX-proteína, su resistencia al álcali se confirmaría al saber que la proteína permanece asociada al AX aún después de la extracción.
Fuente: Elaboración propia.
Figura 5 Mecanismo propuesto para el enlace Galactosa-Hyp en la asociación AX-proteína. AX: arabinoxilano.
Por otro lado, en centeno se aisló un complejo AX-proteína y se determinó que la proteína asociada al polisacárido era rica en los aminoácidos Ser y Gly (Ebringerová et al., 1994). Se propuso que las cadenas de xilosas se encuentran unidas covalentemente a un núcleo proteico, con una estructura similar a la de complejos de arabinogalactanas-proteicas (AGP) aisladas en trigo. En dicha estructura, la unión del carbohidrato a la proteína se da mediante un enlace Hyp-galactosa (Strahm, Amadò & Neukom, 1981). En este contexto, se sabe que los AX de pericarpio de maíz pueden presentar residuos de galactosa y que la proteína asociada a estos presenta contenidos elevados de Hyp. Por lo anterior, no se descarta la posibilidad de que pudiesen estar presentes enlaces de este tipo entre el AX y la proteína. Sin embargo, esta es solamente una propuesta de la estructura que podría estar presente en dicho enlace, la cual no ha sido comprobada. Por ello, es necesario realizar estudios más profundos que permitan determinar el tipo de enlace que existe en esta asociación.
Asociación AX-proteína y gelificación
La asociación AX-proteína y el papel que podría desempeñar la fracción proteica en el proceso de gelificación de los AX son temas de polémica. Uno de los primeros estudios sugiere que la proteína participa en la gelificación, por lo que es necesaria para que se lleve a cabo dicho proceso (Painter & Neukom, 1968). Contrario a esto, Morita, Ito & Hirano (1974) mostraron evidencia de geles formados con fracciones de AX libres de proteína. Otros estudios indicaron que el uso de enzimas proteolíticas en soluciones de AX previenen la gelificación y si son aplicadas en el gel, provocan su degradación (Girhammar & Nair, 1995; Neukom & Markwalder, 1978). A pesar de que hay varios trabajos en los que se ha estudiado la asociación AX-proteína en el proceso de gelificación, los resultados obtenidos no son consistentes. Debido a esto, no ha sido posible determinar el papel que desempeña la proteína y cómo podría influir en la capacidad gelificante de los AX y en las características de los geles formados.
Se sabe que el contenido de proteína en el AX afecta en gran medida la capacidad emulsionante del polisacárido. Esto se debe a que tanto la fracción proteica (hidrofóbica) como el carbohidrato (hidrofílica) son necesarias para estabilizar los sistemas de emulsiones. Por ello, la presencia de proteína en el polisacárido podría resultar indispensable para ejercer su función. Por el contrario, la capacidad gelificante de los AX depende principalmente del AF presente en la molécula, por lo que podría esperarse que la proteína asociada al AX no afecte de manera significativa en el proceso de gelificación. Sin embargo, la presencia de dicha fracción proteica sí podría impactar en las características de los geles formados por los posibles impedimentos estéricos que esta pudiera ocasionar durante la formación de la red tridimensional del gel.
Por otro lado, se han realizado diversos estudios con la finalidad de identificar las posibles interacciones entre el AX y la proteína durante la gelificación. La mayoría de estos experimentos han sido en preparados de harinas de cereales, en donde se adicionan aminoácidos modelo para observar las interacciones que podrían darse entre estos y el AF, y su efecto en la gelificación. Algunos autores mencionan que en presencia de proteínas, el AF podría enlazarse a residuos de Tyr o cisteína (Cys), y que este último aminoácido inhibe la gelificación Moore, Martínez-Muñoz & Hoseney,. 1990). Girhammar & Nair (1995) explican esta inhibición en la gelificación como un efecto de competencia por el agente oxidante durante la reacción. Por su parte, Neukom & Markwalder (1978) sugieren dos vías en las cuales la proteína podría estar involucrada en la gelificación. En la primera, el AF podría enlazarse a un grupo amino terminal, formando un enlace pseudopeptídico. En la segunda, el AF asociado al AX podría entrecruzarse con el residuo de Tyr. Esta última vía es la que coincide con los resultados de la mayoría de los estudios realizados.
En harinas de trigo y centeno se ha encontrado el entrecruzamiento covalente de un dímero de AF-Tyr, el cual puede deberse a la presencia de Tyr libre en la harina y AF en los AX del endospermo, así como a la lignina de las capas externas del grano. Sin embargo, no se descarta la idea de que sea un nuevo entrecruzamiento covalente generado entre el AF de los AX y la Tyr de las proteínas del gluten presente en la harina de cereales (Piber & Koehler, 2005). De igual manera, en harinas de trigo sometidas a gelificación oxidativa fue posible observar la interacción entre AX-proteína mediante puentes de AF-Tyr (Bettge & Morris, 2007). Por su parte, Figueroa-Espinoza, Morel, Surget & Rouau (1999) estudiaron la adición de Tyr en la gelificación oxidativa en presencia de la enzima manganeso peroxidasa. Aunque la Tyr no afectó el proceso de gelificación, se observó una oxidación acelerada del AF, pero con una escasa formación de dímeros de AF. Ellos indicaron que pudo haberse dado una interacción entre AF y Tyr, lo cual sugiere la posibilidad de la existencia de un enlace covalente entre las proteínas y el AX.
Oudgenoeg et al. (2001) demostraron que la Tyr puede acoplarse mediante un enlace covalente a dos moléculas de AF en presencia de la enzima peroxidasa. Por lo que se sugiere la posibilidad de un enlace similar entre las proteínas y los AX. En un estudio similar se utilizaron péptidos modelo que contenían Tyr, los cuales se sometieron a reaccionar con AF en presencia de la enzima lacasa. Los investigadores encontraron que la Tyr formaba un enlace covalente con el AF y se identificó como uno de tipo éter (enlace isoditirosina) (Mattinen et al., 2005).
Los estudios expuestos coinciden en que la interacción que se da entre el AX y las proteínas durante la gelificación involucra el entrecruzamiento covalente AF-Tyr y que este podría ser de tipo éter. Aunque dicho entrecruzamiento ha sido identificado en condiciones simuladas adicionando el aminoácido Tyr, es posible que ciertas interacciones en la asociación AX-proteína sean de esta naturaleza. Por lo anterior, resultaría interesante investigar el efecto que podría tener dicho enlace en el proceso de gelificación del polisacárido y en las características del gel formado. En ese sentido, aunque la proteína no participa directamente en la gelificación, la presencia de residuos de Tyr en esta podrían interaccionar con el AF de otras cadenas del polisacárido y formar los dímeros AF-Tyr. La formación de este tipo de entrecruzamientos podría verse reflejado en una disminución de los di-AF y tri-AF y resultar en la formación de geles más débiles.
Por otro lado, la presencia de un enlace de tipo carbohidrato-aminoácido en la asociación AX-proteína podría influir de otra manera en el proceso de gelificación y en las características reológicas y estructurales de los geles. En este caso, es posible que la presencia de la fracción proteica no afecte en la formación de la red tridimensional del gel, ya que no interviene en la creación de entrecruzamientos entre los residuos de AF (di-AF y tri-AF). Sin embargo, la presencia de esta proteína podría provocar impedimentos estéricos entre las cadenas del polisacárido, y verse reflejado en la formación de un gel con tamaños de poro más grande y una estructura más heterogénea. Por el contrario, la completa eliminación de dicha proteína permitiría la obtención de geles más fuertes y con una estructura más compacta y homogénea.
La relación estructura-función en los AX resulta ser muy importante al momento de diseñar geles para determinadas aplicaciones. Por ello, conocer el tipo de enlace en la asociación AX-proteína permite proponer la elaboración de estudios más profundos en los que sea posible eliminar la fracción proteica, con la finalidad de evaluar el efecto de dicha fracción en la capacidad gelificante del polisacárido. Esta información, además de ampliar el conocimiento sobre la estructura de los AX, ayudaría a tener un mejor entendimiento de la relación estructura-función en este polisacárido. Este conocimiento podría contribuir al diseño de geles de AX con funcionalidades específicas.
Por último, es importante mencionar que no existen estudios relacionados con la asociación AX-proteína y el efecto que podría tener la fracción proteica en la propiedad gelificante del polisacárido y en las características de sus geles. La mayoría de los estudios que se han hecho están dirigidos a evaluar el papel de esta proteína sólo en la capacidad emulsionante del polisacárido.
Conclusiones
Las investigaciones enfocadas a estudiar las características estructurales y la capacidad gelificante de los AX continúan siendo un tema de interés. En ese sentido, la asociación de la proteína remanente con el AX es una característica de la cual no se cuenta con suficiente información. Diversas investigaciones sugieren que la asociación entre los AX y la proteína remanente involucra un enlace de tipo covalente. Se han propuesto dos vías por las cuales se sugiere que la proteína podría estar unida al polisacárido (vía carbohidrato-aminoácido y vía AF-aminoácido). Sin embargo, no existen reportes que demuestren el tipo de enlace existente en la asociación AX-proteína ni la relación de esta fracción proteica con la capacidad gelificante del polisacárido.
Se requiere llevar a cabo investigaciones más profundas sobre el efecto que podría tener la eliminación de dicha proteína en la capacidad gelificante del polisacárido y en las características de los geles formados. Además, es necesario realizar estudios más específicos que permitan identificar el tipo de enlace presente en la asociación AX-proteína. El conocimiento de esta información podría contribuir a comprender mejor la naturaleza y propiedades de los geles que forma el polisacárido, permitiendo así diseñar geles de AX con aplicaciones específicas para la industria alimenticia, biomédica y cosmética, entre otras.











 nueva página del texto (beta)
nueva página del texto (beta)



