Introducción
En las últimas dos décadas, la agricultura ha tenido como uno de sus principales objetivos la reducción del uso de agroquímicos debido a que su aplicación de manera constante ocasiona daños a la salud humana, animal y medio ambiente (Giang et al., 2015). Una alternativa al uso de los agroquímicos es la fertilización biológica, la cual proporciona a las plantas sus requerimientos nutricionales a través de las diversas funciones que presentan algunos microorganismos como hongos y bacterias. Estos microorganismos han demostrado tener la capacidad de promover de manera directa e indirecta el crecimiento vegetal (Abd-Alla, El-Enany, Nafady, Khalaf & Morsy, 2014; Bellone & Carrizo de Bellone, 2012), la mayoría de ellos forman una asociación simbiótica con las raíces de las plantas (Hodge & Storer, 2015).
Entre los microorganismos destacan los hongos micorrízicos arbusculares (HMA), los cuales establecen una simbiosis denominada micorrízica con las raíces de aproximadamente el 80% de las plantas vasculares (Baum, El-Tohamy & Gruda, 2015). Los HMA requieren de la planta hospedera debido al aporte de hidratos de carbono que le proporcionan (Troeh & Loynachan, 2003), a cambio, los HMA le proveen un mayor flujo de nutrientes como el nitrógeno, fósforo, fierro, calcio, potasio, cobre, zinc y agua (Bago, Pfeffer & Shachar-Hill, 2000). La aplicación de HMA en plantas puede realizarse con una sola especie de este simbionte, sin embargo, la inoculación con consorcios de HMA es más eficiente en la promoción del crecimiento, control biológico y productividad de las plantas (Eke et al., 2016). En relación con las bacterias, existen numerosas especies que estimulan el crecimiento de las plantas a través de la síntesis de hormonas reguladoras del crecimiento, fijación de nitrógeno, solubilización de fósforo, producción de sideróforos, entre otros (Vejan, Abdullah, Khadiran, Ismail & Nasrulhaq, 2016). La bacteria Stenotrophomonas rhizophila tiene un gran potencial para promover el crecimiento de las plantas como la soya (Egamberdieva, Jabborova & Berg, 2016), algodón, tomate y chile (Schmidt, Alavi, Cardinale, Müller & Berg, 2012), entre otros. Sin embargo, no existen estudios sobre su aplicación con otros microorganismos en plantas aromáticas; además, solo han sido estudiadas cepas provenientes de raíces de plantas y no de otros ambientes.
La interacción entre HMA y bacterias incrementa las poblaciones de ambos microorganismos en la rizósfera de las plantas, estimulando un incremento en el volumen de raíces que permite una mayor absorción de agua y nutrientes, además de aumentar la solubilización de fósforo, fijación de nitrógeno, inducción de resistencia, se mejora la tolerancia a factores abióticos, entre otros (García-Gutiérrez et al., 2012; Meng et al., 2015). Cuando la inoculación de manera simultánea de HMA y bacterias se realiza en las plantas, existen numerosos reportes sobre la estimulación significativa del crecimiento de garbanzo (Oliveira et al., 2017), maíz (Selvakumar, Kim, Shagol, Joe & Sa, 2017), jitomate (Lira-Saldivar et al., 2014), entre otros. A pesar de que la mayoría de los estudios reportan el uso de HMA y bacterias en cultivos tradicionales, poca es la información generada sobre su aplicación en plantas aromáticas (Singh et al., 2012; Singh, Soni & Kalra, 2013), ya sea de manera individual o en conjunto que permitan mejorar su crecimiento y producción (Wang, Pan, Chen, Yan & Liao, 2011).
La albahaca (Ocimum basilicum L.) es una planta aromática originaria de la India que se produce en climas áridos y semiáridos de todo el mundo. Sus hojas contienen diversas propiedades químicas que permite usarlas en la industria farmacéutica, culinaria, cosmética, de perfumes, entre otros (Lu, Gao, Chen, Charles & Yu, 2014). La superficie sembrada de albahaca en México es de más de 400 ha, de las cuales 208 ha son destinadas para la producción orgánica, 5 ha en invernadero y el resto es bajo el régimen convencional (Juárez-Rosete et al., 2013). En Baja California Sur, se encuentran localizadas el 98% de las has destinadas a la producción de albahaca orgánica, destacando este estado de la República Mexicana debido a que exporta casi la totalidad de la producción, principalmente a Estados Unidos e Italia (Ojeda-Silvera et al., 2015).
Dentro del manejo orgánico de la albahaca está el uso de fertilizantes biológicos, sin embargo, pocos son los estudios enfocados a la aplicación de HMA y bacterias como una alternativa para incrementar la producción de esta hierba aromática (Agüero-Fernández et al., 2016; Singh et al., 2013). El objetivo del presente estudio fue cuantificar el efecto de hongos micorrízicos arbusculares y la bacteria marina Stenotrophomonas rhizophilasobre el crecimiento de plantas de albahaca var. Nufar.
Materiales y métodos
Área de estudio
El experimento se realizó en una estructura con malla anti-áfidos ubicada en el campo experimental El Comitán del Centro de Investigaciones Biológicas del Noroeste S.C. (CIBNOR), localizado en La Paz, Baja California Sur, México a 24° 08' 10'' latitud norte y 110°25' 35'' longitud oeste, a 7 m s.n.m.
Material microbiológico
Se utilizaron dos consorcios de HMA denominados SALCIB01 y ORECIB01. El primero conformado por las especies Funneliformis mosseae, Clareidoglomus etunicatum, Acaulospora morrowiae, Gigaspora sp. Y Glomussp. y el segundo por las especies C. etunicatum, F. mosseae, Gigaspora sp. Y Glomus clarum (Valerio-Landa, 2014), ambos consorcios pertenecen al laboratorio de Fitopatología del CIBNOR. La bacteria marina S. rhizophilacepa RK2, fue previamente aislada de la Salina de Guerrero Negro en Baja California Sur y pertenece a la colección de microorganismos del laboratorio de Fitopatología del CIBNOR.
Actividad de ACC desaminasa
La bacteria marina S. rhizophila se estrió en cajas de Petri con medio mínimo Dworkin y Foster (DF) (Penrose & Glick, 2003), el cual contenía 0.3 g/L de 1-aminociclopropano-1-carboxilico (ACC) como única fuente de nitrógeno. Las cajas de Petri fueron incubadas por 72 h a 30 °C. Se determinó la actividad de ACC desaminasa como positiva, si la bacteria fue capaz de crecer en el medio DF (Sgroy et al., 2009).
Fijación biológica de nitrógeno
Para determinar de manera indirecta la fijación biológica de nitrógeno (FBN), la bacteria marina fue sembrada por punción en cajas de Petri conteniendo el medio semisólido FBN libre de nitrógeno. La FBN es positiva si la bacteria es capaz de crecer en ausencia de nitrógeno mineral (Naher, Radziah, Shamsuddin, Halimi & Razi, 2009).
Semilla
Se utilizaron semillas de albahaca de la var. Nufar (Vis Seed Company®, Arcadia, California, USA).
Sustrato
El sustrato consistió en una mezcla de suelo y un sustrato comercial denominado Cosmopeat en una proporción de 2:3 (v/v), la cual fue previamente esterilizada en autoclave a 121 °C con 14 lb/pulg2 - 15 lb/pulg2 de presión de vapor por 15 min y aireada durante dos días consecutivos. Antes del experimento, al sustrato se le determinó su contenido mineral en el laboratorio de Edafología del CIBNOR, conteniendo 5.6% de materia orgánica (método AS-07 de la NOM-021-RECNAT-2000, Diario Oficial de la Federación [DOF], 2002), 11.4 mg/kg de calcio (Jackson, 1958), 2.8 mg/kg de magnesio (Jackson, 1958), 18.3 mg/kg de fósforo (Jackson, 1976), 4.7 mg/kg de nitrógeno (Solorzano, 1969) y 9.2 mg/kg de azufre (Chesnin & Yien, 1950).
Producción de plántulas
Se llenaron con sustrato estéril bandejas con 200 cavidades, depositando una semilla en cada cavidad. A los 20 días después de la siembra, y una vez que las plántulas presentaron su segundo par de hojas, fueron trasplantadas en macetas de 2 L que contienen 1.8 kg del sustrato estéril. La temperatura media durante el periodo de experimentación fue de 25.1 °C ± 5.6 °C y una humedad relativa del 61% ± 11.7% (datos obtenidos a traves de una estación meteorológica portátil, Vantage Pro2 ® Davis Instruments, USA).
Inoculación de plántulas
Cada planta de albahaca se inoculó con 10 g de cada consorcio de HMA que contenía 180 esporas de SALCIB01 y 196 esporas de ORECIB01. Para los tratamientos que incluían a la bacteria, previamente se cultivó S. rhizophilaen medio CST a 27 °C por 12 h a 100 rpm. Posteriomente, se ajustó su concentracción a 108 células/ml utilizando un espetrofotometro UV (Spectrophotometer visible 1104 RS) a 660 nm y absorbancia de 1. Se inoculó 1 mL directo a las raíces de cada plántula de albahaca.
Trasplante e inoculación de microorganismos
Al momento del trasplante, cada plántula de albahaca fue inoculada con cada consorcio de HMA, la bacteria marina S. rhizophila y HMA+bacteria. El tratamiento control consistió de un lote de plantas sin microorganismos. Todas las plantas se regaron con agua destilada estéril cada tercer día. Las macetas fueron colocadas al azar dentro de una estructura con malla anti-áfidos en un invernadero a 30 °C ± 3 °C. A los 60 días después de inoculadas las plantas con los microorganismos, se determinó la altura de planta (cm), longitud de tallo y raíz (mm), área foliar (cm2), biomasa fresca y seca (g), clorofila a, b (mg/cm-2) y total (mg/mL). Se realizaron cinco repeticiones por tratamiento y cada repetición contenía dos unidades experimentales.
Colonización de HMA
Al final del experimento, se evaluó el porcentaje de colonización de HMA y el número de esporas de cada planta. Para la determinación de la colonización, se tomaron y lavaron 2 g de raíces de cada planta y se procedió a su clareo y tinción mediante la metodología propuesta por Phillips & Hayman (1970) modificado por Koske & Gemma (1989). Posteriormente, se determinó el porcentaje de colonización, siguiendo el método de intersección de la cuadrícula de línea descrita por Giovannetti & Mosse (1980). Para el número de esporas se tomó de cada planta una muestra de 10 g de suelo homogeneizado y se realizó la extracción de esporas mediante el método de gradiente de sacarosa determinando el número de esporas/g de suelo (International Culture Collection of (Vesicular) Arbuscular Mycorrhizal Fungi [Invam], 2014).
Población de S. rhizophila
Se tomaron 10 g de raíz de cada planta, se maceraron y se realizaron dilusiones seriadas que fueron estriadas en cajas de Petri conteniendo medio AST. Las cajas de Petri fueron incubadas a 27 °C por 12 h. La población de la bacteria fue expresa en Unidades Formadoras de Colonias (UFC).
Resultados
Caracterización de S. rhizophila como promotora del crecimiento vegetal
El crecimiento de la bacteria marina S. rhizophila en el medio DF determinó de manera positiva (+) la actividad de ACC desaminasa. En cambio, no se observó presencia celular de S. rhizophila en el medio FBN, por lo que la actividad de la fijación biológica de nitrógeno fue negativa (-).
Parámetros morfométricos de plantas de albahaca inoculada con microorganismos
Se encontraron diferencias significativas entre las variables morfológicas de las plantas de albahaca inoculadas con los consorcios de HMA y la bacteria marina S. rhizophila (cepa RK2) (Tabla 1). Para altura, el mejor tratamiento fue la co-inoculación con ORECIB01 y la bacteria, seguido del tratamiento SALCIB01 más la bacteria con un incremento del 29% y 25%, respectivamente, en comparación con el tratamiento control. La inoculación de la albahaca solo con HMA o bacteria, superaron en altura al tratamiento sin microorganismos (Figura 1). En longitud de tallo, todos los tratamientos con HMA y bacteria respondieron igual; sin embargo, superaron a las plantas control. Con relación a la variable longitud de raíz, las plantas inoculadas con los consorcios ORECIB01 y SALCIB01 más la bacteria incrementaron un 19% y 17%, respectivamente, en comparación al tratamiento control. Para la biomasa fresca y seca, la co-inoculación ORECIB01 más la bacteria incrementó un 9% y 48%, respectivamente. Finalmente, las plantas co-inoculadas con ambos consorcios de HMA más bacteria, incrementaron su área foliar en un 19% con ORECIB01 y un 17% con SALCIB01, en comparación a las plantas control.
Tabla 1 Variables morfológicas evaluadas en plantas de albahaca inoculadas con HMA y una bacteria marina.
| Tratamiento | Altura (cm) | Longitud de tallo (cm) | Longitud de raíz (cm) | Biomasa fresca (g) | Biomasa fresca (g) | Área foliar (cm2) |
|---|---|---|---|---|---|---|
| ORECIB01β | 39.4 ± 0.47bc€ | 32.5 ± 0.37a | 40.5 ± 0.52c | 91.06 ± 0.6c | 13.81 ± 0.3bc | 1198.6 ± 0.4d |
| SALCIB01£ | 38.2 ± 0.45c | 32.1 ± 0.41a | 40.1 ± 0.55c | 91.96 ± 0.44c | 13.63 ± 0.6c | 1121.4 ± 0.63e |
| RK2¥ | 38.3 ± 0.51c | 32.7 ± 0.52a | 38.5 ± 0.4d | 90.74 ± 0.5d | 12.58 ± 0.5d | 1228.3 ± 0.41c |
| ORECIB01+RK2 | 41.7 ± 0.43a | 32.2 ± 0.6a | 42.2 ± 0.61a | 94.78 ± 0.39a | 15.06 ± 0.37a | 1284.4 ± 0.52a |
| SALCIB01+RK2 | 40.4 ± 0.38ab | 32.5 ± 0.5a | 41.5 ± 0.5ab | 93.51 ± 0.5b | 14.54 ± 0.3ab | 1261.7 ± 0.48b |
| Control | 32.2 ± 0.61d | 30.9 ± 0.57b | 35.3 ± 0.53e | 86.32 ± 0.48e | 10.15 ± 0.5e | 1071.4 ± 0.51f |
β Consorcio de HMA conformado por las especies C. etunicatum, F. mosseae, Gigaspora sp. Y G. clarum.
£Consorcio de HMA conformado por las especies F. mosseae, C. etunicatum, A. morrowiae, Gigasporasp. Y Glomus sp.
¥Cepa de la bacteria marina S. rhizophila.
€Todos los valores están expresados como la media ± DE (n = 10). Columnas con diferentes letras fueron significativamente diferentes por la prueba LSD de Fisher (p < 0.05).
Fuente: Elaboración propia.
Contenido de clorofila en hojas de albahaca
La inoculación de los consorcios ORECIB01 y SALCIB01 y la bacteria marina S. rhizophila (cepa RK2) en las plantas de albahaca provocaron diferencias significativas en el contenido de clorofila a, b y total (Tabla 2). La co-inoculación de ORECIB01 más bacteria y de SALCIB01 más bacteria incrementaron el contenido de clorofila a en un 37% y 31%, respectivamente, la clorofila b en un 61% y 56% respectivamente, y la clorofila total en un 47% y 42%, respectivamente.
Tabla 2 Determinación de clorofila en plantas de albahaca inoculada con HMA y una bacteria marina
| Tratamiento | Clorofila a (mg/cm-2) | Clorofila b (mg/cm-2) | Clorofila total (mg/mL) |
|---|---|---|---|
| ORECIB01β | 3.94 ± 0.34b€ | 1.19 ± 0.47b | 4.93 ± 0.42b |
| SALCIB01£ | 3.91 ± 0.53b | 1.07 ± 0.5b | 4.58 ± 0.4b |
| RK2¥ | 3.95 ± 0.6b | 1.03 ± 0.5b | 4.98 ± 0.39b |
| ORECIB01+RK2 | 4.42 ± 0.61a | 2.93 ± 0.39a | 6.36 ± 0.59a |
| SALCIB01+RK2 | 4.22 ± 0.49a | 2.87 ± 0.43a | 6.15 ± 0.66a |
| Control | 3.21 ± 0.58bc | 1.12 ± 0.61b | 4.32 ± 0.39bc |
€Todos los valores están expresados como la media ± DE (n = 10). Columnas con diferentes letras fueron significativamente diferente por la prueba LSD de Fisher (p < 0.05).
Fuente: Elaboración propia.
Colonización micorrízica arbuscular
Existieron diferencias significativas en el porcentaje de colonización micorrízica (Figura 2) y el número de esporas de los consorcios ORECIB01 y SALCIB01 co-inoculados con la bacteria marina S. rhizophila en las plantas de albahaca (Figura 2a, 2b). Las plantas co-inoculadas con ORECIB01 más la bacteria marina (RK2) aumentaron un 64% el porcentaje de colonización y un 81% el número de esporas/g de suelo en comparación al tratamiento de plantas inoculadas solo con el consorcio de HMA. Las plantas co-inoculadas con SALCIB01 más la bacteria aumentaron un 35% el porcentaje de colonización y un 66% el número de esporas (Figura 3).
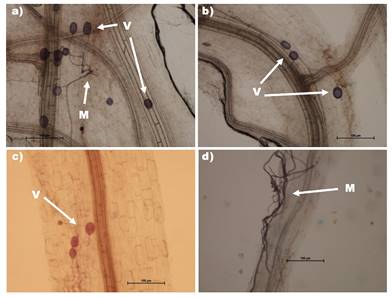
Fuente: Elaboración propia.
Figura 2 Colonización de HMA sobre la raíz de plantas de albahaca después de 60 días de la inoculación. a) Vesículas (V) y micelio (M) en el tratamiento de co-inoculación con ORECIB01+RK2; b) Vesículas (V) en el tratamiento de co-inoculación con SALCIB01+RK2; c) Vesículas (V) en el tratamiento solo con ORECIB01 y d) Micelio (M) en el tratamiento ORECIB01.
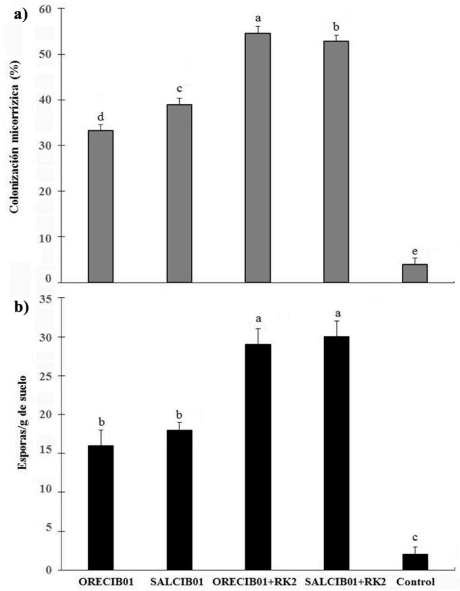
Fuente: Elaboración propia.
Figura 3 Colonización micorrízica en plantas de albahaca co-inoculadas con S. rhizophila. Porcentaje de colonización micorrízica (a) y esporas/g de suelo (b) en plantas inoculadas con ORECIB01 y SALCIB01 = Consorcios de HMA, RK2 = Bacteria marina S. rhizophila y Control = Plantas sin microorganismo. Las barras de los errores indican la desviación estándar (DE) de n = 10. Columnas con diferentes letras fueron significativamente diferente por la prueba LSD de Fisher (p < 0.05).
Población bacteriana
Hubo diferencias significativas en la población de S. rhizophila (RK2) cuando fue co-inoculada con los consorcios ORECIB01 y SALCIB01 en las plantas de albahaca (Figura 4). Las plantas co-inoculadas con RK2 más ORECIB01 aumentaron un 60% su población bacteriana en comparación al tratamiento de plantas inoculadas solo con la bacteria marina.
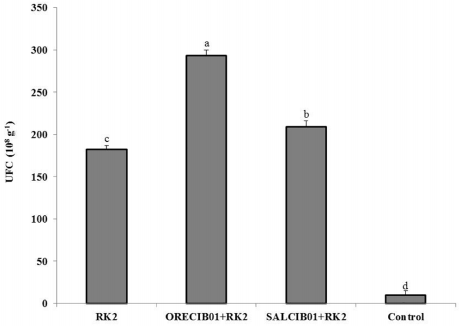
Fuente: Elaboración propia.
Figura 4 Población de S. rhizophila en raíz de plantas de albahaca después de 56 días de la inoculación. Plantas inoculadas solo con la bacteria marina (RK2), con HMA más bacteria (ORECIB01+RK2 y SALCIB01+RK2) y plantas sin microorganismos (control). Las barras de los errores indican la desviación estándar (DE) de n = 10. Columnas con diferentes letras fueron significativamente diferente por la prueba LSD de Fisher (p < 0.05).
Discusión
Las bacterias promueven el crecimiento de las plantas por diferentes mecanismos (Glick, 2012), sin embargo, la característica clave de las bacterias que promocionan el crecimiento vegetal es la capacidad de producir la enzima desaminasa del ácido 1-aminociclopropano-1-carboxílico (ACC) (Glick, 2014). Esta enzima es responsable de degradar el ACC, precursor del etileno en α-cetobutirato y amonio (Glick, 2005). Al disminuir los niveles de ACC desaminasa en las plantas se estimula el crecimiento vegetal; además, con la generación de amonio, las plantas disponen de una fuente extra de nitrógeno (Glick, Cheng, Czarny & Duan, 2007). Entre las bacterias productoras de ACC desaminasa destacan Pseudomonas putida, P. fluorescens (Etesami, Hosseini, Alikhani & Mohammadi, 2014), Rhizobium leguminosarum (Kumar, Dubey, Maheshwari & Bajpai, 2016), P. aeruginosa, Stenotrophomonas maltophilia y Bacillus subtilis (Patil, Suryawanshi, Koli & Patil, 2016), entre otras. Este es el primer reporte de una cepa marina deS. rhizophila productora de ACC desaminasa.
La co-inoculación de los consorcios ORECIB01 y SALCIB01 de HMA y la bacteria S. rhizopila en las plantas de albahaca promovieron significativamente una mayor altura, longitud de tallo y raíz, biomasa y área foliar. Este incremento en el crecimiento de la albahaca es el resultado de la simbiosis mutualista tripartita entre HMA-bacteria-hospedero, la cual aumenta particularmente la capacidad de las plantas para absorver del suelo más agua y nutrientes como el nitrógeno, fósforo, potasio y micro-elementos (Abd-Alla et al., 2014; Bona et al., 2017). Los resultados obtenidos coinciden con el estudio realizado por Hemavathi, Shivakumar, Suresh & Earanna (2006), quienes reportaron un aumento en el crecimiento y rendimiento de la biomasa de albahaca co-inoculada con el HMA Glomus fasciculatum y las bacterias B. megaterium y P. fluorescens. Por su parte Abdel-Rahman, Abdel-Kader & Khalil (2011) encontraron que el efecto de la co-inoculación de G. irradicans y B. subtilis incrementó la altura y el número de ramas de tres variedades de albahaca, superando a los tratamientos donde solo se inoculó cada microorganismo.
En relación al contenido de clorofila en albahaca, Vafadar, Amooaghaie & Otroshy (2014) mencionan que esta variable se acrecenta en las plantas debido al aumento de biomasa vegetal promovida por la inoculación con HMA y bacterias. Los resultados en área foliar, biomasa fresca y seca y contenido de clorofila, en este trabajo, resultan importantes si consideramos que dentro de las características que se buscan en la albahaca para su comercialización en fresco son hojas que visualmente tengan una apariencia de frescura, una uniformidad de tamaño, color verde, hojas grandes, entre otros, que permiten alcanzar los mejores precios en el mercado internacional (Bekhradi et al., 2015).
Diversos estudios han mostrado que comunidades de diversas bacterias asociadas a HMA potencian la micorrización y el crecimiento de las plantas (Agnolucci, Battini, Cristani & Giovannetti, 2015; Singh et al., 2013). Esta interacción entre HMA-bacteria incrementa la colonización de ambos microrganismos en el hospedero debido a que, por una parte, se aumenta la germinación y crecimiento de las hifas de los endofitos y, por otra, se acrecenta la población de bacterias en la rizósfera de las plantas en presencia de los HMA (Fernández et al. 2016; Long, Lin, Yao & Zhu, 2017). En este estudio, el aumento de la población de HMA y S. rhizophila después de las co-inoculaciónes de albahaca, en comparación con las inoculaciones simples, probablemente contribuyeron a mejorar el crecimiento y contenido de clorofila en las plantas; por consiguiente, la bacteria marina S. rhizophilapodría ser designada como bacteria ayudante de la micorrización (termino conocido como mycorrhiza helper bacteria, MHB) (Kataoka & Futai, 2009).
Conclusión
La co-inoculación de HMA y la bacteria marina S. rhizophila en plantas de albahaca promovieron el mayor crecimiento y contenido de clorofila, en comparación con las inoculaciones individiales de ambos microorganismos. Las plantas co-inoculadas con HMA y bacteria tuvieron una mayor área foliar, biomasa fresca y seca y contenido de clorofila, características importantes que son determinantes para su venta en el mercado internacional. La fertilización biológica con HMA y S. rhizophila en plantas de albahaca puede ser una opción viable en el manejo orgánico y sustentable del cultivo.











 nueva página del texto (beta)
nueva página del texto (beta)



