INTRODUCCIÓN
Las raíces secretan una amplia gama de compuestos químicos que juegan un papel importante en las interacciones con la comunidad microbiana y en los cambios de las propiedades físicas del suelo. Las condiciones del suelo y las interacciones microbianas que aquí tienen lugar están involucradas tanto en el aumento de la actividad microbiana para el control de patógenos, como en el proceso de infección ocasionada por los fitopatógenos (Bais, Weir, Perry, Gilroy & Vivanco, 2006; Berendsen, Pieterse & Bakker, 2012; Walker, Bais, Grotewold & Vivanco, 2003; Whipps, 2001). El estudio de estas comunidades de la rizósfera son importantes para desarrollar prácticas de manejo sustentables y productos agrícolas como biopesticidas (Huang et al., 2014).
Algunos cultivos de importancia económica como el nogal, cultivado en los estados del norte de México, se ven afectados por la enfermedad conocida como “pudrición texana”, ocasionada por el hongo Phymatotrichopsis omnívora que afecta la productividad y llega a ocasionar la muerte de las plantas (Hernández, 2002; Samaniego-Gaxiola & Herrera-Pérez, 2003); el nogal es un cultivo importante a nivel estatal, generándose pérdidas económicas (Samaniego, Herrera, Pedraza, Jimenez & Chew, 2003; Tarango, 2006; Tood et al., 2007). Las pérdidas anuales ocasionadas por este patógeno han sido calculadas en aproximadamente un millón de dólares, debido a la reducción en la producción de nuez en árboles afectados por este hongo (Samaniego et al., 2003). Se estima que podría haber alrededor de 350 000 árboles de nogal infectados con Phymatotrichopsis omnívora en el norte de México (Samaniego-Gaxiola, 2007).
No existe un método de control eficiente para este patógeno (Cook, Riggs, Smart & Mullin-Schading, 1995; Rush, Gerlk & Lyda, 1984), por un lado, el control químico, que además de los problemas de contaminación ambiental que traen consigo la aplicación de fungicidas, es caro, y la práctica de rotación de cultivos poco eficiente debido al tiempo de sobrevivencia de los esclerocios (Adam et al., 2013; Uppalapati, Young, Marek & Mysore, 2010; Yoder et al., 2013). Las asociaciones de las raíces con los microorganismos favorecen a la planta, ya que muchos microorganismos producen ciertas sustancias con capacidad de inhibir el desarrollo de otros microorganismos que pudieran ser patógenos para la planta (Berendsen et al., 2012), por lo que algunos de estos microorganismos son utilizados como agentes de biocontrol (Ibarra et al., 2006; Lutz, Wenger, Maurhofer, Defago & Duffy, 2004; Whipps, 2001). Existen gran cantidad de microorganismos antagonistas aislados de las raíces y utilizados para el control de enfermedades fungosas y bacterianas de diversos cultivos (Aquino-Martínez, Vázquez-García & Reyes-Reyes, 2008; Hernández-Rodríguez, Heydrich-Pérez, Velázquez del Valle & Hernández-Lauzardo, 2006; Paredes et al., 2009; Taechowisan, Lu, Shen & Lumyoung, 2005), sin embargo, para P. omnivoraaún no existe un microorganismo capaz de controlarlo efectivamente, por lo que este trabajo tiene como objetivo identificar aquellas bacterias que puedan ser antagónicas para su posterior uso como control biológico de este hongo.
MATERIALES Y MÉTODOS
Aislamiento de bacterias
Para el aislamiento de las bacterias se muestrearon raíces de árboles de durazno (Prunus pérsica), nogal (Juglands regia), vid (Vitis vinífera), manzano (Malus domestica), olmo (Ulmus spp.) y olivo (Olea europaea), infectados de forma natural por el hongo P. omnivora. Las raíces se lavaron con agua corriente para eliminar el exceso de suelo y se colocaron por separado en un matraz EM con caldo nutritivo. Estas se agitaron por 5 min y se incubaron durante 24 h, a 28 °C. De cada matraz se realizaron seis diluciones seriadas en buffer de fosfatos; de las tres últimas diluciones se tomó 0.1 mL y se colocó en cajas de Petri con agar nutritivo. La muestra se extendió con la ayuda de la varilla de Digralsky. Las cajas se incubaron por 48 h a 28 °C.
Los microorganismos que fueron observados con morfología colonial diferente, se separaron para obtener un cultivo puro. Cada cultivo fue identificado mediante un número junto con la inicial del nombre del frutal de dónde provenía. Una vez obtenidos los microorganismos en cultivo puro, se les realizó la tinción de Gram y se observaron con un microscopio óptico para comprobar la pureza del cultivo. Para realizar las pruebas de antagonismo, se tomó una asada de cada microorganismo obtenido, y se colocaron en tubos de ensaye con caldo nutritivo y círculos de papel filtro de 5 mm de diámetro, con la finalidad de que los microorganismos se adhirieran al papel filtro e inmediatamente realizar las pruebas de antagonismo.
Pruebas de antagonismo
Se colocó en el centro de cajas de Petri con medio de cultivo de agar de dextrosa y papa (PDA, por sus siglas en inglés) un círculo de agar con micelio de P. omnivora, y a 2.0 cm de distancia se colocaron cuatro círculos de papel filtro, tres provenientes del caldo nutritivo impregnado con las bacterias a probar y un círculo impregnado únicamente con caldo nutritivo estéril como testigo. Las pruebas se realizaron por triplicado. Aparte en otra caja de Petri, se colocó en el centro un círculo de agar con crecimiento micelial de P. omnívora para utilizarlo como referencia de crecimiento del hongo. Las cajas se incubaron a 28 °C hasta que el crecimiento del hongo de la caja de referencia cubrió toda la superficie. En este momento se tomó como un 100% de crecimiento para compararlo con el desarrollo en las cajas de las pruebas de antagonismo. A los ocho días de incubación a 28 °C, el hongo testigo cubrió la totalidad de la caja, por lo que se realizaron las mediciones de: el halo de inhibición, es decir, la distancia que separa al hongo del antagonista; del crecimiento radial de la colonia del hongo y el crecimiento radial de la colonia del antagonista. Para determinar la eficiencia del antagonista en la inhibición del hongo, se utilizó la fórmula de Aquino et al. (2008): % EA = (CRA-CRP/CRA) × 100, donde: % EA = Eficiencia del antagonista, CRA = Crecimiento radial del antagonista (cm), CRP = Crecimiento radial del patógeno (cm). Además, se realizó el análisis estadístico análisis de varianza (Anava) para el diseño completamente al azar con comparación de medias de Tukey utilizando un nivel de significancia de 0.05, para obtener las cepas que presentaron mejor inhibición del hongo.
Bioensayos en semillas de algodón en cultivo in vitro
Se probaron algunas de las cepas que presentaron algún grado de inhibición las cuales fueron cultivadas en caldo nutritivo, posteriormente se sumergieron semillas de algodón en este cultivo. Previamente las semillas fueron desinfectadas con hipoclorito de sodio al 10%, enjuagadas con agua destilada estéril y finalmente sumergidas durante 5 min en el caldo nutritivo de crecimiento de las cepas (Lagunas et al., 2001). Enseguida las semillas se colocaron en tubos de ensaye que contenían medio de cultivo de Murashige y Skoog (MS) (Murashigue & Skoog, 1962) inoculado con P. omnivora. Se realizaron dos bioensayos: en el primero se colocaron el hongo y la semilla el mismo día, mientras que el segundo se sembró el hongo y cinco días después se sembró la semilla. Las cepas probadas fueron: a) manzano 1 y 2 (M1) y (M2), nogal 8, 13, 14 y 15 (N8, N14, N15), vid 1 y 2 (V1, V2), b) medio de cultivo con inóculo del hongo y c) semillas sin inóculo como testigos (sumergidas en agua estéril). Cada tratamiento consistió de diez repeticiones. Se evaluó la sobrevivencia de la planta a los veinte días de siembra.
Identificación molecular
Después de obtener el DNA genómico, se amplificó la región del RNAr 16S de las tres cepas que mostraron mejores resultados de inhibición. Los primers utilizados para la amplificación de la región 1135 pb fueron 357F (5´ CTCCTCGGGAGGCAGCAG´3) y 1492R (CGGCTACCTTGTTACGACTT)y posteriormente las muestras fueron enviadas para su secuenciación al Instituto de Biotecnología de la Universidad Nacional Autónoma de México (UNAM). El fragmento fue secuenciado en ambas direcciones. Los resultados de los electroferogramas fueron analizados con el software 4Peaks. Una vez que se obtuvieron las secuencias de cada electroferograma para cada cepa, se alineo el par de secuencias con el software Blast del Centro Nacional para la Información Biotecnológica (NCBI, por sus siglas en inglés), esto con el fin de eliminar aquellas bases erróneas o bien para insertar las bases faltantes, esto es lo que comúnmente se denomina limpieza de la secuencia.
El análisis bioinformático para identificar el género y especie de cada una de las cepas analizadas se realizó a través de dos programas Ribosomal Database Project(https://rdp.cme.msu.edu/) y Blast (nucleotide-nucleotide) del NCBI (https://blast.ncbi.nlm.nih.gov)
RESULTADOS
Aislamiento de microorganismos antagonistas
De las raíces de las cinco diferentes especies con presencia de P. omnivora, se obtuvo un total de 88 aislados bacterianos, esta diferencia se determinó mediante la observación de las características morfológicas coloniales. La tinción de Gram mostró bacterias tipo bacilo G (+) y G (-), en donde se observó que las G (+) mostraron los mejores halos de inhibición. La morfología colonial de estas bacterias mostró características típicas del género Bacillus, es decir, colonias blancas opacas, aplanadas y de bordes irregulares, mientras que las características microscópicas son formas bacilares Gram positivo. El número de microorganismos aislados fue diferente para cada raíz, así como el número de cepas encontradas con capacidad de inhibir al hongo (Tabla 1).
Tabla 1 Número de cepas aisladas de raíces de diversos cultivos y cantidad de cepas inhibidoras de Phymatotrichopsis omnivora
| Árbol de Procedencia | Cepas bacterianas aisladas | Cepas que producen inhibición |
|---|---|---|
| Durazno | 18 | 0 |
| Nogal | 14 | 6 |
| Olmo | 23 | 2 |
| Olivo | 11 | 1 |
| Vid | 13 | 2 |
| Manzano | 9 | 2 |
| Total | 88 | 13 |
Fuente: Elaboración propia.
Evaluación de la capacidad de antagonismo de las cepas bacterianas
A los 7 días de incubación, 13 de las 88 cepas bacterianas probadas mostraron capacidad de inhibición in vitro del desarrollo micelial. Los resultados de los análisis estadísticos indicaron que la mejor inhibición del hongo la presentaron las cepas aisladas del nogal (N15 y N8) con un 80% y 90% de inhibición respectivamente (Figura 1). Se observó además que el crecimiento de cada cepa alrededor del círculo de papel filtro fue diferente, es decir, el crecimiento se extendió desde 1.72 cm alrededor del círculo, hasta los 2.87 cm de crecimiento y, aunque el crecimiento fuera abundante, los resultados estadísticos no indicaron que fuera el que proporcionó mejor inhibición (Tabla 2). Esto concuerda con lo señalado por Duffy, Schouten & Raaijmakers (2003), que, así como los antagonistas microbianos poseen mecanismos para dominar las interacciones con los patógenos, los patógenos tienen diversas respuestas para contrarrestar el antagonismo.
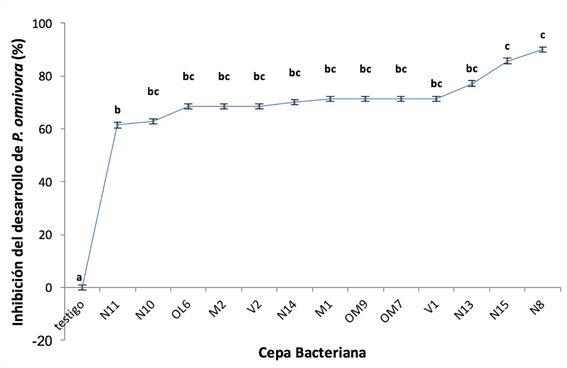
Fuente: Elaboración propia.
Figura 1 Frecuencia de individuos de acuerdo con la altura (m) en ANT (área testigo), AQP (área de quema prescrita), AIC (área de incendio conducido) y AI (área de incendio forestal).
Tabla 2 Crecimiento del hongo P. omnivora y de las cepas antagonistas
| Cepa | Crecimiento del hongo en cm | Crecimiento antagonista en cm |
|---|---|---|
| M1 | 2.1 | 2.37 |
| M2 | 2.2 | 2.18 |
| N8 | 1.5 | 2.31 |
| N10 | 2.3 | 1.78 |
| N11 | 2 | 1.77 |
| N13 | 1.3 | 2.82 |
| N14 | 1.9 | 2 |
| N15 | 1.3 | 2..80 |
| Ol6 | 2.2 | 2 |
| Om7 | 2.1 | 1.95 |
| Om9 | 2.3 | 2.14 |
| V1 | 2 | 1.97 |
| V2 | 2.2 | 1.97 |
Fuente: Elaboración propia.
Bioensayos en semillas de algodón en cultivo in vitro
Se observa cierta efectividad en la protección de las plantas cultivadas in vitro en la algunos de los tratamientos. Las cepas M1, N8 y N15 presentaron actividad protectora de la semilla para ambos tratamientos, aquí se obtuvo el mayor número de plantas sobrevivientes en comparación con las plantas sin tratamiento para ambos ensayos (Tabla 3). De forma global se aprecia que el mayor número de plantas sobrevivientes se presentó cuando se sembraron las semillas cinco días después de haber sembrado el hongo, sin embargo, cuando se sembraron al mismo tiempo, se tuvo una protección del 100% y 87% con las cepas M1 y N8 respectivamente (Tabla 3).
Tabla 3 Plantas tratadas con cepas antagonistas sobrevivientes a P. omnívora
| Número de cepa | Número de plantas sobrevivientes %* | Número de plantas sobrevivientes %** |
|---|---|---|
| M1 | 100.0 | 44.4 |
| M2 | 0.0 | 33.3 |
| N8 | 87.0 | 77.7 |
| N13 | 0 | 22.2 |
| N14 | 5.0 | 11.1 |
| N15 | 25.0 | 22.2 |
| V1 | 0.0 | 22.2 |
| V2 | 0.0 | 11.1 |
| Testigo s/hongo | 100.0 | 100.0 |
| Testigo c/hongo | 12.5 | 22.2 |
*El hongo y las semillas tratadas con el microorganismo a probar se sembraron el mismo día.
**El hongo se sembró cinco días antes de colocar las semillas tratadas con el microorganismo a probar.
Fuente: Elaboración propia.
DISCUSIÓN
Los resultados de este estudio determinaron que las cepas M1, N8 y N15, identificada como B. subtillis presentaron inhibición hacia P. omnivora, lo cual concuerda con otros estudios relacionados con el aislamiento de microorganismos del suelo, en donde se observa mayormente la presencia de Bacillus así como su capacidad de inhibir microorganismos fitopatógenos, como P. omnivora, ya sea por competencia de espacio y nutrientes (Swain & Ray, 2007), o por la capacidad que tienen estas bacterias de sintetizar moléculas antifúngicas (Benítez, Bentley, Bustamante, Consuelo-Sánchez & Corrales, 2007; Layton, Monroy, Maldonado, Corrales & Sánchez, 2011; López-Valenzuela et al., 2015; Sarabia, Pedraza, Trujillo & Abud, 2010). El desarrollo bacteriano abundante no tiene influencia directa en la inhibición del hongo, ya que en este estudio las dos cepas que presentaron estadísticamente la mejor inhibición (N15 y N8) no necesariamente fueron las que presentaron un mejor crecimiento, ya que la N11 presenta un desarrollo colonial un poco menor e inhibió el desarrollo del hongo aunque no significancia estadística, de acuerdo con Cano (2011) puede ser debido a que existen factores que pueden modificar las interacciones entre microorganismos ya que manejan diversos tipos, modos y mecanismos de acción, relacionados con la competencia por espacio y nutrientes.
CONCLUSIONES
La cepa de Bacillus subtilis N8 y N15 son las que provoca la mayor disminución del micelio del P. omnivora. Las cepas de Bacillus subtilis M1 evaluadas con semillas de algodón probadas en cultivo in vitro, ofreció la mejor protección contra la enfermedad ocasionada por P. omnivora. Utilizando los organismos que comparten el mismo medio ambiente se puede tener un manejo integrado y disminuir el uso de agroquímicos evitando el daño que ocasionan al medio ambiente.











 nueva página del texto (beta)
nueva página del texto (beta)


