INTRODUCCIÓN
El tomate de cáscara (Physalis ixocarpa Brot.) ocupa el cuarto lugar en cuanto a superficie cultivada en México, solo es superado por papa, jitomate y chile. La producción de tomate verde de cáscara representa el 4.25% de la superficie total de hortalizas a nivel nacional, teniendo un crecimiento promedio anual de 4.4%. Alrededor del 81% del tomate producido es bajo condiciones de riego, el resto 19% es de temporal. Los principales productores de tomate son: Sinaloa, Zacatecas, Puebla, Michoacán, Jalisco y México (Sistema de Información Agroalimentaria y Pesquera [SIAP], 2016).
Uno de los principales problemas que enfrentan los productores de tomate son las patologías que se presentan cada ciclo, una de ellas se caracteriza por la presencia de plantas que envejecen antes de tiempo. Recientemente (Liefting, Perez-Egusquiza, Clover & Anderson, 2008) determinaron que dichos síntomas están asociados con una nueva bacteria cuyo nombre propuesto es Candidatus liberibacter solanacearum, la cual parece ser la misma bacteria que causa el amarillamiento de los psílidos en tomate (Lycopersicum esculentum Mill.) y chile (Capsicum annum L.). De acuerdo con los investigadores referidos, esta nueva bacteria es transmitida por el psílido Bactericera cockerelli Sulc., que es un insecto ampliamente distribuido en la mayoría de las zonas agrícolas de México. Este psílido es responsable de que los rendimientos disminuyan hasta un 60% comparado con el rendimiento esperado, además que el control químico conlleva un alto gasto, ya que se realizan aplicaciones generalizadas. Por lo tanto, el monitoreo de las poblaciones de huevos de B. cockerelli es un procedimiento muy importante en el manejo de este problema, ya que con ello se puede tener un panorama de cómo se distribuirá la plaga dentro de las parcelas de estudio. Para poder utilizar adecuadamente la información derivada del monitoreo es necesario establecer puntos de muestreo que generen datos fehacientes con los cuales se podrá visualizar el comportamiento espacial de B. cockerelli. La infestación de este insecto-plaga hace importante implementar actividades que permitan conocer su ubicación dentro de las parcelas de tomate de cáscara; por lo tanto, el objetivo de este trabajo fue determinar el comportamiento espacial de las poblaciones de huevos de Bactericera cockerelli Sulc. en el cultivo de tomate de cáscara (Physalis ixocarpa Brot.).
MATERIALES Y MÉTODOS
El estudio se llevó a cabo en el municipio de Luvianos, principal productor de tomate de cáscara del Estado de México (SIAP, 2016), el cual se encuentra ubicado en la parte sur del Estado de México, está comprendido entre los paralelos 18° 55' 30" de latitud norte y 100° 18" de longitud oeste, del meridiano de Greenwich, se encuentra a una altura de 1300 msnm, con temperatura promedio de 25 ° y precipitación que va de 800 mm a 1500 mm.
Para el estudio del comportamiento espacial de las poblaciones de huevos de B. cockerelli se establecieron cuatro parcelas experimentales de una hectárea cada una, de la variedad Mahone, la cual presenta un buen rendimiento en la zona de estudio, el fruto alcanza los 35 mm de diámetro y de 40 mm a 43 mm de ancho, la altura de planta alcanza un promedio de 1.5 m. Las parcelas se ubicaron en diferentes lugares dentro del municipio, con un manejo agronómico similar, bajo condiciones climáticas similares y con un suelo de tipo regosol, en la cuales no se aplicaban insecticidas, utilizando únicamente el control cultural y mecánico.
El muestreo que se utilizó fue el de transectos, en el cual se estableció una malla rectangular de 100 m y se muestreó a cada 10 m en ambas direcciones, de este modo se muestrearon 121 plantas en cada parcela. En cada planta muestreada se tomaron cinco hojas en los diferentes estratos y se contó la cantidad de huevos presentes en cada hoja. Cada planta fue debidamente etiquetada para conocer su posición exacta, con un navegador modelo eTrex Vista HC × 2007 (Ramírez, Porcayo & Sánchez, 2011). Los muestreos se realizaron cada mes, el primer muestreo se realizó cuando el cultivo se encontraba en etapa de floración y los siguientes se llevaron a cabo cuando el cultivo estaba en producción.
Se realizó un análisis estadístico de los datos originales de las poblaciones de huevos de B. cockerelli en los muestreos correspondientes a cada una de las parcelas, se calculó el estadístico de curtosis, el cual mide el grado en que las observaciones están agrupadas en los extremos de la curva de la distribución de datos, cabe señalar que para establecer normalidad los valores del coeficiente de curtosis deben estar en el rango de -3 y 3 (Ramírez & Porcayo, 2010).
Los datos recolectados estuvieron dentro de este rango, por lo que no fue necesario realizar una transformación logarítmica de los datos [log10(n + 1)] para normalizarlos.
Análisis geoestadístico
Se obtuvo el semivariograma experimental a partir del valor promedio mensual de huevos de B. cockerelli contabilizados en cada muestreo utilizando el programa Variowin 2.2 (Software for spatial data análisis en 2D. Springer Verlag, New York USA). El valor experimental del semivariograma fue calculado con la siguiente expresión (Isaaks & Srivastava, 1989; Journel & Huijbregts, 1978):
Donde: γ*(h) es el valor experimental del semivariograma para el intervalo de distancia h; n (h) es el número de pares de puntos muestrales separados por el intervalo de distancia h; z (xi) es el valor de la variable de interés en el punto muestral xi y z (xi+h) es valor de la variable de interés en el punto muestra xi+h.
Estimación de los parámetros del modelo de semivariograma
Una vez obtenido el semivariograma experimental se realizó su ajuste a algún semivariograma teórico (esférico, exponencial, gaussiano, etc.) (England, Sparks & Robinson, 1989) utilizando el programa Variowin versión 2.2.
Validación del modelo teórico
Se sigue un procedimiento de validación cruzada en el cual los parámetros del modelo Co (efecto de pepita), C + Co (meseta) y a (rango o alcance) se van ajustando de forma interactiva (prueba y error) hasta los mejores valores de los estadísticos:
Media de los Errores de Estimación (MEE)
Donde: z*(xi) es el valor estimado de la variable de interés en el punto xi; z (xi) es el valor medido de la variable de interés en el punto xi y n es el número de puntos muéstrales utilizado en la interpolación. La MEE no debe ser significativamente distinta de 0 (Prueba de t), en cuyo caso, indicaría que el modelo de semivariograma permite el cálculo de estimadores no sesgados
Error Cuadrático Medio (ECM)
Un modelo de semivariograma se considera adecuado si, como regla práctica, el valor del estadístico es cercano a cero (Hevesi, Istok & Flint, 1992).
Error Cuadrático Medio Adimensional (ECMA)
Donde: k es la desviación estándar del error esperado en la estimación con el krigeado. La validez del modelo se satisface si ECMA está comprendido entre los valores 12 (2/N) 0.5. d. Otro estadístico para validar el ajuste del modelo consiste en que el valor de la varianza de los errores sea menor a la varianza muestral.
Nivel de dependencia espacial
La determinación del grado de relación entre los datos o nivel de dependencia espacial se obtuvo al dividir el efecto pepita entre la meseta y expresando en porcentaje su resultado. Si el resultado es menor de 25% el nivel de dependencia espacial es alta, si se encuentra entre 26% y 75% el nivel de dependencia espacial es moderado y si es mayor del 76% el nivel de dependencia es bajo (Cambardella et al., 1994).
Elaboración de mapas
Se realizó la interpolación de valores a través del krigeado ordinario que permite la estimación insesgada de valores asociados a puntos que no fueron muestreados, las estimaciones obtenidas fueron representadas en forma de mapa para cada fecha de muestreo mediante el uso del programa Surfer 9 (Surface Mapping System, Golden Software Inc. 809, 14th Street. Golden, Colorado 80401- 1866. USA).
Estabilidad espacial y temporal
La comparación se realizó utilizando la modificación propuesta por Syrjala (1996) a la prueba estadística no paramétrica de Cramérvon Mises, esto consiste en la comparación de mapas, si en la comparación no hay diferencia significativa, existe estabilidad espacial.
RESULTADOS
Análisis geoestadístico
Con los datos obtenidos en los muestreos se generó la modelización espacial y el mapeo de las poblaciones de huevos de B. cockerelli dentro de las parcelas de tomate de cáscara. Todos los muestreos realizados se ajustaron al modelo esférico (Tabla 1). La pepita tuvo valores iguales a cero en la mayoría de los casos, lo que nos indica que la escala de muestreo utilizada fue la correcta y el error de muestreo fue mínimo.
Tabla 1 Parámetros (Efecto Pepita, Meseta y Rango) de los modelos ajustados a los semivariogramas de huevos de B. cockerelli
| Parcela | Fecha | Modelo | Pepita | Meseta | Rango (m) | Pepita/Meseta | Nivel de dependencia espacial |
|---|---|---|---|---|---|---|---|
| 1 | 17-dic-15 | Esférico | 0 | 22.94 | 15.3 | 0 | Alta |
| 14-ene-16 | Esférico | 0 | 1.95 | 14.4 | 0 | Alta | |
| 18-feb-16 | Esférico | 0 | 2.964 | 14.4 | 0 | Alta | |
| 2 | 17-Dic-15 | Esférico | 0 | 45.57 | 15.3 | 0 | Alta |
| 14-Ene-16 | Esférico | 0.126 | 4.725 | 15.4 | 2.66 | Alta | |
| 18-Feb-16 | Esférico | 0 | 9.35 | 14.3 | 0 | Alta | |
| 3 | 17-Dic-15 | Esférico | 0 | 3.51 | 33.8 | 0 | Alta |
| 14-Ene-16 | Esférico | 0 | 5.8477 | 31.2 | 0 | Alta | |
| 18-Feb-16 | Esférico | 0 | 8.554 | 33.8 | 0 | Alta | |
| 4 | 17-Dic-15 | Esférico | 0 | 6.12 | 12 | 0 | Alta |
| 14-Ene-16 | Esférico | 0 | 8.03 | 11.2 | 0 | Alta | |
| 18-Feb-16 | Esférico | 0.76 | 6.36 | 12 | 11.94 | Alta |
Fuente: Elaboración propia.
Se encontró un nivel de dependencia espacial alto en todas las parcelas lo que es indicativo de la existencia de una fuerte distribución agregada y una relación espacial entre las observaciones de cada punto de muestreo (Tabla 1).
Los valores obtenidos en el rango fueron de 14.4 m y 15.36 m en la parcela uno, 14.3 m a 15.4 m en la dos, 31.2 m a 33.8 m para la tres y para la cuatro los valores fueron de 11.2 m a 12 m (Tabla 1). Esta distancia entre los rangos de cada muestreo nos indica hasta donde existe dependencia espacial de los datos muestreados, ya que más allá del valor máximo de la distancia la dependencia espacial es nula, además a mayor rango se explica mejor el modelo y este tiene un mayor alcance.
El mes que presentó mayor grado de infestación fue diciembre con 4.18 huevos por planta y el mes con menor infestación fue enero con 0.78 huevos por planta para la parcela uno, en la parcela dos el mes que presentó mayor grado de infestación fue diciembre con una media de 5.8 y el mes con menor infestación fue enero con 1.14 huevos por planta, para la parcela 3 febrero fue el mes en el que se obtuvo mayor infestación obteniendo un valor de 2.61 huevos y el mes más bajo fue diciembre con un valor de 1.29 huevos por planta y finalmente en la parcela cuatro el valor más alto fue de 2.99 huevos en el mes de febrero y 1.26 huevos por planta en el mes de diciembre (Tabla 2). En las parcelas en las que hubo mayor incidencia en el mes de febrero se puede inferir que es debido a la temperatura, ya que esta presentó temperaturas más altas en ese mes de muestreo.
Tabla 2 Valores de los estadísticos de la validación cruzada: media de los errores de estimación (MEE), error cuadrático medio (ECM) y error cuadrático medio adimensional (ECMA), de los huevos de B. cockerelli
| Parcela | Fecha | Tamaño de muestra |
Media Muestral | Varianza Muestral |
MEE | Varianza de los errores |
ECM | ECMA |
|---|---|---|---|---|---|---|---|---|
| 1 | 17-dic-15 | 121 | 4.1818 | 30.4 | 0.11ns | 22.54 | 0.12 | 1.11 |
| 14-ene-16 | 121 | 0.7851 | 2.5034 | 0.11ns | 1.37 | 0.10 | 1.10 | |
| 18-feb-16 | 121 | 1.4462 | 3.8825 | 0.12ns | 1.99 | 0.07 | 1.12 | |
| 2 | 17-Dic-15 | 121 | 5.8429 | 48.6168 | 0.10ns | 40.51 | 0.11 | 1.09 |
| 14-Ene-16 | 121 | 1.1404 | 6.22550 | 0.12ns | 4.37 | 0.09 | 1.11 | |
| 18-Feb-16 | 121 | 2.4095 | 10.8096 | 0.09ns | 8.61 | 0.13 | 1.13 | |
| 3 | 17-Dic-15 | 121 | 1.2975 | 3.9274 | 0.12ns | 2.93 | 0.13 | 1.12 |
| 14-Ene-16 | 121 | 1.8429 | 6.8501 | 0.13ns | 4.65 | 0.10 | 1.10 | |
| 18-Feb-16 | 121 | 2.6198 | 9.4209 | 0.11ns | 8.29 | 0.12 | 1.07 | |
| 4 | 17-Dic-15 | 121 | 1.2644 | 9.0461 | 0.11ns | 7.03 | 0.11 | 1.10 |
| 14-Ene-16 | 121 | 2.1570 | 10.7001 | 0.12ns | 8.21 | 0.08 | 1.06 | |
| 18-Feb-16 | 121 | 2.9917 | 11.5749 | 0.11ns | 9.35 | 0.11 | 1.11 |
Fuente: Elaboración propia.
Los mapas de densidad obtenidos con el krigeado ordinario mostraron la ubicación de los diferentes centros de agregación, es decir, su localización se encuentra en puntos específicos (Figura 1).
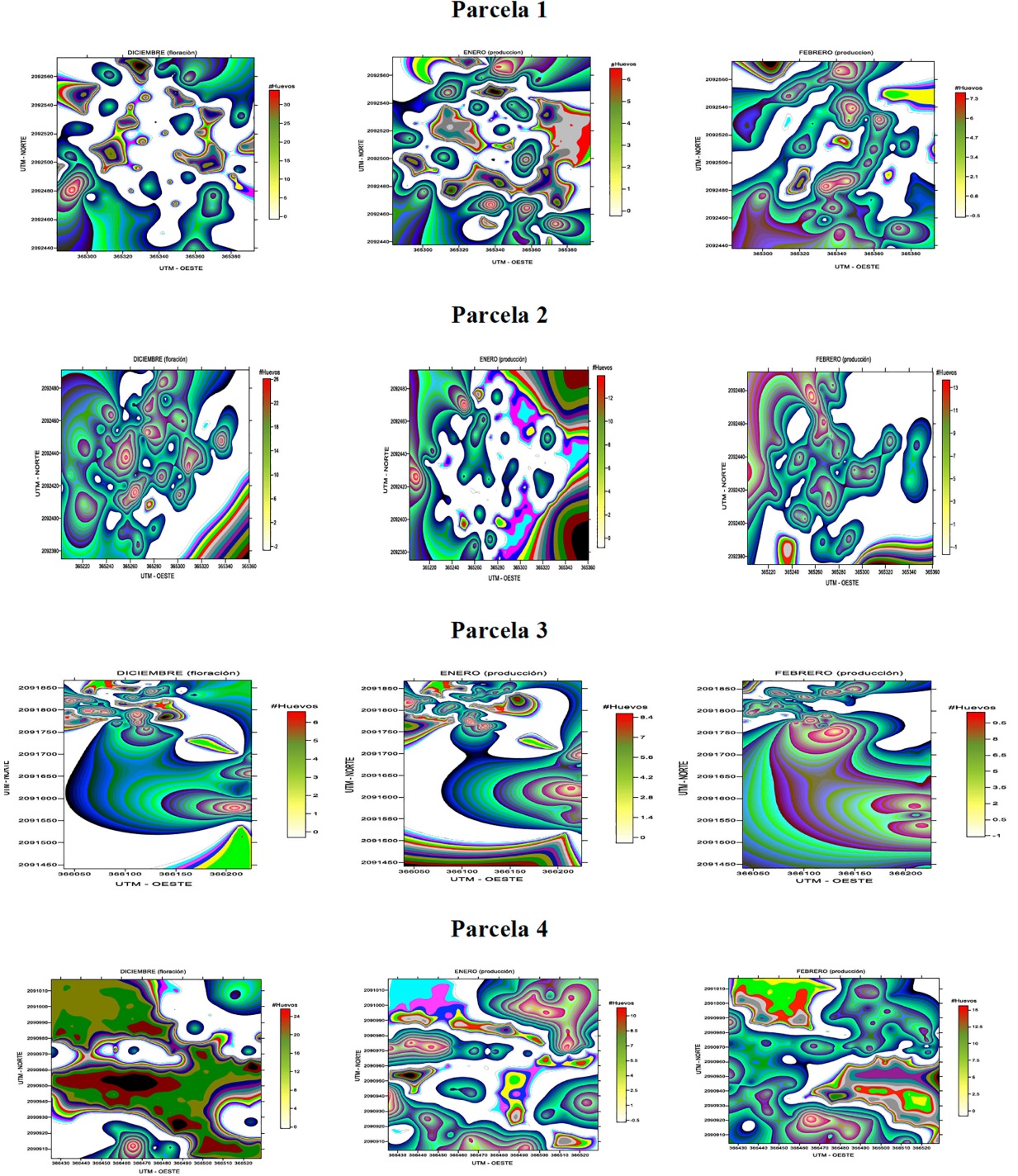
fuente: elaboración propia.
Figura 1 Mapas de densidad de las poblaciones de huevos de B. cockerelli obtenidos en las cuatro parcelas de estudio.
Para la parcela uno los centros de agregación se encontraron distribuidos por toda la superficie experimental en los tres muestreos, sin embargo, los centros de densidad media más alta se encontraron en la parte izquierda y parte superior del mapa, en la segunda parcela los centros de densidad media más alta los encontramos en la parte centro y superior de los mapas, mientras que en la tres encontramos centros de agregación distribuidos en la parte centro-superior e inferior-izquierda de los mapas y finalmente para la parcela cuatro en general se distribuyó en toda la parcela, sin embargo, cabe señalar que para el segundo y tercer muestreo los centros de agregación con mayor densidad se distribuyeron en la parte inferior-izquierda de los mapas. La ubicación en diferentes puntos dentro de la parcela se debe a que por lo regular ningún insecto presenta una distribución total al interior de la parcela y se agrupan en torno a las áreas donde encuentran condiciones favorables para su supervivencia, generando pequeños nichos ecológicos de desarrollo.
La información sobre la dispersión de huevos dentro de la parcela, al combinarlas con información de la plaga y modelos de predicción, permitirán optimizar las actividades de monitoreo y orientar las actividades de manejo en tiempo y espacio.
Superficie infestada
Fue evidente la existencia de variabilidad espacial en la ubicación de los centros de agregación de huevos dentro de las parcelas. En ninguna fecha de muestreo se distribuyó en el 100% del área de la parcela, siempre se observaron espacios donde hubo ausencia de la plaga. Esto permite suponer que la plaga crea refugios y que en los centros de agregación donde se ubicó había condiciones favorables para su reproducción. El mayor porcentaje de infestación se presentó en la parcela en el tercer muestreo con un 76% de infestación, mientras que en la parcela cuatro en el primer muestreo se presentó el menor con un 22% de infestación (Tabla 3).
Estabilidad espacial y temporal
La comparación entre fechas de muestreo de los diferentes mapas obtenidos en cada una de las parcelas nos puede dar indicaciones de la dinámica espacio-temporal del insecto. Más concretamente de la posibilidad de encontrar una estabilidad numérica en el espacio y el tiempo que puede abrir las puertas para la utilización de las técnicas de la agricultura de precisión en este insecto, como la de aplicar algún tipo de control dirigido hacia las áreas específicas de infestación dentro de la parcela.
Los resultados con la prueba estadística bivariable de Cramér-von Mises, indican diferencia no significativa en la estabilidad espacial y temporal de corto plazo entre las fechas de muestreo para las cuatro parcelas, es decir, existió estabilidad espacial y temporal en las poblaciones de B. cockerelli en todos los muestreos analizados (Tabla 4).
Tabla 4 Comparación de mapas (Krigeado) con la prueba bivariable de Cramér-von Mises (Ψ)
| Parcela | Muestreos comparados | Ψ | Valor de P | Diferencia (5%) |
|---|---|---|---|---|
| 1 | 1 vs 2 | 0.34 | 0.40 | No Significativa |
| 2 vs 3 | 0.25 | 0.52 | No Significativa | |
| 2 | 1 vs 2 | 0.26 | 0.45 | No Significativa |
| 2 vs 3 | 0.32 | 0.50 | No Significativa | |
| 3 | 1 vs 2 | 0.30 | 0.39 | No Significativa |
| 2 vs 3 | 0.29 | 0.47 | No Significativa | |
| 4 | 1 vs 2 | 0.35 | 0.49 | No Significativa |
| 2 vs 3 | 0.28 | 0.52 | No Significativa |
Fuente: Elaboración propia.
DISCUSIÓN
La observación de la estructura agregada en la distribución espacial de huevos de B. cockerelli en el cultivo de tomate de cáscara se hizo con el uso de la geoestadística. Crespo-Herrera et al. (2012), utilizando la ley de la potencia de Taylor con estadística clásica, encontraron una estructura agregada de huevos y ninfas en el cultivo de tomate, mientras que los adultos presentaron una distribución aleatoria. En comparación con la estimación de la distribución espacial que realiza la estadística clásica, los modelos geoestadísticos proporcionan una medida más directa de la dependencia espacial, ya que tienen en cuenta la naturaleza bidimensional de la distribución de los organismos a través de su exacta localización espacial, además de ser independiente de la relación entre la media y la varianza (Samper & Carrera, 1996). La geoestadística además permite elaborar mapas de densidad de la distribución espacial de un organismo (Ribes, Bascuñana & Avilla, 1998; Rossi, Mulla, Journel & Franz, 1992). Moral (2004) utilizó la geoestadística para estudiar la distribución espacial del lepidóptero Helicoverpa armígera Hübner, en una parcela de tomate, con el empleo de la función variograma, obteniendo más representaciones gráficas diarias de dichas distribuciones. Estos mapas se basan en la técnica de estimación geoestadística conocida como “krigeado”, particularmente el ordinario en bloques. Contreras et al. (2016) realizaron un estudio de distribución espacial de la enfermedad Candidatus liberibacter solanacearum y de su vector Bactericera cockerelliSulc.; en papa, en el cual pudieron obtener mapas de densidad de B. cockerelli tanto en huevos, ninfas y adultos, usando el krigeado.
El uso de las técnicas para modelizar la distribución espacial de insectos ha mostrado ser una herramienta muy eficiente para determinar la distribución espacial de diversos insectos plaga en cultivos de importancia económica. Diferentes trabajos como el de Jiménez, Cortiñas & López (2000) revelan la distribución temporal y agregada de thrips Palmi Karny en la papa en Cuba. Por otra parte, Sciarretta, Zinni, Mazzocchetti & Trematerra (2008) encontraron una distribución agregada con ajuste al modelo esférico en Lobesia botrana en parcelas de uva. En cuanto a, Bressan, Moral, Sémetey & Boudon (2010) determinaron la distribución espacial de Pentastiridius leporinus L., en campos de trigo, Ramírez et al. (2011) la distribución agregada de Bactericera cockerelli en papa y Jiménez, Ramírez, Sánchez, Salgado & Laguna (2013) las de poblaciones de trips en tomate de cáscara con distribución agregada con varios centros de agregación visualizados en los mapas obtenidos y sus semivariogramas de la distribución espacial se ajustaron a los modelos esférico y gaussiano, de la misma forma que Quiñonez et al. (2015) en todo el ciclo fenológico del cultivo del gladiolo, generando mapas que reflejaron la estructura agregada de la plaga en puntos específicos dentro de la parcela. Contrario a esto Carrillo, Pape, Neira & Balocchi (2004) realizaron un estudio de la distribución espacial de larvas de escarabaeidos en plantas cultivadas y sus resultados mostraron que las larvas estudiadas no tenían una distribución agregada, esto pudo haber estado relacionado con la amplia polifagia de las larvas. Estas técnicas también se han aplicado en enfermedades como: el carbón de la espiga del maíz (Sánchez, Ramírez, González & de León, 2011) y han permitido describir la distribución en agregados de los insectos plaga y enfermedades mencionados, determinando dicha agregación en puntos específicos en las parcelas y regiones estudiadas.
El comportamiento espacial de las poblaciones de huevos de forma agregada en las parcelas de tomate, permite sugerir que se pueden manejar y, por lo tanto, reducirlas aplicando y dirigiendo medidas de control hacia los centros de agregación o puntos específicos en los que se encuentra la plaga, evitando aplicaciones generalizadas o de cobertura total, lo cual nos lleva a un ahorro en los insumos, visualizando los focos de infestación a través de los mapas generados. Lo anterior concuerda con Rong, Dian, Bao, Zhe & Dong (2006) y Esquivel & Jasso (2014) quienes, respectivamente propusieron el manejo de Locusta migratoria manilensis Linnaeus y del gusano soldado en el cultivo de maíz en puntos específicos de presencia de la plaga.
Los valores de cero encontrados en el efecto pepita en la mayoría de los modelos ajustados permite afirmar que la escala de muestreo utilizada fue la adecuada y el error de muestreo fue mínimo (Oliver & Webster, 1998), esto sugiere que los modelos ajustados tienen un 98% de confiabilidad. En consecuencia es válido deducir que más del 90% de la variación total es debido a la dependencia espacial en la escala de muestreo utilizada; dicho de otra manera, más del 90% de la variación de la distribución de las poblaciones de huevos se logró explicar por la estructura espacial establecida con los semivariogramas (Liebhold & Sharov, 1998; Ramírez & Porcayo, 2008). Ramírez et al. (2011) encontraron valores de pepita igual a cero en un estudio de la distribución espacial de Bactericera cockerelli en papa. Valores de pepita iguales fueron obtenidos por Solares, Ramírez & Sánchez (2011) en la distribución espacial de trips en plantaciones comerciales de aguacate.
La distribución espacial ajustada al modelo esférico es indicativo que dentro de la parcela analizada existen zonas en que se manifiesta más la plaga respecto al resto de puntos considerados en el muestreo y que se desplaza de un punto específico hacia otros puntos dentro de la parcela, estos puntos de agregación presentan un crecimiento rápido cerca de su origen pero los incrementos van decreciendo conforme aumenta la distancia, los focos de infestación se observan en los mapas obtenidos. Moral (2003) al realizar la distribución espacial de H. armígera y sus variogramas teóricos encontró que se ajustaron a modelos esféricos o exponenciales, con un efecto pepita. Contreras et al. (2016) encontraron que los semivariogramas para huevos y ninfas de B. cockerelli se ajustaron al modelo esférico, lo que indicó la agregación de la plaga en ciertas zonas de la parcela.
La distribución de los huevos presentó un alto nivel de dependencia espacial en todos los modelos ajustados, esto es indicativo de la existencia de una fuerte relación espacial de los huevos en los puntos muestreados y por lo tanto, sugiere una estabilidad de los centros de agregación que puede permanecer un largo período de tiempo (Maldonado, Ramírez, Arriaga, Némiga & Lara, 2016; Ramírez, Solares, Figueroa & Sánchez, 2013). El alto nivel de dependencia espacial resultó de dividir el efecto pepita entre la meseta que fue menor a 25% para todos los semivariogramas. Asimismo, lo anterior se corrobora con los valores del efecto pepita que indicaron también la existencia de una alta dependencia espacial, lo cual sugiere que las poblaciones de huevos dependen entre sí y que el nivel de agregación es alto (Rossi et al., 1992). Esquivel & Jasso (2014) en un estudio de la distribución espacial de gusano soldado en seis localidades del Estado de México, utilizando las técnicas de la geoestadística, mostraron la existencia de una estructura espacial agregada, con un nivel de dependencia espacial alto para las seis localidades en estudio.
En los mapas de densidad que se obtuvieron mediante la técnica del krigeado se observan los centros de agregación de los huevos dentro de la parcela, lo cual a la hora de proteger el cultivo contra la plaga nos permite dirigir de forma precisa las medidas de control (Acosta-Guadarrama et. al., 2017; Esquivel & Jasso, 2014; Fleischer, Blom & Weisz, 1997; Moral, 2004; Ribes et al., 1998; Rong et al., 2006; Weisz, Fleischer & Smilowitz, 1996). Esto ayudará a que los insectos no generen resistencia a los plaguicidas debido a la creación de refugios temporales dinámicos, al no tratar toda la superficie del cultivo (Moral, Terron & Rebollo, 2011). Con estas acciones se evitará un mayor incremento poblacional del insecto y que puedan causar daños económicos mayores. El comportamiento de los focos de infestación dentro de la parcela permite suponer que los huevos se originan de una fuente puntual (Hoddle, 2002). Los mapas permitieron identificar las áreas de infestación, encontrando que los huevos de B. cockerelli se distribuyeron en diferentes puntos dentro de la parcela, esto concuerda con Jiménez, López, González, Ocete & Soria (2008), quienes determinaron la distribución espacial y mapeo de Curculio elephas Gyllenhal en Quercus ilex Linneo, ellos elaboraron cuatro mapas de densidad, uno por cada año, utilizando el método de la distancia inversa como interpolador del programa Surfer 7; estos mapas indican que el insecto se localizó en diferentes puntos en toda la parcela con una distribución espacial agregada. Quiñonez et al. (2015) encontraron que las poblaciones de trips en el cultivo del gladiolo no infestaron el 100% de la parcela y estos se encontraban en forma agregada en puntos específicos de infestación. Esquivel & Jasso (2014) realizaron un estudio de distribución espacial y mapeo de gusano soldado en seis localidades en el Estado de México en maíz y encontraron que en ninguna de las localidades se presentó un área de infestación del 100% y el porcentaje máximo alcanzado fue del 94%. Jiménez et al. (2013) reportaron que las poblaciones de F. occidentalis en tomate de cáscara no se distribuyen en la totalidad de las parcelas. Ramírez et al. (2013) encontraron que los mapas de infestación de B. cockerelli Sulc. sobre papa reflejaron una estructura agregada del insecto el cual no invadió el 100% de la superficie de la parcela, permitiendo identificar áreas libres de infestación. Ramírez & Porcayo (2008) reportaron que las ninfas de Jacobiasca lybica Bergenin y Zanon no invadieron el 100% de las parcelas de vid en estudio, por lo tanto la infestación no fue uniforme.
CONCLUSIONES
La utilización de métodos geoestadísticos en investigaciones al respecto del comportamiento espacial de insectos plaga permite determinar la fluctuación poblacional de dichos insectos en el total de las parcelas de estudio basándose en muestreos realizados en plantas específicas. Lo anterior, puede coadyuvar en la implementación de programas de manejo integrado de la plaga estudiada con el objeto de dirigir las medidas de control, ya sea químicas o alternativas, hacia sitios donde realmente se encuentra el insecto, ayudando este hecho a la disminución de productos químicos contaminantes del medio ambiente. Esta optimización de insumos proporcionará a los productores el plus de un mayor beneficio económico.











 nueva página del texto (beta)
nueva página del texto (beta)


