Introducción
Los chiles son vegetales de gran importancia económica para México y otras regiones del mundo, pertenecen a la familia Solanaceae y al género Capsicum. Dentro de las cinco especies más cultivadas, Capsicum annuum L. es la más ampliamente conocida y la de mayor importancia económica ya que presenta una distribución mundial, México es el país que presenta la mayor variabilidad de formas cultivadas y silvestres, la cual se encuentra ampliamente distribuida en el país. Esta diversidad ha sido descrita con base en la clasificación comercial de los frutos, realizada dentro de diversos tipos de chile (Latournerie et al., 2010).
Se desarrolla desde cerca del nivel del mar hasta los 2500 m. s. n. m., abarcando diferentes regiones de México, razón por la cual se encuentra chile en el mercado todo el año. Por lo que su consu mo es muy generalizado en fresco e industrializado en diversas modalidades (Latournerie et al., 2010). El chile “chiltepín” (Capsicum annuum cv. ‘glabriusculum’) prácticamente se encuentra en todo México, sobre todo en las zonas aledañas a las costas, en donde registra gran variación y usos desde estado inmaduro, maduro, en salsas, deshidratado y en escabeche (Latournerie et al., 2010).
Diferentes tipos de explantes han sido empleados para la regeneración de plantas tales como meristemos apicales (Christopher & Rajam, 1996), hojas, hipocotilos, cotiledones, raíces y embriones (Agrawal, Chandra & Kothari, 1989) para inducir la embriogénesis somática (Kintzios, Drossopoulos & Lymperopoulos, 2000). Sin embargo, dichas investigaciones no informan resultados satisfactorios en cuanto a la regeneración de plantas normales, porque ocurren desórdenes fisiológicos como una baja elongación de las plántulas, formación de rosetas y de brotes anormales (Ochoa-Alejo & Ramírez-Malagón, 2001).
La 6-bencilaminopurina (BAP) es un potente regulador del crecimiento con actividad citoquinina y ha mostrado buenos resultados en diferentes sistemas de cultivo de chile en germinación y organogénesis, entre otras (Ochoa-Alejo & Ramírez-Malagón, 2001; RoblesPaz & Carrillo-Castañeda, 2004).
Los oligogalacturónidos son oligosacáridos que son liberados de los polisacáridos pécticos, que componen la pared celular durante la degradación de estas estructuras por las enzimas pécticas de la propia planta o proveniente de los microorganismos que invaden los tejidos vegetales, posee capacidad para inducir y desarrollar el enraizamiento, estimular el crecimiento de los callos e incrementar de forma notable el desarrollo y vigor de las vitroplantas de diferentes cultivos (Cid, González-Olmedo, Lezcano & Nieves, 2006); promueven diferentes procesos morfogenéticos, fisiológicos y bioquímicos en las plantas y se utilizan en los medios de cultivo en diferentes concentraciones (1 mg.L-1 - 15 mg.L-1), rango similar al que se emplea para los reguladores tradicionales al expresarlas en unidades de concentraciones molares (10-7 M - 10-6 M) (Simpson, Ashford, Harvey & Bowles, 2007). Regulan, entre otros procesos, la interacción entre las auxinas, citoquininas, giberelinas y el etileno (Souter, Pullen, Topping, Zhang & Lindsey, 2004), por lo que su introducción a mayor escala en los procesos biotecnológicos pudiera hacerlos más eficientes. Los oligogalacturónidos se han empleado en micropropagación por organogénesis o embriogénesis somática en diferentes cultivos como plátanos (Musa paradisiaca, L.) (Díaz et al., 2004; Izquierdo, 2014), caña de azúcar (Saccharum spp.) (Nieves et al., 2006), mandarina (Citrus reshni Hort. ex Tan.) (Hernández et al., 2007) y Spathiphylum sp. (Hernández, Suárez & Valcárcel, 2009), entre otros. Sin embargo, nunca se ha empleado en la micropropagación del chiltepín, como sustituto de las hormonas tradicionales, que permita incrementar el número de brotes por explante y la calidad de las vitroplantas que se obtengan.
Por lo que el objetivo de este trabajo fue evaluar el efecto de un oligogalacturónido de origen péctico (Pectimorf) en la micropropagación del chiltepín (Capsicum annuum L. cv. ‘glabriusculum’) estimulando meristemos preexistentes y la sobrevivencia al transplantarlos a macetas.
Materiales y métodos
La investigación se llevó a cabo en el Laboratorio de Biotecnología Vegetal del Centro de Investigaciones Biológicas del Noroeste, S. C. (Cibnor), que está ubicado en La Paz, Baja California Sur, México.
Material vegetal
Se emplearon explantes (segmentos nodales de 1 cm - 1.5 cm de longitud), sembrados en posición vertical, provenientes de vitroplantas de chiltepín (Capsicum annuum L.) cv. ‘glabriusculum’ (Dunal) Heiser and Pickergill, (accesión CIB #2 Mayo 2014), de 30 días de edad, obtenidos in vitro en medio Murashigue y Skoog (1962) (MS) adicionado con 10-5 M de 6-Bencilaminopurina (6-BAP) a partir de plántulas in vitro, obtenidas de semillas y transferidas cada 30 días.
Medio de Cultivo
Se empleó como medio basal el MS con vitaminas, suplementado con 6.5 g.L-1 de agar y 3% sacarosa. El pH se ajustó a 5.8 antes de realizar la esterilización del mismo en autoclave a 1.5 atm de presión y 121 ºC de temperatura durante 20 min.
Los tratamientos que se emplearon se muestran en la tabla 1. En todos los casos se emplearon 20 mL de medio de cultivo por frasco y se trasplantó un explante. Todos los frascos se sellaron con plástico adhesivo. Se llevaron a cabo 10 repeticiones por tratamiento y tres experimentos independientes, sumando un total de 30 repeticiones por tratamiento.
Tabla 1. Promedio del número de brotes por explante durante el cultivo in vitro de plántulas de chiltepín (Capsicum annuum L.) cv. ‘glabriusculum’, a los 30, 60 y 90 días. Diferentes letras indican diferencias significativas entre tratamientos (prueba de Tukey, p ≤ 0.05). Número de muestras (n = 15).
| Tratamientos | Días | |||
|---|---|---|---|---|
| Número | 30 | 60 | 90 | |
| 1 | MS | 0.4d | 0.5d | 0.6d |
| 2 | BAP 10-5 M | 0.4d | 0.4d | 0.5d |
| 3 | Pectimorf 1mg.L-1 | 2.6a | 2.9a | 3.3a |
| 4 | Pectimorf 5 mg.L-1 | 1.3c | 1.5c | 1.8c |
| 5 | Pectimorf 10 mg.L-1 | 1.5b | 1.8b | 2b |
Fuente: Elaboración propia.
Condiciones de cultivo
Todos los frascos con los explantes se colocaron en una cámara de crecimiento a una temperatura de 28 ºC ± 2 ºC, a una densidad de flujo de fotones fotosintéticos entre 220 µmol.m-2.s-1 - 250 µmol.m-2.s-1, con un fotoperíodo de 16 h de luz y 8 h de oscuridad y subcultivados los explantes cada 30 días al mismo medio de cultivo.
A partir de los siete días, se evaluó:
El total de explantes vivos para determinar posteriormente el porcentaje de supervivencia de las plántulas que se obtuvieron.
Formación de nuevos brotes.
Tiempo en que se formaron los brotes (días).
Vigor: 1.- Poco vigoroso, 2.- Vigoroso; 3.- Muy vigoroso. Esta evaluación se realizó por apreciación visual.
Altura de las vitroplantas (cm).
Total de explantes enraizados para determinar con posterioridad el porcentaje de enraizamiento de las plántulas que se obtuvieron.
Número de raíces por plántulas.
Longitud de las raíces (cm).
Cuantificación de clorofila α, β y feopigmentos.
En el momento de la transferencia de las plántulas a la fase de aclimatización se evaluó:
Se transfirieron a un invernadero con paredes de policarbonato y climatizado con aire acondicionado con temperatura de 26 °C ± 2 °C y 70% ± 5% de humedad relativa. Después de 50 días de transferencia a las macetas se evaluó la tasa de crecimiento en porcentaje.
Se determinó contenido de clorofila α (mg.g MS-1), contenido de clorofila β (mg.g MS-1), contenido de feopigmentos (mg.g MS-1). Por medio de la metodología de Parsons, Maita & Lalli (1984) en un espectrofotómetro (Beckman modelo DU 640)
Diseño experimental y análisis de los datos
Se empleó un diseño completamente aleatorizado con 10 frascos por tratamiento y el mismo se repitió tres veces. Los datos se procesaron mediante Análisis de Varianza de Clasificación Simple (ANOVA) con el programa SPSS 11.5 para Windows (SPSS, Inc., Chicago, IL) y la comparación entre las medias se realizó de acuerdo a la prueba de Tukey (p ≤ 0.05) y Holm-Sodak (p ≤ 0.05).
Resultados y discusión
Porcentaje de supervivencia
Los resultados relacionados con el porcentaje de supervivencia de los explantes in vitro de chiltepín se reflejan en la figura 1. Como se puede observar en general, hubo diferencias significativas entre los tratamientos a los 30, 60 y 90 días. De forma general, se observó que la supervivencia de los explantes se incrementó desde los 30 hasta los 90 días. En sentido general, la supervivencia de los explantes fue alta en esta fase en los tratamientos 1 (MS), 3 (MS + Pectimorf 1 mg/L) y 4 (MS + Pectimorf 5 mg/L a los 90 días fue de 100%, para el tratamientos 2 fue de 80% en el mismo período de tiempo (tabla 1), al parecer el efecto acumulativo del 6-BAP afectó este parámetro, así como las altas concentraciones de Pectimorf (10 mg.L-1) y en el tratamiento 5 (MS + Pectimorf 10 mg/L) fue de 80% en el mismo período de tiempo. La alta supervivencia in vitro de las plántulas pudiera deberse a la activación de la biosíntesis de las oligosacarinas (Côté & Hahn, 1994) y por consiguiente influir en el posterior crecimiento y desarrollo de las mismas.
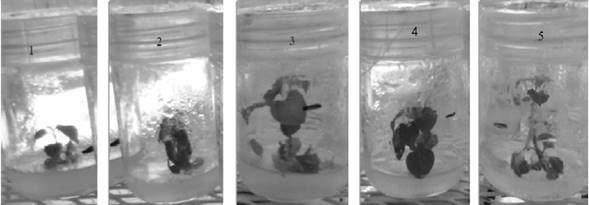
Fuente: Elaboración propia
Figura 1 Vigor de las plántulas de chiltepín (Capsicum annuum L.) cv. ‘glabrius culum’, en el momento de la transferencia a la fase de aclimatización (120 días). 1.- MS [vigorosas]; 2.- MS + 6-BAP (10-5 mM) [poco vigorosas]; 3.- MS + Pectimorf (1 mg.L-1) [muy vigorosas]; 4.- MS + Pectimorf (5 mg.L-1) [muy vigorosas] y 5.- MS + Pectimorf (10 mg.L-1) [muy vigorosas].
Formación de nuevos brotes
Con respecto al número de brotes por explante hubo diferencias significativas entre los tratamientos que se evaluaron a los 30, 60 y 90 días (tabla 1). Los mejores resultados se obtuvieron cuando se empleó el Pectimorf en las diferentes concentraciones, el tratamiento 3 (MS + Pectimorf 1 mg.L-1), fue el mejor con 2.60 brotes (30 días), 2.85 brotes (60 días) y 3.00 brotes (90 días) y los resultados más bajos fueron los del tra tamiento 2 (MS + 6-BAP 10-5 M).
La morfogénesis ocurrió en todos los explantes con independencia del tratamiento, pero fue superior en las plántulas que se obtuvieron con Pectimorf (1 mg.L-1, 5 mg.L-1 y 10 mg.L-1). Sin embargo, este proceso fue muy bajo en los tratamientos 2 (6-BAP 10-5 M) y 1 (MS), por lo que estos resultados pudieran deberse a la concentración de fitohormonas de los segmentos nodales de chiltepín. Sin embargo, Ahmad, Siddique & Anis (2006) informó que no ocurrió formación de brotes en un medio de cultivo sin reguladores del crecimiento.
Valadez-Bustos et al. (2009), evaluaron el efecto de diferentes medios de cultivo y fitohormonas inducción de brotes y regeneración de plantas provenientes de Capsicum annuum var. annuum (Jalapeño y Serrano), C. annuum var. glabriusculum/aviculare (Piquín), and C. chinense (Habanero), empleando explantes de cotiledones. Obtuvieron un alto porcentaje de formación de brotes de Habanero en el medio de cultivo MS adicionado con las fitohormonas ácido indol 3 acético y 6-BAP. Posteriormente Li, Zhao & Xie (2003) obtuvieron alto porcentaje de regeneración de brotes, a partir de explantes de cotiledones de pimiento en un medio MS suplementado con 0.5 mg.dm-3 de thidiazuron (TDZ).
Sanatombi & Sharma (2007) concluyeron que el cultivar ‘Morok Amuba’ genera el mayor número de brotes por explante (4.7), obtuvieron en un medio de cultivo con alta concentración de zeatina (10 mg.L-1), pero sin diferencias estadísticamente significativas de los tratamientos que estaban suplementados con 6-BAP (5 mg.L-1) y AIA (1 mg.L-1) y 6-BAP (10 mg.L-1) y AIA (1 mg.L-1), con 4.4 y 3.8 brotes por explante, respectivamente.
Esta respuesta diferencial puede deberse a la especie, tipo de explante, reguladores del crecimiento y concentraciones de los mismos.
En el cultivar ‘California Wonder’, algunos explantes no completaron su ciclo de crecimiento cuando los mismos fueron transferidos de un medio de inducción de brotes a otro de elongación (Elwan, 2009). Sin embargo, esto no se observó en este trabajo, ya que no hubo que transferir los explantes de un tipo de medio de cultivo a otro; la inducción de brotes y la elongación de los mismos se produjeron en el mismo medio de cultivo.
Evaluación de variables morfológicas
Los resultados relacionados con la evaluación de diferentes variables morfológicas in vitro se muestran en la tabla 2. En todos los casos hubo diferencias significativas entre los tratamientos. Tanto en el número de raíces como en su longitud del tallo, los mejores resultados se alcanzaron con el tratamiento 5 (MS + Pectimorf 10 mg.L-1), incrementándose los valores de las mismas en el transcurso del tiempo (30, 60 y 90 días). Sin embargo, las plántulas más vigorosas fueron las del tratamiento 3 (MS + Pectimorf [1 mg.L-1]), sin diferenciarse estadísticamente de las plántulas del tratamiento 4 (MS + Pectimorf [5 mg.L-1]) a los 90 días, pero sí del resto de los tratamientos (figura 1).
Tabla 2 Variables morfológicas que se evaluaron durante el cultivo in vitro de plántulas de chiltepín (Capsicum annuum L.) cv. ‘glabriusculum’, a los 30, 60 y 90 días 1. Plántulas poco vigorosas 2. Plántulas vigorosas 3. Plántulas muy vigorosas. Diferentes letras indican diferencias significativas entre tratamientos (prueba de Tukey, p ≤ 0.05). Número de muestras (n = 15).
| Tratamientos | Número de raíces por plántulas (promedio) | Longitud de las raíces de las plántulas (cm) | Vigor de las plántulas | ||||||
| días | días | días | |||||||
| 30 | 60 | 90 | 30 | 60 | 90 | 30 | 60 | 90 | |
| 1. MS | 0.45d | 0.45d | 0.50d | 2.74d | 2.86d | 3.00d | 1b | 2b | 2b |
| 2. MS + 6-BAP (10-5 M) | 0.15e | 0.15e | 0.15e | 1.12e | 1.16e | 1.20e | 1b | 1c | 1c |
| 3. MS + Pectimorf (1 mg.L-1) | 2.70c | 2.80c | 2.85c | 3.01c | 3.18c | 3.26c | 2a | 3a | 3a |
| 4. MS + Pectimorf (5 mg.L-1) | 3.40b | 3.65b | 3.70b | 3.33b | 3.42b | 3.50b | 2a | 2b | 3a |
| 5. MS + Pectimorf (10 mg.L-1) | 4.15a | 4.60a | 4.90a | 3.45a | 3.54a | 3.62a | 1b | 2b | 3a |
Fuente: Elaboración propia.
El 100% de los explantes en los tratamientos con Pectimorf enraizaron, mientras que solo entre el 45% - 50% y el 15% de los explantes en el medio de cultivo MS (control) y MS + 6-BAP 10-5 M, emitieron raíces. Como se puede observar al aplicar los tratamientos probados, se estimuló la producción de brotes y enraizamiento con los tratamientos probados. Ahmad et al. (2006) en plantas de chile obtuvieron entre 56.6% - 90% de enraizamiento en medios de cultivo suplementados con ácido indol acético (AIA), ácido naftalen acético (ANA) y ácido indol butírico (AIB), a concentraciones entre 0.5 µM - 1.5 µM. También informaron que las plántulas solo obtuvieron el mayor número de raíces en un medio de cultivo que contenía diferentes concentraciones de AIB.
La literatura relacionada con el efecto de los oligogalacturónidos en el enraizamiento de las plantas es diversa, por ejemplo, en papaya la acción sinérgica del AIB con 9 mg L-1 de Pectimorf permitió obtener plantas in vitro con mayor número de raíces, un alto porcentaje de enraizamiento y un menor porcentaje de estomas abiertos permitiendo alcanzar un 76.2% de supervivencia en condiciones ex vitro (Posada-Pérez et al., 2016), sin embargo, no existen referencias hasta el presente del empleo de oligosacarinas en procesos de micropropagación de Capsicum spp.
Navazio et al. (2002) informaron que en miniexplantes de hojas de tabaco (Nicotiana tabacum L.), la adición al medio de cultivo de concentraciones micromolares de un oligogalacturónido inhibió la formación de las raíces y este efecto se revirtió cuando se incrementó en el medio de cultivo la concentración de una auxina. Posteriormente, Suárez & Hernández (2008) informaron que el empleo de Pectimorf (10 mg.L-1 o 15 mg.L-1) como sustituto del ANA incrementó el número de hojas y raíces por vitroplanta en la yuca (Manihot esculenta Crantz) cultivar 'CMC-40'.
Otros autores plantearon que la violeta africana (Saintpaulia ionantha L.), la caña de azúcar (Saccharum spp.), así como los plátanos y bananos (Musa spp.) incrementaron el número de hojas y raíces, área foliar, masa fresca y seca, así como en la longitud de las raíces (Falcón & Cabrera, 2007; Izquierdo, 2014; Nieves et al., 2006). Estos resultados, pudieran estar dados porque las dosis que se emplearon de Pectimorf fueron capaces de propiciar el balance de fitohormonas adecuado, para estimular el proceso de división y alargamiento celular.
Lo expuesto anteriormente es similar a los resultados que se obtuvieron en este trabajo, por lo que sería interesante continuar profundizando en los efectos fisiológicos de los oligogalacturónidos en los diferentes procesos morfogenéticos en el chiltepín, cultivar ‘glabriusculum’ accesión CIB #2 Mayo 2014, así como realizar estudios en los que se combine una auxina con el Pectimorf, lo cual pudiera aumentar la eficiencia del proceso de micropropagación en este genotipo de gran importancia para el consumo y la venta en frontera de la región de Baja California Sur, México.
Transferencia de las plántulas a la fase de aclimatización
A los 120 días, que fue el momento en que las plántulas se transfirieron a la fase de aclimatización, período en el que se logró un mayor desarrollo de brotes y raíces, las provenientes de los tratamientos 1 (MS), 3 (MS + Pectimorf [1 mg.L-1]) y 4 (MS + Pectimorf [5 mg.L-1]), alcanzaron el 100% de supervivencia, y se diferenciaron estadísticamente de las plántulas de los tratamientos 2 [MS + 6-BAP (10-5 M)] y 5 [MS + Pectimorf (10 mg.L-1)] con 80% de supervivencia.
La supervivencia de las vitroplantas fue eficiente, ya que osciló entre 80% - 100%. Orliňska & Nowaczyk (2015) informaron una supervivencia similar entre 85% - 95%, en cuatro genotipos de Capsicum spp. Resultados similares a los anteriores fueron expuestos por otros autores (Kumar et al., 2007; Kumar, Rupavathi & Subba, 2012; Sanatombi & Sharma, 2007). Sin embargo, los resultados expuestos por Grozeva, Rodeva & Todorova (2012) en dos cultivares de pimiento dulce, la aclimatización fue buena en la variedad ‘stryama’ (83.3%) y regular en la variedad ‘maritsa’ (68.7%).
El empleo del Pectimorf a la concentración de 10 mg.L-1 en Anthurium cubense L. en la fase de aclimatización fue del 90% y las características morfológicas de las vitroplantas fueron superiores a las de las plantas donantes (Montes, Aldaz, Cevallos, Cabrera & López, 2000) y en esquejes de Psidium guajava L. cv. ‘enana roja’, a la concentración de 20 ppm (20 mg.L-1), la supervivencia fue del 80% (Ramírez, Cruz & Franchialfaro, 2003).
Si bien la supervivencia es el principal indicador que se evalúa en la aclimatización de las plantas, es preciso realizar una caracterización más profunda de las mismas que permita explicar el mejor porcentaje de supervivencia que se obtuvo cuando se empleó el Pectimorf en la micropropagación de chiltepín cv. ‘glabriusculum’.
Como se aprecia en la tabla 3, hubo diferencias sig nificativas entre las plántulas que se evaluaron en el momento de la transferencia a la fase de aclimatización (120 días). Las plántulas de los tratamientos 1 (MS) y 2 (MS + 6-BAP [10-5 M]) fueron las que presentaron mayor altura, pero un menor número de brotes por explante (Figura 2), sin diferencias estadísticas entre ellas, pero si se diferenciaron de las de los otros tratamientos. El mayor número y longitud de las raíces se obtuvo con el tratamiento 5 (MS + Pectimorf [10 mg.L-1]) (tabla 3), que se diferenció estadísticamente de las del resto de los tratamientos. Sin embargo, el mayor el mayor número de brotes por explante, masa fresca y seca se obtuvo con las plántulas del tratamiento 3 (MS + Pectimorf [1 mg.L-1]).
Tabla 3 Variables morfológicas y fisiológicas que se evaluaron en las plántulas de chiltepín (Capsicum annuum L.) cv. ‘glabriusculum’, en el momento de la transferencia a la fase de aclimatización (120 días). Diferentes letras indican diferencias significativas entre tratamientos (prueba de Tukey, p ≤ 0.05). Número de muestras (n = 15).
| Tratamientos | Altura de las plántulas (cm) | Número de brotes por plántula | Número de raíces | Longitud de las raíces (cm) | Masa fresca de las plántulas (g) | Masa seca de las plántulas (g) |
| 1. MS | 7.66a | 0.80d | 0.60d | 3.15d | 0.4300b | 0.0560c |
| 2. MS + 6-BAP (10-5 M) | 7.85a | 0.50d | 0.20e | 1.25e | 0.3325c | 0.0350e |
| 3. MS + Pectimorf (1 mg.L-1) | 6.35d | 3.30a | 3.00c | 5.38c | 0.4900a | 0.1009a |
| 4. MS + Pectimorf (5 mg.L-1) | 6.80c | 2.40b | 3.80b | 5.55b | 0.2350d | 0.0700b |
| 5. MS + Pectimorf (10 mg.L-1) | 7.05b | 2.25c | 5.00a | 5.68a | 0.3675c | 0.0400d |
Fuente: Elaboración propia.

Fuente: Elaboración propia.
Figura 2 Número de brotes (flechas) y raíces por explante en las plántulas de chiltepín (Capsicum annuum L.) cv. ‘glabriusculum’, en el momento de su transferencia a la fase de aclimatación (120 días) 1. MS; 2. MS + 6-BAP (10-5 M); 3. MS + Pectimorf (1 mg.L-1); 4. MS + Pectimorf (5 mg.L-1) y 5. MS + Pectimorf (10 mg.L-1). Se separaron los brotes al momento de sembrarlos en macetas.
Las plantas que se obtuvieron con los tratamientos en que se aplicó el Pectimorf (1 mg.L-1 - 10 mg.L-1) presentaron un 100% de enraizamiento, mientras que las del tratamiento 1 (MS solo) y 2 (6-BAP [10-5 M]) alcanzaron un 60% y 25%, respectivamente (datos no mostrados).
Según Swamy, Krupakar, Surendra & Koshy (2014), los explantes a las cuatro semanas de encontrarse en un medio de cultivo suplementado con 6-BAP (0.5 mg.L-1 - 3 mg.L-1) presentaron diferencias entre los cultivares: ‘Red capsicum’ (0.6 - 1.3 brotes por explante), ‘Yellow capsicum (0.3 - 1.3 brotes por explante), ‘Purple capsicum’ y ‘White capsicum’ (0.3 - 1 brotes por explante) y, ‘Green capsicum’ (0.3 - 1.6 brotes por explante). Sin embargo, los mejores resultados lo alcanzaron, en el caso de los cuatro primeros genotipos, cuando el medio se suplementó con 6-BAP (2 mg.L-1) y AIA (0.5 mg.L-1) (3-6.3 brotes por explante) y en el quinto (‘Green capsicum’) en un medio con la misma concentración de AIA pero con 6-BAP (3 mg.L-1) (6.6 brotes por explante).
Kumar et al. (2012) en Capsicum annuum L. cv. ‘X235’ en un medio MS solo no obtuvieron brotes, sin embargo en un medio suplementado con 6-BAP (2 mg.L-1) lograron 3.1 brotes por explante con 70.4% de enraizamiento; las altas concentraciones de esta citoquinina (9 mg.L-1) redujeron estos parámetros a 2.2 brotes por explante y 63% de enraizamiento, respectivamente. Estos autores alcanzaron los mejores resultados con un medio MS que contenía 6-BAP (9 mg.L-1) y AIA (1 mg.L-1) con 19.2 brotes y 95% de enraizamiento de los mismos, pero la elongación de los brotes la lograron en otro medio de cultivo que contenía GA3 (0.50 mg.L-1) con 6.6 cm.
Ahmad et al. (2006) en pimiento rojo (Capsicum annuum L.) cv. ‘pusa jwala’ en un medio de cultivo enriquecido con AIB (0.5-1.5 µM), obtuvieron entre 60% - 90% de enraizamiento, entre 11 - 11.20 raíces por brotes, con una longitud entre 3.40 cm - 3.74 cm.
Los efectos de diferentes combinaciones de reguladores del crecimiento en la micropropagación de Capsicum annuum L. fue expuesto por Otroshy, Moradi & Khayam (2011). Ellos emplearon segmentos nodales que cultivaron in vitro en un medio MS suplementado con AIA (0.5 mg.L-1) y ANA (0.1 mg.L-1) solo con 6-BAP (2 mg.L-1) indujeron un mayor número de brotes por explante comparado con la citoquinina sola que contenían los medios de cultivo. La adición de auxinas o citoquininas solas promovieron la inducción de raíces después de tres semanas de inoculados los explantes.
En el presente estudio, la formación de nuevos brotes, su elongación y enraizamiento se lograron en el mismo medio de cultivo, lo cual reduce la manipulación de las plántulas y los costos durante el período de cultivo in vitro de los explantes.
Cuantificación de clorofila en vitroplantas
Las plántulas que se obtuvieron in vitro con las diferentes concentraciones de Pectimorf 1, 5 y 10 mg.L-1 (tratamientos 3, 4 y 5, respectivamente) generalmente presentaron mayor contenido de clorofila a, b y feopigmentos. En tal sentido las plántulas del tratamiento 4 (MS + Pectimorf [5 mg.L-1]), fueron la que alcanzaron los mejores resultados en las variables que se evaluaron, diferenciándose de las del resto de los tratamientos (tabla 4).
Tabla 4 Contenido de clorofila α, clorofila β y feopigmentos en las plántulas de chiltepín (Capsicum annuum L.) cv. ‘glabriusculum’, en el momento de su transferencia a la fase de aclimatización (120 días). Peso seco (PS)
| Tratamientos | Clorofila α (mg/ g PS) | Clorofila β (mg/ g PS) | Feopigmentos (mg/ g PS) |
| MS | 1.883 | 0.307 | 0.429 |
| 6-BAP (10-5 M). | 1.998 | 0.318 | 0.478 |
| Pectimorf (1 mg.L-1) | 1.080 | 0.182 | 0.238 |
| Pectimorf (5 mg.L-1) | 4.211 | 0.548 | 1.040 |
| Pectimorf (10 mg.L-1) | 2.142 | 0.297 | 0.512 |
Fuente: Elaboración propia.
Siddique & Anis (2006), en Capsicum annuum L cv. ‘Pusa Jwala’ propagado in vitro en un medio MS suplementado con TDZ (1.5 µM) y AIA (0.5 µM), obtuvieron un alto porcentaje de regenearción de plantas y mayor número de brotes por explante; para el enraizamiento de las mismas emplearon el mismo medio basal, pero enriquecido con ANA (1 µM) y para el enraizamiento ex vitro (fase de aclimatización) se le aplicó en la parte basal de los explantes (previamente se le realizó un corte a los mismos) AIB (200 µM) durante 30 min y obtuvieron un 95% de supervivencia. Asimismo, el contenido de carotenoides fue significativamente superior en las plantas obtenidas in vitro comparadas con las plantas provenientes de semillas.
En el trabajo que se presenta, cuando se empleó el Pectimorf (1 mg.L-1 - 10 mg.L-1), el contenido de clorofilas a y b, así como el de feopigmentos y la supervivencia de las plantas fueron superiores a los informados por los autores anteriores. Estos resultados son inéditos en Capsicum spp., pero en otras especies no, tal es el caso de las hojas de banano (Musa spp.) cuando fueron tratadas con esta oligosacarina (1 mg.L-1) presentaron un mayor contenido de clorofilas (Izquierdo, 2014). Por otra parte, el aumento del contenido de clorofilas foliares totales, pudiera contribuir a incrementar la fotosíntesis, ya que las oligosacarinas como el Pectimorf, intervienen en el incremento en masa seca de las plantas.
El 100% de las plántulas tratadas in vitro con Pectimorf, cinco días después de su transferencia a la fase de aclimaztización sobrevivieron; sin embargo murió una planta del tratamiento control (90%) y dos del tratamiento de BAP (80%) (figura 3).

Fuente: Elaboración propia.
Figura 3 Plántulas de chiltepín (Capsicum annuum L.) cv. ‘glabriusculum’, cinco días después de su transferencia a la fase de aclimatación. 1. MS; 2. MS + 6-BAP (10-5 M); 3. MS + Pectimorf (1 mg.L-1); 4. MS + Pectimorf (5 mg.L-1) y 5. MS + Pectimorf (10 mg.L-1).
Se determinó la tasa de crecimiento después de 50 días, en donde se observó que al aplicar Pectimorf en concentración de 10 mg/L el incremento de crecimiento fue mayor que en los otros tratamientos probados y al aplicar BAP fue el menor crecimiento, aún menor que el control y la desviación estándar muy alta, por lo que se observa que hubo alta variabilidad en el crecimiento (tabla 5)
Tabla 5 Tasa de crecimiento (%) de las plantas transplantadas a macetas después de 50 días de siembra. La letras muestra la diferencia significativa entre cada tratamiento de acuerdo al análisis estadístico Holm-Sidak, p ≤ 0.05). Número de muestras (n = 15).
| Tratamientos | Tasa de crecimiento (%) |
| MS | 106.9b |
| 6-BAP (10-5 M). | 52.2c |
| Pectimorf (1 mg.L-1) | 168.2ab |
| Pectimorf (5 mg.L-1) | 144.6ab |
| Pectimorf (10 mg.L-1) | 189.8a |
Fuente: Elaboración propia.
Estos resultados confirman el efecto antiestrés que provoca el Pectimorf en la transferencia de las plántulas de la fase in vitro a la ex vitro y el mayor vigor de las plantas, lo cual es muy benefico para puedan aclimatizarse exitosamente a las condiciones ambientales. Resultados similares se han informado en otros cultivos por diferentes autores en otros cultivos (Izquierdo et al., 2009; Izquierdo, 2014; Suárez & Hernández, 2008).
Capsicum spp. es uno de los géneros de la familia Solanaceae más recalcitrante para su manipulación in vitro. Las mayores dificultades en la regeneración de plantas son la inducción de nuevos brotes y la elongación de los mismos, así como la formación de rosetas a partir de hojas distorcionadas, lo cual afecta el desarrollo normal de los brotes (Ochoa-Alejo & RamírezMalagón, 2001). Sin embargo, en este estudio, no se observaron estas anomalías en las vitroplantas que se obtuvieron con Pectimorf.
El efecto positivo en la regeneración in vitro de plántulas de pimiento cuando utilizaron bajas concentraciones de AgNO3 fue expuesto por Grozeva et al. (2012), sin embargo, las altas concentraciones de esta sustancia (0.2 mg.L-1) inhibieron la regeneración del proceso.
Aunque en este trabajo no se desarrolló el protocolo para organogénesis, es importante mencionar trabajos con pimiento donde la correlación positiva en la organogénesis entre la expresión del gen que activa las proteínas quinasas dependiente de ciclinas tipo A (CDKA) y la etapa de proliferación a partir del cultivo in vitro de cotiledones (Mezghani et al., 2014). Los autores concluyeron que la expresión de las CDKA puede emplearse como un marcador molecular en la fase de desdiferenciación celular. Resultados similares, pero en banano (Musa spp.) clon ‘FHIA-18’, expuso Izquierdo (2014), quien plantea que las citoquininas (CK) se incorporan mediante los transportadores de esta fitohormona, que se encuentran en la membrana, y se unen en el núcleo a los oligogalacturónidos (OGs) como el Pectimorf y a las auxinas como el AIA; y el complejo formado AIA/OGs/CK, pudiera activar las CDKA (presente durante todo el ciclo celular) e inclusive las de tipo B (CDKB) [se expresan preferentemente durante la transición de la fase G2 (post-síntesis)/M (mitosis) del ciclo celular] y estimular la formación de brotes (división celular), lo cual permite que se complete el ciclo celular.
Es importante mencionar que, si se lograran identificar los genes que regulan los procesos de desarrollo en cultivo de tejidos morfogénesis (organogénesis y embriogénesis somática) en Capsicum spp. y otras especies de plantas de importancia económica, sería de gran ayuda para mejorar los tratamientos y obtener mejores resultados.
Conclusiones
En el presente estudio, de acuerdo a los resultados obtenidos, se demostró un nuevo y eficiente método para la regeneración de plantas in vitro mediante el empleo de una oligosacarina de origen péctico (Pectimorf), donde se observó que este compuesto incrementa la producción de brotes y raíces simultáneamente. En cultivos in vitro la mayor producción de brotes, raíces, longitud de raíces, mayor vigor en las plantas se observó al aplicar Pectimorf 10 mg.L-1 a los 90 días. En la transferencia hacia la fase de aclimatación, aumentó el contenido de clorofilas y feopigmentos al aplicar Pectimorf 5 mg.L-1 y en segundo lugar Pectimorf 10 mg.L-1, asegurando la adaptación ex vitro. Así mismo la mayor tasa de crecimiento en la fase de aclimatación fue en las plantas tratadas con Pectimorf 10 mg.L-1 a los 50 días de siembra. Por lo tanto, en general, se puede recomendar el uso de Pectimorf en concentración de 10 mg.L-1.
Este protocolo de regeneración puede ser aplicado a la producción masiva de plantas de chiltepín (Capsicum annuum L.) cv. ‘glabriusculum’ y así conservar el germoplasma, incrementar la producción y reducir el precio del fruto.











 nueva página del texto (beta)
nueva página del texto (beta)


