INTRODUCCIÓN
Los edulcorantes son sustancias capaces de mimetizar el efecto dulce del azúcar y que, por lo general, la aportación energética es menor. Algunos de ellos son extractos naturales, mientras que otros son sintéticos; en este último caso se denominan edulcorantes artificiales (García-Almeida, Gracia, Casado & García, 2013). Los edulcorantes pueden clasificarse, por sus contenidos calóricos, como nutritivos (calóricos) y no nutritivos (acalóricos). Para el caso de los artificiales se dividen en dos grupos: el primero son los azúcares modificados como el jarabe de maíz de alta fructuosa, caramelo y azúcar invertido; el segundo son los alcoholes del azúcar, los cuales engloban al sorbitol, xilitol, manitol, eritritol maltitol, isomaltulosa, lactitol y glicerol.Para el caso de los edulcorantes acalóricos, se dividen también en naturales y sintéticos. Los naturales se conocen como edulcorantes naturales sin y como ejemplo tenemos al luo han guo, stevia, taumatina, pentadina, monelina y brazzeina. En los sintéticos acalóricos se encuentran el aspartame, sucralosa, sacarina, neotamo, acesulfame K, ciclamato, nehosperidina DC, alitamo y asvantamo (Durán, Rodríguez & Record, 2012; García et al., 2013). La importancia de esta clasificación reside en el efecto de los edulcorantes sobre la salud de las personas. En México, el 11% de la población padece diabetes mellitus, esto es, alrededor de 5.5 millones de mexicanos; en tanto, la obesidad afecta a cerca de 54 millones. La Norma Oficial Mexicana NOM-015-SSA2-1994 (Diario Oficial de la Federación, 2010) para la prevención, tratamiento y control de la diabetes, en la sección de definiciones, señala que los edulcorantes nutritivos aportan energía a la dieta e influyen sobre los niveles de insulina y glucosa. Los edulcorantes no nutritivos son endulzantes potentes, su aporte energético es mínimo y no afectan los niveles de insulina o glucosa sérica. Por ello, surge la necesidad de contar con endulzantes de bajo valor calórico que puedan sustituir al azúcar. Una alternativa muy viable es el uso de los glucósidos presentes en la hoja de stevia (Stevia rebaudiana Bertoni).
La stevia en un arbusto perenne que es nativa delsur de América. Sus hojas contienen glucósidos diterpénicos nombrados como steviósido, rebaudiósido A-F, steviolbiósido y dulcósido A. Los principales componentes endulzantes que se encuentran en la Stevia rebaudiana Bertoni son: steviósido (3% - 8%, peso seco), que es el endulzante de mayor presencia en las hojas, con un poder endulzante 300 veces mayor al del azúcar de caña; el rebaudiósido A es el segundo compuesto de mayor abundancia (1% - 2%) y el de mayor interés debido a que su sabor es de mejor calidad con un poder endulzante 400 veces mayor al del azúcar de caña; el dulcósido A tiene un poder endulzante de 50 - 120 veces mayor al del azúcar, pero su presencia en la hoja es de solo el 0.5%, peso seco, y finalmente se encuentra el steviolbiósido con una concentración en la hoja del 0.00059%, pero con un poder endulzante entre 100 - 125 veces mayor al de la caña de azúcar (trazas).
Se ha encontrado que los glucósidos son compuestos de bajo valor calórico, no exhiben ninguna toxicidad, es no cancerígeno y no presenta acción mutagénica (Liu, Li & Tang, 2010; Puri, Sharma & Tiwary, 2011). El valor terapéutico de la stevia consiste en la habilidad de estimular la secreción de insulina por el páncreas en el tratamiento de la diabetes y de otros disturbios del metabolismo de los carbohidratos (Adesh, Gopalakrishna, Kusum & Tiwari, 2012). Se encontró que extractos provenientes de la parte inferior de la stevia poseen propiedades antivirales y producen un efecto positivo en el tratamiento de neuralgia, anemia, lumbago, reumatismo, eczema y dermatitis. Además, recientemente se observó que los steviósidos tienen propiedades anti-amnesia y anti-tumorales (Adesh et al., 2012). Madan et al. (2010) mencionan que el steviósido, steviol y el isosteviol presentan actividad antioxidante debido a que causan la inhibición de la fosforilación oxidativa en las mitocondrias del hígado de ratas. Esta inhibición actúa sobre la ATP-asa, NASDH-oxidasa, succinato-oxidasa, succinato deshidrogenasa y sobre la actividad de la glutamato deshidrogenasa. Estudios in vitro han demostrado que extractos de stevia presentan actividad antimicrobiana sobre Streptococcous mutans, Streptococcus sobrinus y Lactobacillus acidophillus, organismos estrechamente relacionados en la producción y desarrollo de caries. Estudios in vivo han comprobado el efecto anti placa principalmente debido a una disminución en la producción de polímeros insolubles bacterianos. Además, sus propiedades antiinflamatorias y cicatrizantes podrían resultar potencialmente efectivas en el tratamiento de enfermedades periodontales (Contreras, 2013).
El interés por el gran potencial de los steviósidos ha generado la necesidad de establecer métodos de extracción y purificación, que van desde los métodos convencionales que involucran el uso de soluciones acuosas, alcohólicas o solventes orgánico, seguido por precipitación, coagulación y cristalización (Puri, Sharman, Barrow & Tiwary, 2012). También se han desarrollado métodos basados en técnicas modernas de extracción, como extracción con líquidos presurizados, extracción con agua caliente presurizada, extracción con fluidos supercríticos, extracción asistida por microondas (Puri et al., 2012) y la extracción asistida por ultrasonido (Liu et al., 2010). Esta última permite la extracción de los glucósidos de la stevia de una forma rápida y sin el uso de solventes orgánicos. En los últimos años la tecnología basada en el uso del ultrasonido se ha convertido en una herramienta valiosa en la ingeniería de los procesos alimentarios.
El uso del ultrasonido ha tomado dos direcciones en su aplicación. La primera es en el uso de ultrasonido de alta frecuencia, pero bajo poder usado principalmente en el control de calidad de procesos. La segunda es usar ultrasonido de baja frecuencia y alto poder para el procesamiento de productos o la intervención directa en algún punto del proceso. Dentro de esta aplicación del ultrasonido encontramos la extracción de productos naturales, la modificación de ingredientes, elaboración de emulsiones, inactivaciónenzimática y microbiana, así como procesos de fermentación (Escaplez & García-Pérez, 2011). En la extracción asistida por ultrasonido de los glucósidos se tiene un sistema sólido-líquido, el cual es uno de los más comunes. Uno de los principales beneficios que ofrece el ultrasonido en estos sistemas es el aumento de la trasferencia de masa inducida por el proceso de cavitación. La presión de una onda acústica consiste en una serie de compresiones y expansiones del medio en la dirección de la propagación de la onda. Cuando una alta presión negativa es aplicada a un líquido, las fuerzas intermoleculares de Van der Waals no son lo suficientemente fuertes para mantener la cohesión y se inicia la formación de pequeñas cavidades o microburbujas llenas de gas. La rápida nucleación, crecimiento y colapso de estas burbujas a microescala constituyen el fenómeno de cavitación (Cravotto & Cintas, 2006). La cavitación puede en general ser definida como fenómeno de formación, crecimiento y subsecuente colapso de microburbujas o cavidades que ocurre en un extremadamente pequeño intervalo de tiempo, liberando una gran cantidad de energía. La cavitación puede ser considerada uno de los métodos de introducción de energía más discretos, la energía disipada por unidad de volumen (huecos) es la energía promedio que entra y es de algunos órdenes de magnitud mayores que los procesos convencionales (Riesz, Berdahl & Christman, 1985). Liu et al. (2010) encontraron que la extracción asistida con ultrasonido de los glucósidos de la stevia a un tiempo de 32 min y a una temperatura de 68 ºC presentó un aumento 1.5 veces en el rendimiento comparado a una extracción convencional.
Al igual que los procesos convencionales, uno de los limitantes para el aprovechamiento de los glucósidos de la stevia es la presencia de color en los extractos y en los cristales. Para hacer más atractivo el uso de los glucósidos de la stevia es necesario implementar una serie de pasos para la remoción de los colorantes liberados durante el proceso de extracción.
La adsorción es una de las técnicas más empleadas para la remoción de color en virtud de la simplicidad del diseño, facilidad de operación e insensibilidad a las sustancias tóxicas. La adsorción es un proceso de separación, en el cual un componente que puede estar en fase gas o líquido se transfiere de forma selectiva a la superficie de un sólido que se convierte en un adsorbente. La selección correcta del material adsorbente puede hacer una gran diferencia entre una eficaz o mala separación. Existen atributos importantes que un material debe tener para ser considerado como un adsorbente; estos atributos son capacidad adsorbente, selectividad, regenerabilidad, cinética, compatibilidad y costo (Kent, 1995). De los materiales adsorbentes más utilizados se encuentra el carbón activado (CA). Los carbones activados, por su gran porosidad, son empleados ampliamente como adsorbentes en las operaciones industriales de purificación y recuperación química, lo cual se debe a su extensa área superficial entre 500 m2g-1 y 200 m2g-1 (Ortega, Arrieta, Guerrero & Taboada, 2013). Los procesos de adsorción se pueden clasificar en procesos dinámicos cuando la adsorción se realiza en una columna de lecho empacado y en procesos estáticos cuando se realizan en dispositivos que se operan por lotes. Los estudios de adsorción en disoluciones mediante experimentos por lotes proporcionan una forma de medir la eficacia, así como la capacidad máxima de adsorción. Estos experimentos consisten en colocar una cantidad determinada del material adsorbente en contacto con la disolución que contiene la sustancia a remover, manteniéndola en suspensión por medio de agitación por un determinado tiempo hasta alcanzar el equilibrio (Ortega et al., 2013). Para la remoción de colorantes en soluciones acuosas se han ocupado métodos químicos (coagulantes o floculantes), biológicos y físicos (filtración por membranas, destrucción electroquímica, irradiación, ozonización y la adsorción). La mayoría de estos procesos son costosos y conducen a la generación de lodos o a la formación de subproductos, sin embargo, se conoce que la adsorción es el método más eficaz y barato en la eliminación de color (Castellar, Angulo, Zambrano & Charris, 2013). Ensuncho, Robles & Carriazo (2015) realizaron la remoción del colorante azoico amarillo anaranjado, usando carbón activado como material adsorbente. Determinaron que el fenómeno de adsorción se ajustó al modelo de Langmuir con valores máximos de capacidad de adsorción (qmax) entre 162.601 mgg-1 y 373.134 mgg-1. Por su parte, Castellar et al. (2013) encontraron que la remoción del colorante azul de metileno por medio de carbón activado se ajustó a la isoterma descrita por el modelo de Langmuir con valores de qmax entre el rango de 76.3 mgg-1 a 87.0 mgg-1 y valores de b entre 0.64 dm3mg-1 y 0.53 dm3mg-1. Ribeiro, Lourenco & Monteiro (2011) realizaron una adsorción selectiva para remover impurezas presentes en el aceite crudo de vegetales. Determinaron con base en la afinidad de los compuestos a remover que la adsorción ocurre en el siguiente orden clorofilas>carotenoides>hidroper óxidos>productos de oxidación>ácidos grasos libres. Ribeiro et al. (2001) mencionan el uso del hidróxido de calcio como un agente decolorante, la función del hidróxido de calcio es el de precipitar las moléculas de clorofila así como posibles impurezas presentes en los extractos. Por lo expuesto anteriormente, el objetivo que persiguió el presente trabajo fue el probar y evaluar la capacidad del carbón activado y a la cal grado alimenticio en la remoción de clorofilas presentes en los extractos crudos de stevia.
MATERIALES Y MÉTODOS
Molienda y tamizado
Para dar mayor rendimiento a la extracción se sometió la hoja de stevia a una molienda. Este proceso se realizó en un mortero de porcelana. El resultado de la molienda se guardó en frascos limpios y secos con el fin de evitar que la muestra se humedezca. Se tamizó la muestra pulverizada con la malla de Nº 70, con el fin de aumentar la interacción de las ondas sónicas con la muestra y permitir la ruptura de las paredes celulares.
Extracción y determinación de clorofilas totales
Se utilizó el método espectrofotométrico propuesto por Hansmann (1973). La muestra triturada se suspende en una solución de acetona-agua al 90% (v/v) como disolvente extractor de los pigmentos. Se agitó y se dejó reposar en la oscuridad a 4 °C durante 24 h. Terminado el periodo se llevó a temperatura ambiente y se centrifugó a 2700 xg durante 5 min. Se midió la densidad óptica del sobrenadante a 665 nm, 645 nm y 630 nm, comprobando que no existiese turbidez ni partículas en suspensión. Como blanco se utilizó el propio disolvente.
Para la cuantificación se utilizó la ecuación propuesta por Parsons & Strickland (1965).
Ca(mgA-1) = 11.6 D.O.665 - 1.31 D.O.645 - 0.14 D.O.630
Cb(mgA-1) = 20.7 D.O.645 - 4.34 D.O.665 - 4.42 D.O.630
Cc(mgA-1) = 55.0 D.O.630 - 4.64 D.O.665 - 16.3 D.O.645
Donde Ca, Cb y Cc son las concentraciones de clorofila a, b y c respectivamente, y D.O. es la densidad óptica medida.
Extracción asistida por ultrasonido del Steviósido y Rebaudiósido A
Se utilizaron hojas de stevia adquiridas de un invernadero ubicado en el municipio de Ojo Zarco, en el estado de Veracruz. La hoja seca es pulverizada y tamizada, posteriormente se introduce en un matraz corazón de 125 ml de capacidad y se agrega 100 ml de agua destilada. El proceso de ultrasonido se realiza introduciendo la muestra stevia/agua a temperatura ambiente en un baño ultrasónico durante 6 h. La mezcla de extracción presenta dos fases. Se separó el sobrenadante con una pipeta y se depositó en un frasco para su análisis, el precipitado se dejó en el matraz de corazón. La parte del sobrenadante se filtró con papel filtro de poro grande, con el propósito de eliminar restos de hoja. Posteriormente se depositó en un matraz, del cual se retiró 1 ml y se diluye en 100 ml, con el fin de cuantificar la clorofila presente en el sobrenadante. La parte del precipitado resultante de la extracción se somete a lavados con agua destilada; se filtró la pasta con papel filtro y se lavó hasta que la pasta tienda a tener un aspecto fino desapareciendo la consistencia lodosa. Posteriormente se deposita en un matraz para cuantificar la clorofila presente en el precipitado.
Adsorción de clorofilas usando carbón activado (CA) como adsorbente
La parte del sobrenadante filtrado se sometió a un proceso de adsorción con carbón activado con el fin de separar la clorofila de la muestra. Se utilizaron 4 muestras de 50 ml de extracto con cantidades de carbón activado de 0.5 g, 1 g, 1.5 g y 2 g, respectivamente, y se pusieron en agitación magnética. Para evaluar la adsorción de clorofilas sobre el carbón activado en cada matraz se tomaron muestras de 5 ml del extracto tratado con el carbón activado cada 20 min por cada matraz. Las muestras se someten a centrifugación a 2000 xg durante 10 min para precipitar el carbón activado. Cada muestra se filtró con papel filtro de poro grande. Se preparó una dilución de 1 ml en 100 ml de agua destilada para cada muestra y se evaluó la cantidad de clorofila presente en cada muestra de 5 ml. Se comparó la cantidad de clorofila presente en el sobrenadante antes de utilizar el carbón activado.
Precipitación de clorofilas usando hidróxido de calcio (cal) en roca y cal grado alimenticio
La parte del sobrenadante filtrada se sometió a un proceso de precipitación con cal en roca y con cal grado alimenticio con el fin de separar la clorofila de la muestra. Se utilizaron 4 muestras de 50 ml con 10 g, 15 g, 20 g, 25 g y 30g de cada uno de ellos para evaluar el efecto en cada matraz. Se tomaron muestras de 5 ml cada 20 min por cada matraz. Las muestras se someten a centrifugación a 2000 xg durante 10 min para precipitar la cal. Cada muestra se filtró con papel filtro. Se preparó una dilución de 1 ml en 100 ml de cada muestra para evaluar la cantidad de clorofila presente en cada muestra de 5 ml. Se comparó la cantidad de clorofila presente en el sobrenadante antes de utilizar la cal.
Cuantificación de glucósidos retenidos en carbón activado y cal grado alimenticio
Para determinar la cantidad de glucósidos retenidos durante el proceso de adsorción y de precipitación se usó un método de cromatografía de líquidos (HPLC). Se utilizó Módulo de Separación 1100 HP HPLC con un controlador del sistema Agilent OpenLab Software inteligente, como fase móvil acetonitrilo: agua (30:70), con una columna de adsorción C18; detector UV-Vis a una longitud de 205 nm, a un flujo de 1 ml por minuto, volumen de inyección de 10 μL.
RESULTADOS
Cuantificación de clorofilas totales en extractos
Se llevó a cabo el proceso de cuantificación utilizando un espectrofotómetro de UV-VIS, para obtener los datos de concentración de clorofilas presentes en las hojas de stevia y construir una curva de calibración que relacionara las concentraciones en los experimentos de remoción de color. En la figura 1 se muestran los resultados de clorofila A, B y C presente en las hojas de stevia.

Fuente: Elaboración propia.
Figura 1 Concentración de clorofilas A, B y C presentes en extractos de stevia.
Se puede apreciar que existe una mayor concentración de clorofila tipo C en los extractos de stevia obtenidos por ultrasonido.
Adsorción de clorofilas con CA
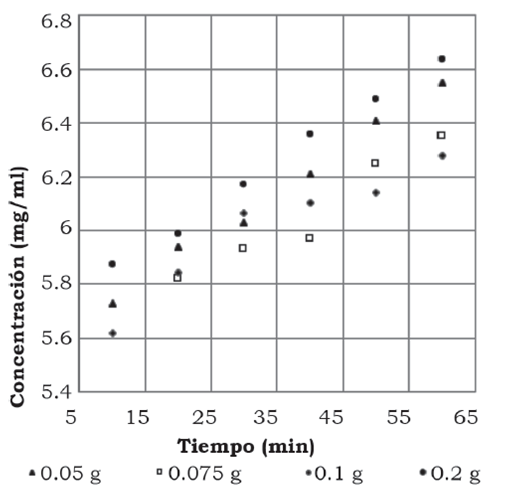
Se realizaron adsorciones con cantidades diferentes de carbón activado (0.05 g, 0.075 g, 0.1 g y 0.2 g). Se obtuvieron los siguientes resultados de disminución de concentración de clorofila en los extractos. En la figura 2 se observa la adsorción de clorofila A sobre diferentes cantidades de carbón activado a un tiempo máximo de 1 h de concentración.

Fuente: Elaboración propia.
Figura 2 Adsorción de clorofila A sobre diferentes cantidades de carbón activado.
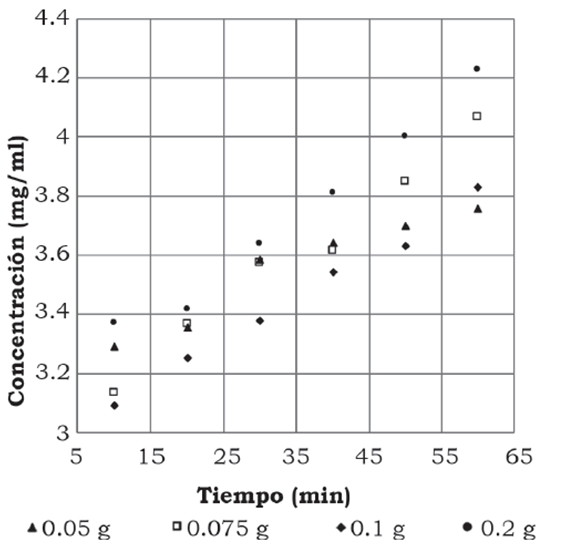
Las mejores adsorciones fueron a los 10 min con 0.05 g de CA, la concentración final fue de 5.521 mg/ml equivalente a una remoción del 22.3% de clorofila A, para la adsorción con 0.075 g la concentración final fue de 5.512 mg/ml, lográndose una remoción del 30.12% de clorofila A. En la figura 3 se observa la adsorción de clorofila B con 0.05 g de CA, la concentración final en el extracto fue de 3.29 mg/ml (39.24% de clorofila B adsorbido), para 0.075 g de CA se logró una concentración final de 3.13 mg/ml, lo que equivale al 49% de clorofila B removida.
Fuente: Elaboración propia.
Figura 3 Adsorción de clorofila B sobre diferentes cantidades de carbón activado.
Para el caso de la clorofila C, se probó de igual manera con 0.05 g, como se puede observar en la figura 4, la concentración final fue de 5.73 mg/ml que equivale al 70.40% de la clorofila C total, para el proceso con 0.075 g la concentración final fue de 5.06 mg/ml, un 74% de clorofila C removida del extracto.
Precipitación de clorofilas con cal
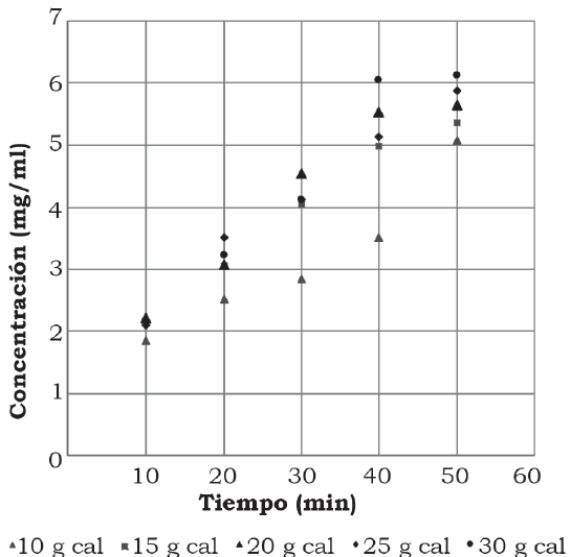
Para los experimentos usando cal grado alimenticio se realizaron ensayos con cantidades diferentes de cal (10 g, 15 g, 20 g y 25 g). En la figura 5 se observa la remoción de clorofila A sobre diferentes cantidades de cal a un tiempo máximo de 50 min.
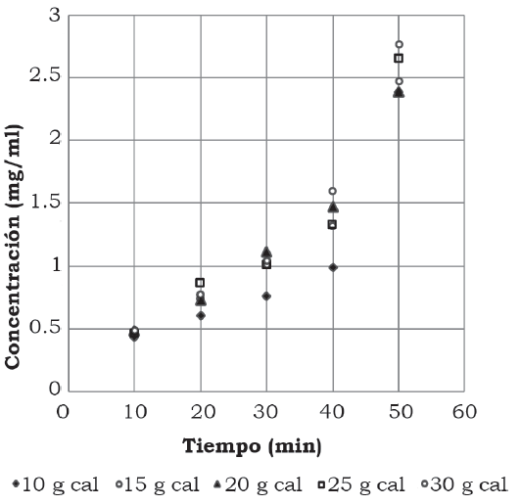
Fuente: Elaboración propia.
Figura 5 Remoción de clorofila A sobre diferentes cantidades de cal grado alimenticio.
Las mejores remociones fueron a los 10 min, usando 10 g de cal, la concentración final fue de 0.477 mg/ml equivalente a una remoción del 69.76% de clorofila A. La clorofila B presentó una mejor remoción sobre 10 g de cal con un tiempo de 10 min como se muestra en la figura 6, la concentración final de clorofila B en el extracto fue de 0.593 mg/ml lo cual representa una remoción del 67.4%.

Fuente: Elaboración propia.
Figura 6 Remoción de clorofila B sobre diferentes cantidades de cal grado alimenticio.
En la figura 7 se observa la remoción de clorofila C, al igual que con la clorofila A y B la mejor remoción se obtuvo con 10 g de cal a un tiempo de 10 min, la concentración de clorofila C en el extracto después del ensayo fue de 1.857 mg/ml que corresponde al 73.75% de la clorofila C presente en el extracto.
Determinación del modelo de isoterma de adsorción
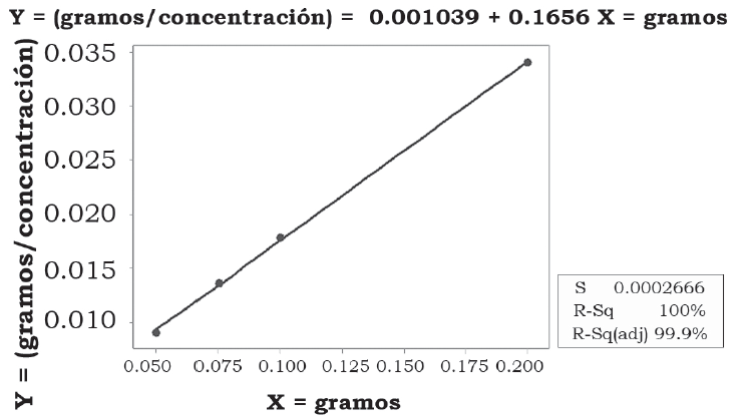
Se probaron tres modelos de adsorción, Freundlich, Langmuir y Brunauer-Emmett-Teller (BET), con el fin de determinar si el proceso de adsorción de las clorofilas presentes en los extractos de stevia sobre carbón activado se realiza por medio de la formación de monocapas, bicapas o multicapas. Se analizaron los resultados de la mejor adsorción con carbón activado, encontrándose que para la isoterma de Freundlich los datos se ajustaron un 89.1%, para la isoterma de BET los datos se ajustaron un 68.2% y para Langmiur un 100%. Como se puede observar en la figura 8, el proceso de adsorción con carbón activado se realiza por medio de la formación de monocapa, descrito por la isoter ma de Langmuir.
Determinación de la cantidad de glucósidos retenidos por el CA y por la cal grado alimenticio
Para determinar la cantidad de glucósidos retenidos en el carbón activado y la cal grado alimenticio durante los procesos de remoción, se usó un método de cromatografía de líquidos de alta resolución (HPLC, por sus siglas en inglés). En la figura 9a se presenta el cromatograma del extracto sin pasar por alguno de los procesos de remoción.

Fuente: Elaboración propia.
Figura 9 Cromatogramas de los glucósidos de la stevia. a) Sin pasar por el proceso de adsorción. En el tiempo 5.668 min se encuentra el pico del rebaudiosido A, a los 5.976 min se encuentra el pico del steviósido. b) Extracto después del proceso de adsorción con carbón activado. En el tiempo 5.646 min se encuentra el pico del rebaudiosido A, a los 5.964 min se encuentra el pico del steviósido. c) Extracto después del proceso de adsorción con cal grado alimenticio. En el tiempo 5.634 min se encuentra el pico del reabaudiosido A, a los 5.943 min se encuentra el pico del steviósido.
En las figuras 9b y 9c se presentan los cromatogramas de extractos después de pasar por el proceso de adsorción por carbón activado y de remoción por cal grado alimenticio respectivamente.
En la tabla 1 se presentan los gramos de steviósido y rebaudiósido A retenidos en el carbón activado y en la cal grado alimenticio.
Tabla 1 Gramos de steviósido y rebaudiosido A retenidos por el carbón activado y cal grado alimenticio durante el proceso de remoción de clorofilas.
| Gramos de glucósidos sin proceso de remoción de clorofilas |
Gramos de glucósidos retenidos en el carbón activado |
Gramos de glucósidos retenidos en la cal grado alimentico |
|
|---|---|---|---|
| Steviósido (g) | 0.0826 | 0.0196 | 0.004 |
| Rebaudiosido A (g) | 0.4126 | 0.0764 | 0.0132 |
Fuente: Elaboración propia.
Como se puede apreciar, la cal retuvo solo el 0.2% de steviósido y el 0.66% de rebaudiósido A.
DISCUSIÓN
El uso de los compuestos de la planta stevia, principalmente el steviósido y el rebaudiósido A como edulcorantes, es una opción totalmente viable y saludable debido a los beneficios extras que aportan. La principal desventaja en el uso de estos dos glucósidos es su sabor amargo y herbal debido a la presencia de clorofilas A, B, C, así como la presencia de aceites esenciales en el extracto. En algunos casos las hojas son pretratadas con un solvente no polar como el hexano, con la finalidad de retirar aceites esenciales y clorofilas (Asrul, Shazani & Ranajit, 2013). Otra forma de retirar el color es mediante el uso de éter dietílico, el cual además de ser costoso es altamente tóxico y aunque es posible eliminar todo el éter de los cristales de los glucósidos, esta operación involucra el uso de otros solventes. Es conocido que la clorofila se precipita en presencia de hidróxido de calcio o pH alcalinos (Puri et al., 2011; Ribeiro et al., 2001). La combinación de la extracción asistida por ultrasonido y el proceso de adsorción o de precipitación ha mostrado ser una alternativa eficaz, barata y ecológicamente amigable, pues no se requiere el uso de solventes orgánicos. La extracción asistida con ultrasonido de los glucósidos promueve la formación de fases. Ello disminuye la concentración de las clorofilas, debido a que estas se encuentran concentradas en la fase superior, constituida principalmente por aceites esenciales (los cuales promueven la formación de las fases) y clorofila. La mayoría de los glucósidos se encuentran en la fase inferior del extracto. Esto se debe a que el ultrasonido promueve la ruptura celular, liberando una mayor cantidad de clorofilas, concentrándose en la fase superior del extracto, permitiendo tener cristales con menos presencia de clorofilas. Durante el proceso de adsorción con carbón activado se logró retirar el 30.12% de clorofila A, 49% de clorofila B y un 74% de clorofila C, usando 0.075 g de carbón activado con un tiempo de contacto de 10 min. Posterior a los 10 min, se observó que la adsorción dejaba de suceder y que la concentración de clorofilas en los extractos volvía a aumentar por una posible desorción. Este proceso de adsorción se ajustó a la isoterma de Langmuir, indicando que el proceso de adsorción se da por la formación de una monocapa, con una capacidad máxima de adsorción de clorofilas de qmax = 962 mgg-1 y un valor de la constante de Langmuir de b = 159.413 gml-1. Al igual que lo descrito por Ensuncho et al. (2015), donde describen la adsorción de un colorante azoico, el fenómeno de adsorción de clorofilas se ajustó al modelo de Langmuir. Castellar et al. (2013) encontraron que la remoción del colorante azul de metileno por medio de carbón activado se ajustó a la isoterma descrita por el modelo de Langmuir con valores de qmax entre el rango de 76.3 mgg-1 a 87.0 mgg-1 y valores de b entre 0.64 dm3mg-1 y 0.53 dm3mg-1. Comparando los valores obtenidos en la remoción de clorofilas, se puede deducir que hay una mayor afinidad del carbón activado por las clorofilas presentes en los extractos de stevia. Esta conclusión es similar a la obtenida por Ribeiro et al. (2013). Al realizar una adsorción selectiva para remover impurezas presentes en el aceite crudo de vegetales determinaron, con base en la afinidad de los compuestos a remover, que ocurre en el siguiente orden clorofilas>carotenoides>hidroperóxidos>produc tos de oxidación>ácidos grasos libres. Para el proceso de precipitación de las clorofilas se usó cal grado alimenticio como agente precipitante, el mejor tiempo de contacto fue de 10 min con 10 g de cal, lográndose un 69.76% de remoción de clorofila A, 67.4% de clorofila B y una remoción del 73.75% de clorofila C. Ambos procesos mostraron tener pérdidas pequeñas de steviósido y rebaudiósido A, siendo la cal el material que menos glucósidos retuvo durante el proceso de adsorción, reteniendo solo el 0.2% de steviósido y 0.66% de rebaudiósido A en comparación con el carbón activado que retuvo solo el 0.98% de steviósido y el 3.82% de rebaudiósido A.
CONCLUSIONES
El proceso de adsorción y de precipitado para la remoción de color generado por la presencia de clorofilas en los extractos de stevia mostraron ser procesos eficaces. En el proceso de adsorción con carbón activado, el mejor tiempo fue de 10 min, un tiempo mayor provoca que la adsorción deje de efectuarse y se empieza liberar la clorofila ya adsorbida. El fenómeno de adsorción de clorofilas se ajusta a la isoterma del modelo de Lagmuir. El uso de la cal grado alimenticio como material precipitante en el proceso de remoción de clorofilas presentó un mejor desempeño que el carbón activado, debido a que retiró porcentajes mayores de clorofila y retuvo una menor cantidad de glucósidos. Las condiciones de operación para el proceso de remoción de clorofila en extractos usando la cal son los siguientes: tiempo de contacto 10 min, 10 g de cal y una temperatura de 25 ºC. Además de ser un material no tóxico, el uso de la cal grado alimenticio es barato y fácil de manejar.











 nueva página del texto (beta)
nueva página del texto (beta)