INTRODUCCIÓN
El estado de Oaxaca es reconocido por albergar la mayor biodiversidad de fauna y flora terrestre del país (González-Pérez, Briones-Salas & Alfaro, 2004), al tener 8431 especies de plantas vasculares (García-Mendoza, 2004); 3112 especies de artrópodos y 1431 especies de vertebrados terrestres (49.1% de las especies del país) (González-Pérez et al., 2004), de las cuales 129 son de peces dulceacuícolas (Martínez-Ramírez & Gómez-Ugalde, 2006), 133 de anfibios y 245 de reptiles (Casas-Andreu, Méndez-de la Cruz & Aguilar-Miguel, 2004), 736 de aves (Navarro, García-Trejo, Peterson & Rodríguez-Contreras, 2004) y 190 de mamíferos (Briones-Salas & Sánchez-Cordero, 2004). La alta biodiversidad observada en este estado se relaciona con su fisiografía y geomorfología, originadas por una evolución geológica compleja mayor a mil millones de años (Centeno-García, 2004; Ortiz-Pérez, Hernández-Santana & Figueroa, 2004).
El litoral sur del Pacífico mexicano se encuentra delimitado por las costas de los estados de Guerrero, Oaxaca y Chiapas. Los estudios en esta área han recibido menor atención científica en comparación con otras áreas del mismo litoral en México (por ejemplo, el Golfo de California). En contraste con la parte terrestre, los estudios en el medio marino del estado de Oaxaca han sido escasos, sin embargo se ha contabilizado una biodiversidad marina y costera representada por cerca de 2157 especies (Bastida-Zavala et al., 2013).
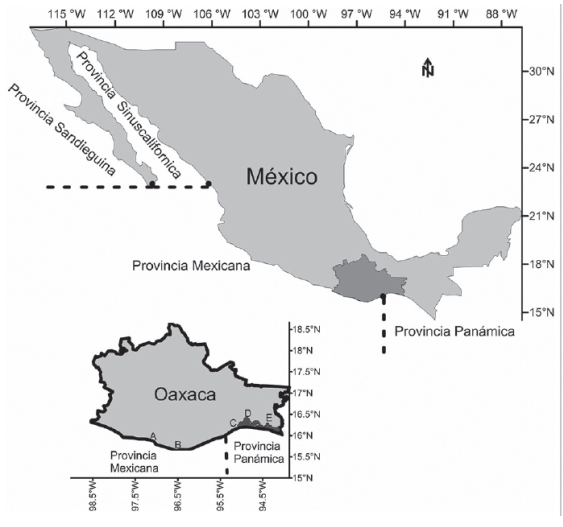
En el Océano Pacífico, Oaxaca tiene una franja litoral de 597.5 km, 8623 km2 de plataforma continental, 10 733 km2 de mar patrimonial y 184 000 km2 de zona marítima económica exclusiva; en este litoral se encuentran 170 000 ha de ecosistemas estuarinos, de las cuales 145 000 ha son lagunas costeras en 61 sistemas lagunarios (Martínez, 2000; Gobernador Constitucional del Estado de Oaxaca [GCEO], 2004). Dicho litoral colinda al norte con el estado de Guerrero y al sur con Chiapas (figura 1).
Fuente: Elaboración propia.
Figura 1 Mapa del área de estudio que delimita las provincias biogeográficas que ocurren en el litoral del Pacífico mexicano (sensu Briggs, 1974), y en particular lo correspondiente al estado de Oaxaca. En la actualidad, la provincia mexicana se considera parte de la panámica.
Con respecto a la ictiofauna marina, Bastida-Zavala et al. (2013) presentan un inventario a nivel estatal donde se refieren varias especies sin señalar su registro válido para Oaxaca, y tampoco distingue entre las especies de hábitos dulceacuícolas y las estrictamente marinas. Hasta el momento no existe un listado de los peces marinos donde se corrobore su posición sistemática actual ni sus patrones generales de distribución. Existen listados enfocados a regiones muy particulares, como lo son arrecifes coralinos (López-Pérez, Calderon-Aguilera, Zepeta-Vilchis, Pérez-Maldonado & López-Ortíz, 2013; López-Pérez et al., 2014), bahías (López-Pérez et al., 2010; Ramírez-Gutiérrez, Tapía-García, Ramos-Santiago & Ulloa, 2007) y lagunas costeras (Castro-Aguirre, Parra-Alcocer & De Lachica-Bonilla, 1977; Castro-Aguirre, 1982; Chávez 1979; Tapía-García & Mendoza-Rodríguez, 2005). Además se ha evaluado la composición ictiofaunística del Golfo de Tehuantepec (Acal & Arias, 1990; Anónimo, 1978; Bianchi, 1991; López-Chávez et al., 2012; Tapia-García, García-Abad, González-Medina, Macuitl-Montes & Cercenares-Ladrón de Guevara, 1994), sin embargo, dada su extensión geográfica compartida entre Chiapas y Oaxaca, es difícil distinguir las especies de cada estado.
Debido a la carencia de un listado de los peces marinos registrados para el estado de Oaxaca y dada su implicación económica y ecológica que tiene este recurso (por ejemplo, la importancia pesquera y el manejo sustentable), en la presente contribución se enlista de manera sistemática los recursos ícticos conlos que cuenta dicho estado.
MATERIALES Y MÉTODOS
Para determinar la composición ictiofaunística marina de Oaxaca se generó una base de datos (incluye los campos básicos de sus categorías taxonómicas, curatoriales y de georreferencia) conformada por registros de ejemplares depositados en las colecciones de referencia, nacionales (Colección Nacional de Peces [CNPE], Instituto de Biología de la Universidad Nacional Autónoma de México [UNAM]; Colección Ictiológica del Instituto de Ciencias del Mar y Limnología [I-ICMYL], UNAM; Colección de Peces del Laboratorio de Ictiología y Biología Pesquera de la Universidad del Mar, Campus Puerto Ángel [CP-UMAR]; Colección de Peces Continentales del Centro Interdisciplinario de Investigación para el Desarrollo Integral Regional del Instituto Politécnico Nacional [CPC-CIIDIR OAXACA]; Colección Ictiológica de la Dirección General Adjunta de Oceanografía, Secretaría de Marina [DIGADOC-P]); Colección de Referencia de Peces de la Unidad-Mazatlán del Centro de Investigación en Alimentación y Desarrollo, A. C. [CIAD]; y extranjeras (Institución Scripps de Oceanografía de la Universidad de California [SIO]; Museo de Historia Natural del Condado de Los Ángeles [LACM, por sus siglas en inglés]; Academia de Ciencias de California, San Francisco [CAS, por sus siglas en inglés]; Academia de Ciencias Naturales de la Universidad Drexel, Filadelfia [ANSP, por sus siglas en inglés]; Museo Americano de Historia Natural, Instituto Smithsoniano [USNM, por sus siglas en inglés]; Museo Americano de Historia Natural, New York [AMNH, por sus siglas en inglés]; Laboratorio de Investigación Costera del Golfo, Universidad del Sur de Mississippi [GCRL, por sus siglas en inglés]; Universidad de Stanford, Palo Alto, California [SU, por sus siglas en inglés]; Museo Royal Ontario, Departamento de Historia Natura [ROM, por sus siglas en inglés]). Los acrónimos siguen a Sabaj-Pérez (2014). El listado se complementó con información proveniente de literatura especializada (artículos científicos, libros de la ictiología nacional, catálogos de especies, entre otros), nuevos registros para el área (Del Moral-Flores, Anislado-Tolentino & González-Medina, 2014; Zepeta-Vilchis, Ayala-Bocos, Valencia-Méndez & López-Pérez, 2013) y nuevas especies descritas (Del Moral-Flores, Ramírez-Antonio, Angulo & Pérez-Ponce de León, 2015), así como algunas recolectas realizadas a lo largo de su costa.
Los registros de diversas colecciones fueron verificados físicamente (CPC-CIIDIR OAXACA, CNPE-IBUNAM, CP-UMAR). El estatus taxonómico actual de las especies fue verificado y validado con ayuda del trabajo de Eschmeyer & Fricke (2015). El listado taxonómico sigue el esquema sistemático de Nelson (2006), con modificaciones para determinados grupos, como en el grupo Elasmobranchii (Castro-Aguirre & Espinosa-Pérez, 1996; Espinosa-Pérez, Castro-Aguirre & Huidobro-Campos, 2004).
Las afinidades zoogeográficas de las especies fueron establecidas bajo el esquema de regiones y provincias de Briggs (1974, 1995) con modificaciones de Briggs & Bowen (2012), considerando su presencia en ellas bajo su distribución actual. Además, se consideraron las especies anfiamericanas (AA), anfipacíficas (AP) y circumtropicales (CT).
RESULTADOS
La ictiodiversidad marina del estado de Oaxaca está representada por 487 especies agrupadas en 284 géneros, 108 familias, 36 órdenes y dos clases (tabla 1).
Tabla 1 Elenco sistemático de la ictiofauna marina del estado de Oaxaca.
| Taxon supraespecífico | Afinidad biogeográfica | Referencia y colecciones |
| Especie | ||
| Clase Elasmobranchii | ||
| Orden Echinorhiniformes | ||
| Familia Echinorhinidae | ||
| Echinorhinus cookei Pietschmann, 1928 | AP | xiv |
| Orden Heterodontiformes | ||
| Familia Heterodontidae | ||
| Heterodontus mexicanus Taylor y Castro-Aguirre, 1972 | PS, PSC, PP | 3, 6, 8, xiv |
| Orden Orectolobiformes | ||
| Familia Ginglymostomatidae | ||
| Ginglymostoma unami Del Moral-Flores, Ramírez-Antonio, Angulo & Pérez Ponce de León, 2015 | PSC, PP | 3, 5, 6, 8, xiv |
| Familia Rhincodontidae | ||
| Rhincodon typus Smith, 1828 | CT | 6 |
| Orden Lamniformes | ||
| Familia Alopiidae | ||
| Alopias pelagicus Nakamura, 1935 | AP | 6, 8, xiv |
| Alopias superciliosus Lowe, 1839 | CT | 6, xiv |
| Orden Carcharhiniformes | ||
| Familia Triakidae | ||
| Mustelus henlei (Gill, 1863) | PS, PSC, PP | 6, xiv |
| Mustelus lunulatus Jordan y Gilbert, 1882 | PS, PSC, PP, PG | 1, 6, 8, ii, xiv |
| Familia Carcharhinidae | ||
| Carcharhinus cerdale Gilbert, 1898 | PSC, PP | 8, xiv |
| Carcharhinus falciformis (Muller y Henle, 1839) | CT | 8, xiv |
| Carcharhinus leucas (Müller y Henle, 1839) | CT | 8, xiv |
| Carcharhinus limbatus (Müller y Henle, 1839) | CT | 3, 6, 8, xiv |
| Galeocerdo cuvier (Péron y Lesueur, 1822) | CT | 6, 8, xiv |
| Nasolamia velox (Gilbert, 1898) | PSC, PP, PG, PCP | 8, xiv |
| Rhizoprionodon longurio (Jordan y Gilbert, 1882) | PS, PSC, PP, PCP | 3, 8, iv |
| Familia Sphyrnidae | ||
| Sphyrna corona Springer, 1940 | PSC, PP | xiv |
| Sphyrna lewini (Griffith y Smith, 1834) | CT | 8, xiv |
| Sphyrna mokarran (Rüppell, 1837) | CT | 8, xiv |
| Sphyrna vespertina Springer, 1940 | PS, PSC, PP | 6 |
| Sphyrna zygaena (Linnaeus, 1758) | CT | 8 |
| Orden Pristiformes | ||
| Familia Pristidae | ||
| Pristis pectinata Latham, 1794 | CT | 3 |
| Taxon supraespecífico | Afinidad biogeográfica | Referencia y colecciones |
| Especie | ||
| Pristis pristis (Linnaeus, 1758) | CT | 3 |
| Orden Torpediniformes | ||
| Familia Narcinidae | ||
| Diplobatis ommata (Jordan y Gilbert, 1890) | PSC, PP | 6 |
| Narcine entemedor Jordan y Starks, 1895 | PS, PSC, PP | 6, i, iii, v, vi, xiv |
| Narcine vermiculatus Breder, 1928 | PSC, PP | 6, i, iii, v, vi, xiv |
| Orden Rhinobatiformes | ||
| Familia Rhinobatidae | ||
| Rhinobatos glaucostigma Jordan y Gilbert, 1883 | PSC, PP | 6, 8, iii, v |
| Rhinobatos leucorhynchus Günther, 1867 | PS, PSC, PP | 3, 6, 8, iii, vi |
| Rhinobatos prahli Acero p. y Franke, 1995 | PP | xiv |
| Zapteryx xyster Jordan y Evermann, 1896 | PP | xiv |
| Orden Rajiformes | ||
| Familia Rajidae | ||
| Raja equatorialis Jordan y Bollman, 1890 | PSC, PP | 6 |
| Orden Myliobatiformes | ||
| Familia Urotrygonidae | ||
| Urobatis concentricus Osburn y Nichols, 1916 | END | 4, viii |
| Urotrygon sp. | PSC, PP | 3, 6, i, vi |
| Urotrygon cimar López y Bussing, 1998 | PP | vi |
| Urotrygon chilensis (Günther, 1872) | PSC, PP, PCP | 6, i, v, vi, xiv |
| Urotrygon munda Gill, 1863 | PSC, PP | 3, i, ii, vi |
| Urotrygon nana Miyake y McEachran, 1988 | PSC, PP | 3, 6, i, vi, xiv |
| Urotrygon rogersi (Jordan y Starks, 1895) | PSC, PP | 6, 8, i, vi, vii |
| Familia Dasyatidae | ||
| Dasyatis dipterura (Jordan y Gilbert, 1880) | PS, PSC, PP, PG, PCP | 8 |
| Dasyatis longa (Garman, 1880) | PS, PSC, PP, PG, PCP | 3, 6, 8, ii, iii, vi |
| Himantura pacifica (Beebe y Tee-Van, 1941) | PP | 3 |
| Pteroplatytrygon violacea (Bonaparte, 1832) | CT | |
| Familia Gymnuridae | ||
| Gymnura marmorata (Cooper, 1863) | PS, PSC, PP, PCP | 3, 6, 8, vi, xiv |
| Familia Myliobatidae | ||
| Aetobatus laticeps Gill, 1865 | PS, PSC, PP, PG | 4, 5, 6, 8, vi |
| Familia Rhinopteridae | ||
| Rhinoptera steindachneri Evermann y Jenkins, 1891 | PS, PSC, PP, PG | 6, 8 |
| Familia Mobulidae | ||
| Mobula japanica (Müller y Henle, 1841) | CT | 8 |
| Mobula thurstoni (Lloyd, 1908) | AP | 8 |
| Taxon supraespecífico | Afinidad biogeográfica | Referencia y colecciones |
| Especie | ||
| Clase Actinopterygii | ||
| Orden Elopiformes | ||
| Familia Elopidae | ||
| Elops affinis Regan, 1909 | PS, PSC, PP, PCP | 1, 2, 3, 8, iii, vi, xiv |
| Orden Albuliformes | ||
| Familia Albulidae | ||
| Albula esuncula (Garman, 1899) | PSC, PP, PG | 3, xiv |
| Albula gilberti Pfeiler y Van der Heiden, 2011 | PS, PSC, PP | 1, 2, 3, 8 |
| Albula pacifica (Beebe, 1942) | PSC, PP | 3, 8 |
| Orden Anguilliformes | ||
| Familia Muraenidae | ||
| Echidna nebulosa (Ahl, 1789) | AP | 5 |
| Gymnomuraena zebra (Shaw, 1797) | AP | 5 |
| Gymnothorax castaneus (Jordan y Gilbert, 1883) | PSC, PP, PG | 4, 5 |
| Gymnothorax equatorialis (Hildebrand, 1946) | PSC, PP | v, xiv |
| Gymnothorax panamensis (Steindachner, 1876) | PS, PSC, PP, PG | 8, vi |
| Gymnothorax verrilli (Jordan y Gilbert, 1883) | PP | i |
| Muraena argus (Steindachner, 1870) | PS, PSC, PP, PG | xiv |
| Muraena lentiginosa Jenyns, 1842 | PSC, PP, PG | 5, 8, iv |
| Familia Ophichthidae | ||
| Ichthyapus selachops (Jordan y Gilbert, 1882) | PSC, PP, PG | iv |
| Myrichthys tigrinus Girard, 1859 | PS, PP, PG | 4, 5 |
| Myrophis vafer Jordan y Gilbert, 1883 | PS, PSC,PP | 7 |
| Ophichthus triserialis (Kaup, 1856) | PS, PSC, PP | 7, 8, vi, xiv |
| Ophichthus zophochir Jordan y Gilbert, 1882 | PSC, PP | 7, 8, iv |
| Scytalichthys miurus (Jordan y Gilbert, 1882) | PSC, PP, PG | iv |
| Familia Congridae | ||
| Ariosoma gilberti (Ogilby, 1898) | PSC, PP, PG | 7 |
| Bathycongrus varidens (Garman, 1899) | PS, PSC, PP | 7, vii |
| Paraconger californiensis Kanazawa, 1961 | PSC, PP, PG | 7, iv, vii |
| Rhynchoconger nitens (Jordan y Bollman, 1890) | PSC, PP | viii |
| Xenomystax atrarius Gilbert, 1891 | PS, PSC, PP | ii |
| Familia Muraenesocidae | ||
| Cynoponticus coniceps (Jordan y Gilbert, 1882) | PSC, PP | 8 |
| Orden Clupeiformes | ||
| Familia Clupeidae | ||
| Etrumeus acuminatus Gilbert, 1890 | PS, PSC, PP, PG, PCP | 7 |
| Harengula thrissina (Jordan y Gilbert, 1882) | PS, PSC, PP, PG, PCP | 3, 5, 7, iv, v, vi, xiv |
| Taxon supraespecífico | Afinidad biogeográfica | Referencia y colecciones |
| Especie | ||
| Lile gracilis Castro-Aguirre y Vivero, 1990 | PP | 3, iii, vi, xiv |
| Lile stolifera (Jordan y Gilbert, 1882) | PS, PSC, PP, PG, PCP | 2, iii |
| Opisthonema bulleri (Regan, 1904) | PSC, PP, PCP | iv |
| Opisthonema libertate (Günther, 1867) | PS, PSC, PP, PG, PCP | 2, 3, 8, iii, iv, vi |
| Opisthonema medirastre Berry y Barrett, 1963 | PS, PSC, PP, PCP | |
| Sardinops sagax (Jenyns, 1842) | AP | 4 |
| Familia Pristigasteridae | ||
| Ilisha fuerthii (Steindachner, 1875) | PP, PCP | 3 |
| Neoopisthopterus tropicus (Hildebrand, 1946) | PSC, PP, PCP | vi |
| Odontognathus panamensis (Steindachner, 1876) | PP | 3 |
| Opisthopterus dovii (Günther, 1868) | PS, PSC, PP, PCP | 3, 8, vi, xiv |
| Opisthopterus equatorialis Hildebrand, 1946 | PP | vi |
| Pliosteostoma lutipinnis (Jordan y Gilbert, 1882) | PSC,PP | 8, vi, xiv |
| Familia Engraulidae | ||
| Anchoa analis (Miller, 1945) | END | 3 |
| Anchoa argentivittata (Regan, 1904) | PSC, PP, PG | 2, 3, iii, iv, vi |
| Anchoa curta (Jordan y Gilbert, 1882) | PS, PSC, PP, PCP | 2, 3, iii |
| Anchoa exigua (Jordan y Gilbert, 1882) | PS, PSC, PP | 2, 3, vi |
| Anchoa ischana (Jordan y Gilbert, 1882) | PSC, PP | 2, 3, iii |
| Anchoa lucida (Jordan y Gilbert, 1882) | PS, PSC, PP, PG | 2, 3, iii, vi |
| Anchoa mundeola (Gilbert y Pierson, 1898) | PSC, PP | 3, iii |
| Anchoa mundeoloides (Breder, 1928) | END | 2, 3 |
| Anchoa nasus (Kner y Steindachner, 1867) | PS, PSC, PP, PCP | 2, 3, vi, xiv |
| Anchoa panamensis (Steindachner, 1875) | PP | 2, vi |
| Anchoa scofieldi (Jordan y Culver, 1895) | PP | 2, vi |
| Anchoa walkeri Baldwin y Chang, 1970 | PSC, PP | 3 |
| Anchovia macrolepidota (Kner, 1863) | PSC,PP | 2, 3, iii, vi, xiv |
| Cetengraulis mysticetus (Günther, 1867) | PSC, PP, PG | 3, 7 |
| Orden Gonorynchiformes | ||
| Familia Chanidae | ||
| Chanos chanos (Forsskål, 1775) | AP | 1, 2, 3, 8, vi, xiv |
| Orden Siluriformes | ||
| Familia Ariidae | ||
| Bagre panamensis (Gill, 1863) | PS, PSC, PP, PCP | 8, iii, vi |
| Cathorops dasycephalus (Günther, 1864) | PSC,PP | |
| Cathorops fuerthii (Steindachner, 1876) | PP | 3, vi |
| Cathorops liropus (Bristol, 1897) | END | 2 |
| Notarius kessleri (Steindachner, 1876) | PP | vi |
| Notarius planiceps (Steindachner, 1876) | PP | 3 |
| Notarius troschelii (Gill, 1863) | PSC, PP, PCP | 3, 8 |
| Occidentarius platypogon (Günther, 1864) | PS, PSC, PP | 8, vi |
| Taxon supraespecífico | Afinidad biogeográfica | Referencia y colecciones |
| Especie | ||
| Sciades dowii (Gill, 1863) | PP | 2, 3 |
| Sciades guatemalensis (Günther, 1864) | PP | 2, 3, iii, xiv |
| Sciades seemanni (Günther, 1864) | PSC, PP, PCP | 2, 3, 8, xiv |
| Orden Osmeriformes | ||
| Familia Bathylagidae | ||
| Bathylagoides nigrigenys (Parr, 1931) | PS, PSC, PP | 7 |
| Orden Stomiiformes | ||
| Familia Phosichthyidae | ||
| Vinciguerria lucetia (Garman, 1899) | AP | 7, vii |
| Familia Stomiidae | ||
| Bathophilus filifer (Garman, 1899) | AP | vii |
| Idiacanthus antrostomus Gilbert, 1890 | AP | 7, vii |
| Orden Aulopiformes | ||
| Familia Paralepididae | ||
| Lestidiops neles (Harry, 1953) | PP | 7 |
| Familia Synodontidae | ||
| Synodus evermanni Jordan y Bollman, 1890 | PSC, PP | v, vii |
| Synodus lacertinus Gilbert, 1890 | PS, PSC, PP, PG | 4, 5, 8 |
| Synodus scituliceps Jordan y Gilbert, 1882 | PS, PSC, PP | 8, iii, iv, v, vi, xiv |
| Synodus sechurae Hildebrand, 1946 | PS, PSC, PP, PG | 4, 5, vi |
| Familia Scopelarchidae | ||
| Scopelarchoides nicholsi Parr, 1929 | PSC, PP | 7, sio |
| Orden Myctophiformes | ||
| Familia Myctophidae | ||
| Benthosema panamense (Tåning, 1932) | PS, PSC, PP | 7, vii |
| Diaphus pacificus Parr, 1931 | AP | 7, vii |
| Diogenichthys laternatus (Garman, 1899) | AP | 7 |
| Hygophum atratum (Garman, 1899) | PP | 7 |
| Lampanyctus parvicauda Parr, 1931 | AP | 7, vii |
| Myctophum aurolaternatum Garman, 1899 | AP | vii |
| Orden Lampriformes | ||
| Familia Trachipteridae | ||
| Trachipterus altivelis Kner, 1859 | PS, PP | 7 |
| Familia Regalecidae | ||
| Regalecus russelii (Cuvier, 1816) | AP | xiv |
| Orden Gadiformes | ||
| Familia Bregmacerotidae | ||
| Bregmaceros bathymaster Jordan y Bollman, 1890 | PS, PSC, PP, PG, PCP | 7, v, vii |
| Orden Ophidiiformes | ||
| Familia Ophidiidae | ||
| Brotula clarkae Hubbs, 1944 | PS, PSC, PP | v |
| Taxon supraespecífico | Afinidad biogeográfica | Referencia y colecciones |
| Especie | ||
| Cherublemma emmelas (Gilbert, 1890) | PSC, PP | 7, vii |
| Lepophidium pardale (Gilbert, 1890) | PSC, PP, PG, PCP | |
| Lepophidium prorates (Jordan & Bollman, 1890) | PS, PSC, PP, PCP | v |
| Ophidion galeoides (Gilbert, 1890) | PS, PSC, PP | |
| Ophidion imitator Lea, 1997 | PP | iv |
| Ophidion aff. scrippsae (Hubbs, 1916) O SP.1 | PS, PP | ii |
| Orden Batrachoidiformes | ||
| Familia Batrachoididae | ||
| Batrachoides boulengeri Gilbert y Starks, 1904 | PP | 2 |
| Batrachoides waltersi Collette y Russo, 1981 | PP | 3, vi |
| Batrachoides pacifici (Günther, 1861) | PP | vi, xiv |
| Porichthys ephippiatus Walker y Rosenblatt, 1988 | END | iv, v, vii |
| Porichthys margaritatus (Richardson, 1844) | PSC, PP | v, vi |
| Orden Lophiiformes | ||
| Familia Lophiidae | ||
| Lophiodes caulinaris (Garman, 1899) | PSC, PP | v, xiv |
| Familia Antennariidae | ||
| Antennatus sanguineus (Gill, 1863) | PSC, PP, PG | iv |
| Fowlerichthys avalonis (Jordan y Starks, 1907) | PS, PSC, PP | |
| Familia Ogcocephalidae | ||
| Zalieutes elater (Jordan y Gilbert, 1882) | PS, PSC, PP | v |
| Orden Mugiliformes | ||
| Familia Mugilidae | ||
| Chaenomugil proboscideus (Günther, 1861) | PSC, PP, PG | 8 |
| Mugil cephalus Linnaeus, 1758 | CT | 1, 2, 3, 7, 8, vi |
| Mugil curema Valenciennes, 1836 | AA | 1, 2, 3, 4, 5, iii, iv, vi, xiv |
| Mugil hospes Jordan y Culver, 1895 | AA | 2, 3 |
| Mugil setosus Gilbert, 1892 | PSC, PP, PG | xiv |
| Orden Gobiesociformes | ||
| Familia Gobiesocidae | ||
| Arcos erythrops (Jordan y Gilbert, 1882) | END | iv |
| Tomicodon eos rhadinus Briggs, 1955 | END | iv |
| Tomicodon boehlkei Briggs, 1955 | PSC, PP | xiv |
| Tomicodon petersii (Garman, 1875) | PSC, PP | vi |
| Tomicodon zebra (Jordan y Gilbert, 1882) | END | vi |
| Orden Atheriniformes | ||
| Familia Atherinopsidae | ||
| Atherinella eriarcha Jordan y Gilbert, 1882 | PSC, PP | 3, iv, vii |
| Atherinella guatemalensis (Günther, 1864) | PP | 3 |
| Taxon supraespecífico | Afinidad biogeográfica | Referencia y colecciones |
| Especie | ||
| Atherinella nepenthe (Myers y Wade, 1942) | PSC, PP | 3, iv |
| Melanorhinus cyanellus (Meek y Hildebrand, 1923) | PP, PG | iv, vii |
| Orden Beloniformes | ||
| Familia Exocoetidae | ||
| Cheilopogon papilio (Clark, 1936) | PS, PP | x |
| Cypselurus callopterus (Günther, 1866) | PS, PSC, PP, PG | 8 |
| Exocoetus monocirrhus Richardson, 1846 | AP | ix |
| Fodiator rostratus (Günther, 1866) | PS, PSC, PP, PG | 7, 8, vii |
| Prognichthys sealei Abe, 1955 | AP | ii |
| Prognichthys tringa Breder, 1928 | PSC, PP, PG | 7, iv, vii, xiii |
| Familia Hemiramphidae | ||
| Hemiramphus saltator Gilbert y Starks, 1904 | PS, PSC, PP, PG | 3, 4, 5, 8, vii |
| Hyporhamphus gilli Meek y Hildebrand, 1923 | PS, PSC, PP, PG | 3 |
| Hyporhamphus naos Banford y Collette, 2001 | PS, PSC, PP, PG, PCP | xiv |
| Hyporhamphus rosae (Jordan y Gilbert, 1880) | PS, PSC, PP | 2, 3, 5, vi |
| Hyporhamphus snyderi Meek y Hildebrand, 1923 | PP | 2, 3 |
| Oxyporhamphus micropterus (Valenciennes, 1847) | AP | 7, vii |
| Familia Belonidae | ||
| Ablennes hians (Valenciennes, 1846) | CT | 8 |
| Platybelone argalus (Lesueur, 1821) | CT | 4, 5 |
| Strongylura exilis (Girard, 1854) | PS, PSC, PP, PG | 2, 3, 8 |
| Tylosurus fodiator Jordan y Gilbert, 1882 | PSC, PP, PG | 3, 8, iv |
| Tylosurus pacificus (Steindachner, 1876) | PSC, PP, PG, PCP | 5, 8, ii |
| Orden Stephanoberyciformes | ||
| Familia Melamphaidae | ||
| Scopelogadus bispinosus (Gilbert, 1915) | PS, PSC, PP | 7, vii |
| Orden Beryciformes | ||
| Familia Holocentridae | ||
| Sargocentron suborbitale (Gill, 1863) | PSC, PP | 4, 5, 8 |
| Myripristis leiognathus Valenciennes, 1846 | PS, PSC,PP, PG | 4, 5, 7, 8, vii |
| Orden Syngnathiformes | ||
| Familia Fistulariidae | ||
| Fistularia commersonii Rüppell, 1838 | AP | 4, 5, 8, ii |
| Fistularia corneta Gilbert y Starks, 1904 | PS, PSC, PP, PG | vii, xiv |
| Familia Syngnathidae | ||
| Cosmocampus arctus (Jenkins y Evermann, 1889) | PS, PSC, PP, PG | iv |
| Hippocampus ingens Girard, 1858 | PS, PSC, PP | 3, 5, 8, iv, xiv |
| Pseudophallus starksii (Jordan y Culver, 1895) | PSC, PP | 3, iii, vi, viii |
| Syngnathus auliscus (Swain, 1882) | PS, PSC, PP | 3 |
| Taxon supraespecífico | Afinidad biogeográfica | Referencia y colecciones |
| Especie | ||
| Orden Scorpaeniformes | ||
| Familia Scorpaenidae | ||
| Scorpaena mystes Jordan y Starks, 1895 | PS, PSC, PP, PG | 5, ii |
| Scorpaena russula Jordan y Bollman, 1890 | PS, PSC, PP | v, vi, xiv |
| Scorpaenodes xyris (Jordan y Gilbert, 1882) | PS, PSC, PP, PG | 7 |
| Familia Triglidae | ||
| Bellator loxias (Jordan, 1897) | PSC, PP | |
| Bellator xenisma (Jordan y Bollman, 1890) | PS, PSC, PP | |
| Prionotus albirostris Jordan y Bollman, 1890 | PSC, PP | v |
| Prionotus birostratus Richardson, 1844 | PSC, PP | |
| Prionotus horrens Richardson, 1844 | PS, PSC, PP | vi |
| Prionotus ruscarius Gilbert y Starks, 1904 | PS, PSC, PP | 8, v, vi, xiv |
| Prionotus stephanophrys Lockington, 1881 | PS, PSC, PP, PG | v, vi, xiv |
| Orden Perciformes | ||
| Familia Centropomidae | ||
| Centropomus armatus Gill, 1863 | PP | 2, 3, iii, vi, viii |
| Centropomus medius Günther, 1864 | PSC, PP | 3, vi, xiv |
| Centropomus nigrescens Günther, 1864 | PS, PSC, PP | 3, 8, iii, vi, xiv |
| Centropomus robalito Jordan y Gilbert, 1882 | PSC, PP | 2, 3, 8, i, iii, vi, xiv |
| Centropomus unionensis Bocourt, 1868 | PSC, PP, PCP | 3, xiv |
| Centropomus viridis Lockington, 1877 | PS, PSC, PP | vi |
| Familia Serranidae | ||
| Alphestes immaculatus Breder, 1936 | PSC, PP, PG | 5 |
| Alphestes multiguttatus (Günther, 1867) | PSC, PP, PG | i, ii, v |
| Cephalopholis panamensis (Steindachner, 1876) | PSC, PP, PG | 4, 5, 7, 8 |
| Dermatolepis dermatolepis (Boulenger, 1895) | PS, PSC, PP, PG | 5, vi |
| Diplectrum euryplectrum Jordan y Bollman, 1890 | PS, PSC, PP, PG | |
| Diplectrum labarum Rosenblatt y Johnson, 1974 | PS, PSC, PP | iv, v |
| Diplectrum macropoma (Günther, 1864) | PS, PSC, PP | v |
| Diplectrum pacificum Meek y Hildebrand, 1925 | PS, PSC, PP | v, vi, xiv |
| Epinephelus analogus Gill, 1863 | PS, PSC, PP, PG, PCP | 5, 8, v |
| Epinephelus labriformis (Jenyns, 1840) | PS, PSC, PP, PG, PCP | 4, 5, 8, iii |
| Epinephelus quinquefasciatus (Bocourt, 1868) | PSC, PP, PCP | 5 |
| Hyporthodus acanthistius (Gilbert, 1892) | PS, PSC, PP, PCP | 8, ii, v |
| Hyporthodus exsul (Fowler, 1944) | PSC, PP | 8 |
| Hyporthodus niphobles (Gilbert y Starks, 1897) | PS, PSC, PP, PG, PCP | 8, v, vii |
| Paranthias colonus (Valenciennes, 1846) | PS, PSC, PP, PG, PCP | 8, |
| Rypticus bicolor Valenciennes, 1846 | PS, PSC, PP, PG | 5 |
| Rypticus nigripinnis Gill, 1861 | PS, PSC, PP, PG | xiv |
| Taxon supraespecífico | Afinidad biogeográfica | Referencia y colecciones |
| Especie | ||
| Serranus aequidens Gilbert, 1890 | PS, PSC, PP, PG | v |
| Serranus psittacinus Valenciennes, 1846 | PSC, PP, PG, PCP | 5 |
| Familia Opistognathidae | ||
| Opistognathus panamaensis Allen y Robertson 1991 | PP | |
| Opistognathus scops (Jenkins y Evermann, 1889) | PSC, PP, PG | xiv |
| Familia Priacanthidae | ||
| Pristigenys serrula (Gilbert, 1891) | PS, PSC, PP, PG | 8, iv, v, vi, xiv |
| Familia Apogonidae | ||
| Apogon pacificus (Herre, 1935) | PS, PSC, PP, PG | 5 |
| Apogon retrosella (Gill, 1862) | PSC, PP | 5 |
| Familia Nematistiidae | ||
| Nematistius pectoralis Gill, 1862 | PS, PSC, PP, PG | 8 |
| Familia Coryphaenidae | ||
| Coryphaena equiselis Linnaeus, 1758 | CT | 8, vii |
| Coryphaena hippurus Linnaeus, 1758 | CT | 7, 8, sio |
| Familia Echeneidae | ||
| Remora remora (Linnaeus, 1758) | CT | iv, vii |
| Familia Carangidae | ||
| Alectis ciliaris (Bloch, 1787) | CT | 8, i, vi, xi |
| Caranx caballus Günther, 1868 | PS, PSC, PP, PG | 1, 5, 7, 8, i, iii, iv, vi, xiv |
| Caranx caninus Günther, 1867 | PS, PSC, PP, PG | 2, 3, 4, 5, 8, iii, vi, xiv |
| Caranx sexfasciatus Quoy y Gaimard, 1825 | AP | 3, 7, 8, vi |
| Carangoides otrynter (Jordan y Gilbert, 1883) | PS, PSC, PP, PG | 8, i, iv, v |
| Carangoides vinctus (Jordan y Gilbert, 1882) | PS, PSC, PP | 3, 8, i |
| Chloroscombrus orqueta Jordan y Gilbert, 1883 | PS, PSC, PP, PG | 7, 8, i, iv, vi, xiv |
| Decapterus macarellus (Cuvier, 1833) | CT | 8, |
| Decapterus macrosoma Bleeker, 1851 | AP | 8, ii |
| Elagatis bipinnulata (Quoy y Gaimard, 1825) | CT | 4, 5, 8 |
| Gnathanodon speciosus (Forsskål, 1775) | AP | 1, 2, 3, 8, iii |
| Hemicaranx leucurus (Günther 1864) | PSC, PP | 2, 3, 8, vi |
| Hemicaranx zelotes Gilbert, 1898 | PS, PSC, PP, PG, PCP | 3 |
| Naucrates ductor (Linnaeus, 1758) | CT | 5, 7 |
| Oligoplites altus (Günther, 1868) | PSC, PP, PCP | 1, 2, 3, 8, iii, vi, xiv |
| Oligoplites refulgens Gilbert y Starks, 1904 | PS, PSC, PP | 8 |
| Oligoplites saurus (Bloch y Schneider, 1801) | AA | 2, 7, 8, iii, iv, vi, xiv |
| Selar crumenophthalmus (Bloch, 1793) | CT | 4, 5, 7, 8, v, vi |
| Selene brevoortii (Gill, 1863) | PS, PSC, PP | 1, 8, vi |
| Selene orstedii Lütken 1880 | PSC, PP | 8 |
| Selene peruviana (Guichenot, 1866) | PS, PSC, PP, PG | 1, 3, 7, 8, i, vi |
| Taxon supraespecífico | Afinidad biogeográfica | Referencia y colecciones |
| Especie | ||
| Seriola lalandi Valenciennes, 1833 | CT | 8 |
| Seriola rivoliana Valenciennes, 1833 | CT | 4, 5, 8 |
| Trachinotus kennedyi Steindachner, 1876 | PS, PSC, PP | 8, xiv |
| Trachinotus paitensis Cuvier, 1832 | PS, PSC, PP, PG, PCP | 2, 3, 8 |
| Trachinotus rhodopus Gill, 1863 | PS, PSC, PP, PG | 4, 5, 8, iv, vi |
| Trachurus symmetricus (Ayres, 1855) | PS, PSC, PP | 8 |
| Uraspis helvola (Forster, 1801) | AP | 8 |
| Familia Gerreidae | ||
| Deckertichthys aureolus (Jordan y Gilbert, 1882) | PSC, PP | 3, i, iii, v, vi |
| Diapterus brevirostris (Sauvage, 1879) | PS, PSC, PP, PG | 2, 3, 8, i, iii, vi, vii, viii, xiv |
| Eucinostomus currani Zahuranec, 1980 | PS, PSC, PP | 3, 4, 5, 8, i, iii, v, vi, xii, xiv |
| Eucinostomus dowii (Gill, 1863) | PSC, PP, PG | 3, v, vi, xiv |
| Eucinostomus entomelas Zahuranec, 1980 | PS, PSC, PP | 3, i |
| Eucinostomus gracilis (Gill, 1862) | PS, PSC, PP, PG | 2, 3, i, iii, v, vi, ix |
| Eugerres axillaris (Günther, 1864) | PSC, PP | iii, vi |
| Eugerres brevimanus (Günther, 1864) | PP | iii |
| Eugerres lineatus (Humboldt, 1821) | PSC, PP, PG | xiv |
| Gerres simillimus Regan, 1907 | PSC, PP, PG | 1, 2, 3, 4, 5, 8, iii, iv, vi, viii, xiv |
| Familia Lutjanidae | ||
| Hoplopagrus guentherii Gill, 1862 | PS, PSC, PP, PG | 5, 8 |
| Lutjanus aratus (Günther, 1864) | PS, PSC, PP | iii |
| Lutjanus argentiventris (Peters, 1869) | PS, PSC, PP, PG | 4, 5, 8, iii, vi, xiv |
| Lutjanus colorado Jordan y Gilbert, 1882 | PS, PSC, PP | 8, ii, vi, xiv |
| Lutjanus guttatus (Steindachner, 1869) | PS, PSC, PP, PG | 1, 5, 8, vi, xiv |
| Lutjanus inermis (Peters, 1869) | PSC, PP | 5, 8, iii |
| Lutjanus jordani (Gilbert, 1898) | PSC, PP, PG | 3, 8, xiv |
| Lutjanus novemfasciatus Gill, 1862 | PS, PSC, PP, PG | 5, 8, iii, vi, xiv |
| Lutjanus peru (Nichols y Murphy, 1922) | PS, PSC, PP, PCP | 8 |
| Lutjanus viridis (Valenciennes, 1846) | PSC, PP, PG | 5, xiv |
| Familia Lobotidae | ||
| Lobotes pacificus Gilbert, 1898 | PSC, PP | 3, 8, iii |
| Familia Haemulidae | ||
| Anisotremus caesius (Jordan y Gilbert, 1882) | PP | 8 |
| Anisotremus interruptus (Gill, 1862) | PS, PSC, PP, PG | 8, xiv |
| Anisotremus taeniatus Gill, 1861 | PS, PSC, PP | 2, 8 |
| Conodon serrifer Jordan y Gilbert, 1882 | PSC, PP | 3, vi |
| Genyatremus dovii (Günther, 1864) | PSC, PP | 3, 8, vi |
| Taxon supraespecífico | Afinidad biogeográfica | Referencia y colecciones |
| Especie | ||
| Genyatremus pacifici (Günther, 1864) | PP | 8 |
| Haemulon californiensis (Steindachner, 1876) | PS, PSC, PP | 1 |
| Haemulon flaviguttatum Gill, 1862 | PS, PSC, PP | 1, 5, 8, iii, xiv |
| Haemulon maculicauda (Gill, 1862) | PS, PSC, PP, PG | 1, 4, 5, 8, ii, vii |
| Haemulon scudderii Gill, 1862 | PS, PSC, PP | 5, 8, xiv |
| Haemulon sexfasciatum Gill, 1862 | PS, PSC, PP, PG | 2, 4, 5, 8 |
| Haemulon steindachneri (Jordan y Gilbert, 1882) | PSC, PP | 4, 5, 8 |
| Haemulopsis axillaris (Steindachner, 1869) | PSC, PP | 8, v, vi, vii, xiv |
| Haemulopsis elongatus (Steindachner, 1879) | PSC, PP, PCP | 3, 8, iii, xiv |
| Haemulopsis leuciscus (Günther, 1864) | PSC, PP, PCP | 2, 3, 8, i, iii, iv, v, vi, xiv |
| Haemulopsis nitidus (Steindachner, 1869) | PSC, PP | 3, 8, v, vi, vii |
| Microlepidotus brevipinnis (Steindachner, 1869) | PSC, PP | 8 |
| Orthopristis chalceus (Günther, 1864) | PS, PSC, PP, PG | 8, v, vi, vii |
| Orthopristis reddingi Jordan y Richardson, 1895 | END | 8 |
| Pomadasys bayanus Jordan y Evermann, 1898 | PSC, PP | iii, vi |
| Pomadasys branickii (Steindachner, 1879) | PSC, PP, PCP | iii |
| Pomadasys macracanthus (Günther, 1864) | PSC, PP | 2, 3, iii, vi, xiv |
| Pomadasys panamensis (Steindachner, 1876) | PSC, PP | 8, i, vi, vii, xiv |
| Xenichthys xanti Gill, 1863 | PSC, PP, PG | 1, 8, i, v, vi |
| Familia Sciaenidae | ||
| Bairdiella ensifera (Jordan y Gilbert, 1882) | PP | 3, vi, xiv |
| Cynoscion albus (Günther, 1864) | PSC, PP | vi |
| Cynoscion nannus Castro-Aguirre y Arvizu-Martínez, 1976 | PSC, PP | v |
| Cynoscion phoxocephalus Jordan y Gilbert, 1882 | PSC, PP, PG | 8 |
| Cynoscion reticulatus (Günther, 1864) | PSC, PP | 8, i, vi |
| Cynoscion squamipinnis (Günther, 1867) | PSC, PP | |
| Cynoscion stolzmanni (Steindachner, 1879) | PSC, PP | 1 |
| Cynoscion xanthulus Jordan y Gilbert, 1882 | PSC, PP | iii |
| Elattarchus archidium (Jordan y Gilbert, 1882) | PS, PSC, PP | 8, vi |
| Isopisthus remifer Jordan y Gilbert, 1882 | PS, PSC, PP | 1, iii, vi, xiv |
| Larimus acclivis Jordan y Bristol, 1898 | PSC, PP | 1, 8, v, vi |
| Larimus argenteus (Gill, 1863) | PS, PSC, PP | 8 |
| Larimus effulgens Gilbert, 1898 | PSC, PP | 8, vi |
| Larimus pacificus Jordan y Bollman, 1890 | PSC, PP, PG, PCP | |
| Menticirrhus elongatus (Günther, 1864) | PSC, PP, PCP | 8 |
| Menticirrhus panamensis (Steindachner, 1876) | PS, PSC, PP, PCP | 3, 8, xiv |
| Menticirrhus nasus (Günther, 1868) | PS, PSC, PP | 8, vi |
| Micropogonias altipinnis (Günter, 1864) | PSC, PP | 2, 3, 8, iii, vi, xiv |
| Micropogonias ectenes (Jordan y Gilbert, 1882) | PS, PSC, PP | vi |
| Taxon supraespecífico | Afinidad biogeográfica | Referencia y colecciones |
| Especie | ||
| Nebris occidentalis Vaillant, 1897 | PP, PG | 3, vi |
| Ophioscion scierus (Jordan y Gilbert, 1884) | PP | 8 |
| Ophioscion vermicularis (Günther, 1867) | PSC, PP | 8 |
| Paralonchurus goodei Gilbert, 1898 | PP | 3, vi |
| Pareques fuscovittatus (Kendall y Radcliffe, 1912) | END | 8 |
| Stellifer ericymba (Jordan y Gilbert, 1882) | PP | 8 |
| Stellifer fuerthii (Steindachner, 1876) | PP | vi |
| Stellifer illecebrosus Gilbert, 1898 | PSC, PP | vi |
| Umbrina bussingi López, 1980 | PP | FES-Z |
| Umbrina dorsalis Gill, 1862 | PS, PSC, PP | ENCB |
| Umbrina xanti Gill, 1862 | PS, PSC, PP | 1, i, v, vi |
| Familia Polynemidae | ||
| Polydactylus opercularis (Gill, 1863) | PS, PSC, PP, PCP | 8, iii, vi |
| Polydactylus approximans (Lay y Bennett, 1839) | PS, PSC, PP | 1, 3, 8, i, vi, vii, xiv |
| Familia Mullidae | ||
| Mulloidichthys dentatus (Gill, 1862) | PS, PSC, PP, PG | 4, 5, 8, i, vi, xiv |
| Pseudupeneus grandisquamis (Gill, 1863) | PSC, PP, PG | 1, 8, v, vi, vii, xiv |
| Familia Kyphosidae | ||
| Kyphosus elegans (Peters, 1869) | PSC, PP, PG | 3, 4, 5, 8 |
| Kyphosus vaigiensis (Quoy & Gaimard 1825). | AP | 4, 5, 8 |
| Kyphosus ocyurus (Jordan y Gilbert, 1882) | AP | 5, 8 |
| Familia Chaetodontidae | ||
| Chaetodon humeralis Günther, 1860 | PS, PSC, PP, PG | 4, 5, 8, i, v, vi |
| Johnrandallia nigrirostris (Gill, 1862) | PSC, PP, PG | 4, 5 |
| Familia Pomacanthidae | ||
| Holacanthus passer Valenciennes, 1846 | PS, PSC, PP, PG | 4, 5 |
| Pomacanthus zonipectus (Gill, 1862) | PS, PSC, PP, PG | 4, 5, xiv |
| Familia Cirrhitidae | ||
| Cirrhitichthys oxycephalus (Bleeker, 1855) | AP | 5 |
| Cirrhitus rivulatus Valenciennes, 1846 | PSC, PP, PG | 4, 5, 8, xiv |
| Oxycirrhites typus Bleeker, 1857 | AP | 5 |
| Familia Pomacentridae | ||
| Abudefduf concolor (Gill, 1862) | PSC, PP | 4 |
| Abudefduf declivifrons (Gill, 1862) | PS, PSC, PP | 5, iii, iv |
| Abudefduf troschelii (Gill, 1862) | PS, PSC, PP, PG | 4, 5, 8, iv, vi |
| Chromis atrilobata Gill, 1862 | PS, PSC, PP, PG | 4, 5, iv |
| Microspathodon bairdii (Gill, 1862) | PSC, PP, PG | 4, 5 |
| Microspathodon dorsalis (Gill, 1862) | PS, PSC, PP, PG | 4, 5 |
| Stegastes acapulcoensis (Fowler, 1944) | PSC, PP, PG | 4, 5 |
| Stegastes flavilatus (Gill, 1862) | PS, PSC, PP, PG | 4, 5, iv, vii |
| Taxon supraespecífico | Afinidad biogeográfica | Referencia y colecciones |
| Especie | ||
| Stegastes rectifraenum (Gill, 1862) | PS, PSC, PP | 4, 5 |
| Familia Labridae | ||
| Bodianus diplotaenia (Gill, 1862) | PS, PSC, PP, PG, PCP | 4, 5, 8, xiv |
| Halichoeres chierchiae Di Caporiacco, 1948 | PSC, PP, PG | 4, 5, 8 |
| Halichoeres dispilus (Günther, 1864) | PS, PSC, PP, PG | 4, 5, v |
| Halichoeres melanotis (Gilbert, 1890) | PS, PSC, PP | 5 |
| Halichoeres nicholsi (Jordan y Gilbert, 1882) | PSC, PP, PG | 4, 5, 8 |
| Halichoeres notospilus (Günther, 1864) | PSC, PP | 4, 5, 8, iv |
| Iniistius pavo (Valenciennes, 1840) | AP | 4, 5, 8 |
| Novaculichthys taeniorus (Lacepède, 1801) | AP | 4, 5 |
| Thalassoma grammaticum Gilbert, 1890 | PSC, PP, PG | 4, 5 |
| Thalassoma lucasanum (Gill, 1862) | PSC, PP, PG | 4, 5 |
| Familia Scaridae | ||
| Scarus compressus (Osburn & Nichols, 1916) | PSC, PP, PG | 4, 5 |
| Scarus ghobban Forsskål, 1775 | AP | 4, 5, 8 |
| Scarus perrico Jordan y Gilbert, 1882 | PSC, PP, PG | 8 |
| Scarus rubroviolaceus Bleeker, 1847 | AP | 4, 5 |
| Familia Uranoscopidae | ||
| Astroscopus zephyreus Gilbert y Starks, 1897 | PS, PSC, PP | 8, xiv |
| Familia Tripterygiidae | ||
| Axoclinus storeyae (Brock, 1940) | END | |
| Enneanectes carminalis (Jordan y Gilbert, 1882) | PS, PSC, PP | |
| Familia Dactyloscopidae | ||
| Dactyloscopus amnis Miller y Briggs, 1962 | PP | 3 |
| Dactyloscopus elongatus Myers y Wade, 1946 | END | iv |
| Dactyloscopus lunaticus Gilbert, 1890 | PSC, PP | iv, ix |
| Gillellus arenicola Gilbert, 1890 | PSC, PP | iv |
| Gillellus semicinctus Gilbert, 1890 | PS, PSC, PP | iv |
| Heteristius cinctus (Osburn y Nichols, 1916) | PSC, PP | iv |
| Myxodagnus macrognathus Hildebrand, 1946 | PSC, PP, PCP | iv |
| Familia Blenniidae | ||
| Entomacrodus chiostictus (Jordan y Gilbert, 1882) | PSC, PP, PG | iv |
| Hypsoblennius brevipinnis (Günther, 1861) | PSC, PP, PG | vii |
| Ophioblennius steindachneri Jordan y Evermann, 1898 | PS, PSC, PP, PG | 4, 5 |
| Plagiotremus azaleus (Jordan y Bollman, 1890) | PS, PSC, PP, PG | 5, iv |
| Familia Labrisomidae | ||
| Malacoctenus hubbsi Springer, 1959 | PS, PSC, PP | |
| Malacoctenus zonifer (Jordan y Gilbert, 1882) | END | iv |
| Paraclinus mexicanus (Gilbert, 1904) | PSC, PP | iv |
| Taxon supraespecífico | Afinidad biogeográfica | Referencia y colecciones |
| Especie | ||
| Starksia grammilaga Rosenblatt y Taylor, 1971 | PP | |
| Familia Chaenopsidae | ||
| Acanthemblemaria balanorum Brock, 1940 | PSC, PP | fes i |
| Acanthemblemaria macrospilus Brock, 1940 | PSC, PP | vii |
| Chaenopsis coheni Böhlke, 1957 | END | 5 |
| Coralliozetus boehlkei Stephens, 1963 | PSC, PP | iv |
| Emblemaria piratica Ginsburg, 1942 | PSC, PP | vii |
| Stathmonotus lugubris Böhlke, 1953 | END | iv, xi |
| Familia Eleotridae | ||
| Dormitator latifrons (Richardson, 1844) | PS, PSC, PP, PG | 1, iii, vi, viii, xiv |
| Eleotris picta Kner, 1863 | PSC, PP, PG | iii, vi, viii, xiv |
| Gobiomorus maculatus (Günther, 1859) | PSC, PP, PG | iii, vi, xiv |
| Gobiomorus polylepis Ginsburg, 1953 | PP | iii, vi |
| Familia Gobiidae | ||
| Aboma etheostoma Jordan y Starks, 1895 | PSC, PP | |
| Barbulifer mexicanus Hoese y Larson, 1985 | END | |
| Bathygobius ramosus Ginsburg, 1947 | PS, PSC, PP, PCP | iv |
| Bollmannia stigmatura Gilbert, 1892 | PS, PSC, PP | ii |
| Bollmannia marginalis Ginsburg, 1939 | PSC, PP | vii |
| Bollmannia umbrosa Ginsburg, 1939 | PSC, PP | vii |
| Coryphopterus urospilus Ginsburg, 1938 | PS, PSC, PP, PG | vii |
| Chriolepis cuneata Bussing, 1990 | PSC, PP | |
| Ctenogobius sagittula (Günther, 1862) | PS, PSC, PP | 1, 2, 3 |
| Elacatinus puncticulatus (Ginsburg, 1938) | PSC, PP | 5 |
| Evermannia zosterura (Jordan y Gilbert, 1882) | PSC, PP, PCP | 3 |
| Gobionellus microdon (Gilbert, 1892) | PSC, PP | 2, 3, iii, vi, xii, xiv |
| Microgobius erectus Ginsburg, 1938 | PSC, PP | vii |
| Microgobius miraflorensis Gilbert y Starks, 1904 | PSC, PP | 2, 3, iii |
| Microgobius tabogensis Meek y Hildebrand, 1928 | PP | 3 |
| Parrella lucretiae (Eigenmann y Eigenmann, 1888) | PP | 3 |
| Familia Microdesmidae | ||
| Microdesmus dorsipunctatus Dawson, 1968 | PSC, PP | 3 |
| Familia Ephippidae | ||
| Chaetodipterus zonatus (Girard, 1858) | PS, PSC, PP | 1, 8, vi, vii, xiv |
| Parapsettus panamensis (Steindachner, 1876) | PSC, PP | 8, vi, xiv |
| Familia Zanclidae | ||
| Zanclus cornutus (Linnaeus, 1758) | AP | 5 |
| Familia Acanthuridae | ||
| Acanthurus nigricans (Linnaeus, 1758) | AP | 5 |
| Taxon supraespecífico | Afinidad biogeográfica | Referencia y colecciones |
| Especie | ||
| Acanthurus xanthopterus Valenciennes, 1835 | AP | 3, 4, 5, 8, iii |
| Prionurus laticlavius (Valenciennes, 1846) | PSC, PP, PG | 4, 5, |
| Prionurus punctatus Gill, 1862 | PSC, PP, PG | 4, 5, 8, xiv |
| Familia Sphyraenidae | ||
| Sphyraena ensis Jordan y Gilbert, 1882 | PSC, PP | 1, 8, iv, v, vi |
| Familia Trichiuridae | ||
| Trichiurus nitens Garman, 1899 | PSC, PP, PG, PCP | vi |
| Familia Gempylidae | ||
| Nealotus tripes Johnson, 1865 | CT | |
| Familia Scombridae | ||
| Acanthocybium solandri (Cuvier, 1832) | CT | 8 |
| Auxis brachydorax Collette y Aadland, 1996 | PS, PSC, PP, PG | 8, vii |
| Euthynnus lineatus Kishinouye, 1920 | PS, PSC, PP, PG | 8 |
| Katsuwonus pelamis (Linnaeus, 1758) | CT | 8 |
| Sarda orientalis (Temminck y Schlegel, 1844) | AP | 8 |
| Scomber japonicus Houttuyn, 1782 | AP | 8 |
| Scomberomorus sierra Jordan y Starks, 1895 | PS, PSC, PP, PG, PCP | 8 |
| Thunnus albacares (Bonnaterre, 1788) | CT | 8 |
| Familia Xiphiidae | ||
| Xiphias gladius Linnaeus, 1758 | CT | 8 |
| Familia Istiophoridae | ||
| Istiompax indica (Cuvier, 1832) | AP | 8 |
| Istiophorus platypterus (Shaw, 1792) | CT | 8, vii, viii |
| Kajikia audax (Philippi, 1887) | AP | 8 |
| Makaira nigricans Lacepède, 1802 | CT | 8 |
| Familia Stromateidae | ||
| Peprilus medius (Peters, 1869) | PSC, PP, PG | v, vi, xiv |
| Peprilus snyderi Gilbert y Starks, 1904 | PS, PSC, PP, PCP | 8, vi |
| Orden Pleuronectiformes | ||
| Familia Achiridae | ||
| Achirus mazatlanus (Steindachner, 1869) | PS, PSC, PP | 3, iii, vi |
| Achirus scutum (Günther, 1862) | PSC, PP, PCP | 3, i, vi, xiv |
| Trinectes fimbriatus (Günther, 1862) | PP | 3 |
| Trinectes fonsecensis (Günther, 1862) | PS, PSC, PP, PG | 2, 3, vi, xiv |
| Familia Cynoglossidae | ||
| Symphurus atramentatus Jordan y Bollman, 1890 | PS, PSC, PP, PG | ii, iv |
| Symphurus atricauda (Jordan y Gilbert, 1880) | PS, PSC, PP | i |
| Symphurus elongatus (Günther, 1868) | PSC, PP | i, vi |
| Symphurus fasciolaris Gilbert, 1892 | PS, PSC, PP | ii |
| Taxon supraespecífico | Afinidad biogeográfica | Referencia y colecciones |
| Especie | ||
| Symphurus melanurus Clark, 1936 | PS, PSC, PP, PCP | iv |
| Symphurus melasmatotheca Munroe y Nizinski, 1990 | PP | vii |
| Symphurus prolatinaris Munroe, Nizinski y Mahadeva, 1991 | PP | vii |
| Symphurus undecimplerus Munroe y Nizinski, 1990 | PP | vii |
| Symphurus williamsi Jordan y Culver, 1895 | PS, PSC, PP, PCP | vii |
| Familia Paralichthyidae | ||
| Ancylopsetta dendritica Gilbert, 1890 | PSC, PP | v |
| Cyclopsetta panamensis (Steindachner, 1876) | PSC, PP | 1, 3, 8, vi, xiv |
| Cyclopsetta querna (Jordan y Bollman, 1890) | PSC, PP | 1, 8, ii, vi |
| Citharichthys gilberti Jenkis y Evermann, 1889 | PS, PSC, PP | 2, 3, i, iii, vi, xiv |
| Etropus crossotus Jordan y Gilbert, 1882 | AA | xiv |
| Etropus peruvianus Hildebrand, 1946 | PSC, PP, PCP | 3, vi, xiv |
| Paralichthys woolmani Jordan y Williams, 1897 | PS, PSC, PP, PG | 8 |
| Syacium latifrons (Jordan y Gilbert, 1882) | PS, PSC, PP, PG | 3, 8, i,v, vi, vii, xiv |
| Syacium longidorsale Murakami y Amaoka, 1992 | PP | vi |
| Syacium ovale (Günther, 1864) | PS, PSC, PP | 8, i, iv, v, vi, xiv |
| Familia Bothidae | ||
| Bothus constellatus (Jordan, 1889) possible sino | PSC, PP, PG | iv, xiv |
| Bothus leopardinus (Günther, 1862) | PSC, PP, PG | i, iv, vi |
| Engyophrys sanctilaurentii Jordan y Bollman, 1890 | PS, PSC, PP | iv, v |
| Monolene asaedae Clark, 1936 | END | iv, v |
| Orden Tetraodontiformes | ||
| Familia Balistidae | ||
| Balistes polylepis Steindachner, 1876 | PS, PSC, PP, PG, PCP | 5, 8, i, v, vi, vii, xiv |
| Canthidermis maculata (Bloch, 1786) | CT | 8, xiv |
| Melichthys niger (Bloch, 1758) | CT | 5 |
| Pseudobalistes naufragium (Jordan y Starks, 1895) | PS, PSC, PP, PG | 5, 8 |
| Sufflamen verres (Gilbert y Starks, 1904) | PS, PSC, PP, PG | 4, 5, 8, ii, v |
| Familia Monacanthidae | ||
| Aluterus monoceros (Linnaeus, 1758) | CT | 8, i, v, vi |
| Aluterus scriptus (Osbeck, 1765) | CT | 5, 8 |
| Cantherhines dumerilii (Hollard, 1854) | AP | 5 |
| Familia Ostraciidae | ||
| Ostracion meleagris Shaw 1796 | AP | 5 |
| Familia Tetraodontidae | ||
| Arothron hispidus (Linnaeus, 1758) | AP | 4, 5, xiv |
| Arothron meleagris (Anonymous, 1798) | AP | 4, 5, xiv |
| Canthigaster punctatissima (Günther, 1870) | PSC, PP, PG | 4, 5, iv |
| Sphoeroides annulatus (Jenyns, 1842) | PS, PSC, PP, PG | 2, 3, 5, 8, I, iv, v, vi, xiv |
| Taxon supraespecífico | Afinidad biogeográfica | Referencia y colecciones |
| Especie | ||
| Sphoeroides lobatus (Steindachner, 1870) | PS, PSC, PP, PG | 5, i, ii, iv, v, vi |
| Sphoeroides sechurae Hildebrand, 1946 | PS, PSC, PP | 3, v, vi |
| Sphoeroides trichocephalus (Cope, 1870) | PP | vi |
| Familia Diodontidae | ||
| Chilomycterus reticulatus (Linnaeus, 1758) | CT | ii |
| Diodon holocanthus Linnaeus, 1758 | CT | 4, 5, 8,v, vi, xiv |
| Diodon hystrix Linnaeus, 1758 | CT | 4, 5, xiv |
| Familia Molidae | ||
| Masturus lanceolatus (Liérnard, 1840) | CT | xiv |
| Ranzania laevis (Pennant, 1776) | CT |
Afinidad biogeográfica: PS = provincia sandieguina, PSC = provincia sinuscalifornica, PP = provincia panámica, PG = provincia de las galápagos, PCP = provincia chileno-peruana, CT = circumtropical, AA = Anfiamericana, END = Endémica, AP = Anfipacifica. Referencias y colecciones: 1) Linder (1947); 2) Castro-Aguirre (1978); 3) Castro-Aguirre, Espinoza-Pérez & Schmitter-Soto (1999); 4) Ramírez-Gutiérrez et al. (2007); 5) López-Pérez et al. (2010); 6) Medina-Bautista (2011); 7) López-Chávez et al. (2012); 8) Ramírez-Antonio (2013); i) DIGADOC-P; ii) CI-ICMyL; iii) CNPE-IBUNAM; iv) CAS; v) CIAD; vi) CPC-CIIDIR OAXACA; vii) SIO; viii) AMNH; ix) LACM; x) ROM; xi) ANSP; xii) GCRL; xiii) SU; xiv) CP-UMAR. Fuente: Elaboración propia.
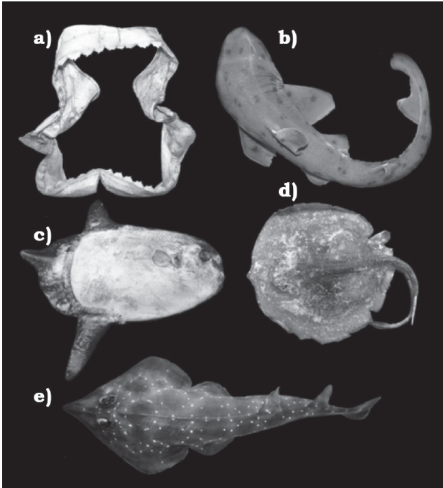
Los condrictios están representados por 46 especies (26 géneros, 18 familias y 10 ordenes) y los peces óseos por 441 (258 géneros, 90 familias y 26 ordenes). De manera general los órdenes con mayor riqueza específica son Perciformes con 244 spp. (50.1%), Clupeiformes 28 (5.7%) y Pleuronectiformes 27 (5.5%), mientras que a nivel de familias son: Sciaenidae con 30 especies (6.2% del total), seguida por Carangidae 28 (5.7%) y Haemulidae 24 (4.9%). Se reportan registros meridionales para tres especies: Echinorhinus cookei (CPUMAR 0001), Heterodontus mexicanus (CP-UMAR 0002) y Masturus lanceolatus (CP-UMAR 0003). Se confirma la presencia de las especies Urotrygon cimar (CP-UMAR 0004) y Rhinobatus prahli (CP-UMAR 0005) en aguas mexicanas (figura 2).
Fuente: Elaboración propia.
Figura 2 Especímenes de interés. Registros más meriodales en México: a) mandíbual de Echinorhinus cookei (CP-UMAR 0001); b) Heterodontus mexicanus (CP-UMAR 0002); c) Masturus lanceolatus (CP-UMAR 0003). Registros que confirma su presencia en México: d) Urotrygon cimar (CP-UMAR 0004); e) Rhinobatus prahli (CP-UMAR 0005).
Del conjunto ictiofaunístico cuatro especies son anfíamericanas (Etropus crossotus, Mugil curema, M. hospes y Oligoplites saurus), un número elevado tienen amplia distribución (42 son anfipacíficas y 42 son circumtropicales) y el resto son endémicas del Pacífico oriental (399 spp.). De estas últimas, 17 tienen una distribución restringida a los litorales mexicanos. La ictiogeografía marina oaxaqueña tiene mayor afinidad tropical al estar representada por 382 especies (78.4% del total) afines a la provincia Panámica, seguidas por la provincia Sinuscalifornica (67.8%) y la de Galápagos (28.5%). En tanto hay un menor número de especies propias de aguas frías (Sandieguina [35.7%] y Chileno-Peruana (11.7%)). Las especies Anchoa panamensis, Batrachoides waltersi, Himantura pacifica, Hyporhamphus snyderi, Nebris occidentalis, Odontognathus panamensis, Opisthopterus equatorialis, Parrella lucretiae, Symphurus prolatinaris, S. undecimplerus, Trinectes fimbriatus y Urotrygon cimar (12 spp; 2.1%) son propias de la provincia panámica, cuyo límite septentrional corresponde al litoral del estado de Oaxaca.
DISCUSIÓN
En el estado de Oaxaca se han registrado 129 especies ícticas en ambientes epicontinentales (Martínez-Ramírez, Doadrio-Villarejo & De Sosta-Fernández, 2004; Martínez-Ramíez & Gómez-Ugalde, 2006), que en conjunto con las 487 especies marinas registradas en la presente contribución se conforma el listado íctico más completo para Oaxaca (cerca de 600 spp.). Por lo que es necesario considerar realizar más estudios de diversidad alfa en el ambiente marino de esta región, principalmente en áreas y parches arrecifales, playas rocosas, zonas pelágicas alejadas de la costa y en aguas profundas.
A diferencia del listado íctico para Oaxaca presentado por Bastida-Zavala et al. (2013), la presente contribución presenta mayor posicionamiento taxonómico de las especies, congruencia con la distribución geográfica y soporte físico de los registros. Por ejemplo, ellos consideran un sinnúmero de especies bajo
sinonimia (Dasyatis brevis, Gymnura crebripunctata y Achirus zebrinus), otras especies no cuentan con una denominación taxonómica correcta y actualizada para la región, como ejemplo: Carcharhinus porosus (Ranzani, 1839) (=Carcharhinus cerdale Gilbert, 1898); Sphyrna tiburo (Linnaeus, 1758) (=Sphyrna vespertina Springer, 1940); Aetobatus narinari (Euphrasen, 1790) (=Aetobatus laticeps Gill, 1865); Trichiurus lepturus Linnaeus, 1758 (=Trichiurus nitens Garman, 1899); Gerres cinerus (Walbaum, 1792) (=Gerres simillimus Regan, 1907); Diapterus peruvianus (Cuvier, 1830) (=Diapterus brevirostris (Sauvage, 1879)). Además incluyen especies con distribución distinta a la del litoral de Oaxaca, como: Raja cortezensis McEachran & Miyake, 1988, especie endémica del Golfo de California y pueda ser confundida con Raja equatorialis Jordan & Bollman, 1890; la especie Eucinostomus argenteus Baird & Girard, 1855 se distribuye a lo largo de las costas del Atlántico occidental y es reemplazada en el Pacífico oriental por Eucinostomus dowii (Giil, 1863); Zapteryx exasperata (Jordan & Gilbert, 1880) y Heterodontus francisci (Girard, 1855) habitan en aguas templadas del Pacífico nororiental incluyendo al Golfo de California, al sur en la parte tropical son sustituidas por Zapteryx xyster Jordan & Evermann, 1896 y Heterodontus mexicanus Taylor & Castro-Aguirre, 1972 respectivamente. Incluyen, además, especies registradas en Oaxaca, pero cuya distribución se restringue a los tributarios de la vertiente Atlántica del estado, como sucede con Joturus pichardi Poey, 1860, especie catadroma que nunca ha sido registrada en la vertiente Pacífica de México. Finalmente, gran parte de los registros aludidos por Bastida-Zavala et al. (2013) fueron obtenidos de catálogos (e.g., Robertson & Allen, 2008) donde solo se demarca de manera general la distribución de las especies, sobreestimando su presencia en las costas de Oaxaca.
La diversidad íctica marina observada es comparativamente mayor a la registrada en otros estados de la franja litoral del Pacífico mexicano como Jalisco, Colima y Michoacán con 373 spp. (Castro-Aguirre, González-Acosta, De la Cruz-Agüero & Moncayo- Estrada, 2006; Lucano-Ramírez, Ruiz-Ramírez, Aguilar- Palomino & Rojo-Vázquez, 2001), Chiapas 299 spp. (Rodiles-Hernández, González-Díaz, González-Acosta, Soria-Barreto & Espinosa-Pérez, 2013). Esta diferencia, probablemente sea soportada por la heterogeneidad ambiental del litoral de Oaxaca, con la presencia de amplias playas arenosas, zonas rocosas, parches pequeños de coral, lagunas costeras (como Lagunas de Chacahua, Pastoría), áreas de manglar, zonas de surgencias y variable extensión en el talud continental siendo mayor en lo que corresponde al Golfo de Tehuantepec, cada uno de estos ambientes marinos con sus propias variables oceanográficas (Martínez, 2000). Pero, además, es posible que el esfuerzo de muestreo sea menor en dichos litorales creando un sesgo en la diferencia de la diversidad observada.
Las afinidades biogeográficas observadas en la ictiofauna marina de Oaxaca pueden estar enmascaradas. A pesar de existir una clara predominancia de las especies tropicales propias de la provincia panámica (sensuBriggs & Bowen, 2012), existen especies tropicales que no se extienden hasta Centroamérica. Ello puede explicarse debido a que anteriormente se reconocía a las provincias mexicana y panámica de manera independiente (Briggs, 1974). La primera se extendía desde el sur del Golfo de California, incluyendo a Bahía Magdalena (B.C.S.), hasta su límite sur en la Bahía Tangolunda (Oax.) (López-Chávez et al., 2012); la provincia mexicana había sido designada por la presencia de algunas especies endémicas pertenecientes a la familia Gobiesocidae (e.g., Tomicodon eos rhadinusBriggs, 1955) y Labrisomidae (e.g., Starksia grammilaga Rosenblatt & Taylor, 1971) (Briggs, 1955, 1960; Springer, 1958). Por su parte, la provincia Panámica alcanza hasta los 6 °S, aunque algunos autores debaten su ubicación entre Paita (Perú) o el Golfo de Guayaquil (Ecuador). Robertson & Cramer (2009) consideran un continuo entre estas dos provincias, considerándolas como la provincia Panámica. Briggs & Bowen (2012) tienen la misma opinión, pero con una configuración distinta del Pacífico Oriental Tropical. Como se observa son distintas las propuestas de la regionalización biogeográfica del Pacífico Oriental Tropical (POT) (Boschi, 2000; Briggs, 1974; Ekman, 1953; Hastings, 2000; Spalding et al., 2007; Walker, 1960), por lo que aún se deben realizar estudios ictiogeográficos para ayudar a comprender las zonaciones y patrones de diversidad en el Pacífico mexicano. En este sentido, hasta el momento no se han realizado estudios sobre las relaciones biogeográficas de la ictiofauna del Pacífico sur mexicano salvo en el área que corresponde al Pacífico central mexicano (Castro-Aguirre & Balart, 2002; Castro-Aguirre et al., 2006).
CONCLUSIONES
La diversidad ictiofaunística marina del estado de Oaxaca es alta y está representada por 487 especies. Al considerar las especies epicontinentales registradas previamente se genera el listado íctico más completo hasta el momento para todo el estado (cerca de 600 spp.). Se evidencia la distribución meridional de tres especies en el Pacífico mexicano y se confirma la presencia de dos especies en México. Biogeográficamente, la ictiofauna marina de Oaxaca es más afin a las aguas tropicales, propias de la provincia Panámica.











 nueva página del texto (beta)
nueva página del texto (beta)


