INTRODUCCIÓN
La transfusión de componentes sanguíneos es una práctica terapéutica habitual en las unidades de pacientes críticos, pudiendo presentar reacciones adversas en alrededor del 2% de los casos (Kuriyam & Carson, 2004). La enfermedad injerto contra hospedero asociada a la transfusión (EICH-AT) es una reacción postransfusional poco frecuente, pero con una mortalidad del 80% al 90%, desarrollada cuando son transfundidos componentes sanguíneos celulares (concentrados eritrocitarios [CE], plaquetarios y de granulocitos) (Kopolovic et al., 2015). La EICH-AT se presenta principalmente en pacientes inmunosuprimidos, e incluso en pacientes inmunocompetentes, cuando se transfunden componentes de un donador familiar consanguíneo de primer o segundo grado o cuando el donante y el receptor comparten algún(os) locus de Human Leukocyte Antigens (HLA) (Naveen, Athanker, Rajoor & Sindhoor, 2015). La sintomatología puede empezar de forma inmediata, o bien, días después de la transfusión, manifestándose por la presencia de fiebre y erupción cutánea con compromiso del tracto gastrointestinal, hígado y médula ósea, confundible al inicio con enfermedades banales frecuentes, por lo que el retraso en su atención puede llevar a complicaciones graves, y en la mayoría de los casos es mortal (Gupta, Bansal, Dass & Das, 2004).
La EICH-AT se ocasiona por la transfusión de linfocitos residuales (LR) del donador que se encuentran presentes en los componentes transfundidos. Debido a la inmunosupresión o la susceptibilidad genética, en algunos pacientes los linfocitos del donador no son rechazados por el sistema inmunitario del paciente e injertan, se activan y se proliferan desencadenando una respuesta inmune celular, atacando diversos órganos y tejidos (Kopolovic et al., 2015). La reducción de linfocitos en los hemocomponentes mediante lavados o filtración (Vamvakas & Blajchman, 2009) y el fraccionamiento con tecnología top and bottom no han demostrado una total eficacia para su prevención. Una vez que se ha desarrollado la EICH-AT en un paciente transfundido, el tratamiento va dirigido hacia inhibir su respuesta inmunitaria. El procedimiento más eficaz es el uso de esteroides en altas dosis. A los pacientes que no responden a los esteroides se les administran anticuerpos contra los linfocitos (Nollet & Holland, 2003). Sin embargo, el pronóstico de un paciente con EICH-AT depende de la gravedad de la afección. En muchos casos, cuando son tratados con éxito, pueden presentarse complicaciones graves, tales como colestasis, daño hepático, pulmonar o de tubo digestivo e infecciones graves; en el peor de los casos, puede llevar a la muerte (Strouthidis et al., 2003). Por lo tanto, la mejor estrategia para evitar la EICH-AT es la prevención con una adecuada práctica transfusional, garantizando transfusiones efectivas y seguras de componentes sanguíneos celulares en los cuales se haya eliminado la viabilidad de los LR con un método validado para este fin.
Aunque se han establecido métodos de inactivación de patógenos y LR basados en el crosslinking mediado por luz ultravioleta (UV) del ácido desoxirribonucleico (DNA) con compuestos como la roboflavina, azul de metileno y amotosalem, aún no están disponibles para su uso en CE (Khurshid & Moiz, 2015). Actualmente, el único método eficaz en el mundo para la eliminación de los LR en hemocomponentes es la irradiación de los mismos, utilizando isotopos radioactivos (Cesio 137 o Cobalto 60) o rayos X (Pelszynski, Moroff, Luban, Taylor & Quinones, 1994). Para evitar la EICH-AT es necesaria la irradiación gamma a dosis mayores a 2500 cGy; esto reduce la capacidad mitótica de los linfocitos en más del 90% y dosis más altas de 5000 CGy lo hacen en más del 98%, sin comprometer la funcionalidad de otras células (plaquetas, eritrocitos y granulocitos) (Department of Health, 2012; Diario Oficial de la Federación, 2012).
El principal objetivo de la irradiación de hemocomponentes celulares es inducir mutaciones en los ácidos nucleicos e inhibir la capacidad de proliferación de los linfocitos sin afectar la capacidad hemostática de las plaquetas y la de transporte de oxígeno de los eritrocitos. Sin embargo, también se han reportado otros efectos no deseados al dañar las membranas celulares, como la liberación de potasio intracelular y un aumento de la “hemoglobina libre” en plasma, debido a la lisis de algunos eritrocitos. Además, es importante tomar en cuenta que la irradiación no reduce la formación de aloanticuerpos, no evita reacciones transfusionales febriles no hemolíticas, ni inactiva microorganismos (Serrano et al., 2014; Thorp et al., 1990).
La NOM-253-SSA1-2012, Para la disposición de sangre humana y sus componentes con fines terapéuticos (Diario Oficial de la Federación, 2012), establece la vigencia de los hemocomponentes irradiados y los requisitos legales y administrativos para su uso; y las guías nacionales e internacionales describen los padecimientos para los que deberían prescribirse, entre los cuales sobresale su aplicación en pacientes pediátricos y en pacientes adultos inmunodeprimidos o con inmunodeficiencias, y receptores de trasplante de regeneración de médula ósea, entre muchas otras aplicaciones (Organización Mundial de la Salud [OMS], 2001; Secretaría de Salud [SS], 2007). En el mundo existen irradiadores que han sido fabricados específicamente para irradiar hemocomponentes. Sin embargo, en México solo existen en hospitales de tercer nivel en las principales ciudades del país, en el resto de los estados de la República mexicana no se cuenta con este servicio y, por tanto, tampoco se puede garantizar la seguridad de los pacientes transfundidos que por prescripción requieren componentes sanguíneos irradiados. En este trabajo se establece la metodología apoyada en evidencias científicas para la validación y el control de calidad del irradiador terapéutico THERATRON® PhoenixTM basado en Cobalt-60, y se proponen los parámetros para la validación de otros equipos que no fueron fabricados originalmente para este fin, con la intención de incrementar la seguridad de las transfusiones sanguíneas en México.
MATERIALES y MÉTODOS
Para la autorización de la realización de este proyecto en instituciones de la Secretaría de Salud, el protocolo fue registrado y autorizado por el Departamento de Investigación en Salud de los Servicios de Salud de Oaxaca con folio de registro UABJO-13-CA-2.
Debido a que la totalidad de los CE irradiados que se utilizarían en este proyecto iban a ser manipulados experimentalmente y no podrían ser utilizados después con fines terapéuticos, el número de CE a analizar (tamaño de la muestra) fue establecido con base en un análisis costo-beneficio que permitiera utilizar un número confiable de CE para evaluar el efecto de la irradiación, pero sin afectar la disponibilidad de CE para fines terapéuticos. Se tomó en cuenta el número de CE que se podrían obtener por intercambio con otras instituciones en caso de emergencia. El análisis arrojó un mínimo de 6 CE y un máximo de 8 CE evaluados que provinieran preferentemente de donadores voluntarios y no de familiares o de reposición.
Se procesaron 7 CE provenientes de donadores de sangre voluntarios, bajo consentimiento informado y seleccionados con base en los criterios establecidos en el capítulo 6 de la NOM-253-SSA1-2012. Los CE fueron muestreados tomando 10 mL antes y 10 mL después de la irradiación
Los CE fueron analizados inmediatamente después de su obtención por fraccionamiento. Cada unidad fue identificada con un número de control interno y se realizó una asepsia a la bolsa en el tubo de salida donde se introdujo una jeringa para obtener 10 mL de muestra. Posterior a la extracción de las muestras, las bolsas se sellaron y se trasladaron para su irradiación. Los CE siempre fueron trasladados bajo condiciones óptimas de transporte (en un recipiente termoaislante a una temperatura de 2 °C a 6 °C). La irradiación de los CE se realizó en el Centro de Oncología y Radioterapia de Oaxaca, en el irradiador THERATRON® PhoenixTM (Cobalto 60), irradiando cada concentrado eritrocitario durante 12 min a una dosis de rayos gamma de 210 cGy/min durante 12 min (2520 cGy).
La cuantificación del número de LR, concentración de hemoglobina y hematocrito, se realizó por citometría, haciendo una dilución 1:10 de las muestras de CE con solución salina isotónica y utilizando el equipo automatizado para hematología Human Count 30TS. La cuantificación de hemoglobina libre o hemólisis y la cuantificación de potasio en el plasma de los CE se realizó por triplicado con el método de cianometahemoglobina (Reactivo de Drabkin y estándar, Hysel inc. Houston) y por turbidimetría (Licon, Stanbio Laboratory, EUA), respectivamente. La purificación de los LR se realizó utilizando 15 mL de buffer de lisis (solución 10X [NH4Cl (8.02 g), KHCO3 (0.84 g), EDTA (0.37 g) y H2O milliQ c.b.p. 100 mL]) a partir de 1 mL de concentrado eritrocitario. El cálculo del porcentaje de la viabilidad de los LR se realizó por afinidad (células muertas) o exclusión (células vivas) al colorante azul de tripano (SIGMA Aldrich). La evaluación de la capacidad de proliferación de los LR se realizó mediante reacción leucocitaria mixta (RLM) (cocultivo en medio RPMI (Sigma life science) suplementado con 10% de suero fetal bovino descomplementado, L-glutamina 2 mM, piruvato de sodio 1 mM, aminoácidos no esenciales 0.1 mM (Hyclone), penicilina/estreptomicina/fungisona 1% y 2-mercaptoetanol 50 µM (Gibco), en atmósfera de 5% de CO2 a 37 °C, utilizando proporciones iguales de leucocitos de dos individuos diferentes, durante cinco días para inducir su proliferación por respuesta alogénica. Al término, los linfocitos fueron recolectados y se cuantificó el número de células viables por exclusión de azul de tripano, como se describió anteriormente.
Los datos se presentan como resultados del comportamiento de cada parámetro analizado en los CE individualmente antes y después de la irradiación. Se realizaron medidas de tendencia central para analizar la distribución de los datos. Para evaluar si existían diferencias estadísticamente significativas entre ambos grupos de datos, se utilizó la prueba t de student de dos colas, asumiendo varianzas iguales. Un valor de p ≤ 0.05 se consideró significativo.
RESULTADOS
Análisis de los parámetros de potencial terapéutico y LR
En la Tabla 1 se presentan los resultados obtenidos de los parámetros analizados antes y después de la irradiación. El análisis estadístico de los datos reveló que la irradiación no afectó significativamente el número de LR en los CE ni la concentración de hemoglobina y ni el hematocrito. Las diferencias de los datos obtenidos fueron debidas únicamente a las variaciones experimentales entre muestras, indicando hasta el momento que la irradiación no había afectado el potencial terapéutico de los CE al conservar los valores de hemoglobina y hematocrito, pero que tampoco había inducido directa e inmediatamente la destrucción de los LR
Tabla 1 Parámetros de calidad terapéutica y LR en los CE antes y después de la irradiación.
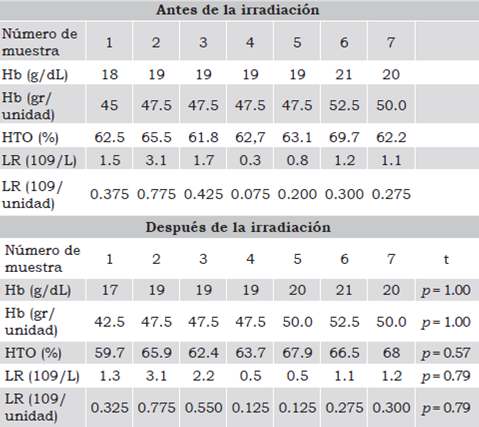
Se muestran los resultados de la concentración de hemoglobina (Hb) por decilitro (dL) y por unidad, el porcentaje de hematocrito (HTO), así como el número de LR por litro (L) y por unidad. El análisis estadístico evaluó diferencias significativas entre los parámetros analizados antes y después de la irradiación con un intervalo de confianza del 5%. Valor de p significativo ≤ 0.05.
Fuente: Elaboración propia.
Determinación de hemoglobina libre y potasio en plasma
Para evaluar si la irradiación de los CE había afectado la membrana de los eritrocitos induciendo la liberación de hemoglobina y potasio intracelular, se cuantificaron estos parámetros por triplicado en el plasma de las muestras obtenidas antes y después de la irradiación. Los resultados del promedio y la desviación estándar de la concentración de hemoglobina libre se muestran en la Figura 1, y de potasio en la Figura 2. El análisis estadístico de los datos mostró que la irradiación no produjo cambios estadísticamente significativos en la concentración de ambos analitos y que las diferencias de los datos fueron debidas a las variaciones experimentales entre muestras, indicando que la irradiación no había afectado la membrana de los eritrocitos
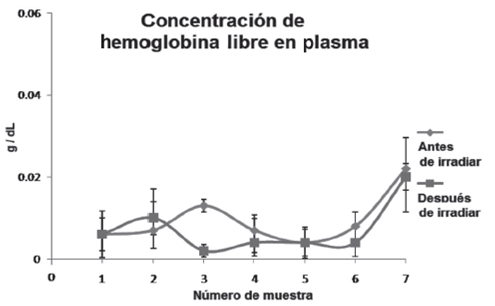
Fuente: Elaboración propia.
Figura 1 Concentración de hemoglobina libre en plasma de los CE antes y después de la irradiación. La gráfica muestra los promedios ± SD de la cuantificación de hemoglobina. El análisis estadístico evaluó diferencias significativas antes y después de la irradiación con un intervalo de confianza del 5%. * = Valor de p significativo ≤ 0.05. No se encontraron diferencias significativas.
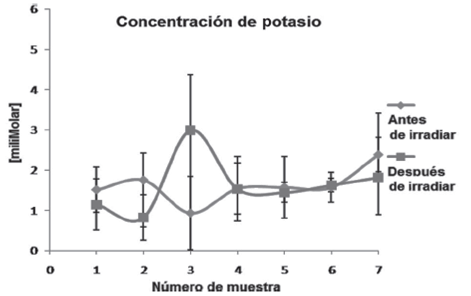
Fuente: Elaboración propia.
Figura 2 Concentración de potasio en plasma de los CE antes y después de la irradiación. La gráfica muestra los promedios ± SD de la cuantificación de potasio. El análisis estadístico evaluó diferencias significativas antes y después de la irradiación con un intervalo de confianza del 5%. * = Valor de p significativo ≤ 0.05. No se encontraron diferencias significativas.
Análisis de la viabilidad celular de los LR
Hasta el momento se había apreciado que la irradiación de los CE no había disminuido de modo significativo el número de los LR. Por lo tanto, con el fin de evaluar si la irradiación podría estar afectando su viabilidad, los LR se purificaron con buffer de lisis y se cuantificó el porcentaje de células vivas con el colorante azul de tripano. Los resultados obtenidos se muestran en la Tabla 2, donde se puede apreciar que los porcentajes de linfocitos viables no se vieron afectados con la irradiación, ya que no existieron diferencias estadísticamente significativas. Cabe señalar que la irradiación induce mutaciones en el ADN, por tanto a pesar de que las células se mantuvieron viables temporalmente podrían haber perdido su capacidad de proliferar.
Tabla 2 Viabilidad de los LR en los CE antes y después de la irradiación.
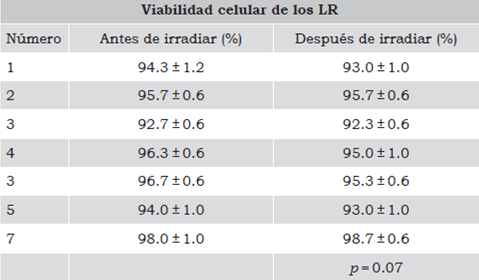
Se muestran los resultados de los promedios de los porcentajes de los linfocitos viables ± D.S. El análisis estadístico evaluó diferencias significativas entre los parámetros analizados antes y después de la irradiación con un intervalo de confianza del 5%. Valor de p significativo ≤ 0.05.
Fuente: Elaboración propia.
Análisis de la capacidad de proliferación de los LR
Cuando se realiza una transfusión de un concentrado eritrocitario con LR pueden ocurrir dos situaciones: a) que el sistema inmunitario del receptor reaccione en contra de los LR del donador conllevando al rechazo de los linfocitos transfundidos; b) que los LR del donador injerten y proliferen, ocasionando la enfermedad injerto contra hospedero asociada a la transfusión (EICH-AT) en el receptor.
El cultivo leucocitario o reacción leucocitaria mixta es una prueba in vitro, donde se mezclan cantidades iguales de leucocitos de dos personas distintas; los linfocitos, al reconocer los aloantígenos mostrados por las células presentadoras de antígeno del individuo contrario, proliferan incrementando su número.
Para evaluar si después de la irradiación los LR aún tenían capacidad de proliferar, se realizaron cultivos de reacción leucocitaria mixta, utilizando como controles leucocitos de los mismos individuos sin irradiar.
Como se puede apreciar en la Tabla 3, en los controles establecidos con los leucocitos purificados de CE sin irradiar, en todos los casos se observó un incremento en el número de linfocitos recolectados con respecto al número de leucocitos cultivados, indicando una proliferación positiva. Sin embargo, en los linfocitos purificados de seis de los siete CE irradiados, se evidenció una disminución en el número de linfocitos recolectados, señalando una ausencia de proliferación e incremento de la muerte de los linfocitos. Solo en uno de los CE irradiados (número 4) se observó una ligera proliferación positiva, muy por debajo del promedio de proliferación observada en los controles. Estos resultados nos indican que aunque la irradiación no había reducido el número de LR ni había disminuido inmediatamente su viabilidad, sí redujo significativamente su capacidad de proliferación.
Tabla 3 Proliferación de los LR en los CE.
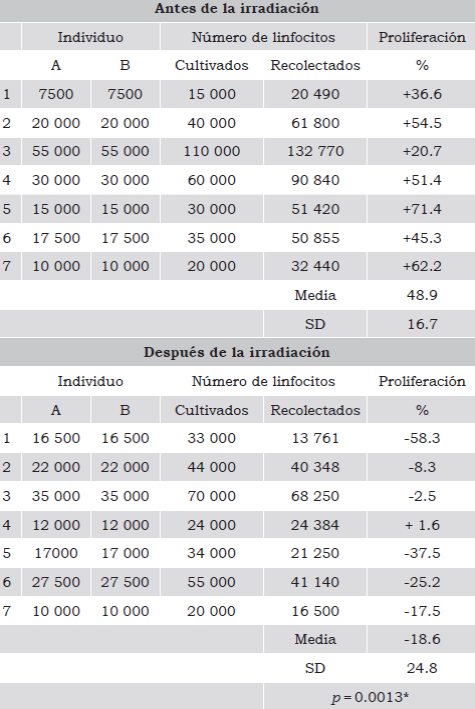
Capacidad de proliferación de los LR de los CE. La proliferación positiva (+) indica el incremento en el número de linfocitos recolectados después de la reacción leucocitaria mixta con respecto al número de linfocitos cultivados. La proliferación negativa (-) señala una disminución de este mismo número. El análisis estadístico evaluó diferencias significativas entre los parámetros analizados antes y después de la irradiación con un intervalo de confianza del 5%. * indica un valor de p significativo ≤0.05.
Fuente: Elaboración propia.
Implementación del control de calidad y análisis de costos
Tomando en cuenta los resultados anteriores, se propone el establecimiento del control de calidad de irradiación de los CE para la validación de irradiadores terapéuticos, implementando los parámetros analizados que en su conjunto evalúan las propiedades terapéuticas y la seguridad de los CE después de la irradiación.
Concentración de hemoglobina.
Hematocrito.
Concentración de hemoglobina libre (hemólisis).
Concentración de potasio en plasma.
Número de LR.
Viabilidad de los LR.
Capacidad de proliferación de los LR.
Para los seis primeros parámetros mencionados no se requiere material ni equipo extra a los que ya tienen en un laboratorio clínico y no representa gastos mayores. Sin embargo, la prueba que determinó la efectividad de la irradiación por haber mostrado diferencias estadísticas significativas fue la reacción leucocitaria mixta. Por tal motivo se propone que esta sea implementada en los bancos de sangre como un estándar de oro para el control de calidad de los CE irradiados. Si se compara el costo de inversión con la garantía de seguridad de no desarrollar EICH-AT al utilizar componentes irradiados, el análisis de costos para el establecimiento de la irradiación de hemocomponentes y su control de calidad no es alto, como se representa resumidamente en la Tabla 4.
Tabla 4 Análisis de costos de la implementación de la irradiación de los CE y su control de calidad.
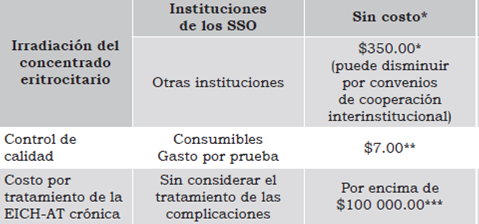
* Datos proporcionados por los directivos del Centro de Oncología y Radioterapia de Oaxaca. ** calculado al dividir el costo total de los reactivos entre las 500 pruebas que se pueden realizar con el volumen del reactivo limitante RPMI (500ml). Con base en precios del 2014. *** revisado en Scott (2006).
Fuente: Elaboración propia.
DISCUSIÓN
La irradiación de componentes sanguíneos sigue siendo el único método eficaz y de disposición para con CE a nivel mundial para inhibir la activación de los LR e impedir el desarrollo de la EICH-AT. No obstante, el uso de dosis inadecuadas podrían tener algunos efectos desfavorables; dosis bajas podrían no inactivar a los LR y dosis altas pueden inducir lisis de los eritrocitos, produciendo altas dosis de hemoglobina libre y potasio en el plasma (Serrano et al., 2014). Los niveles de potasio liberados podrían ser irrelevantes para transfusiones en los adultos, pero pueden causar problemas graves cuando se realizan transfusiones intrauterinas o exanguineotransfuiones (Thorp et al., 1990). Los altos niveles de hemólisis podrían indicar una reducción significativa del número de eritrocitos y, por tanto, una importante reducción en los efectos terapéuticos.
El análisis de los parámetros que evalúan el potencial terapéutico y la seguridad de los CE posirradiación (concentración de hemoglobina, hemoglobina libre y potasio en plasma; hematocrito; y número, viabilidad y capacidad de proliferación de los LR), mostraron que el método y la dosis de irradiación gamma utilizados no dañaron a los eritrocitos. Por ello, los resultados indican que estas condiciones de irradiación no afectarían la calidad de los CE irradiados. Por otra parte, la irradiación no afectó de forma inmediata el número total de linfocitos ni su viabilidad, sugiriendo que la irradiación no destruyó de modo inmediato a los linfocitos. Favorablemente, los linfocitos recuperados de los CE irradiados perdieron su capacidad de proliferación ante un estímulo alogénico en la reacción leucocitaria mixta, por lo cual, en caso de ser transfundidos, los resultados indican que morirían por apoptosis al llegar a su término de vida, que sería mucho más corto por la afectación de su ADN, no serían capaces de injertar y proliferar y serían eliminados por el sistema inmune del paciente sin representar una amenaza para la inducción de la EICH-AT.
Por lo anterior, basados en los resultados, se propone que el control de calidad y la validación de la eficacia de irradiadores terapéuticos para la irradiación de CE debe incluir al menos los parámetros utilizados durante este proyecto: a) hematocrito, b) concentración de hemoglobina, c) concentración de hemoglobina libre, d) concentración de potasio, e) número total de linfocitos, f) porcentajes de linfocitos vivos y h) capacidad de proliferación de linfocitos, siendo este último el más importante para evaluar la eficacia del proceso.
Las guías nacionales e internacionales para el uso terapéutico de la sangre (OMS, 2001; SS, 2007) especifican el tipo de pacientes que preferentemente deben recibir componentes sanguíneos irradiados. En la mayoría de los servicios de transfusión del país, la irradiación de la sangre no es un procedimiento de rutina, sin embargo, muchos centros de salud cuentan con irradiadores terapéuticos y/o de rayos X que pueden ser validados para este efecto, con el objeto de proporcionar mayor seguridad a los pacientes transfundidos que requieren este servicio. La generalización de la irradiación de CE para su transfusión en pacientes en quienes está prescrito ayudaría a disminuir significativamente la incidencia de la EICH-AT en todo el país, ofreciendo una mayor seguridad transfusional para los pacientes y reduciendo los costos que en el sector salud aplica para el tratamiento de sus complicaciones.
CONCLUSIONES
La irradiación de CE con el irradiador terapéutico THERATRON® PhoeniTM (cobalto 60) a una dosis de 2520 cGy no indujo lisis de los eritrocitos, ni incrementó la concentración de potasio en el plasma, conservó sus propiedades terapéuticas sin inducir mayores riesgos a los pacientes. Adicionalmente, eliminó de forma eficiente la capacidad de proliferación de los LR, indicando que cuando sean transfundidos no representarán una amenaza para la inducción de la EICH-AT. Este trabajo pone en evidencia la factibilidad de la irradiación de CE con irradiadores terapéuticos que no han sido fabricados específicamente para este proceso, y proporciona una alternativa eficiente, confiable y de bajo costo para la irradiación y el control de calidad de este proceso. La generalización de la irradiación de hemocomponentes celulares en todo México, para su aplicación en los pacientes que lo requieran, reducirá significativamente la incidencia de la EICH-AT y los costos al sector salud ocasionados por sus complicaciones.
CONSIDERACIONES ÉTICAS
Este proyecto se realizó bajo autorización del Departamento de Investigación en Salud de los servicios de salud de Oaxaca con número UABJO-13-CA-2.
Los concentrados eritrocitarios (CE) fueron obtenidos bajo consentimiento informado de donadores voluntarios, seleccionados bajo los criterios establecidos en el capítulo 6 de la NOM-253-SSA1-2012.











 nueva página del texto (beta)
nueva página del texto (beta)


