INTRODUCCIÓN
La importancia del cultivo de lechuga ha aumentado en los últimos años, debido a la diversificación de variedades y al incremento de su consumo a nivel nacional y mundial (Suárez & Serrano, 2012). En México, en el 2014 la superficie cultivada fue de 19 440.40 ha, con una producción de 406 678.05 ton y un valor de la producción de 1 226 325.49 miles de pesos. Los principales estados productores fueron Guanajuato, Zacatecas, Puebla, Aguascalientes, Baja California y Querétaro, con 102 639 ton, 69 041 ton, 51 702 ton, 44 330 ton, 22 085 ton y 26 064 ton, respectivamente (Servicio de Información Agroalimentaria y Pesquera [SIAP], 2014). En 2014 se cultivaron en Guanajuato y Querétaro 6 033 ha y 732 ha, con rendimientos promedio de 17.64 ton ha-1 y 28.55 ton ha-1, respectivamente (SIAP, 2014).
Las hortalizas para ensaladas, dentro de las que se encuentra la lechuga, son afectadas por una serie de enfermedades que merman su producción. La incidencia y severidad de estas depende del agente causal, la susceptibilidad de la planta y el medio ambiente (Blancard, Lot & Maisonneuve, 2006). De los principales factores a considerar en el proceso productivo de la lechuga son las virosis (Blancard et al., 2006). Las enfermedades virales de la lechuga se han incrementado en diversas regiones del mundo, destacando las regiones productoras de esa hortaliza en España (Moreno et al., 2004).
El cultivo de lechuga se desarrolla durante todo el año, por lo cual las plantas están expuestas al ataque de patógenos; de estos, los virus son de particular importancia, ya que son difíciles de prevenir y sus vectores están presentes durante todo el año (Conti et al., 2000); además, los virus afectan directamente la calidad de las hojas, impidiendo la venta de las lechugas afectadas (Blancard et al., 2006; Davis, Subbarao, Raid & Kurtz, 2002). Dependiendo de las condiciones ambientales y del manejo que se le haya dado al cultivo, los virus pueden llegar a causar pérdidas de hasta el 100% en el cultivo de lechuga (Resende & Cupertino, 1995). El virus del mosaico de la lechuga (Lettuce mosaic virus [LMV]) se ha reportado como uno de los patógenos más importantes a nivel mundial (Blancard et al., 2006); se pueden desarrollar rápidamente epidemias del virus LMV en híbridos de lechuga susceptibles, lo que puede ocasionar pérdidas del 80% hasta el 100% (Dinant & Lot, 1992).
En condiciones de campo, la lechuga es un hospedero natural de los virus del género Tospovirus (Costa & Forster, 1942). Costa & Forster (1942) realizaron el primer reporte de una enfermedad causada por un virus del género Tospovirus en 1938 en Brasil. Desde 1986, el virus de la marchitez manchada del tomate (Tomato spotted wilt virus [TSWV]) ha causado severas pérdidas en lechuga en Brasil; en el verano (diciembre a marzo), las pérdidas bajo condiciones de campo pueden ser del 30% al 100% (Moraes, Wanderly & Costa, 1986). El TSWV está presente en todas las regiones productoras de lechuga del mundo, variando su grado de severidad. Su daño puede ser muy significantivo en varios estados de los Estados Unidos de América, y en varios países europeos, como Bulgaria, Hungría, Polonia y Grecia (Blancard et al., 2006).
Moreno et al. (2004) mencionan que considerando los daños provocados a la lechuga en la región de Murcia y Navarra, España, los principales virus que afectan a esta hortaliza son: Cucumber mosaic virus (CMV), LMV, TSWV y Beet western yellow virus (BWYV); además, son transmitidos por varios tipos de áfidos y trips. Soleimani, Mosahebi & Habibi (2011) reportan que en la provincia de Terán, Irán, en un estudio realizado en los cultivares de lechuga Mantilia y Terocadero, obtuvieron porcentajes de infección de los virus LMV, CMV y TSWV de 21%, 16% y 10%, respectivamente. Los daños indirectos que provocan los trips en el cultivo de lechuga son más graves, y consisten en la transmisión del virus de la marchitez manchada del tomate (TSWV) (Blancard et al., 2006). La especie de trips más importante, considerando la incidencia de TSWV, es el trips occidental Frankliniella occidentalis (Pergande) (Agrios, 2005; Blancard et al., 2006; Lacasa & Contreras 1993). Para el control de cualquier enfermedad es de gran importancia conocer qué la causa, lo cual permitirá implementar diferentes medidas de manejo y control. Por lo anterior, para la certera detección e identificación de los virus es necesario utilizar pruebas en laboratorio como microscopía electrónica, serología, métodos inmuno-enzimáticos, técnicas moleculares como la reacción en cadena de la polimerasa (PCR, por sus siglas en inglés), hibridación molecular, entre otras (Agrios, 2005; Blancard et al., 2006). Con base en la problemática antes mencionada, se planteó el desarrollo del presente estudio, el cual tuvo como objetivos: a) determinar la incidencia y severidad de las virosis en los híbridos de lechuga bajo estudio y b) detectar los virus presentes en el cultivo de lechuga durante el periodo febrero-julio de 2010, en dos fechas de plantación, en tres localidades, de los municipios de Corregidora, Pedro Escobedo y de Huimilpan, del estado de Querétaro, México.
MATERIALES Y MÉTODOS
Híbridos de lechuga evaluados
En las localidades de Rancho Vanegas, municipio de Corregidora, Rancho Noria Nueva, municipio de Pedro Escobedo, y Rancho el Milagro, municipio de Huimilpan, se evaluaron los híbridos de lechuga: Mixteca, Stallion, Antigua, Cartagonova y Centauro.
Fechas de plantación y localización de los experimentos
En la primera fecha de plantación del 9 de febrero de 2010 se establecieron dos experimentos: el primero en el Rancho Vanegas, en el municipio de Corregidora (coordenadas: norte 20° 36', al sur 20° 22' de latitud norte, este 100° 22', oeste 100° 30' de longitud oeste, altitud 1820 msnm) y el segundo en el Rancho Noria Nueva, en el municipio de Pedro Escobedo (coordenadas norte 20° 35' 01.90'', sur 20° 21' de latitud norte, este 100° 04', oeste 100° 18' al oeste de longitud oeste, altitud 1 920 msnm). En la segunda fecha de plantación del 1 de junio de 2010 se establecieron tres experimentos: el primero en el Rancho Vanegas en Corregidora, el segundo en el Rancho Noria Nueva, en Pedro Escobedo, y el tercero en el Rancho el Milagro, en el municipio de Huimilpan (coordenadas: norte 20°36', sur 20° 22' de latitud norte; este 100° 11', oeste 100° 24' de longitud oeste, altitud 1 970 msnm), los tres municipios pertenecientes al estado de Querétaro, México. La precipitación pluvial durante el ciclo de cultivo de la primera fecha de plantación fue de 3.7 mm. En la segunda fecha de plantación hubo una precipitación de 167.2 mm en Pedro Escobedo y de 131.3 mm en Corregidora y Huimilpan. La temperatura media durante el ciclo de cultivo de la primera fecha de plantación fue de 15.7 °C, y de 21.1 °C en la segunda fecha de plantación en las localidades evaluadas.
Análisis estadístico
El diseño experimental utilizado fue un bloque completo al azar, en un arreglo factorial, con tres repeticiones. El factor A se le asignó a la fecha de plantación (con dos niveles), el factor B se le asignó a la localidad (con tres niveles) y el factor C se asignó a los híbridos de lechuga (con cinco niveles). La comparación múltiple de medias se hizo con la prueba de Tukey P < 0.05 (Statgraphics Centurion XVII, 2014). Cada uno de los cinco experimentos tuvo 15 parcelas o unidades experimentales, las cuales consistieron de un surco de 5.0 m de largo por 1.0 m de ancho; se establecieron dos hileras de plántulas de lechuga por surco, con una separación entre hileras de 0.3 m y una distancia entre plantas de 0.3 m, lo que dio una densidad de población de 65 000 plantas ha-1. Antes de realizar el análisis de varianza para las variables evaluadas, se llevó a cabo la prueba de Shapiro-Wilk y la de Cochran para verificar si las variables evaluadas cumplían los supuestos de normalidad y homocedasticidad del análisis de varianza (Zar, 1999).
Variables analizadas
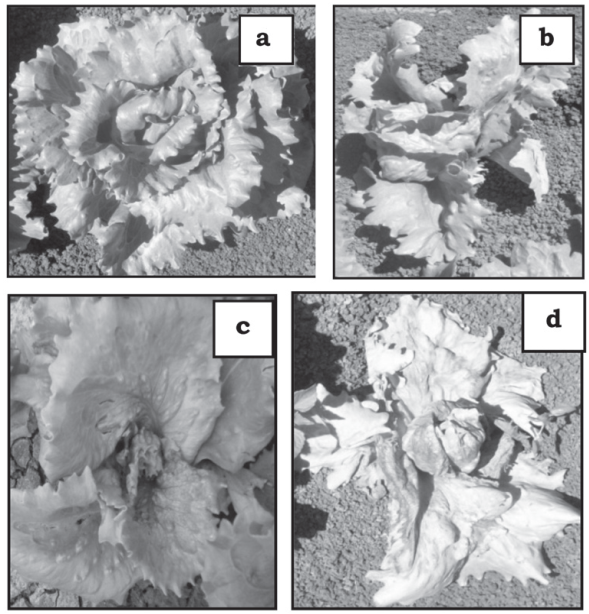
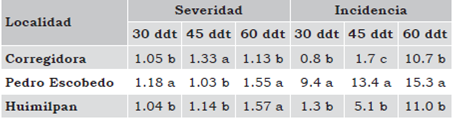
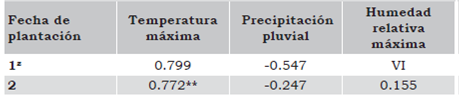
Incidencia de virosis en función de síntomas externos (%). En cada unidad experimental se contaron las plantas totales y las plantas que manifestaban síntomas de virosis, como planta más pequeña, amarilla-miento, enchinamiento y necrosis (Figura 1 b, c, d), a los 30, 45 y 60 días después del trasplante (ddt). Para determinar la incidencia de virosis se dividió el número de plantas con síntomas virales entre el número de plantas totales, y se multiplicó por 100.
Severidad de virosis. Calificado con una escala de 1 a 5, donde 1 = plantas asintomáticas (Figura 1a); 2 = plantas con ligeros síntomas de virosis (Figura 1b); 3 = plantas con síntomas regulares de virosis (Figura 1c); 4 = plantas con síntomas fuertes de virosis y 5 = plantas con síntomas intensos de virosis (Figura 1d).
Evaluación viral
Las muestras se procesaron en el Laboratorio de Fitopatología de la División de Ciencias de la Vida, Campus Irapuato-Salamanca, de la Universidad de Guanajuato. Se evaluó la presencia del luteovirus: virus del amarilla-miento occidental de la remolacha (Beet western yellow virus [BWYV]), del cucumovirus: virus mosaico del pepino (Cucumber mosaic virus [CMV]), del potyvirus: virus mosaico de la lechuga (Lettuce mosaic virus [LMV]), del alfamovirus: virus mosaico de la alfalfa (Alfalfa mosaic virus [AMV]) y el tospovirus: virus de la marchitez manchada del tomate (Tomato spotted wilt virus [TSWV]). Para la detección de los virus se utilizó la técnica de inmunoabsorción enzimática (ELISA) (Clark & Adams, 1977; Cruz & Frías-Treviño, 1997). Para la determinación de los virus se utilizaron los kits del proveedor Agdia Inc. (30 380 County Road 6, Elkhart, Indiana, 46 514, USA), conjugándose con la enzima fosfatasa alcalina. Los controles positivo y negativo (extracto de hojas de lechuga) fueron del mismo proveedor. La absorbancia se determinó en el espectrofotómetro BIO-RAD Modelo 3550-UV, a una longitud de onda de 405 nm.
Fechas de evaluación y colectas
La detección viral se realizó en tres fechas de muestreo, a los 30, 45 y 60 días después del trasplante (ddt). Para integrar la muestra a evaluar, se colectó una hoja de cada una de cinco plantas de la parcela experimental; dependiendo del híbrido evaluado, las plantas podían presentar síntomas presuntivos de una virosis, por ejemplo: enchinamiento, mosaico, amarillamiento, necrosamiento y enanismo, o ser asintomáticas. Cada uno de los cinco experimentos tuvo 15 parcelas o unidades experimentales, a las cuales se les realizaron tres muestreos, dando un total de 225 muestras. Estas se colocaron en bolsas de plástico y se mantuvieron en congelación (-20 °C) hasta su procesamiento.
Evaluación de resultados y determinación del límite de detección
Se obtuvo el promedio de las lecturas por duplicado de cada muestra. El valor del testigo negativo se obtuvo con el promedio de los dos valores de lectura de absorbancia del testigo negativo, que se lograron para cada virus en las diferentes muestras de follaje analizadas. Como criterio para determinar el límite de detección se utilizó el valor promedio del testigo negativo + 0.05 de densidad óptica para cada uno de los virus estudiados; todo valor por arriba de este límite se consideró positivo (Cruz & Canseco, 1995).
RESULTADOS
Severidad de virosis
Para el factor fechas de plantación solo hubo diferencias altamente significativas a los 30 ddt, con un coeficiente de variación del 16%; mientras que para el factor localidades hubo diferencias altamente significativas, a los 30 ddt, 45 ddt y 60 ddt, con coeficientes de variación del 16%, 19% y 24%. La severidad de virosis fue significativamente menor a los 30 ddt entre la primera y segunda fecha de plantación (Tabla 1). También la severidad de virosis fue estadísticamente mayor en el primer y tercer muestreo, 1.18a% y 1.55a% en la localidad de Pedro Escobedo, respectivamente; en comparación con 1.05b% y 1.13b% en la localidad de Corregidora, respectivamente (Tabla 2).
Tabla 1 Severidad e incidencia de virosis en follaje de lechuga (Lactuca sativa L.) en las dos fechas de plantación en el ciclo febrero-julio de 2010, en el estado de Querétaro.
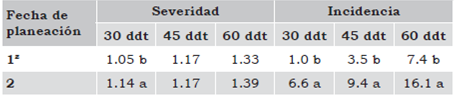
1z: 10 de febrero de 2010; 2: 1 de junio de 2010. Cifras con diferente letra en cada columna son estadísticamente diferentes Tukey (P ≤ 0.05).
Fuente: Elaboración propia.
Incidencia de virosis
Hubo diferencias altamente significativas para los factores fechas de plantación y localidades a los 30 ddt, 45 ddt y 60 ddt, con coeficientes de variación del 63%, 50% y 68%, respectivamente. La incidencia de virosis fue significativamente mayor en el primer, segundo y tercer muestreo, 6.6a%, 9.4a% y 16.1a% en la segunda fecha de plantación, respectivamente; en comparación con el primer, segundo y tercer muestreo, 1.0b%, 3.5b% y 7.4b% en la primera fecha de plantación, respectivamente (Tabla 1). Además, la incidencia de virosis fue estadísticamente mayor en el primer, segundo y tercer muestreo, 9.4a%, 13.4a% y 15.3a% en la localidad de Pedro Escobedo, respectivamente; en comparación con 0.8b%, 1.7c% y 10.7b% y 1.3b%, 5.1b% y 11.0b% en las localidades de Corregidora y Huimilpan, respectivamente (Tabla 2).
Asociación entre severidad e incidencia de virosis y variables climáticas
La asociación entre la severidad de virosis del factor fecha de plantación fue positiva y moderada con la temperatura máxima y negativa y altamente significativa con la precipitación pluvial en la primera fecha de plantación, lo cual muestra que a menor precipitación pluvial habrá mayor severidad de virosis (Tabla 3). La asociación entre la incidencia del factor fecha de plantación con la temperatura máxima fue positiva, moderada y significativa en la segunda fecha de plantación, lo cual muestra que a mayor temperatura habrá mayor incidencia de virosis en las plantas (Tabla 4).
Tabla 3 Correlación de severidad de virosis del factor fechas de plantación con las variables climatológicas, en el ciclo febrero-julio de 2010.
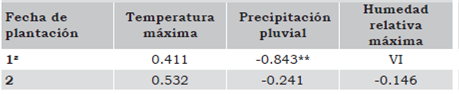
1z: 10 de febrero de 2010; 2: 1 de junio de 2010. ** p < = 0.05. VI = Valor indefinido.
Fuente: Elaboración propia.
Detección de virus presentes en follaje de lechuga por la técnica de ELISA
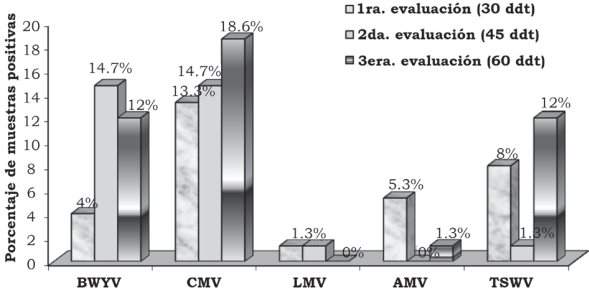
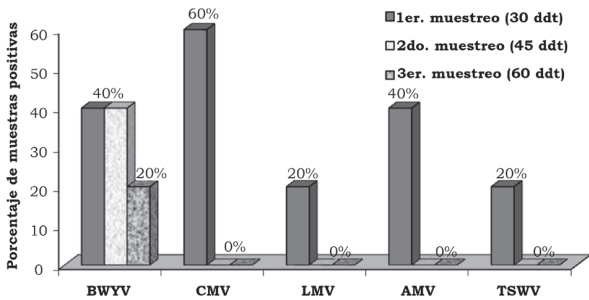
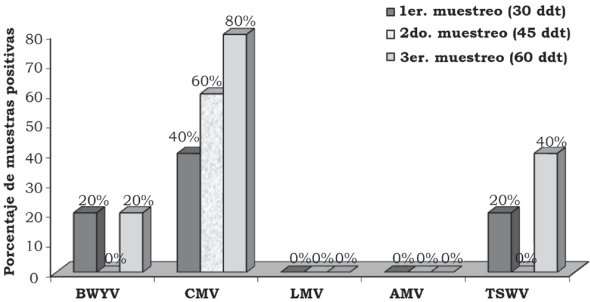
En la primera, segunda y tercera fecha de evaluación se detectó el BWYV con una frecuencia de 4.0%, 14.7% y 12.0%, el CMV con 13.3%, 14.7% y 18.6%, el LMV con 1.3%, 1.3% y 0.0%, AMV con 5.3%, 0.0% y 1.3% y TSWV con 8.0%, 1.3% y 12.0% (Figura 2). En la localidad de Corregidora, en la primera fecha de plantación se detectó el virus BWYV con una frecuencia de 40%, 40% y 20%, el CMV con 60%, 0% y 0%, el LMV con 20%, 0% y 0%, el AMV con 40%, 0% y 0% y el TSWV con 20%, 0% y 0% de híbridos positivos, en la primera, segunda y tercera fechas de muestreo, respectivamente (Figura 3). En la localidad de Corregidora en la segunda fecha de plantación se detectó el virus BWYV con una frecuencia 20%, 0% y 20%, el CMV con una frecuencia de 40%, 60% y 80%, los virus LMV y AMV no fueron detectados y el TSWV se mostró con una frecuencia de 20%, 0% y 40% de híbridos positivos, en la primera, segunda y tercera fecha de muestreo, respectivamente (Figura 4). En la localidad de Pedro Escobedo en la primera fecha de plantación se detectó el virus BWYV con una frecuencia de 0%, 0% y 60%, el CVM con 60%, 80% y 100%, el virus LMV no fue detectado, el AMV con 40%, 0% y 20% y el TSWV se detectó con una frecuencia de 0%, 20% y 40% de híbridos positivos, en la primera, segunda y tercera fecha de muestreo, respectivamente (Figura 5). En la localidad de Pedro Escobedo en la segunda fecha de plantación se detectó el virus BWYV con una frecuencia de 0%, 20% y 80%, el CMV con 0%, 40% y 100%, el LMV con 0%, 20% y 0%, el AMV no fue detectado y el TSWV se detectó con una frecuencia de 80%, 0% y 100% de híbridos positivos, en la primera, segunda y tercera fecha de muestreo, respectivamente (Figura 6). En la localidad de Huimilpan en la segunda fecha de plantación se detectó el virus BWYV con una frecuencia de 0%, 60% y 0%, el CMV con 20%, 60% y 0% de híbridos positivos, en tanto que los virus LMV, AMV y TSWV no se detectaron (Figura 7).
Fuente: Elaboración propia.
Figura 2 Frecuencia (%) de infección por los virus BWYV, CMV, LMV, AMV y TSWV en follaje de cinco híbridos de lechuga (Lactuca sativa L.), en dos fechas de plantación, colectados en tres fechas de evaluación, en tres localidades, durante el periodo de febrero-julio de 2010, en el estado de Querétaro, México.
Fuente: Elaboración propia.
Figura 3 Porcentaje de híbridos positivos a cinco virus en follaje de lechuga (Lactuca sativa L.), en la primera fecha de plantación, en la localidad Vanegas, en el municipio de Corregidora, Qro., México.
Fuente: Elaboración propia.
Figura 4 Porcentaje de híbridos positivos a cinco virus en follaje de lechuga (Lactuca sativa L.), en la segunda fecha de plantación, en la localidad Vanegas, en el municipio de Corregidora, Qro., México.
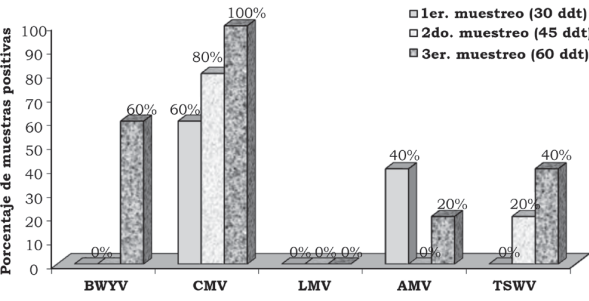
Fuente: Elaboración propia.
Figura 5 Porcentaje de híbridos positivos a cinco virus en follaje de lechuga (Lactuca sativa L.), en la primera fecha de plantación, en el rancho Noria Nueva, en el municipio de Pedro Escobedo, Qro., México.
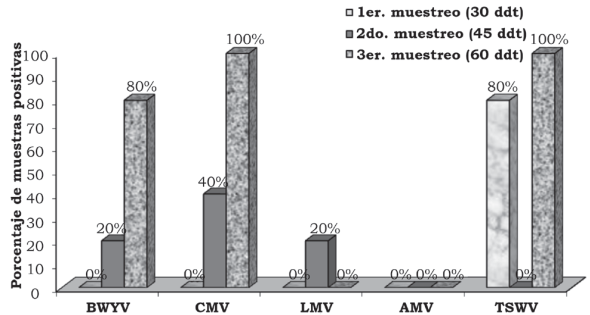
Fuente: Elaboración propia.
Figura 6 Frecuencia de los virus en follaje de lechuga (Lactuca sativa L.), en la segunda fecha de plantación, en el rancho Noria Nueva, en el municipio de Pedro Escobedo, Qro., México.
DISCUSIÓN
Los resultados de la presente investigación, en relación con la severidad e incidencia de virosis en los cinco híbridos de lechuga evaluados, indican que los virus estuvieron presentes en los cinco híbridos probados, en las dos fechas de plantación y en las tres localidades evaluadas.
Las plantas infectadas presentaron sintomatología variada presuntiva de virosis, como es el enchinamiento, mosaico, amarillamiento, necrosamiento y achaparra-miento, lo cual imposibilita asociar una sintomatología específica con alguno de los virus en particular por la sola observación, y no se puede determinar con precisión qué virus están presentes al observar el síntoma. Esto coincide con lo reportado por Blancard et al. (2006). Como lo demuestra la información obtenida, varios tipos de virus producen síntomas bastante similares, lo que puede llevar a confusiones en la identificación, por lo que se debe tener cuidado al realizar el diagnóstico de un virus específico (Blancard et al., 2006). Aun cuando existan diferencias relacionadas con el estado fisiológico del cultivo, con la relación virus-cultivo y con la temperatura ambiental, se pueden presentar variaciones en la sintomatología. Lo anterior coincide con lo reportado por Besoain & Salinas (2003), Blancard et al. (2006), Garnica, Yanguas, Lezáun & Sola (2007) y Rosales, Araya, Mora & Aljaro (2006), quienes mencionan que en algunos casos la sintomatología que presentaron las plantas enfermas de lechuga fue claramente de virosis, sin tener la seguridad de qué virus estaban presentes, por lo cual ellos detectaron la presencia de otros virus reportados en el cultivo de lechuga para tener la seguridad de asociar una específica sintomatología viral con determinados virus.
Es importante conocer la frecuencia viral en cada muestreo para determinar de acuerdo con la fecha de plantación cuál es la etapa fenológica de la planta de lechuga en la cual se debe realizar la determinación de los virus presentes, con el fin de llevar a cabo un manejo integrado de las virosis. En el presente estudio, los porcentajes de muestras seropositivas variaron en los diferentes muestreos; lo anterior no significa que los virus hayan desaparecido de las plantas en el periodo transcurrido de un muestreo a otro, sino que posiblemente se haya reducido la concentración viral y, por lo tanto, la prueba de ELISA no lo detectó. Ello coincide con lo reportado por Conci, Canavelli & Lunello (2003), Dovas et al. (2001) y Shiboleth, Gal-On, Koch, Rabinowitch & Salomon (2001), quienes señalan que aunque la técnica de ELISA a menudo ha sido utilizada para realizar el diagnóstico de virus en ajo, la técnica de PCR ha demostrado ser más eficiente y sensible.
La severidad de virosis en la primera fecha de plantación presentó una correlación positiva moderada con la precipitación pluvial; mientras que la incidencia de virosis tuvo una correlación positiva y moderada en las dos fechas de plantación. Estos resultados concuerdan con los reportados por Morales & Fereres (2008) y Torres-Vila et al. (1998), quienes mencionan que las temperaturas mínimas pueden ser un factor determinante de la irregular incidencia de los insectos transmisores de virus.
La mayor severidad e incidencia de virosis observadas en la segunda fecha de plantación, en la localidad de Pedro Escobedo, sugieren que la presencia del complejo viral incrementa la sintomatología de las plantas enfermas, dando lugar a un aumento en la enfermedad. Lo anterior concuerda con lo reportado por Besoain & Salinas (2003), Pardo, Jorda & Alfaro (1985) y Rosales et al. (2006), quienes indican que el complejo viral incrementó la severidad e incidencia de las virosis en las zonas productoras de lechuga de la Quillota, de la V región, y en la región central de Chile. La incidencia de virosis en Pedro Escobedo, a los 45 ddt y 60 ddt, y en Corregidora y Huimilpan a los 60 ddt concuerda con la reportada para el cultivo de ajo por Pérez, Navarro, Ramírez & Mendoza (2010), quienes argumentan que la incidencia viral en el cultivo varió de un 28% a un 100%, dependiendo del virus, de la localidad y de la etapa fenológica del cultivo. Se encontró que en las localidades de Corregidora y Pedro Escobedo, el BWYV, el CMV y el TSWV fueron los virus más frecuentes. También para el total de muestras analizadas se determinó que la frecuencia de los virus BWYV, CMV, LMV, AMV y TSWV fue de 9.8%, 23.6%, 0.9%, 2.2% y 9.3%, respectivamente. Esto concuerda con los resultados reportados por Garnica et al. (2007), quienes mencionan no haber encontrado muestras positivas para el virus LMV; sin embargo, no coinciden con los resultados obtenidos por Moreno et al. (2004), quienes mencionan que obtuvieron el 13% de muestras positivas para el LMV; y por Parisa, Gholamhossein & Habibi (2011), quienes reportan que el 21% de las muestras analizadas fueron positivas con infección simple y el 49% con infección mixta para el LMV. La discrepancia entre los resultados obtenidos en este estudio con los obtenidos por Moreno et al. (2004) y Parisa et al. (2011) pudiera atribuirse a que las condiciones climáticas prevalentes en las localidades de evaluación fueron diferentes y a que los híbridos de lechuga evaluados tuvieron distinta susceptibilidad a los virus presentes. Con respecto al TSWV, los resultados obtenidos en el presente estudio coinciden con los reportados por Parisa et al. (2011), quienes alcanzaron una frecuencia del 10% para este virus con infecciones simples y una frecuencia del 8% con infecciones mixtas; en cambio, difieren de los resultados publicados por Moreno et al. (2004), que reportaron una frecuencia del 55.5% para el TSWV. Con respecto al virus CMV, los resultados obtenidos en el presente estudio tuvieron un rango en la frecuencia del 0% al 100%, lo cual coincide con lo publicado por Moreno et al. (2004), quienes señala-ron una variación en la frecuencia del 13% al 100%; también coinciden con lo reportado por Parisa et al. (2011), que indican una variación en la frecuencia del 16% con infecciones simples y una frecuencia del 5% con infecciones mixtas, del total de muestras positivas dependiendo de la localidad evaluada. Lo anterior sugiere que, dependiendo de la localidad y la época del año en que se realice la plantación, puede variar la incidencia de virosis. En la segunda fecha de plantación del presente estudio, la disminución de las virosis se pudo deber a la disminución poblacional de insectos vectores, ya que durante una semana del ciclo de cultivo se presentaron lluvias, y esto pudo influir en la infección viral. Esto significa que la infección de los virus transmitidos de manera no persistente por pulgones a menudo se produce cuando especies de áfidos no colonizantes se posan en el cultivo y comprueban si es el hospedero adecuado (Blancard et al., 2006).
CONCLUSIONES
La fecha y localidad de plantación son factores que incrementan la severidad e incidencia de virosis en el cultivo de lechuga. La localidad de Pedro Escobedo, en la fecha de plantación del 1 de junio de 2010 presentó la mayor severidad e incidencia de virosis. Los virus más abundantes detectados en follaje de lechuga fueron el CMV, el BWYV y el TSWV, con una frecuencia del 23.6%, 9.8% y 9.3%, respectivamente.











 nueva página del texto (beta)
nueva página del texto (beta)