INTRODUCCIÓN
La esquizofrenia es un trastorno mental grave caracterizado por perturbaciones del lenguaje, del pensamiento, de la percepción, del afecto y de la funcionalidad global (Asociación Psiquiátrica Americana [APA], 2014). Los principales síntomas de este padecimiento suelen clasificarse como positivos (delirios, alucinaciones, desorganización conceptual, suspicacia, hostilidad) y negativos (retraimiento social y emocional, pensamiento estereotipado, dificultad de abstracción); ambos implican un abanico de limitaciones en la funcionalidad global de las personas que la padecen.
Según la Organización Mundial de la Salud (OMS, 2013), la esquizofrenia afecta a más del 1% de la población mundial, es decir, 24 millones de personas en todo el mundo sufren esta enfermedad. La APA (2014) define su etiología como multifactorial al no demostrarse que el sexo, la raza, la cultura, la clase social u otra variable sean determinantes únicas en la aparición de este trastorno. Si bien, diversas investigaciones han indagado sobre los distintos factores ambientales, familiares y psicosociales que pudieran estar relacionados con el inicio de la esquizofrenia, otros estudios han analizado la asociación de los factores genéticos y hereditarios para el desarrollo de este trastorno con una incidencia de hasta un 80% (Kempisty et al., 2007).
A propósito de estos últimos factores, los recientes estudios sobre las variantes genéticas en la esquizofrenia sugieren una fuerte asociación entre la aparición de este padecimiento y la presencia de los polimorfismos de la enzima Metilenotetrahidrofolato reductasa (MTHFR) C677T y el A1298C, ya que ambos alteran el ciclo metabólico de la homocisteína e interfieren en el metabolismo y las concentraciones de folatos. Sin embargo, aunque el cambio de un glutamato por una alanina produzca un descenso en la actividad de la enzima en el polimorfismo A1298C, ni el estado homocigoto C ni el heterocigoto CT han demostrado asociación con el aumento de la concentración plasmática de homocisteína o la disminución de la concentración de folato en plasma, fenómeno que sí es evidente en el polimorfismo C677T, en particular en su expresión homocigota T (Gutiérrez, Pérez, Calvo, Tamparillas & Gracia, 2003).
El polimorfismo MTHFR C677T consiste en el cambio de una citosina (C) por una timina (T) en la posición 677 del gen MTHFR que se encuentra ubicado en el brazo corto del cromosoma 1. El homocigoto T provoca una disminución en la actividad de la enzima MTHFR de hasta un 70% (Goyette et al., 1994), a diferencia del homocigoto C o el heterocigoto CT, en los que no se presentan alteraciones enzimáticas. Esto conlleva como consecuencia el incremento de homocisteína oxidada, ocasionando hiperhomocisteinemia, la cual causa neurotoxicidad en las células neuronales y genera especies reactivas de oxígeno, efectos protrombóticos, promoción del estrés oxidativo, formación de derivados de homocisteína, incremento de la toxicidad de la proteína β-amiloide y la activación de apoptosis (Sánchez-Cuevas, Jiménez-Reséndiz & Morgado-Vázquez, 2009); circunstancias asociadas a distintas enfermedades neurológicas, cerebrovasculares y psiquiátricas, en particular con el riesgo de padecer esquizofrenia (Nishi et al., 2014; Numata et al., 2015).
Las recientes investigaciones a nivel internacional que han encontrado una relación entre la esquizofrenia y la presencia del polimorfismo C677T se han desarrollado en Polonia, Inglaterra y China. Entre ellas se encuentran los estudios de Kempisty et al. (2007), Gilbody, Lewis & Lightfoot (2007) y Zhang et al. (2013), que reportaron riesgos relativos de 2.75, 1.44 y 0.79, respectivamente, para la presentación de este polimorfismo en la esquizofrenia. Por su parte, Roffman et al. (2008), en Estados Unidos de América, además de encontrar una relación significativa entre estas dos variables, descubrieron asociación entre el homocigoto T, la predominancia sintomatológica negativa y el género femenino en pacientes con esquizofrenia de una muestra de 200 pacientes (p = 0.041).
No obstante, otros estudios contradicen los resultados de la asociación entre el polimorfismo C677T y la esquizofrenia. Investigaciones como las de Yu et al. (2004)), Kang et al. (2010), Kim et al. (2011) y Saetre et al. (2011) no hallaron evidencia consistente para establecer esta asociación. En los índices consultados para los países de Centroamérica y Sudamérica no se registran estudios sobre la asociación estadística de estas dos variables. En México, sólo una investigación ha reportado datos acerca de esta posible relación, donde no se encontró asociación entre la esquizofrenia y el polimorfismo C677T en 105 pacientes con este diagnóstico, pero sí se halló una asociación significativa entre el homocigoto T y los altos niveles de homocisteína (García-Miss et al., 2010). Sin embargo, tal como lo sugieren los autores del presente estudio, se requiere profundizar sobre este tema en población mexicana para esclarecer su probable implicación con el trastorno (Tabla 1).
Tabla 1 Antecedentes del polimorfismo MTHFR C677T y la esquizofrenia.

* media y rango de los promedios del homocigoto T * s/d: dato desconocido.
Fuente: Elaboración propia.
Los distintos estudios que han analizado el polimorfismo C677T en grupos de poblaciones sanas a lo largo del mundo mostraron rangos muy bajos de la frecuencia del alelo T en etnias de sudafricanos, africanos, afroamericanos y caucásicos, los cuales van del 4.5% al 28%. Contrario a países con mayor mestizaje como México y otros grupos hispánicos, donde se ha evidenciado una frecuencia que va del 30% al 59% (González-Herrera et al., 2002).
Estudios realizados en México sobre el polimorfismo
En la población mexicana sana, la frecuencia del alelo T es alta (Dávalos et al., 2000), la cual va del 30% al 60%; lo mismo sucedió con la presencia del homocigoto T, donde se expresó en un rango del 19.7% al 47.7% (Baptista-González, 2000). Los datos obtenidos por Mutchinick, López, Luna, Waxman & Babinsky (1999) respaldan esta afirmación, ya que ellos encontraron en 250 mujeres sanas la frecuencia del alelo T en 58% y la presencia del homocigoto T en un 35%. Estos investigadores sostienen también que la prevalencia del polimorfismo C677T fue alta en toda la República Mexicana, debido a la uniforme distribución del homocigoto T, por lo cual uno de cada tres individuos sanos pudiera tener la expresión termolábil (TT) del gen MTHFR (Mutchinick et al., 1999).
Por otro lado, González-Herrera et al. (2002) encontraron en el sur de México datos muy similares, con una frecuencia de 54% para el alelo T y de 30% del homocigoto T en 110 controles sanos. Delgado-Enciso et al. (2006), en el norte de México, observaron una cifra de 22.5% del homocigoto T en 70 personas sanas de Nuevo León y una frecuencia del alelo T de 50%, cifra más baja para el homocigoto T en comparación con las reportadas en el centro y sur de México. Esfahani, Cogger & Caudill (2003), más al norte del país, reportaron una frecuencia inferior a éstas, que fue de 18.1% para el homocigoto T en 193 mujeres de descendencia mexicana. A propósito de esto, Mutchinick et al. (1999) también percibieron en su estudio que la región norte del país tuvo menos propensión a presentar el alelo T y el homocigoto T.
Con base en estos datos, Aguirre-Rodríguez, Martínez, Velazco, Sampallo & Esmer (2008) afirmaron que el gradiente del polimorfismo en México mostró una prevalencia descendente de sur a norte, hasta llegar a los Estados Unidos de América, donde se presentaron las frecuencias más bajas del genotipo T. Aguirre-Rodríguez et al. (2008), en su estudio en el estado de Nuevo León, reportaron en 533 individuos una proporción de homocigotos T de 19.7% con una frecuencia del alelo T de 47%. Un estudio más, realizado en Chihuahua por Chávez (2004), respalda esta afirmación al reportar una frecuencia promedio del alelo T de 38% y 39%, y un porcentaje del homocigoto T de 10.4% y 18.4% en población mestiza y tarahumara, respectivamente.
Baptista-González (2000) señaló que las investigaciones en México que han estudiado la incidencia del C677T no han mostrado que el polimorfismo tenga asociación estadísticamente significativa con embolismo pulmonar postoperatorio, padecimientos cardiovasculares, trombosis venosa profunda durante el embarazo, postoperatoria en cirugía ortopédica y en pacientes pediátricos con la leucemia linfoblástica aguda. Pocos artículos en México han asociado significativamente los polimorfismos del MTHFR con alguna anomalía médica, tal como lo hicieran Rodríguez-Guillén et al. (2009) en pacientes con factor de riesgo de aborto espontáneo. Respecto a la esquizofrenia, sólo existe un estudio en México, mas no esclarece la asociación reportada en otros países. García-Miss et al. (2010) no demostraron que el polimorfismo pudiera ser un factor de riesgo para la esquizofrenia, aun cuando el homocigoto T estuvo presente en el 30% de los casos. Tampoco se estudió la probable relación registrada en otros estudios (Roffman et al., 2008), entre la predominancia sintomatológica y el polimorfismo MTHFR C677T. Por tanto, se decidió realizar esta investigación, la cual es la primera en analizar la asociación de este polimorfismo con la predominancia sintomatológica en una muestra de pacientes con esquizofrenia de Jalisco, México.
MATERIALES Y MÉTODOS
Con un diseño observacional, se realizó un estudio descriptivo, transversal, con enfoque retrospectivo, aprobado por el Comité de Ética e Investigación del Instituto Jalisciense de Salud Mental (Salme) y la Universidad de Guadalajara, donde se seleccionó un total de 49 pacientes con diagnóstico de esquizofrenia del Centro de Atención Integral en Salud Mental Estancia Prolongada (CAISAME-EP) de Jalisco, México, bajo los siguentes criterios de inclusión: pacientes mayores de edad, ambos sexos, con diagnóstico de esquizofrenia establecido por médicos psiquiatras a través de la entrevista clínica del Manual diagnóstico y estadístico de los trastornos mentales DSM-V (APA, 2014), sin comorbilidad psiquiátrica, con capacidad de respuesta a la escala PANSS, hospitalización en unidad prolongada y aprobación de participación bajo consentimiento informado. Como criterios de exclusión se establecieron los casos en los que no fue posible tomar la muestra sanguínea por falta de cooperación o dificultades técnicas para la punción de la vía venosa o que la muestra fuera inadecuada para su procesamiento o interpretación (muestra coagulada y cantidad insuficiente de muestra). El cálculo de la muestra se realizó con base en la fórmula de Feinstein (1977) para distribuciones no paramétricas a partir de la prevalencia mínima de 13% y máxima de 43% reportadas por Saetre et al. (2011) sobre la presentación del polimorfismo MTHFR C677T en la esquizofrenia, con un nivel de confianza de 99% y de error de 1%. Resultando una n de 42, misma que se incrementó ≈20% con el propósito de compensar posibles pérdidas. Posterior a la firma del consentimiento informado por parte del responsable de la institución y del paciente, éstos fueron evaluados con la escala PANSS (Kay, Fisbein & Opler, 1987) validada en México por Ortega-Soto, Jasso, Ceceña & Hernández-Ávila (1991), con un coeficiente Alfa de Cronbach elevado de 0.73, 0.83 y 0.79 para las subescalas positiva, negativa y de psicopatología general, además de un coeficiente de correlación interclase promedio de 0.80. La escala PANSS fue el instrumento utilizado para clasificar a los pacientes en dos grupos con base en el sistema categorial inclusivo: uno con predominancia de síntomas positivos y otro de síntomas negativos. Estos dos grupos se compararon para determinar la asociación de los síntomas con los genotipos del polimorfismo MTHFR C677T.
Después se procedió a la toma de sangre periférica recolectada en tubos con ácido etildiaminotetraacético (EDTA). La extracción de ácido desoxirribonucleico (ADN) se realizó basándose en el método modificado de Miller, Dykes & Polesky (1988). La reacción en cadena de la polimerasa (PCR, por sus siglas en inglés) se realizó con el reactivo Master Mix para PCR marca Promega en un termociclador Techne TC-412. Para la amplificación del fragmento se utilizó la técnica descrita por Frosst et al. (1995). Los primeros utilizados para la amplificación fueron 5’-TGA AGG AGA AGG TGT CTG CGG GA -3’ y 5’-AGG ACG GTG CGG TGA GAG TG-3’. El fragmento amplificado de 198 pb se digirió con HinfI (Promega).
Los fragmentos resultantes se corrieron en un gel de agarosa al 2% en una cámara de electroforesis Scientific Co., MGU-502T, y se tiñó el gel con SYBR Green (Invitrogen). El marcador de peso molecular fue de 50 pb. Se visualizó el gel en un Transluminador Ultravioleta Spectroline, donde se buscó una banda de 198 pb correspondiente al homocigoto C (silvestre), una banda de 175 pb y otra de 198 pb correspondes al heterocigoto CT y una banda de 175 pb corresponde al homocigoto T. Los datos (numéricos y categóricos) fueron analizados con base en su escala de medición para aplicar los estadígrafos descriptivos e inferenciales correspondientes, con ayuda del software de analítica predictiva (SPSS) 20. Para establecer o no diferencias estadísticas entre polimorfismos y otras variables se utilizó la Ji cuadrada o sus variantes y se consideró significativa una “p ≤ 0.05”.
RESULTADOS
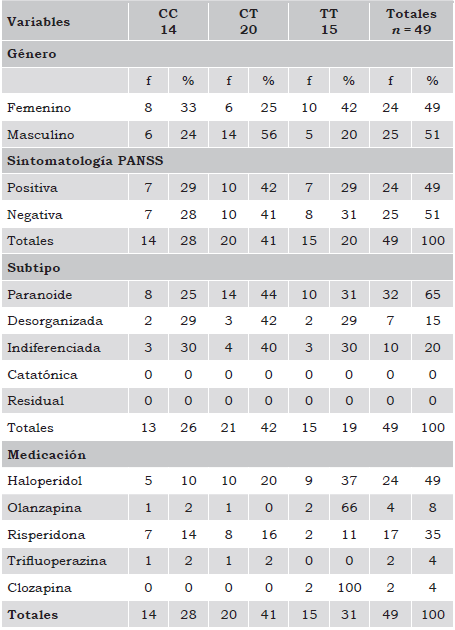
La muestra estuvo conformada por 49 pacientes con diagnóstico de esquizofrenia: 25 fueron hombres y 24 mujeres. La media de edad fue de 43 ± 12 años (19 - 70 años). Del total de pacientes, 37% completaron la primaria, 19% la secundaria, 8% la preparatoria, 14% estaban titulados de alguna carrera profesional y 22% no reportaron escolaridad. En relación con el estado civil, 88% de ellos eran solteros, debido a la disfuncionalidad del área interpersonal que el trastorno mental grave produce; 8% casados; el resto eran divorciados o vivían en unión libre. Los subtipos de esquizofrenia estuvieron representados por las siguientes clases: paranoide con 65% (17 hombres y 15 mujeres), desorganizada con 15% (4 hombres y 3 mujeres) e indiferenciada con 20% (4 hombres y 6 mujeres) (Tabla 2).
El 49% de los pacientes tomaron Haloperidol como medicamento antipsicótico de base, de los cuales 5 tuvieron la variante CC, 10 la CT y 9 la TT. Prevaleció el uso de este neuroléptico clásico en el subtipo de esquizofrenia paranoide y los pacientes con sintomatología positiva. El 35% fue tratado con Risperidona, 6% con Olanzapina y el resto con Trifluoperazina o Clozapina. La Risperidona tuvo una alta incidencia de uso en los pacientes con predominancia sintomatológica negativa (66%), la cual fue administrada a siete pacientes con genotipos CC, a ocho con CT y dos con TT.
La muestra estuvo en equilibrio Hardy-Weinberg (χ2= 1.693, p ≥ 0.05). La frecuencia del homocigoto T en la muestra fue de 31% y del alelo T de 51%. Del total de pacientes, el 28% correspondió al homocigoto C, el 41% al heterocigoto CT y 31% al homocigoto T (Tabla 3).
Entre los genotipos y la predominancia sintomatológica, CC/CT (p = 0.72), CC/TT (p = 0.84), CT/TT (p = 0.88), no hubo significancia estadística. En la población estudiada tampoco se presentó diferencia significativa entre los síntomas positivos y negativos por género (p = 0.11). El género femenino mostró mayor propensión a la sintomatología positiva (60%) (alucinaciones, delirios y excitabilidad) y al homocigoto T (66%). En cambio, los hombres con homocigoto T tuvieron propensión a los síntomas negativos (80%) (apatía, abulia y anhedonia). El 33% de las mujeres expresaron el homocigoto C (8/24), 25% el heterocigoto CT (6/24) y el 42% el homocigoto T (10/24). El 24% de los hombres tuvieron el genotipo CC (6/25), 56% el CT (14/25) y 20% el TT (5/25).
En el heterocigoto CT se observó una predominancia de síntomas negativos en el género masculino a diferencia del femenino (10/0). También se apreció tendencia a la significancia estadística en relación con síntomas positivos en mujeres con genotipo CT (p = 0.05) y de síntomas negativos en mujeres con genotipo homocigoto C (p = 0.09), sin diferencias entre el genotipo TT, género y predominancia sintomatológica (Tabla 4).
Tabla 4 Relación de los polimorfismos con la predominancia sintomatológica por sexo.
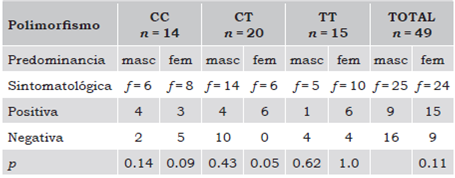
Fuente: Elaboración propia.
No se encontró significancia entre los genotipos CC, CT y TT en relación con algún subtipo de esquizofrenia (paranoide, desorganizada, catatónica, indiferenciada y residual). Respecto a la asociación entre la predominancia sintomatológica y el subtipo de enfermedad, la esquizofrenia paranoide mostró una tendencia significativa a estar vinculada con los síntomas positivos (p = 0.06), en comparación con el subtipo indiferenciado.
DISCUSIÓN
El promedio de edad de los pacientes incluidos en el estudio fue de 43 años, coincidente con la media de edad publicada en otros artículos, como el de Gilbody et al. (2007). La esquizofrenia paranoide fue el subtipo más representativo en la población estudiada con un 65%, como lo reporta la OMS (2013) a nivel mundial. La falta de predominio del homocigoto T en la población estudiada coincide con los resultados obtenidos en México por García-Miss et al. (2010), Kang et al. (2010), Kim et al. (2011), Saetre et al. (2011) y Yu et al. (2004), en el resto del mundo, quienes no encontraron una predominancia entre la esquizofrenia y el homocigoto T. Dato contrario a lo que reportan estudios como el de Allen et al. (2008), Gilbody et al. (2007), Kempisty et al. (2006), Roffman et al. (2008) y Zhang et al. (2013), quienes refieren un riesgo de presentación de la enfermedad de hasta 2.75.
A propósito de estas discrepancias, Barber et al. (citado en González-Herrera et al., 2002) señalan que los alelos T pudieran expresar asociación estadística significativa con algunas enfermedades en las regiones geográficas donde la frecuencia de estos alelos es baja, y una menor asociación en poblaciones donde la mutación alélica es más común. Los estudios antes mencionados que han encontrado asociación significativa entre el homocigoto T del polimorfismo C677T y la esquizofrenia presentan una frecuencia baja de la expresión alélica y genotípica del polimorfismo (Sadewa et al., 2002).
Los estudios realizados en mexicanos que muestran elevadas frecuencias alélicas (Sadewa et al., 2002) tienden a reportar una baja asociación entre el polimorfismo C677T y otras patologías. La heterogeneidad y el grado de mestizaje son factores que pueden incidir en la alta frecuencia alélica, al grado de considerarla un marcador genético de la población latina e indoamericana (Aguirre-Rodríguez et al., 2008; Cerda-Flores et al., 2002; Mutchinick et al., 1999), dada la homogeneidad genética de la población mestiza en México (Cerda-Flores et al., 2002). Por tanto, el alelo T del MTHFR pudiera ser un factor de riesgo en algunos grupos étnicos y en otros no.
Así, las investigaciones que tienden a considerar una asociación significativa entre este polimorfismo y la esquizofrenia suelen ser investigaciones realizadas en algunas poblaciones con alta densidad racial caucásica y asiática, en las cuales la presentación del homocigoto T y el alelo T en gente sana es muy baja (daneses, irlandeses, ingleses y norteamericanos). En poblaciones latinoamericanas, el alelo T suele presentarse de forma más común. En las regiones donde el alelo T y el homocigoto T son frecuentes, la probable asociación con la esquizofrenia es baja y viceversa.
La muestra estudiada en la presente investigación estuvo en equilibrio Hardy-Weinberg. Los resultados respecto a los porcentajes de presentación del homocigoto T (31%) y alelo T (51%) fueron también similares a una de las frecuencias más altas reportadas del polimorfismo MTHFR C677T en México por González-Herrera et al. (2002) en Yucatán (homocigoto T 30% y alelo T de 54%). El estudio previo realizado en 105 pacientes con esquizofrenia en Cuernavaca, México, muestra una similitud con la frecuencia alélica y el porcentaje de homocigotos T (alelo T de 51% y homocigoto T de 30%) encontrados en nuestro estudio (alelo T de 51% y homocigoto T de 31%) a pesar de la diferencia en el tamaño de la muestra.
Se observó que las mujeres, quienes portan el genotipo heterocigoto CT, tienden a presentar síntomas positivos en comparación con el género masculino. Sin embargo, esta tendencia no logró ser significativa. Esto difiere de lo observado por Roffman et al. (2008), y coincide con lo planteado por el Consejo de Expertos de la APA (2014), quienes afirman que las mujeres tienden más a mostrar síntomas positivos y los hombres a los negativos.
El diseño de esta investigación permitió describir la presencia del polimorfismo MTHFR C677T en la esquizofrenia y su probable asociación con la predominancia sintomatológica en la población estudiada, y aporta valiosos datos concordantes con las cifras reportadas en estudios anteriores. Esta situación plantea la necesidad de profundizar en el tema e incrementar la cantidad de estudios sobre este polimorfismo y su posible implicación en la esquizofrenia en México, con diseños metodológicos alternativos. Las limitaciones del estudio radicaron en el diseño de investigación y en los escasos recursos materiales para poder reunir y estudiar una mayor población de pacientes.
CONCLUSIÓN
Con base en los resultados del presente estudio, se puede señalar que no hubo asociación significativa entre el polimorfismo MTHFR C677T y la predominancia sintomatológica en pacientes con esquizofrenia. No obstante, en las mujeres el homocigoto T y los síntomas positivos fueron más frecuentes que en los hombres.
Este contexto plantea la necesidad de profundizar en el tema y realizar una mayor cantidad de estudios sobre este polimorfismo y su probable implicación con otros factores genéticos, en muestras más grandes de pacientes a lo largo de la República Mexicana.
De acuerdo con los resultados de esta investigación, la variante termolábil del gen MTHFR (homocigoto T) en pacientes con esquizofrenia no es un factor predisponente para presentar alguna predominancia sintomatológica.











 nova página do texto(beta)
nova página do texto(beta)