Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Acta universitaria
versión On-line ISSN 2007-9621versión impresa ISSN 0188-6266
Acta univ vol.25 no.5 México sep./oct. 2015
https://doi.org/10.15174/au.2015.800
Talla de madurez de almeja de sifón Panopea globosa en la parte central del Golfo de California
Size at maturity of the Cortes geoduck Panopea globosa in Central Gulf of California
Eugenio Alberto Aragón-Noriega*
* Centro de Investigaciones Biológicas del Noroeste, Unidad Sonora. Km 2.35 Camino al Tular, Estero Bacochibampo, Guaymas, Sonora, México, C.P. 85454. Tel.: (622) 221 2237; fax: (622) 221 2238. Correo electrónico: aaragon04@cibnor.mx
Recibido: 21 de mayo de 2015.
Aceptado: 8 de septiembre de 2015.
Resumen
Se describe la talla de madurez de almeja de sifón Panopea globosa, la cual habita en la parte central Golfo de California. El objetivo del estudio fue conocer la talla a la cual el 50% de la población se encuentra madura. La justificación es que este valor se desconoce, no sólo de esta especie en particular, sino en general de otros congéneres este conocimiento es escaso. Otra justificación es que la talla mínima legal en la pesquería mexicana, la cual es de 130 mm de longitud de concha (LC), fue emitida desconociendo aspectos biológicos claves de la especie en México. Las almejas fueron recolectadas a profundidades de 20 m a 25 m, durante enero de 2014 en Bahía Guaymas-Empalme, Sonora. Para obtener el valor de talla de madurez se utilizó un modelo logístico ajustado con el criterio de máxima verosimilitud. El 50% de la población estaba madura, y la talla fue de 91.906 mm de LC para hembras y 91.909 mm de LC para machos. Sin embargo, el análisis de los residuales de suma de cuadrados mostró que ambos sexos no son significativamente diferentes (F0.284; p < 0.7547). Se ha demostrado con este estudio que el tamaño mínimo legal de 130 mm es más grande de lo necesario. Dato importante en tanto la talla de madurez se toma como requisito de restricción en la pesca de esta especie.
Palabras clave: Almeja de sifón; Golfo de California; Panopea globosa; talla de madurez; talla mínima legal.
Abstract
This paper describes the size at maturity of the Cortés geoduck Panopea globosa in the central Gulf of California. The objective of this study was to determine the size at which 50% of the population is mature. The justification is that this value is still unknown not only of this particular species, but in general, for other species of the genus such knowledge is scarce. Another justification for the study is that the minimum legal size in Mexican Cortés geoduck fishery, which is 130 mm in shell length (SL), was determined ignoring key biological aspects of the species in Mexico. Mexican geoducks were collected sub-tidal, 20 m to 25 m depth in Bahía Guaymas-Empalme, Sonora located in the Central Gulf of California in January 2014. A logistic model was used fit with the maximum likelihood criterion to get the size value at 50% maturity, which was 91.906 mm SL and 90.909 mm SL, female and male respectively. The analyses of the residual sum of squares showed both curves were not significantly different (F0.284; p < 0.7547), demonstrating that the 130 mm legal size is larger than necessary if the size at maturity was the constraining requirement.
Keywords: Cortes geoduck; Gulf of California; minimum legal size; Panopea globosa; size at maturity.
INTRODUCCIÓN
Las especies del género Panopea, comúnmente conocidas como almeja de sifón (Familia Hiatellidae), tienen una distribución cosmopolita. El género comprende varias especies como Panopea abbreviata (Valenciennes, 1839), la cual es endémica del suroeste Atlántico; P. zelandica (Quoy & Gaimard, 1835), que se encuentra en el Pacífico suroeste; P. globosa (Dall, 1898), localizada principalmente en el Golfo de California y Bahía Magdalena en Baja California Sur; y P. generosa (Gould, 1850), distribuida desde Alaska a Baja California, México. La pesca comercial de la almeja de sifón del Pacífico se inició en 1970, en el estado de Washington, Estados Unidos de América, y en 1976 en British Columbia, Canadá, donde el promedio de desembarques (2006 a 2010) es de ~1600 t y 1335 t, respectivamente (datos disponibles en www.st.nmfs.noaa.gov y www.env.gov.bc.ca/omfd). Más recientemente, la explotación de las especies de almeja generosa se ha extendido hacia el noroeste de México; P. generosa a lo largo de la costa del Pacífico en Baja California y P. globosa en el Golfo de California y Bahía Magdalena, Baja California Sur (Aragón-Noriega, Alcántara-Razo, Calderón-Aguilera & Sánchez-Fourcade, 2012).
Existe escasa información de los aspectos básicos de la biología de ambas especies en México. Esto ha motivado el desarrollo de la investigación científica de las dos especies para adquirir conocimientos biológicos estructurales y funcionales. Entre los más importantes está la determinación de aspectos reproductivos, ciclos reproductivos, talla de madurez, entre otros. Se debe añadir también que las reglas de control de las pesquerías establecen una talla mínima legal de extracción en los 130 mm de longitud de concha (LC), por lo que el conocimiento de la talla de primera madurez se vuelve importante para el manejo de esta pesquería, ya que se busca preservar la especie bajo explotación, pues se capturan organismos por debajo de la talla a la cual el 50% de la población está madura se puede caer en sobrepesca de reclutamiento. Este criterio se utiliza en diferentes recursos pesqueros, tanto en peces (Solana-Sansores, Dicante, Luna & Villaseñor-Talavera, 2012) como en crustáceos (Rodríguez-Domínguez, Castillo-Vargasmachuca, Pérez-González & Aragón-Noriega, 2012). En cuanto a los moluscos, se puede consultar en el sitio de la Comisión Nacional de Acuacultura y Pesca (Conapesca) que los recursos como abulón, almeja catarina, ostión y pulpo, entre otros, se manejan con tallas mínimas de captura (Conapesca, 2015).
En el Golfo de California, el periodo reproductivo se restringe a los meses de noviembre a febrero, tanto para la parte central (Aragón-Noriega et al., 2007; Arámbula-Pujol, García-Juárez, Alcántara-Razo & Aragón-Noriega, 2008) como para el Alto Golfo de California (Calderón-Aguilera, Aragón-Noriega, Reyes-Bonilla, Paniagua-Chávez, Romo-Curiel & Moreno-Rivera, 2010). Sin embargo, aún no se ha determinado la talla de primera madurez en ninguno de estos dos sitios para los cuales ya se describió el ciclo biológico reproductivo.
En biología pesquera se entiende como talla de primera madurez la longitud a la cual el 50% de la población presenta gónadas maduras listas para la puesta o desove, por esa razón también se conoce como L50. No se debe confundir con la talla o longitud a la cual un individuo puede encontrase maduro, ya que ésta regularmente es muy inferior a L50. Para mejorar el manejo de la pesquería y contribuir a plantear estrategias bien fundadas para el aprovechamiento y conservación, es muy importante conocer la talla de primera madurez, pues la determinación imprecisa puede provocar una sobreexplotación de poblaciones, debido a que esta talla está relacionada con los procesos biológicos clave del éxito reproductivo.
En muchos organismos sujetos a explotación, la talla de primera madurez es factor clave para el manejo pesquero, ya que se parte de la premisa de protección de la descendencia para futuras temporadas de pesca. En realidad se busca permitir a los organismos que se reproduzcan al menos una vez antes de ser extraídos. Sin embargo, en los congéneres de P. globosa (P. generosa y P. zelandica) no se utiliza la talla de primera madurez como medida de manejo pesquero; incluso no hay una talla mínima de captura como en México. Como se dijo líneas arriba, las autoridades pesqueras mexicanas han establecido 130 mm de LC como talla mínima de captura. Si la protección o aseguramiento del éxito reproductivo es lo que motivó esta medida de manejo, entonces es necesario conocer cuál es esta talla de primera madurez. Por esa razón el presente estudio se realizó para determinar la talla de primera madurez de P. globosa en la parte central del Golfo de California y contribuir, de manera general, al conocimiento biológico de la especie y, de manera particular, al aprovechamiento pesquero sustentable.
MATERIALES Y MÉTODOS
Muestreo biológico
Los ejemplares se recolectaron de la Bahía de Guaymas-Empalme. Esto debido a que en una prospección previa del área fue localizado un banco de almejas al sur de Empalme, en el sitio conocido como Playas del Sol (figura 1). El polígono de estudio comprende una superficie de 35'822 555.599 m2, localizado entre las coordenadas geográficas: 27° 55" y 27°51 N y 110° 45" y 110°40" W. Se recolectaron muestras solamente en enero de 2014, porque ese mes fue determinado como el pico de la maduración y desove (Aragón-Noriega et al., 2007; Calderón-Aguilera et al., 2010).
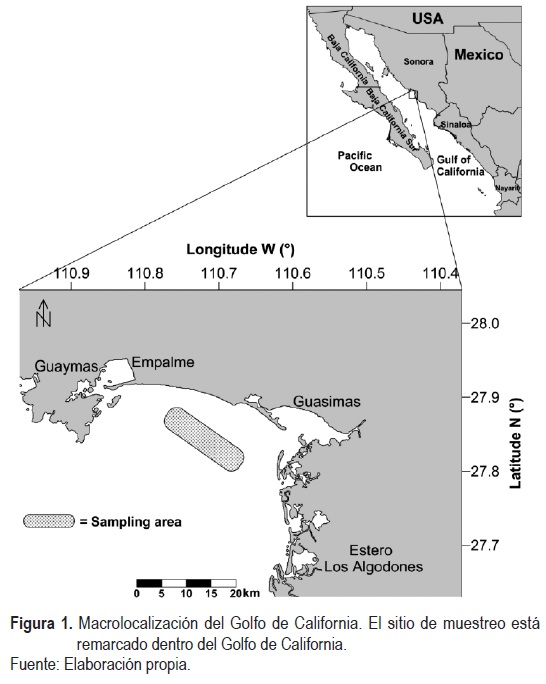
La extracción de la almeja de sifón se realizó con embarcaciones menores de fibra de vidrio de siete metros de eslora, equipadas con motor fuera de borda de capacidad de 115 HP, y un compresor de aire para buceo semiautónomo (hooka), el cual es operado por un motor de gasolina de 7 HP. También se utilizó una motobomba de agua que inyecta agua a presión para la remoción del sustrato y la extracción de la almeja de sifón. Por lo general, el buzo trabajó a una profundidad de 20 m a 25 m; en su búsqueda localizó las marcas ocasionadas por el sifón de la almeja. Una vez en la embarcación, se manipuló el organismo con cuidado de no romperlo, y cada uno fue colocado individualmente en hieleras a las que se les estuvo cambiando constantemente el agua para mantenerlas en buen estado.
Los organismos recolectados fueron llevados al laboratorio en las mismas hieleras, y posteriormente pasados a otros recipientes para realizarles las biometrías correspondientes y eviscerarlos cuidadosamente con un bisturí, procurando no dañar la gónada. Una vez eviscerado, se procedió a retirar la gónada, aislando el tejido conectivo, así como el tejido muscular que hubiera quedado adherido a la misma. Una vez que se obtuvo la gónada, se fijó en solución Davidson's por 24 h, luego fueron colocadas en alcohol al 70% para posteriormente ser procesadas. Se siguieron los procedimientos histológicos empleados en los estudios previos (Aragón-Noriega et al., 2007; Calderon-Aguilera et al., 2010). Los cortes histológicos obtenidos fueron utilizados para la descripción del estadio de madurez. Las almejas se consideraron sexualmente maduras si los gametos estaban presentes y el tejido conectivo tenía bien desarrolladas las células primarias evidentes en las paredes del folículo o si el desarrollo de ovocitos o espermatocitos era observable. Los individuos inmaduros no tenían ninguna diferenciación en tejido gonadal y tejido fino conectivo vesicular flojo en la gónada.
Análisis de los datos
La información proveniente de las fases de madurez fue utilizada para estimar la longitud de primera madurez sexual (L50). Esta variable se define como el valor de talla a la cual el 50% de los individuos muestreados se encuentran maduros o han tenido alguna puesta. La estimación se realizó obteniendo el porcentaje de individuos maduros por clase de tallas cada 5 mm, y posteriormente ajustando estos valores a un modelo logístico. El ajuste y la comparación de las tallas de primera maduración obtenidas para machos y hembras fueron realizados por el método de máxima verosimilitud. La técnica es probabilística y genera un grupo de probabilidades, un parámetro en el que puede ocurrir; en la parte más alta de la curva generada se representa la máxima probabilidad de ocurrencia del parámetro. Por esa razón es llamado estimador de máxima verosimilitud (Cervantes-Hernández, Flores-Gómez & Sánchez-Meraz, 2005).
El cálculo de L50 se basó en el modelo logístico que relaciona la proporción de individuos maduros a través de la siguiente ecuación:

Donde:
Pi = porcentaje de madurez a la talla i
Li = intervalo de talla
L50 = talla del 50% de madurez poblacional
α = constante de ajuste
Mediante iteraciones, los parámetros del modelo fueron ajustados maximizando un algoritmo de log verosimilitud de la función binomial (Brouwer & Griffiths, 2005):
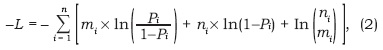
Donde:
n = número de total de organismos de la clase i
m = número de organismos maduros en la clase i
Se obtuvieron los intervalos de confianza de la talla de primera madurez con base en los perfiles de verosimilitud y la distribución chi-cuadrada (Venzon & Moolgavkar, 1988). El intervalo de confianza fue definido como todos los valores de θ que satisfacen la siguiente desigualdad:
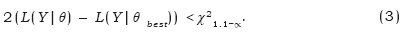
Donde L[Y|θbest] es la log verosimilitud negativa del valor más probable de θ y χ21.1– ∝ es el valor de χ2 con un grado de libertad al nivel de confianza 1–∝. Así, el intervalo de confianza al 95% de θ abarca todos los valores de θ que son dos veces la diferencia entre la log verosimilitud negativa de un θ dado y la log verosimilitud negativa de la mejor estimación de que sea menor que 3.84 (Haddon, 2001).
Se estimó el perfil de similitud para θi que genera una log verosimilitud negativa igual a la máxima verosimilitud negativa L[Y|θbest] menos la mitad del valor requerido de χ2 (3.84/2). El estimador es:

Un método de comparación de las dos curvas (machos vs hembras) fue hecho según la propuesta de Haddon (2001). Se llama análisis residual de suma de cuadrados (ARSC). ARSC es una comparación total, lo que significa que no se compara los parámetros por separado, sino simplemente muestra cuando dos o más curvas son estadísticamente diferentes (Haddon, 2001). Esta prueba utiliza el estadístico F y el detalle se puede consultar en Zar (1996). De manera resumida, se utilizan los siguientes pasos: para cada grupo de datos se ajusta la curva y se calculan los residuales de la suma de cuadrados RSCi y sus grados de libertad GLi asociados. Los resultante de RSCi y GLi se suman para obtener la ∑RSCi y la ∑GLi. Después se juntan los datos de todas las curvas y se obtiene una nueva curva que se ajusta con el total de datos combinados y se calculan RSCp y GLp (la p es por la palabra en inglés pooled). Se usa la F calculada y la F esperada para probar la hipótesis de que las curvas que se están comparando son equivalentes.
RESULTADOS
Se analizaron un total de 608 almejas de sifón (tabla 1) con una proporción de sexos de 1:1.13 H:M. Las fases observadas en los organismos mediante análisis histológico de las gónadas mostraron tres niveles de gametogénesis: inmadura, madura y parcialmente agotada. Las tallas de ambos sexos se encontraron entre los 50 mm - 170 mm de LC. Los organismos maduros en ambos sexos sólo fueron de 70 mm a 170 mm de LC. La distribución de tallas fue más homogénea en hembras, mientras que en machos fue más representada en las tallas de 135 mm - 150 mm de LC (tabla 1).

Según el ARSC (la prueba utilizó el estadístico F), las curvas de ambos sexos no fueron significativamente diferentes (ANOVA: F = 0.284, p < 0.7547). La talla de madurez al 50% (L50) fue de 91.906 mm de LC en hembras y 91.909 mm de LC en machos, y la global de 91.904 mm de LC (figura 2). Los perfiles de verosimilitud para la talla de madurez se muestran en la figura 3. Se observa que el intervalo de confianza es de 88 mm - 96 mm de LC.


DISCUSIÓN
El estudio se realizó sólo en enero porque este mes es el pico de desove (Aragón-Noriega et al., 2007; Arámbula-Pujol et al., 2008; Calderón-Aguilera et al., 2010). P. globosa tiene un muy corto periodo reproductivo de tres a cinco meses (Aragón-Noriega et al., 2007; Arámbula-Pujol et al., 2008) y un periodo de descanso durante el cual no podrían ser identificados los sexos. En contraste, P. zelandica tienen una fase de reposo de uno a dos meses (Gribben, Helson & Jeffs, 2004), mientras que el periodo de reproducción de P. generosa del estado de Washington y la Columbia Británica es continua, sin periodo de descanso en absoluto (Andersen, 1971; Sloan & Robinson, 1984).
La talla de primera madurez sexual es uno de los aspectos mas importantes del ciclo biológico de las especies, como también lo es para el manejo de las pesquerías. La talla de primera madurez promedio o esperada es generalmente estimada ajustando un modelo logístico a la proporción de hembras maduras por intervalo de talla. Se puede asumir que el modelo logístico representa una función de densidad de probabilidad y la talla de primera madurez corresponde a la talla donde el 50% de los individuos de la población están maduros. A la fecha no existe ningún trabajo arbitrado acerca de la talla de primera madurez para esta especie, el único estudio es la tesis doctoral de Cortez-Lucero (2013), donde se destaca que dada la dificultad para contar con tallas pequeñas, los métodos para determinar la talla de primera madurez son muy sensibles; este autor menciona que la talla, cuando el 50% de la población alcanza la madurez, es a los 80.56 mm o 94.25 mm, dependiendo del método utilizado para calcularla. En este estudio se encontró que la talla al 50% de madurez es a los 91.9 mm, utilizando un método no lineal. Se destaca también que el estudio de Cortez-Lucero (2013) es en la misma zona, pero con cuatro años de diferencia; además, el estudio lo realizó con almejas recolectadas en el 2010.
Para los congéneres de P. globosa sí se han encontrado estudios sobre la talla de primera madurez. Andersen (1971) menciona que la talla a la cual el 50% de la población alcanza la madurez es a los 7.5 cm (75 mm), y que a los 8.5 cm (85 mm) el 100% de los organismos ya están maduros. Este autor realizó su estudio para la especie P. generosa de las costas del estado de Washington, Estados Unidos. Para la misma especie, pero en las costa de la Columbia Británica en Canadá (Campbell & Ming 2003), se encontró que la talla de primera madurez se alcanza a los 58.3 mm de LC y 60.5 mm de LC. Valores muy similares a éstos se registraron para P. zelandica en dos bahías de Nueva Zelanda, por Gribben & Creese (2003), quienes reportaron 55 mm y 57 mm de LC a al 50% de madurez poblacional para las bahías Kennedy y Shelly, respectivamente. Lo anterior coloca a P. globosa como la almeja de sifón del género Panopea que alcanza su talla de 50% de madurez poblacional a una mayor longitud.
Aunque muy discutido, existe un criterio de que se les debe permitir a los organismos sujetos a explotación reproducirse al menos una vez antes de ser capturados. Sorprendentemente se ha encontrado que no se ha tomado en cuenta ni las tasas de crecimiento ni las tallas de primera madurez reportado para otras especies de Panopea hasta ahora para fijar la talla mínima legal. Así, el tamaño legal de 130 mm de LC no tiene ningún significado en cuanto a la talla de primera madurez para P. globosa en México o para lo reportado en la literatura, incluso en la zona intermareal (Andersen 1971).
El resultado obtenido en el presente estudio sobre talla de primera madurez que se alcanzó a los 91.9 mm de LC se puede interpretar como una subexplotación del recurso, ya que el plan de manejo determina una longitud mínima de captura del organismo de 130 mm; y según lo encontrado en este estudio, a esas tallas la almeja P. globosa de la parte central del Golfo de California tiene al menos diez años de estarse reproduciendo, lo cual nos indica que tal plan de manejo no es el adecuado para esta especie y debería hacerse una revisión del mismo, tomando en cuenta los resultados obtenidos en este trabajo.
La talla mínima de captura, definida como la longitud mínima que debe tener un organismo para que pueda ser capturado, es una medida de manejo pesquero que se utiliza para proteger a los organismos juveniles de una pesquería. Ello se calcula con base en la talla, que de acuerdo con los muestreos biológicos los organismos alcanzan la madurez sexual, donde se presume que el ejemplar ha tenido al menos un evento reproductivo. Las tallas mínimas son específicas a las especies y se pueden aplicar a varias etapas de la captura. Las tallas mínimas deben tener bases biológicas correspondientes al tamaño, con el cual se alcanza la madurez sexual, además de un tiempo adicional para que puedan contribuir al desove. Por esta razón, las tallas mínimas son diferentes entre especies e incluso entre regiones para una misma especie. En el caso de almeja catarina (Argopecten circularis), se ha establecido la talla mínima de extracción diferenciada. Para los grupos poblacionales ubicados dentro de las zonas lagunarias que comprenden las lagunas Manuela, Guerrero Negro, Ojo de Liebre, San Ignacio y la Ensenada de la Paz, es de 56 mm de longitud de diámetro mayor de la concha y para el resto de los grupos poblacionales de las aguas de jurisdicción federal de los estados de Baja California y Baja California Sur, la talla mínima de extracción es de 60 mm de longitud de diámetro mayor de la concha. Para el caso de las especies de abulón, se han establecido tallas diferenciadas por especies y zonas de captura. Para el abulón amarillo (Halitotis corrugata) se tienen tallas mínimas de captura de 110 mm, 130 mm, 135 mm y 140 mm para cuatro zonas de pesca. En el mismo orden de las zonas, el abulón azul (H. fulgens) puede ser extraído con tallas de 120 m, 140 m, 145 m y 150 mm. Esto da la oportunidad de ejemplificar las medidas de manejo pesquero basado en tallas mínimas y como se establecen según la especie entre sitios y las diferencias entre especies de un mismo género.
En el caso de almeja de sifón, se ha determinado por la autoridad pesquera que las tallas mínimas de captura serán establecidas mediante acuerdos publicados en el Diario Oficial de la Federación, contando con la opinión del Instituto Nacional de Pesca (Inapesca). Dichas tallas de captura podrán ser definidas por zonas o regiones de pesca. En el presente estudio se aportó información biológica sobre la talla de madurez poblacional y se espera que se utilice como base para tomar decisiones y para proponer una talla mínima de captura adecuada a la almeja de sifón P. globosa.
Es necesario destacar que la mayoría de los moluscos maduran a tallas inferiores a las que demanda el mercado, por lo que el establecimiento de una talla mínima de captura es innecesario. Otro argumento en favor de eliminar las tallas mínimas de captura para el caso de almeja de sifón es la tasa de explotación establecida en 1% de la biomasa (Aragón-Noriega et al., 2012). Con ese criterio de manejo se asegura la conservación de la especie de manera más contundente que estableciendo una talla mínima de captura.
CONCLUSIONES
Si la estrategia de manejo es establecer una cuota del 1% de la existencia poblacional que está por encima de los 130 mm de LC, ya está siendo una estrategia muy conservadora. Es posible que la autoridad pesquera no tenga una buena estimación de los parámetros de la población (stock permanente, reclutamiento, talla de madurez, mortalidad natural, etc.), así que no hay razón para establecer una talla mínima de captura si se pretende ser conservador en su manejo. Se recomienda modificar esta estrategia de gestión según hallazgos científicos del presente estudio.
AGRADECIMIENTOS
A los pescadores de la Sociedad Cooperativa de Producción Pesquera Ricardo Loreto por su apoyo logístico en el campo. El estudio fue financiado con los fondos institucionales. Las recomendaciones de tres revisores anónimos ayudaron a mejorar el trabajo. Diana Dorantes editó el texto en inglés.
REFERENCIAS
Andersen, A. M. (1971). Spawning, growth, and spatial distribution of the geoduck clam, Panope generosa (Gould), in Hood Canal, Washington (PhD. Thesis), University of Washington: Estados Unidos. [ Links ]
Aragón-Noriega, E. A., Alcántara-Razo, E., Calderón-Aguilera, L. E., & Sánchez-Fourcade, R. (2012). Status of Geoduck clam fisheries in Mexico. Journal of Shellfish Research, 31(3), 733-738. [ Links ]
Aragón-Noriega, E. A., Chávez-Villalba, J., Gribben, P. E., Alcántara-Razo, E., Maeda-Martínez, A. N., Arambula-Pujol, E. M., García-Juárez, A. R., & Maldonado-Amparo, R. (2007). Morphometric relationships, gametogenic development and spawning of the geoduck clam Panopea globosa (Bivalvia: Hiatellidae) in the central Gulf of California. Journal of Shellfish Research, 26(2), 423-431. [ Links ]
Arámbula-Pujol, E. M., García-Juárez, A. R., Alcántara-Razo, E., & Aragón-Noriega, E. A. (2008). Aspectos de biología reproductiva de la almeja de sifón Panopea globosa (Dall 1898) en el Golfo de California. Hidrobiológica, 18(2), 89-98. [ Links ]
Brouwer, S. L., & Griffiths, M. H. (2005). Reproductive biology of carpenter seabream (Argyrozona argyrozona) (Pisces: Sparidae) in a marine protected area. Fisheries Bulletin, 103(2), 258-269. [ Links ]
Calderón-Aguilera, L. E., Aragón-Noriega, E. A., Reyes-Bonilla, H., Paniagua-Chávez, C. G., Romo-Curiel, A. E., & Moreno-Rivera, V. M. (2010). Reproduction of the Cortes geoduck Panopea globosa (Bivalvia: Hiatellidae) and its relationship with temperature and ocean productivity. Journal of Shellfish Research, 29(2), 135-141. [ Links ]
Campbell, A., & Ming, M. D. (2003). Maturity and growth of the Pacific geoduck clam, Panopea abrupta, in Southern British Columbia, Canada. Journal of Shellfish Research, 22(1), 85-90. [ Links ]
Cervantes-Hernández, P., Flores-Gómez, A., & Sánchez-Meraz, B. (2005). Mínimos cuadrados versus verosimilitud. Ciencia y Mar, IX(27), 41-45. [ Links ]
Comisión Nacional de Acuacultura y Pesca (Conapesca) (2015). Normas oficiales de pescados y mariscos. Recuperado el 20 de julio de 2015 de http://www.conapesca.gob.mx [ Links ]
Cortez-Lucero, G. (2013). Ecología, biología y pesquería de almeja de sifón Panopea globosa en la región central del Golfo de California (tesis doctoral). Centro de Investigaciones Biológicas del Noroeste: México. [ Links ]
Gribben, P. E., Helson, J., & Jeffs, A. G. (2004). Reproduction cycle of the New Zealand geoduck, Panopea zelandica, in two North Island populations. The Veliger, 47(1), 53-65. [ Links ]
Gribben, P. E., & Creese, R. G. (2003). Protandry in the New Zealand geoduck, Panopea zelandica (Mollusca, Bivalvia). Invertebrate Reproduction and Development, 44(2-3), 119-129. [ Links ]
Haddon, M. (2001). Modelling and Quantitative Methods in Fisheries. Boca Raton, FL: Chapman and Hall/CRC. [ Links ]
National Marine Fisheries Service (2015). Comercial fisheries statistics. Recuperado el 23 de marzo de 2015 de http://www.st.nmfs.noaa.gov [ Links ]
Oceans and Marine Fisheries Branch (2015). Capture fisheries statistics. Recuperado el 23 de marzo de 2015 de http://www.env.gov.bc.ca/omfd [ Links ]
Rodríguez-Domínguez, G., Castillo-Vargasmachuca, S. G., Pérez-González, R., & Aragón-Noriega, E.A. (2012). The size at maturity of the brown crab Callinectes bellicosus (Decapoda, Portunidae) in the Gulf of California. Crustaceana, 85(12-13), 1513-1523. [ Links ]
Sloan, N. A., & Robinson, S. M. C. (1984). Age and gonad development in the geoduck clam Panopea abrupta (Conrad) from southern British Columbia, Canada. Journal of Shellfish Research, 4(2), 131-137. [ Links ]
Solana-Sansores, L. R., Dicante, I., Luna, L., & Villaseñor-Talavera, R. (2012). Selectividad de redes para capturar curvina golfina (Cynoscion othonopterus) en el Alto Golfo de California, México. Hidrobiológica, 22(2), 132-141. [ Links ]
Venzon, D. J., & Moolgavkar, S. H. (1988). A method for computing profile-likelihood-based confidence intervals. Applied Statistics, 37(1), 87-94. [ Links ]
Zar, J. H. (1996). Biostatistical Analysis (3rd edition). Upper Saddle River, N. J.: Prentice Hall. [ Links ]














