Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Acta universitaria
versão On-line ISSN 2007-9621versão impressa ISSN 0188-6266
Acta univ vol.25 no.4 México Jul./Ago. 2015
https://doi.org/10.15174/au.2015.773
Ciencias biológicas, agropecuarias y del medio ambiente
Variabilidad genética del membrillo cimarrón (Malacomeles denticulata [Kunth] Jones) obtenida mediante marcadores Inter Secuencias Simples Repetidas o Intermicrosatélites (ISSR)
Genetic variability of Mexican serviceberry (Malacomeles denticulata [Kunth] Jones) obtained by inter simple sequence repeated or intermicrosatellites (ISSR) markers
Daniela González-Cerritos*, Carlos Alberto Núñez-Colín**, Emiliano Villordo-Pineda***, Gabriela Medina-Ramos*, Mario Martín González-Chavira***
* Departamento de Ingeniería Agroindustrial, Universidad Politécnica de Guanajuato. Ave. Universidad Norte s/n, Juan Alonso, Cortazar, Guanajuato, México, C.P. 38483.
** Ingeniería en Biotecnología, Universidad de Guanajuato. Mutualismo núm. 303, Esq. Prolongación Río Lerma, Colonia La Suiza, Apartado Postal 91, Celaya, Guanajuato, México, C.P. 38060. Correo electrónico: carlos.nunez@ugto.mx
*** Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias (INIFAP). Campo Experimental Bajío, km 6.5 Carretera Celaya-San Miguel de Allende, Roque, Celaya, Guanajuato, México, C.P. 38110.
Recibido: 22 de abril de 2015.
Aceptado: 4 de agosto de 2015.
Resumen
Malacomeles denticulata es un fruto nativo de México al que recientemente se le ha encontrado características funcionales para proponerlo como una opción frutal. Esta investigación tuvo como objetivo elucidar la variabilidad de doce poblaciones de M. denticulata mediante marcadores Inter Secuencias Simples Repetidas o Intermicrosatélites (ISSR). Todos los ISSR presentaron altos valores en el Contenido de Información Polimórfica (PIC, por sus siglas en inglés) y el índice de diferenciación poblacional de Nei (GST), así como altos porcentajes de polimorfismo. Se crearon tres grupos de variabilidad, donde siete poblaciones de Guanajuato y la población del Tepozán, Querétaro, conformaron un grupo; mientras que las poblaciones de Agua Zarca (Guanajuato), La Joya (Querétaro) y Santa Catarina del Monte (México) conformaron otro. Finalmente, la población de San Miguel Tlaixpan (México) quedó separada como un grupo atípico. De acuerdo con el Análisis Molecular de Varianza (Amova), la variabilidad intrapoblacional representa el 47% y la interpoblacional el 53% de la variabilidad total, lo que concuerda con la variabilidad en caracteres de semilla, pero difiere a lo reportado para marcadores SSR.
Palabras clave: Rosaceae; marcadores de ADN; frutales nativos; recursos fitogenéticos.
Abstract
Malacomeles denticulata is a native fruit of Mexico that recently had been reported functional proprieties to be proposed as a fruit option. This research aims to elucidate the variability of twelve populations of M. denticulata by Inter Simple Sequence Repeated or Inter-microsatellites (ISSR) markers. All ISSR showed high values of Polymorphic Information Content (PIC) and Nei's Index of Population Differentiation (GST) as well as high percentage of polymorphism. Three groups of variability were conformed, where seven populations of Guanajuato and the population of El Tepozán, Querétaro conformed the first group; while the populations of Agua Zarca (Guanajuato), La Joya (Querétaro), and Santa Catarina del Monte (México) conformed the other group. Finally, the population of San Miguel Tlaixpan (México) was separated as outlier group. According to Analysis of Molecular Variance (Amova), the within population variability was 47% and among population variability was 53% of total variability, that agree on the variability of seed traits but disagree on the variability of SSR markers.
Keywords: Rosaceae; DNA markers; native fruits; plant genetic resources.
Introducción
El membrillo cimarrón (Malacomeles denticulata [Kunth] Jones) es una planta perteneciente a la familia de las Rosaceae subtribu Pyrinae (anteriormente la subfamilia Maloideae) (Campbell, Evans, Morgan, Dickinson & Arsenault, 2007; Turner, 2011). Malacomeles denticulata se encuentra distribuida desde el sur de Texas (Estados Unidos de América) hasta Guatemala y Honduras, teniendo en México su mayor distribución; por las características climáticas, las regiones de crecimiento óptimas están en los estados de Hidalgo, Estado de México, Querétaro, Guanajuato, Tlaxcala, Puebla, Nuevo León y Oaxaca (Núñez-Colín, 2010).
El género Malacomeles tiene una estrecha relación con los géneros Amelanchier y Peraphyllum. En este sentido, especies del género Amelanchier son explotadas de manera comercial en Estados Unidos de América y Canadá, tanto para arquitectura del paisaje como para producción de fruta (Stushnoff, 1991).
Recientemente, se ha publicado información sobre los usos etnobotánicos del membrillo cimarrón (Hernández-Martínez, Espinosa-Trujillo & Núñez-Colín, 2010; Núñez-Colín & Hernández-Martínez, 2011), su variabilidad tanto morfológica con caracteres de semillas (Hernández-Martínez, Núñez-Colín, Guzmán-Maldonado, Espinosa-Trujillo & Herrera-Hernández, 2011) como genética mediante Secuencias Simples Repetidas o Microsatélites (SSR) (Torres-Hernández et al., 2013), así como de sus propiedades nutrimentales (Cázares-Franco et al., 2014; Herrera-Hernández, Núñez-Colín, Guzmán-Maldonado & Hernández-Martínez, 2013).
Para hacer un primer acercamiento a la variabilidad de M. denticulata, Hernández-Martínez et al. (2011) utilizaron características de semillas de membrillo cimarrón como patrón de variabilidad. En este estudio determinaron una alta variación tanto intra como interpoblacional, lo cual sugiere que esta especie puede ser de reproducción sexual.
Torres-Hernández et al. (2013) reportaron que a partir de 23 SSR de manzana (Malus domestica) aplicados a nueve poblaciones de membrillo cimarrón determinaron una alta heterocigocidad y falta de equilibrio Hardy-Weinberg en todas las poblaciones. Ello sugiere que esto podría estar relacionado con autoincompatibilidad gametofítica (AIG).
Debido a estos antecedentes, en este trabajo se pretendió determinar y validar la variabilidad de M. denticulata con marcadores moleculares Inter Secuencias Simples Repetidas o Intermicrosatélites (ISSR) que, a diferencia de los SSR, son marcadores semialeatorios (González & Aguirre, 2007) que brindan información complementaria para ampliar el conocimiento sobre la variabilidad genética del membrillo cimarrón.
MATERIALES Y MÉTODOS
Material vegetal
Durante el otoño de 2011 y primavera y otoño de 2012, una serie de viajes de colecta fueron hechos en las zonas con probable presencia de membrillo cimarrón basado en Núñez-Colín (2010). En el transcurso de esos viajes se obtuvieron once poblaciones silvestres de membrillo cimarrón en las comunidades de La Valenciana (dos poblaciones), El Derramadero, Victoria, Puerto de Ardillas, Agua Zarca y La Huerta en el estado de Guanajuato, así como en El Tepozán y La Joya en el estado colindante de Querétaro, y también en Santa Catarina del Monte y San Miguel Tlaixpan en el Estado de México. Adicionalmente, se consideró una población establecida en el Arboretum de Plantas Nativas de Guanajuato del Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias (INIFAP), la cual originalmente fue colectada de La Calera, municipio de San Miguel de Allende, Guanajuato (figura 1). La muestra utilizada de cada población fue de diez individuos colectados de manera aleatoria en cada caso. Las muestras colectadas se colocaron en sílica gel hasta su traslado al laboratorio, donde fueron almacenadas a –20 °C, para después liofilizarlas y molerlas en tubos tipo falcón; finalmente se almacenaron a –20 °C.
Aislamiento de ADN
El aislamiento de Ácido Desoxirribonucleico (ADN) se realizó con base en el protocolo Bromuro de hexadeciltrimetilamonio (CTAB) modificado con Cloruro de Sodio-Tris-EDTA (STE) (Doyle & Doyle, 1987); se utilizaron hojas jóvenes, sin manchas y sin evidencias de plagas. Su calidad y pureza fueron determinados utilizando el espectrofotómetro Thermo scientific Nanodrop 8000 version 2.1.0.
Amplificación por PCR de los ISSR
Se seleccionaron 17 iniciadores ISSR utilizados comúnmente en organismos vegetales (tabla 1). Para la amplificación por Reacción en cadena de la Polimerasa (PCR, por sus siglas en inglés) se utilizó la siguiente mezcla de reacción: 10 µL de buffer 1 x, 3 mM MgCl2, 0.2 mM dNTP, 1 pMol de primer y 1 U Taq Polimerasa recombinante (Invitrogen®), donde se usó un volumen de 20 µL con aproximadamente 20 ng de ADN. El perfil de temperatura utilizado fue el siguiente: 94 °C por 5 min, 35 x (94 °C por 60 s, Tm °C [tabla 1] por 60 s, 72 °C por 60 s), 72 °C por 10 min.
Los productos de PCR fueron desnaturalizados con una solución de carga de formamida (98% formamida, 10 mM EDTA pH 8.0, ~40 mg azul de bromofenol) a 95 ºC por 5 min, después fueron puestos en hielo. El gel de poliacrilamida al 8.5% fue hecho con 40 mL de solución de poliacrilamida (19:1, Urea 8 M), 200 µL de persulfato de amonio 25% y 40 µL de TEMED. 12 µL de cada producto de PCR fue cargado en el gel. La electroforesis fue hecha usando el buffer TBE 1 x en una cámara de electroforesis vertical a 250 volts por 90 min. Finalmente, los geles de poliacrilamida fueron teñidos con bromuro de etidio para visualizar los fragmentos mediante luz UV.
Análisis estadísticos
El índice de información de Shannon (I), los estadísticos de diferenciación de subpoblaciones de Nei (HS, HT, GST), la prueba de flujo genético (NM), el porcentaje de polimorfismo (%P) y la distancia genética de Nei (Nei, 1972) fueron calculados con el programa POPGENE versión 1.32 (Yeh, Yang & Boyle, 1999). Además, a partir de los cálculos de POPGENE se dibujó un dendrograma con la distancia genética de Nei y el método de agrupación en pares por media aritmética no ponderada (UPGMA, por sus siglas en inglés) con TreeView versión 1.6.6
Asimismo, se calculó el Contenido de Información Polimórfica (PIC, por sus siglas en inglés) de acuerdo con la fórmula propuesta por Roldán-Ruiz, Dendauw, van Bockstaele, Depicker & De Loose (2000):

donde PIC es el contenido de información polimórfica del marcador i, fi la frecuencia de los fragmentos del marcador que estaban presentes y 1 – fi la frecuencia de los fragmentos del marcador que estaban ausentes. El PIC fue un promedio de los fragmentos para cada ISSR.
El PIC toma valores entre 0 y 0.5 para datos dominantes, como los ISSR, y se considera que valores menores a 0.15 es no informativo, valores entre 0.15 y 0.25 como informativo y mayor a 0.25 como altamente informativo (Laurentin & Karlovsky, 2007). También se calculó el análisis molecular de varianza (Amova) y un análisis de coordenadas principales (ACooP) utilizando el programa GenAlEx versión 6.5 (Peakall & Smouse, 2012).
RESULTADOS
Variabilidad intrapoblacional
Se encontró que las poblaciones presentaron diversos valores de HT, I y %P en las diferentes poblaciones (tabla 2).
El ISSR Pv02 fue monomórfico dentro de todas las poblaciones, Pv10 en las poblaciones de La Valenciana 2, La Joya y San Miguel Tlaixpan, el Pv09 en La Joya y Pv05 e ISSR19 en San Miguel Tlaixpan (tabla 2).
Se encontró que la población más homogénea fue la de San Miguel Tlaixpan, y la más heterogénea fue la de La Valenciana 1 (tabla 2). Las poblaciones variaron del 25.12% hasta el 55.02% de polimorfismo intrapoblacional.
Variabilidad interpoblacional e índices de información de los marcadores ISSR
Todos los ISSR fueron polimórficos en las doce poblaciones, donde los porcentajes de polimorfismo fueron mayores del 85% y valores de PIC altamente informativos (> 0.25), con excepción del Pv02 que fue del 22.22 % y PIC de 0.0478 (tabla 3).
Los valores del índice de diferenciación entre poblaciones (GST) fueron altos (tabla 3) y destaca Pv02, ya que el polimorfismo que presenta en dos de las nueve bandas de este ISSR son específicos de poblaciones, lo cual permite identificarlos perfectamente; y el número de migrantes promedio dado por el índice de flujo genético (NM) varía entre 0 y 2.76 con un promedio de 1.0840, el cual es bajo, por tal motivo se traduce en que poca de la variación de las poblaciones puede explicarse por efectos de migración.
Distancias genéticas y representación de agrupamiento de las poblaciones
La distancia genética de Nei (Nei, 1972) arrojó que las diferencias entre las distintas poblaciones de membrillo cimarrón variaron entre 0.0932 (9.32%) y 0.4194 (41.94%), lo que dio identidades genéticas entre el 0.6574 (65.74%) y 0.9110 (91.10%) (tabla 4).
La población de San Miguel Tlaixpan fue la que presentó la mayor distancia genética con todas las otras poblaciones, que entre ellas presentaron diferencias menores al 30% (tabla 4).
En el dendrograma se observa que la población de San Miguel Tlaixpan es diferente al resto, mientras que las poblaciones de Guanajuato, a excepción de Agua Zarca, están agrupadas en un mismo grupo, incluyendo a la población de El Tepozán (Querétaro), y quedaron en otro grupo las poblaciones de La Joya (Querétaro), Agua Zarca (Guanajuato) y Santa Catarina del Monte (Estado de México) (figura 2).
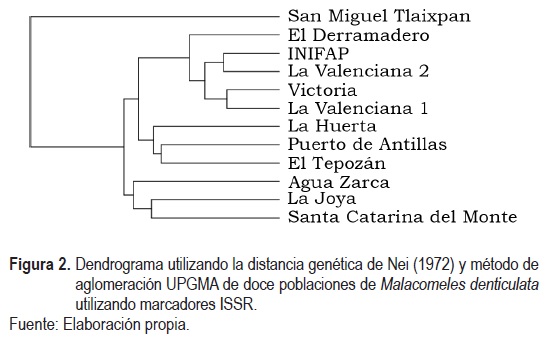
En el ACooP, el cual acumuló el 54.01% de la variabilidad total al tercer componente, se corroboran las agrupaciones visualizadas en el dendrograma (figura 3), donde se observa que la población de San Miguel Tlaixpan está separada del resto, principalmente por la Coordenada Principal 1 (CooP1), mientras que el grupo de La Joya, Agua Zarca y Santa Catarina del Monte está separado del grupo de poblaciones de Guanajuato y El Tepozán, principalmente por la Coordenada Principal 2 (CooP2) (figura 3).
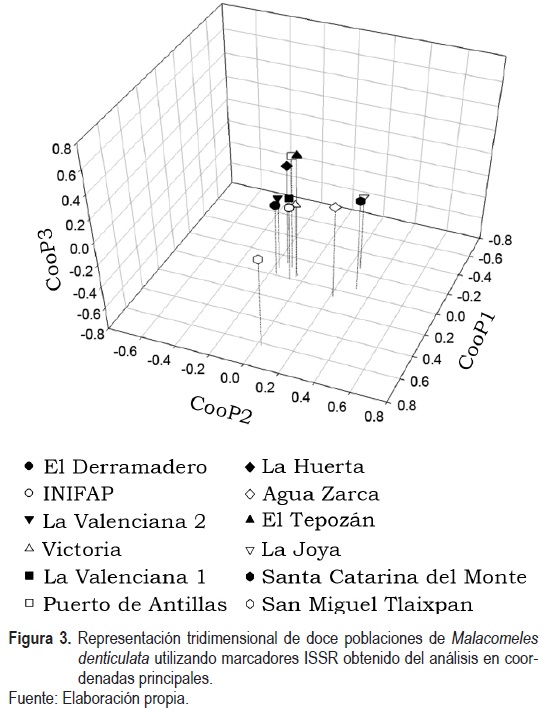
En el grupo de las poblaciones de Guanajuato y en Tepozán se presentaron ligeras disimilitudes entre El Tepozán, Puerto de Ardillas y La Huerta con el resto del grupo en la Coordenada Principal 3 (CooP3). No obstante, por su cercanía en el CooP1 y CooP2 se corrobora que se trata de un mismo grupo.
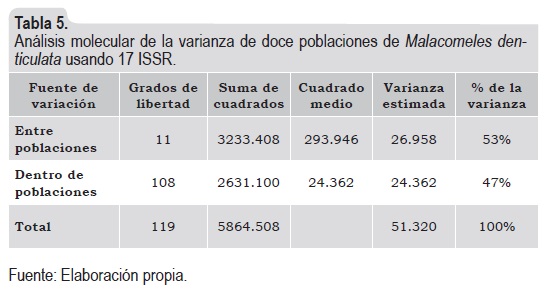
Análisis Molecular de la Varianza (Amova)
En el Amova, la variabilidad intrapoblacional representa el 47% de la variación general, y el 53% corresponde a la variabilidad interpoblacional (tabla 5). Por lo anterior, aunque es ligeramente mayor la variabilidad interpoblacional, la variabilidad de esta especie se debe tanto a su variación intra como interpoblacional.
DISCUSIÓN
Los resultados obtenidos en este estudio presentaron disimilitudes con el de Torres-Hernández et al. (2013), debido principalmente a que las poblaciones de La Valenciana y el Tepozán fueron más similares en esta investigación a las poblaciones de Guanajuato, mientras que en el trabajo de Torres-Hernández et al. (2013) estaban como diferentes grupos de variación; caso contrario fue la población de La Joya, que en este caso queda separada del resto y que estaba agrupada con poblaciones de Guanajuato. Esto puede deberse a que los SSR, marcadores más específicos, definen las agrupaciones con diferencias genéticas puntuales (Nybom & Weising, 2010), mientras que los ISSR, marcadores que exploran todo el genoma, pueden ayudar a encontrar polimorfismos aleatorios en diferentes regiones del mismo para diferenciar las poblaciones de manera general o agrupar poblaciones parecidas genéticamente, pero con diferencias que sólo pueden ser elucidadas con marcadores específicos, como los SSR (Weising, Nybom, Wolff & Kahl, 2005).
Los polimorfismos en los ISSR tienden a ser altamente variables entre individuos debido a las altas tasas de mutación que experimentan, ya que cuando el ADN se replica durante la meiosis, la ADN polimerasa puede "tartamudear" hacia adelante o hacia atrás en las unidades repetidas, eliminando o agregando unidades a la cadena microsatétlite (González & Aguirre, 2007). Las cadenas resultantes pueden, entonces, presentar menos o más unidades de repetición (o pares de bases) que las cadenas parentales (Zietkiewicz, Rafalski & Labuda, 1994). Además de que su codificación y análisis es como marcadores dominantes, donde cada banda se considera un solo locus con dos alelos, por lo que no se sabe si la presencia de la banda se debe a un homocigoto dominante o un heterocigoto. SSR e ISSR, por tanto, son marcadores complementarios que permiten elucidar de una mejor manera la variabilidad real de una especie.
A diferencia de Torres-Hernández et al. (2013), con los ISSR la variabilidad interpoblacional es mayor y es casi igual la variabilidad interpoblacional a la intrapoblacional, lo que concuerda más con el estudio de Hernández-Martínez et al. (2011), con características morfológicas de semilla, quienes reportaron una alta variabilidad tanto intrapoblacional como interpoblacional, asunto comprobado en este trabajo.
No obstante, en este trabajo se consideraron poblaciones del Estado de México no consideradas por trabajos anteriores, así como una población atípica morfológicamente de Guanajuato, como la población de Agua Zarca, principalmente por tener las hojas más redondas que las otras poblaciones de Guanajuato, las cuales en este estudio se encuentran en grupos de variabilidad diferentes, en particular la población de San Miguel Tlaixpan, identificada como un grupo atípico (outlier). Por ello, estas poblaciones junto con la población de La Joya podrían ser una especie diferente a las de Guanajuato, como lo reportó Turner (2011), quien reclasificó a M. denticulata var. psilantha como M. psilantha y que la distribución reportada por este autor para dicha especie corresponde con el de las poblaciones del estado de Guanajuato, con excepción de Agua Zarca, y el Tepozán, Querétaro; mientras que el resto de las poblaciones podría tratarse de M. denticulata sensu stricto. Sin embargo, esto da cabida a que se haga un trabajo taxonómico sobre el género Malacomeles para asegurar si se trata de dos especies o solamente una, sobre todo cuando una de ellas era considerada una variedad botánica de la otra. Por lo tanto, este estudio podría servir de base como primer acercamiento para poder distinguirlas, por lo menos como grupos de variabilidad distintos. No obstante, un estudio como el realizado por Lo, Stefanović & Dickinson (2007), quienes secuenciaron genes conservados nucleares y de cloroplasto en el género Crataegus, sería más apropiado para concluir si se trata de dos especies diferentes.
CONCLUSIONES
Los marcadores ISSR aplicados a M. denticulata presentaron altos valores de PIC y de polimorfismo en general, motivo por el cual se consideran adecuados para estudios de variabilidad para esta especie.
Se encontró que la agrupación de las poblaciones obtenida con estos marcadores fue diferente a la reportada por Torres-Hernández et al. (2013), así como la distribución de la variabilidad inter e intrapoblacional; sin embargo, por la diferencia en el tipo de marcador se pueden considerar complementarios para conocer la diversidad real de la especie.
AGRADECIMIENTOS
Este trabajo fue financiado parcialmente por el Fondo de Ciencia Básica del Consejo Nacional de Ciencia y Tecnología (Conacyt) por el proyecto CB2009/134193, así como por los fondos fiscales del Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias (INIFAP) por el proyecto SIGI 1145232069.
REFERENCIAS
Campbell, C. S., Evans, R. C., Morgan, D. R., Dickinson, T. A., & Arsenault, M. P. (2007). Phylogeny of subtribe Pyrinae (formerly the Maloideae, Rosaceae): Limited resolution of a complex evolutionary history. Plant Systematic and Evolution, 266(1-2), 119-145. doi: 10.1007/s00606-007-0545-y [ Links ]
Cázares-Franco, M. C., Ramírez-Chimal, C., Herrera-Hernández, M. G., Núñez-Colín, C. A., Hernández-Martínez, M. A., & Guzmán-Maldonado, S. H. (2014). Physicochemical, nutritional and health-related component characterization of the underutilized Mexican serviceberry fruit (Malacomeles denticulata [Kunth] G. N. Jones). Fruits, 69(1), 47-60. doi: 10.1051/fruits/2013100 [ Links ]
Doyle, J. J., & Doyle, J. L. (1987). A rapid DNA isolation procedure for small quantities of fresh leaf tissue. Phytochemical Bulletin, 19, 11-15. [ Links ]
González, A., & Aguirre, X. (2007). Inter Simple Sequence Repeats (ISSRs). En L. E. Eguiarte, V. Souza & X. Aguirre (Comp.), Ecología molecular (pp. 567-571). Ciudad de México: Instituto Nacional de Ecología (Semarnat) y Comisión Nacional para el Conocimiento y Uso de la Biodiversidad (Conabio). [ Links ]
Hernández-Martínez, M. A., Espinosa-Trujillo, E., & Núñez-Colín, C. A. (2010). Perspectivas del membrillo cimarrón (Amelanchier denticulata [Kunth] Koch) como un frutal alternativo para el centro de México. Journal of the Interamerican Society for Tropical Horticulture, 54, 49-53. [ Links ]
Hernández-Martínez, M. A., Núñez-Colín, C. A., Guzmán-Maldonado, S. H., Espinosa-Trujillo, E., & Herrera-Hernández, M. G. (2011). Variabilidad morfológica mediante caracteres de semilla de poblaciones de Amelanchier denticulata (Kunth) Koch, originarias de Guanajuato, México. Revista Chapingo Serie Horticultura, 17(3), 161-172. doi: 10.5154/r.rchsh.2011.17.027 [ Links ]
Herrera-Hernández, M. G., Núñez-Colín, C. A., Guzmán-Maldonado, S. H., & Hernández-Martínez, M. Á. (2013). Contenido de algunos compuestos antioxidantes en tres estados de madurez y dos localidades en frutos de membrillo cimarrón (Malacomeles denticulata). Revista Chapingo Serie Horticultura, 19(4), 45-57. doi: 10.5154/r.rchsh.2012.02.022 [ Links ]
Laurentin, H., & Karlovsky, P. (2007). AFLP fingerprinting of sesame (Sesamum indicum L.) cultivars: identification, genetic relationship and comparison of AFLP informativeness parameters. Genetic Resources and Crop Evolution, 54(7), 1437-1446. doi: 10.1007/s10722-006-9128-y [ Links ]
Lo, E. Y. Y., Stefanović, S., & Dickinson, T. A. (2007). Molecular Reappraisal of Relationships Between Crataegus and Mespilus (Rosaceae, Pyreae)—Two Genera or One? Systematic Botany, 32(3), 596-616. doi: 10.1600/036364407782250562 [ Links ]
Luna-Páez, A., Valadez-Moctezuma, E., Barrientos-Priego, A. F., & Gallegos-Vázquez, C. (2007). Caracterización de Opuntia spp. mediante semilla con marcadores RAPD e ISSR y su posible uso para diferenciación. Journal of the Professional Association for Cactus Development, 9, 43-59. [ Links ]
Marotti, I., Bonetti, A., Minelli, M., Catizone, P. & Dinelli, G. (2007). Characterization of some Italian common bean (Phaseolus vulgaris L.) landraces by RAPD, semi-random and ISSR molecular markers. Genetic Resources and Crop Evolution, 54(1), 175-188. doi: 10.1007/s10722-005-3133-4 [ Links ]
Nei, M. (1972). Genetic distance between populations. The American Naturalist, 106(949), 283-292. [ Links ]
Núñez-Colín, C. A. (2010). Distribución y caracterización eco-climática del membrillo cimarrón (Amelanchier denticulata [Kunth Koch]) en México. Revista Chapingo Serie Horticultura, 16(3), 195-206. doi: 10.5154/r.rchsh.2010.16.025. [ Links ]
Núñez-Colín, C. A., & Hernández-Martínez, M. Á. (2011). The Mexican Serviceberry (Amelanchier denticulata): a New Potential Berry Fruit Crop from Semi-Arid Areas. Acta Horticulturae, 918, 917-924. [ Links ]
Nybom, H., & Weising, K. (2010). DNA-based identification of clonally propagated cultivars. Plant Breeding Reviews, 34, 221-295. doi: 10.1002/9780470880579.ch6 [ Links ]
Peakall, R., & Smouse, P. E. (2012). GenAlEx 6.5: genetic analysis in Excel. Population genetic software for teaching and research – an update. Bioinformatics, 28(19), 2537-2539. doi: 10.1093/bioinformatics/bts460 [ Links ]
Roldán-Ruiz, I., Dendauw, J., van Bockstaele, E., Depicker, A., & De Loose, M. (2000). AFLP markers reveal high polymorphic rates in ryegrasses (Lolium spp.). Molecular Breeding, 6(2), 125-134. doi: 10.1023/A:1009680614564 [ Links ]
Stushnoff, C. (1991). Amelanchier species. Acta Horticulturae, 290, 549-566. [ Links ]
Torres-Hernández, S., Pérez-Rodríguez, F., Serrano-Jamaica, L. M., Villordo-Pineda, E., Hernández-Martínez, M. Á., González-Chavira, M. M., & Núñez-Colín, C. A. (2013). Genetic variability in Malacomeles denticulata (Rosaceae) from central Mexico revealed with SSR markers. Genetic Resources and Crop Evolution, 60(7), 2191-2200. doi: 10.1007/s10722-013-0041-x [ Links ]
Turner, B. L. (2011). Recension of the genus Malacomeles (Rosaceae). Phytologia, 93(1), 99-106. [ Links ]
Vijayan, K. (2004). Genetic relationships of Japanese and Indian mulberry (Morus spp.) genotypes revealed by DNA fingerprinting. Plant Systematics and Evolution, 243(3-4), 221-232. doi: 10.1007/s00606-003-0078-y [ Links ]
Weising, K., Nybom, H., Wolff, K., & Kahl, G. (2005). DNA fingerprinting in plants: principles, methods, and applications. Boca Raton: CRC Press. [ Links ]
Yeh, F. C., Yang, R., & Boyle, T. (1999). POPGENE version 1.31, Microsoft Window-based Freeware for Population Genetic Analysis, Quick User Guide. Edmonton: University of Alberta and Centre for International Forestry Research. [ Links ]
Zietkiewicz, E., Rafalski, A., & Labuda, D. (1994). Genome fingerprinting by simple sequence repeats (SSR)-anchored polymerase chain reaction amplification. Genomics, 20(2), 176-183. [ Links ]














