Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Acta universitaria
versión On-line ISSN 2007-9621versión impresa ISSN 0188-6266
Acta univ vol.25 no.3 México may./jun. 2015
https://doi.org/10.15174/au.2015.778
Ciencias exactas e ingenierías
Adsorción del naranja de metilo en solución acuosa sobre hidróxidos dobles laminares
Methyl orange adsorption from aqueous solution on layered double hydroxide
Laura Alicia Ramírez Llamas*, Araceli Jacobo Azuara*, J. Merced Martínez Rosales*
* Departamento de Química, División de Ciencias Naturales y Exactas, Campus Guanajuato, Universidad de Guanajuato. Noria Alta s/n, Guanajuato, Guanajuato, México, C.P. 36000. Tel.: (473) 73 2 00 06, ext. 6006 y 6023. Correos electrónicos: laramirez@ugto.mx; aazuara@ugto.mx; mercedj@ugto.mx
Recibido: 23 de abril de 2015
Aceptado: 4 de junio de 2015
Resumen
En este trabajo, los hidróxidos doble laminares (HDL) fueron sintetizados y caracterizados usando técnicas de fisisorción de nitrógeno; infrarrojo; desorción a temperatura programada; difracción de rayos X; microcalorimetría de inmersión y análisis termogravimétrico, para determinar las propiedades básicas del adsorbente. El naranja de metilo (NM) es usado como colorante y como resultado se encuentra frecuentemente en los efluentes de las industrias textiles. Las isotermas de adsorción del colorante sobre HDL fueron estudiadas en función del pH y temperatura. La capacidad máxima de adsorción del colorante se llevó a cabo a pH 5 y la mínima capacidad de adsorción a pH 11, siendo de 40.2 mg/g y 22.1 mg/g, respectivamente. Además, la temperatura adecuada para favorecer la adsorción del colorante sobre HDL fue a 25 °C, ya que a 35 °C presenta una disminución considerable.
Palabras clave: Hidróxido doble laminar; naranja de metilo; colorante; adsorción.
Abstract
In this paper, layered double hydroxides (LDH) were synthesized and characterized using techniques of Physisorption of Nitrogen, Infrared, Temperature Programmed Desorption, X-Ray Diffraction, TGA and Immersion Microcalorimetry, in order to determine the basic properties of the adsorbent. The methyl orange (MO) is used as a dye and as a result, it is frequently found in effluents from textile industries. The dye adsorption isotherms on LDH were studied as function of pH and temperature. The maximum adsorption capacity of methyl orange on LDH was carried out at pH 5, and the minimum adsorption capacity at pH 11, being 40.2 mg/g and 22.1 mg/g, respectively. Furthermore, the suitable temperature to promote the adsorption of methyl orange on LDH was at 25 °C, as at 35 °C shows a significant decrease.
Keywords: Layered double hydroxide; methyl orange; dye; adsorption.
INTRODUCCIÓN
El desarrollo tecnológico ha incrementado la contaminación de los efluentes de agua con materiales muy variados en sus características y grado de riesgo al entorno ecológico. Los materiales denominados orgánicos, por ejemplo, significan un problema serio, y aunque se han realizado grandes esfuerzos para su eliminación, es importante buscar nuevas metodologías eficientes y económicas. La presencia de colorantes en agua es, principalmente, de origen antropogénico en los efluentes ligados a las industrias textiles, de papel, cuero, comida y minería, donde la presencia de color es indeseable desde el punto de vista estético, pues impide la penetración de la luz que es esencial para los ecosistemas acuáticos y puede llegar a los sistemas de riego de productos para el consumo humano (Mandal, Tichit, Lerner & Marcotte, 2009).
Acorde con la NOM-065-ECOL-1994, el límite máximo permisible en las descargas de aguas residuales a cuerpos receptores provenientes de las industrias de pigmentos y colorantes es de 200 mg/L en sólidos suspendidos totales de colorantes.
Para la remoción de colorantes, tradicionalmente se han aplicado métodos químicos y biológicos, pero estas técnicas no pueden lograr la remoción de muchos colorantes no biodegradables (Orthman, Zhu & Lu, 2003). Existe un gran número de colorantes utilizados en la industria textil, un ejemplo de ellos es el colorante Azul Reactivo 4 (RB4), un colorante de antraquinona de importancia comercial; para este colorante, el valor estimado de la concentración letal media (CL50) para la toxicidad aguda para peces es de 1500 mg/L, y el efecto a largo plazo y la exposición al colorante necesita también ser evaluada (Epolito, Lee, Bottomley & Pavlostathis, 2005).
Otro ejemplo de colorante riesgoso en medio acuoso es el naranja de metilo (NM), compuesto químico azoderivado con características de ácido débil (figura 1), el cual cambia de color de rojo a naranja-amarillo entre pH 3.1 y 4.4 (Zhe-Ming, Sheng-Jie, Li-Grng, Fang-Fang & Guo-xiang, 2007). El nombre del compuesto químico del colorante es sal sódica de ácido sulfónico de 4-Dimetilaminoazobenceno. La fórmula molecular de esta sal sódica es C14H14N3NaO3S y su peso molecular es de 327.34 g/mol. En la actualidad se registran muchas aplicaciones desde preparaciones farmacéuticas y como colorante de teñido al 5%.

Hoy en día, uno de los tratamientos utilizados para la remoción de colorantes es la degradación de varios azocolorantes de las aguas residuales textiles de algodón sometidas bajo irradiación UV en presencia de H2O2. El método de degradación aplicando UV/H2O2 demostró ser capaz de la degradación completa y la mineralización de los colorantes azoicos (Georgiou, Melidis, Aivasidis & Gimouhopoulos, 2002). Bajo este tratamiento también se ha degradado el naranja de metilo presente en agua, bajo irradiaciones γ (You-Peng, Shao-Yang, Han-Qing, Hao & Qian-Rong, 2008). También se han realizado estudios utilizando la electrocoagulación para la reducción del color y la turbidez de las aguas residuales textiles (Merzouk et al., 2011).
Las técnicas de adsorción son una de las mejores alternativas para remover compuestos orgánicos de agua, justo por su alta eficiencia y habilidad para separar completamente un rango de compuestos químicos (Yujiang et al., 2008). Así, el uso de materiales adsorbentes para la purificación del agua es cada vez más frecuente (Kameda, Saito & Umetsu, 2005).
El carbón activado puede ser utilizado ampliamente como adsorbente en el tratamiento de agua para remover contaminantes orgánicos e inorgánicos, ya que posee una alta área específica, exhiben una alta eficiencia en la remoción de muchos compuestos disueltos, tiene buena capacidad para la adsorción de muchas moléculas orgánicas, sin embargo, la dificultad y el costo para su regeneración es complicado. Actualmente se están estudiando la viabilidad de otros materiales de bajo costo, tales como cáscara de naranja, algodón, arroz, bentonita, hojas pulverizadas, cáscara de coco y carbón de aserrín, para remover varios colorantes del agua (Jain & Sikarwar, 2008).
Otro tipo de materiales son las arcillas consideradas como adsorbentes alternativos de bajo costo. Entonces, algunas arcillas derivadas pueden ser fáciles de preparar y su regeneración es económica, por lo que es alternativa y buena técnica de remoción de compuestos orgánicos (Orthman et al., 2003; Pavan, Gomes & Valim, 1998).
En la búsqueda de materiales eficientes para remover contaminantes de efluentes, a principios del 2000, surgen materiales tipo hidróxidos mixtos de Al y Mg con estructural laminar, denominados también como hidrotalcita, los cuales han atraído la atención por su habilidad de intercambio aniónico, su potencial uso en catálisis y buen adsorbente selectivo de compuestos orgánicos (Barriga et al., 2002; Yia-Feng, Pin-Chieh & Shan-Li, 2008).
Los hidróxidos dobles laminares (HDL) son utilizados para remover aniones del agua, debido a su principal característica del remplazo parcial del catión bivalente con el trivalente, lo cual genera un exceso de carga positiva en la lámina. Se considera importante esta característica porque se puede remover compuestos tóxicos del agua y, al mismo tiempo, obtener materiales híbridos de los HDL, teniendo una gran variedad de moléculas orgánicas que pueden ser incorporadas dentro del espacio interlaminar; por ejemplo, carboxilatos alifáticos o aromáticos, sulfonatos y fosfonatos, aniones alquil sulfatos, fosforinas, drogas aniónicas, colorantes y contaminantes orgánicos (Hermosín, Pavlovic, Ulibarri & Cornejo, 1995). Además, la incorporación de estos compuestos permiten adaptar la funcionalidad de los híbridos de HDL para encontrar otras aplicaciones tanto en pigmentos, dispositivos ópticos, nano y macro compositos de polímeros, portadores de drogas y catálisis (Choudhary, Jha & Narkhede, 2005; Zavoianu, Birjega, Pavel, Cruceanu & Alifanti, 2005). La formación de compuestos intercalados es particularmente relevante para la inmovilización por adsorción de colorantes orgánicos. Una prometedora aplicación es usar los HDL como adsorbente en la remoción de colorantes de efluentes textiles, plásticos y la industria del papel.
Estos materiales HDL por su características texturales y habilidad de regeneración son estudiados en este trabajo para la remoción del colorante naranja de metilo.
MÉTODOS
Síntesis del HDL
El material tipo HDL en estudio se obtuvo por el método de coprecipitación similar al reportado en la literatura para la hidrotalcita por Vágvölgyi, Palmer, Kristóf, Frost & Horváth (2008), basado en la adición lenta de una mezcla de soluciones acuosas de sales, una solución con metal divalente (MgSO4) y otra con metal trivalente [Al2(SO4)3], ambas grado técnico, con un límite de impurezas bajo (entre 0.5% a 1.0%), pudiendo variar la proporción molar x = Al/Al + Mg desde 0.2 a 0.4 y adicionando el carbonato de sodio grado reactivo JT Baker como anión interlaminar.
El HDL sintetizado fue secado en una estufa a 80 °C por 18 h. Posteriormente se molió en un mortero de ágata hasta obtener un tamaño de partícula muy fino (malla 325), con un tamaño de partícula de 0.043 mm.
Caracterización del HDL
Fisisorción de Nitrógeno (N2)
Las propiedades de textura (área específica, volumen promedio de poro y diámetro promedio de poro) de los HDL fueron determinadas por el método BET-N2, usando un equipo MICROMERITICS ASAP-2010. Las muestras fueron desgasificadas a 100 °C bajo un vacío dinámico de ~4 μmmHg.
Difracción de rayos X (DRX)
Las fases cristalinas del HDL se obtuvieron con la técnica de DRX, utilizando un difractómetro INEL modelo Equinox System serie EQUI22102003, usando CuKα (λ = 1.5408 Å), operado con una radiación de 20 mA y 30 KV, con un barrido de 2θ de 10 ºC - 80 °C. Los patrones de DRX obtenidos se compararon con una base de datos para determinar las estructuras cristalinas correspondientes.
Análisis Termogravimétrico (TGA)
El Análisis Termogravimétrico permite evaluar la variación de la pérdida de peso de un material cuando se calienta. En este análisis se evaluó la estabilidad térmica y el porcentaje de humedad del HDL. El equipo que se utilizó es un analizador termogravimétrico SDT 2960 Simultaneous DSC-TGA, TA Instrument, en el que se colocó 20 mg - 30 mg del HDL en un portamuestras de α-alúmina, con una velocidad de calentamiento de 10 °C/min hasta alcanzar una temperatura máxima de 900 °C, utilizando un flujo de aire sintético comprimido; después los resultados fueron analizados utilizando un método llamado Stepwise isothermal.
Infrarrojo (IR)
Los grupos funcionales, vibraciones y tipos de enlace del HDL se determinaron por un análisis de absorción en el infrarrojo, utilizando un espectrofotómetro marca Infinity Gold Mattson con una resolución de 8 cm-1, con 100 scan. Las muestras se prepararon por dilución en bromuro de potasio en una concentración entre el 1% - 3% en peso, con un número de onda de 400 cm-1 - 4000 cm-1, por transmitancia.
Desorción Térmica Programada (TPD)
La TPD permite determinar el número, tipo y fuerza de los centros activos presentes en la superficie de un catalizador por medida de la cantidad de una molécula sonda desorbida a diferentes temperaturas. Para caracterizar los centros básicos de los materiales se utiliza dióxido de carbono como molécula sonda por su carácter de ácido débil, con un flujo de helio de 50 cm3/min por una hora a 80 °C con una velocidad de calentamiento de 5 °C/min a 100 mg de HDL. Para recolectar los datos se utilizó un espectrómetro de masas marca Omnistar, GDS 301 Pfeiffer Vacuum D-35614 Asslar.
Calorimetría de Inmersión
La técnica de calorimetría de inmersión se ha utilizado en los últimos años para determinar características de los sólidos como su área superficial, la forma y distribución de los poros existentes en el sólido y de acuerdo al reactivo de mojado empleado, se puede tener conocimiento del tipo de grupos activos presentes en la superficie. Tal técnica se emplea además en investigaciones de interacciones sólido-líquido, y actualmente se ha convertido en un método importante para el estudio de catalizadores, adsorbentes y carbones activados, entre otros. La muestra fue introducida en un bulbo de vidrio que se pone en un sistema a vacío provisto de una bomba mecánica y otra difusora a una presión de 10-6 torr por 4 h a 100 °C. Entonces, el bulbo fue sellado y sujetado a una barra de teflón.
Este ensamblaje fue introducido a una celda de teflón del calorímetro que contiene 7 cm3 del líquido que se quiere poner en contacto con el HDL, en este caso agua desionizada. Todo el sistema fue introducido dentro del equipo y así permitir que se logre un equilibrio de la temperatura entre la muestra y el calorímetro. La integración de estas señales da el calor experimental de inmersión total, el cual puede ser corregido por la energía del rompimiento del bulbo (exotérmico) y el calor de vaporización de la inmersión del líquido para ocupar el volumen vacío del bulbo con el vapor, correspondiente a la presión de vapor (endotérmico). El equipo utilizado para este análisis es marca Setaram C80, Francia.
Método para determinar el equilibrio de adsorción
Los datos experimentales del equilibrio de adsorción se realizaron en un adsorbedor por lote, que consiste en tubos de polipropileno de 50 mL, a los cuales se añadieron 0.1 g de HDL en soluciones de 2 ppm - 100 ppm a pH 5, 6, 7, 9 y 12 a una temperatura de 25 °C por cinco días, hasta alcanzar el equilibrio. El pH fue regulado utilizando soluciones de HNO3 y NaOH 0.1 N, para mantenerlo constante. Una vez alcanzado el equilibrio, el HDL fue separado de la solución por filtración al vacío con un papel filtro (20 μm) para su análisis.
Determinación de la concentración de naranja de metilo en solución acuosa
Las concentraciones de naranja de metilo en solución acuosa se determinaron mediante un método colorimétrico directo utilizando un espectrofotómetro UV-visible de doble haz, marca Perkin-Elmer. Para el caso del naranja de metilo se utilizó agua desionizada como blanco y se realizó una curva de calibración, la cual se preparó a concentraciones que van de 0.1 mg/L - 1 mg/L. La longitud de onda utilizada en el análisis del naranja de metilo fue de 466 nm, de acuerdo con lo reportado por Mandal et al. (2009). Los datos de la curva de calibración, concentración vs. absorbancia se correlacionaron por medio de la ecuación (1):

Donde C es la concentración del naranja de metilo, mg/L, Abs es la absorbancia y κ , b son las constantes de ajuste.
La concentración del naranja de metilo se determinó midiendo la absorbancia y substituyéndola en la ecuación de la curva de calibración. Las concentraciones del naranja de metilo en la solución deben estar entre 0.1 mg/L y 1 mg/L. En el caso de que las concentraciones fueron mayores se realizaron las diluciones necesarias.
RESULTADOS
Caracterización del HDL
Propiedades de Textura
Las propiedades de textura del HDL se muestran en la tabla 1. En la figura 2 se muestra la isoterma de adsorción-desorción de N2 sobre HDL; esta isoterma se obtuvo por el método de Brunauer, Emmett y Teller (BET). El comportamiento de la isoterma para el HDL es de tipo IV y presenta un lazo de histéresis del tipo H3 (Carja, Nakamura, Aida & Niiyama, 2001). Este comportamiento está asociado a la presencia de mesoporos formados por el acomodo de la estructura laminar. El diámetro promedio de poro fue de 15.94 nm.


El lazo de histéresis muestra que son agregados de partículas tipo plato con forma de poros tipo rendija no uniformes (Hosni & Srasra, 2009).
Difracción de rayos X del HDL y HDL / naranja de metilo
Los materiales como el HDL y HDL / naranja de metilo muestran un patrón típico de los compuestos laminares (figura 3), con una intensidad máxima de la reflexión (001) a bajos valores de 2θ.

Además, los difractogramas de la figura 3 indican que el HDL con el naranja de metilo adsorbido no presenta ningún desplazamiento en el ángulo 2θ en el pico máximo de reflexión en comparación con un HDL, lo que indica que el naranja de metilo no aumenta el espacio interlaminar del adsorbente. A diferencia de lo reportado por Extremera, Pavlovic, Pérez & Barriga (2012), llevándose a cabo la eliminación del naranja ácido 10 (AO10) sobre MgAl-HDLs, el análisis de DRX sugiere la intercalación de AO10 en el HDL, de tal forma que causa un aumento en la distancia basal de 7.7 Å a 17.7 Å.
En este trabajo se considera que al no variar el espacio interlaminar podría atribuirse a que el naranja de metilo está orientado de tal manera que la molécula no aumente la distancia interlaminar de las capas para una concentración alta de colorante, como se muestra en la figura 4.

Análisis térmico
Mediante el análisis térmico del material HDL, como se muestra en el termograma en la figura 5, se distinguen las principales zonas de cambios que el material presenta con el incremento de temperatura. Por ejemplo, un incremento de temperatura desde 22 °C hasta aproximadamente 200 °C dan como resultado la eliminación del agua fisisorbida del sólido y del agua interlaminar (Das & Samal, 2004). Esta pérdida supone un porcentaje del 18% de la masa total inicial de la muestra.

En un intervalo de temperatura entre 200 °C - 400 °C, se produce la descomposición de los aniones carbonato CO32- eliminándose en forma de dióxido de carbono, y la condensación de los grupos hidroxilo en las capas octaédricas (Kanezaki, 1998); usualmente estas señales se traslapan aunque realizando el análisis térmico diferencial permite la identificación de dichas etapas. La eliminación de los carbonatos y los hidroxilos supone una pérdida de masa del 28.05%, aunque algunos autores estiman esta pérdida de aniones en 35 wt% (±2) (Sampieri, Fetter, Pfeiffer & Bosch, 2007).
Adicionalmente, el equipo de termoanálisis desarrolla un análisis diferencial de la pérdida de peso (termogravimetría diferencial [DTG, por sus siglas en inglés]); en la curva resultante se muestran picos de pérdidas de agua y dos señales correspondientes a la eliminación de carbonatos y la deshidroxilación de las láminas. Ello no se ve a simple vista con la curva de la pérdida de peso. Esto ocasiona que por arriba de los 550 °C el material sufra transformaciones estructurales, como la presencia de una fase amorfa cuando el contenido de magnesio se incrementa, o la existencia de la estructura intermedia tipo espinela, además del colapso total de la estructura con una pérdida mínima de masa 0.5%.
Desorción a temperatura programada
Mediante el análisis por desorción a TPD, los HDL fueron desgasificados a 80 °C por 1 h para eliminar impurezas del adsorbente; después al incrementar la temperatura los aniones CO32- son transformados a CO2, los cuales se pierden del material a 220 °C según lo reportado por Fishel & Davis (1994), donde la descomposición total de los carbonatos de la región interlaminar está en el rango de 200 °C - 400 °C.
El TPD resultante muestra que las señales a bajas temperaturas alrededor de los 80 °C - 140 °C son picos atribuidos a sitios básicos débiles correspondientes a OH- débiles; para sitios básicos moderados se encuentran en un rango de 180 °C - 200 °C asignados al par M-O; y a temperaturas altas de 250 °C - 300 °C se localizan los sitios básicos fuertes. Como se muestra en la figura 6, existe una distribución predominante de sitios básicos fuertes (Cheng et al., 2008; López, Gómez, Llanos & López, 1999; Wu, Wang, Wei & Sun, 2010). También mediante la ubicación de las señales de los sitios básicos se puede saber a qué tipo de estructura pertenece, pues a los sitios básicos se les relaciona con estructuras tipo HDL y Al2O3; en cambio, a picos a altas temperaturas de 250 °C - 430 °C claramente se distingue sólo la estructura de MgO (Béres, Pálinko, Kiricsi & Mizukami, 2001).

Calorimetría de inmersión
El experimento de microcalorimetría de inmersión fue realizado de acuerdo con lo reportado por Silvestre-Albero, Gómez, Sepúlveda-Escribano & Rodríguez-Reinoso (2001). Los sitios son separados en tres categorías acordes con la fuerza definida por el calor de adsorción según lo reportado por Dussault, Dupin, Dumitriu, Auroux & Guimon (2005), los cuales son: alto (Q > 150 KJ/mol), intermedios (Q entre 150 KJ/mol y 100 KJ/mol) y débil (Q < 100 KJ/mol). Para HDL son de 198.8 KJ/mol. Esto indica que los sitios básicos predominantes son fuertes.
Espectroscopía Infrarroja
En relación con el análisis por espectroscopía IR, en la figura 7 se muestran los espectros IR del material tipo HDL con el naranja de metilo adsorbido a diferentes concentraciones, para observar los grupos característicos del HDL, así como los pertenecientes al naranja de metilo, y así comprobar la eficacia de la adsorción del naranja de metilo sobre el HDL.

En ambos infrarrojos se aprecian las señales características de HDL. La banda es observad ancha a 1767 cm-1 correspondiente al modo vibracional de flexión del OH de las moléculas de agua en la región interlaminar. A 1357 cm-1 corresponde al modo ν3 del carbonato presente. El naranja de metilo caracterizado por las bandas de adsorción notables a 1608 cm-1 y 1420 cm-1 para las vibraciones de alargamiento de enlaces aromáticos C = C y N = N, respectivamente, a 1120 cm-1 el C-N y a 1031 cm-1 para la vibración de alargamiento del grupo SO3-. Las señales son más evidentes en el infrarrojo en el HDL con mayor concentración del naranja de metilo adsorbido.
Isoterma de adsorción
Los datos del equilibrio de adsorción del naranja de metilo sobre HDL se interpretaron y ajustaron al modelo de la isoterma de Langmuir (ecuación 2) y Freundlich (ecuación 3). Las constantes para este modelo de la isoterma se estimaron usando el método de mínimos cuadrados que se basó en el algoritmo de optimización Rosembrock-quasi-Newton.

Donde C es la concentración del soluto en equilibrio (mg/L), q es la masa de soluto adsorbido por unidad de masa del adsorbente (mg/g), qm es la máxima masa de soluto que se adsorbe sobre el adsorbente (mg/g) y K es la constante de la isoterma de Langmuir relacionada con el calor de adsorción (L/mg).


Donde K es la constante de la isoterma de Freundlich relacionada con la capacidad de adsorción (mg1-1/nL1/n/g) y n es la intensidad de la adsorción.
El porcentaje de desviación se evaluó por medio de la ecuación 4. Los valores de las constantes del modelo de la isoterma de Freundlich, así como los porcentajes de desviación, se muestran en la tabla 2. La isoterma de Freundlich no se ajustó adecuadamente, ya que los porcentajes de desviación variaron entre 38.3% - 43.9% dependiendo del pH.

Donde N es el número de datos experimentales, qcal es la masa del naranja de metilo adsorbido que se predice con el modelo de isoterma (mg/g) y qexp es la masa del naranja de metilo adsorbido determinado experimentalmente (mg/g).
Los valores de las constantes de la isoterma de Langmuir, así como los porcentajes de desviación, se muestran en la tabla 2. La isoterma de Langmuir se ajustó adecuadamente, ya que los porcentajes de desviación variaron entre 8.56% - 26.2% dependiendo del pH.
Efecto del pH
El efecto del pH en la isoterma de adsorción de naranja de metilo sobre HDL se obtuvo a pH de 5, 7, 9 y 11 y a una temperatura de 25 °C. En la figura 8 se muestran los datos de equilibrio de adsorción del naranja de metilo sobre HDL a diferentes valores de pH y se observa que la máxima capacidad de adsorción del HDL se presentó a pH 5, siendo de 40.2 mg/g, mientras que la mínima capacidad de adsorción es a pH 11 de 22.1 mg/g. A pH 7 es muy cercana la máxima capacidad de adsorción respecto al pH 5. La capacidad de adsorción disminuye drásticamente al aumentar el pH de 9 a 11, de 37.9 mg/g y 22.1 mg/g, respectivamente.

Efecto de la temperatura
El efecto de la temperatura se estudió determinando las isotermas de equilibrio de adsorción del naranja de metilo a pH 5 sobre HDL a las temperaturas de 25 °C y 35 °C. Los datos del equilibrio de adsorción del naranja de metilo se muestran en la figura 9.
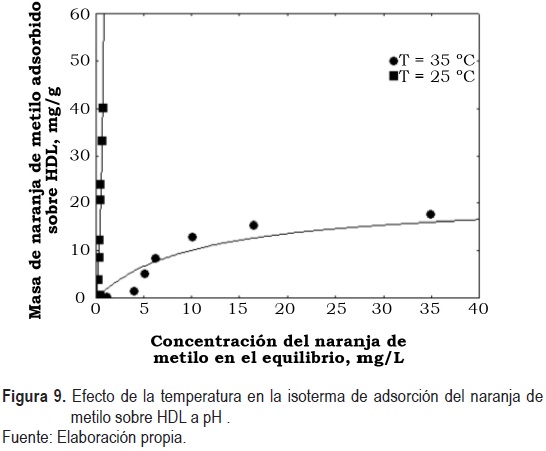
La masa del naranja de metilo adsorbido a una concentración en el equilibrio de 100 mg/L a las temperaturas de 25 °C y 35 °C fue de 40.2 mg/g y 14.8 mg/g, respectivamente. En la isoterma de adsorción se observa una clara disminución en la capacidad de adsorción cuando la temperatura se aumentó de 25 °C a 35 °C.
Los datos linealizados (Inq vs. ε2) de la ecuación 5 de D-R para el naranja de metilo se muestra en la figura 10, en la cual los datos se correlacionan muy bien con la ecuación de Dubinin-Raduskevich a la temperatura de 25 °C y de 35 °C.


Donde ε es el potencial de Polayani y es igual a RT In [(1+(1/c)]. Esta ecuación se expresa en forma lineal por la ecuación 6:

Donde qm es la máxima capacidad de adsorción (mol/g), ε es el potencial de Polayani, R es la constante de los gases ideales (KJ/molK), C la concentración del naranja de metilo en el equilibrio (mol/L), T es la temperatura (K) y β es la constante relacionada con la energía de adsorción (mol2/KJ2).
Si se considera que la superficie del HDL es homogénea, entonces la energía de adsorción del naranja de metilo sobre HDL, Eads, se puede relacionar con β1/2 de acuerdo con la ecuación 7.

Con base en los resultados mostrados en la tabla 3, se observa que no existe una diferencia significativa en la energía de adsorción a las temperaturas de 25 °C y 35 °C. El valor de la energía de adsorción mostrado en la figura 10, para el naranja de metilo sobre HDL calculado con la ecuación de D-R, fue de 6.6 KJ/mol, tratándose de un proceso endotérmico, lo cual indica que se trata de una adsorción física donde predominan las fuerzas de Van der Waals, entre el naranja de metilo y la superficie del HDL.

CONCLUSIONES
El pH de la solución es importante en la adsorción del naranja de metilo sobre HDL. La más alta capacidad de adsorción se redujo considerablemente al aumentar el pH 5 a pH 11. Este efecto se atribuyó a las interacciones electrostáticas entre el naranja de metilo en la solución y la carga superficial del HDL.
La adsorción del naranja de metilo ocurre por fisisorción, favoreciendo la entrada de la molécula por las dimensiones más pequeñas, por lo que no se ve afectada la distancia interlaminar de la estructura. Debido a ello, además de eliminar un contaminante del agua se podrían utilizar como aditivos multifuncionales combinando las moléculas de colorante con los hidróxidos dobles laminares para formar nanopigmentos.
REFERENCIAS
Barriga, C., Gaitán, M., Pavlovic, I., Ulibarri, M. A., Hermosín, M. C. & Cornejo, J. (2002). Hydrotalcite as sorbent for 2, 4, 6-trinitrophenol: influence of the layer composition and interlayer anion. Journal of Materials Chemistry, 12(4), 1027-1034. [ Links ]
Béres, A., Pálinko, I., Kiricsi, I. & Mizukami, F. (2001). Characterization and catalytic activity of Ni-Al and Zn-Cr mixed oxides obtained from layered double hydroxides. Solid State Ionics, 141-142, 259-263. [ Links ]
Carja, G., Nakamura, R., Aida, T. & Niiyama, H. (2001). Textural properties of layered double hydroxides: effect of magnesium substitution by copper ori ron. Microporous Mesoporous Mater, 47, 275-284. [ Links ]
Cheng, W., Wang, W., Zhao, Y., Liu, L., Yang, J. & He, M. (2008). Influence of acid-base properties of ZnMgAl-mixed oxides for the synthesis of 1-methoxy-2-propanol. Appied Clay Science, 42(1), 111-115. [ Links ]
Choudhary, V. R., Jha, R. & Narkhede, V. S. (2005). In-Mg-Hydrotalcite anionic clays as catalyst or catalyst precursor for Friedel-Crafts type benzylation reactions. Journal of Molecular Catalysis: A: Chemical, 239(1), 76-81. [ Links ]
Das, N. & Samal, A. (2004). Synthesis, characterisation and rehydration behaviour of titanium (IV) containing hydrotalcite like compounds. Microporous Mesoporous Mater, 72(1-3), 219-225. doi:10.1016/j.micromeso.2004.04.004. [ Links ]
Dussault, L., Dupin, J. C., Dumitriu, E., Auroux, A. & Guimon, C. (2005). Microcalorimetry, TPR and XPS studies of acid-base properties of NiCuMgAl mixed oxides using LDHs as precursors. Thermochimica acta, 434, 93-99. [ Links ]
Epolito, W.J., Lee, Y. H., Bottomley, L. A. & Pavlostathis, S. G. (2005). Characterization of the textile anthraquinone dye Reactive Blue 4. Dyes and Pigments, 67(1), 35-46. [ Links ]
Extremera, R., Pavlovic, I., Pérez, M. R. & Barriga, C. (2012). Removal of acid orange 10 by calcined Mg/Al layered double hydroxides from water and recovery of the adsorbed dye. Journal of Chemical Engineering, 213, 392-400. [ Links ]
Fishel, C. T. & Davis, R. J. (1994). Characterization of Mg-Al mixed oxides by temperature-programmed reaction of 2-propanol. Langmuir, 10(1), 159-165. [ Links ]
Georgiou, D., Melidis, P., Aivasidis, A. & Gimouhopoulos, K. (2002). Degradation of azo-reactive dyes by ultraviolet radiation in the presence of hydrogen peroxide. Dyes and Pigments, 52(2), 69-78. [ Links ]
Hermosín, M. C., Pavlovic, I., Ulibarri, M. A. & Cornejo, J. (1995). Hydrotalcite as sorbent for trinitrophenol: Sorption capacity and mechanism. Water Research, 30(1), 171-177. [ Links ]
Hosni, K. & Srasra, E. (2009). Simplified synthesis of layered double hydroxide using a natural source of magnesium. Appied Clay Science, 43(3-4), 415-419. doi:10.1016/j.clay.2008.12.008. [ Links ]
Jain, R. & Sikarwar, S. (2008). Removal of hazardous dye congo red from waste material. Journal of Hazardous Materials, 152, 942-948. [ Links ]
Kameda, T., Saito, M. & Umetsu, T. (2005). Preparation of a composite material for the uptake of bisphenol A from aqueous solutions, the dodecylsulfate ion-intercalated Mg-Al layer-structured double hydroxide particles. Journal of Alloys and Compounds, 402(1), 46-52. [ Links ]
Kanezaki, E. (1998). Thermal behavior of the hydrotalcite-like layered structure of Mg and Al-layered double hydroxides with interlayer carbonate by means of in situ power HTXRD and DTA/TG. Solid State Ionics, 106(3), 279-284. [ Links ]
López, T., Gómez, R., Llanos, M. E. & López, S. E. (1999). Acidic-base properties of silica-magnesia sol-gel mixed oxides: use of 2 butanol as test reaction. Materials Letters, 38(4), 283-288. [ Links ]
Mandal, S., Tichit, D., Lerner, D. A. & Marcotte, N. (2009). Azoic dye hosted in layered double hydroxide: Physicochemical characterization of the intercalated materials. Langmuir, 25(18), 10980-10986. doi: 10.1021/la901201s. [ Links ]
Merzouk, B., Yakoubi, M., Zongo, I., Leclerc, J. P., Paternotte, G., Pontvianne, S. & Lapicque, F. (2011). Effect of modification of textile wastewater composition on electrocoagulation efficiency. Desalination, 275(1-3), 181-186. doi:10.1016/j.desal.2011.02.055. [ Links ]
Norma Oficial Mexicana (1995). NOM-065-ECOL-1994. Que establece los límites máximos permisibles de contaminantes en las descargas de aguas residuales a cuerpos receptores provenientes de las industrias de pigmentos y colorantes. Diario Oficial de la Federación, 1° de mayo de 1995. [ Links ]
Orthman, J., Zhu, H. Y. & Lu, G. Q. (2003). Use of anion clay hydrotalcite to remove coloured organics from aqueous solutions. Separation and Purification Technology, 31(1), 53-59. doi:10.1016/S1383-5866(02)00158-2. [ Links ]
Pavan, P. C., Gomes, G. & Valim, J. B. (1998). Adsorption of sodium dodecyl sulfate on layered double hydroxides. Microporous and Mesoporous Materials, 21(4), 659-665. [ Links ]
Ramírez-Llamas, L. A., Leyva-Ramos, R., Jacobo-Azuara, A., Martínez-Rosales, J. M. & Isaacs-Páez, E. D. (2015). Adsorption of Fluoride from Aqueous Solution on Calcined and Uncalcined Layered Double Hydroxide. Adsorption Science & Technology, 33(4), 393-410. [ Links ]
Sampieri, A., Fetter, G., Pfeiffer, H. & Bosch, P. (2007). Carbonate phobic (Zn, Mn)-Al hydrotalcite-like compounds. Solid State Sciences, 9(5), 394-403. doi:10.1016/j.solidstatesciences.2007.03.014. [ Links ]
Silvestre-Albero, J., Gómez de Salazar, C., Sepúlveda-Escribano, A. & Rodríguez-Reinoso, F. (2001). Characterization of microporous solids by immersion calorimetry. Colloids and Surfaces A, 187-188, 151-165. [ Links ]
Vágvölgyi, V., Palmer, S. J., Kristóf, J., Frost, R. L. & Horváth, E. (2008). Mechanism for hydrotalcite decomposition: A controlled rate thermal analysis study. Journal of Colloid and Interface Sciences, 318(2), 302-308. [ Links ]
Wu, G., Wang, X., Wei, W. & Sun, Y. (2010). Fluorine-modified Mg-Al mixed oxides: A solid base with variable basic sites and tunable basicity. Applied Catalysis A: General, 377(1-2), 107-113. doi:10.1016/j.apcata.2010.01.023 [ Links ]
Yia-Feng, C., Pin-Chieh, C. & Shan-Li, W. (2008). Adsorption of 2, 4-D on Mg/Al-NO3 layered double hydroxide with varying layer charge density. Appied Clay Science, 40(1-4), 193-200. [ Links ]
You-Peng, C., Shao-Yang, L., Han-Qing, Y. Hao, Y. & Qian-Rong, L. (2008). Radiation-induced degradation of methyl orange in aqueous solutions. Chemosphere, 72(4), 532-536. [ Links ]
Yujiang, L., Baoyu, G., Tao, W., Weisuo, C., Xia, L. & Biao, W. (2008). Adsorption kinetics for removal of thiocyanate from aqueous solution by calcined hydrotalcite. Colloids and Surfaces A, 325(1), 38-43. doi:10.1016/j.colsurfa.2008.04.046. [ Links ]
Zavoianu, R., Birjega, R., Pavel, D. O., Cruceanu, A. & Alifanti, M. (2005). Hydrotalcite like compounds with low Mo-loading active catalysts for selective oxidation of cyclohexene with hydrogen peroxide. Applied Catalysis A: General, 286(2), 211-220. [ Links ]
Zhe-Ming, N., Sheng-Jie, X., Li-Grng, W., Fang-Fang, X. & Guo-xiang, P. (2007). Treatment of methyl orange by calcined layered double hydroxides in aqueous solution: adsorption property and kinetic studies. Journal of Colloid and Interface Sciences, 316(2), 284-291. [ Links ]














