Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Acta universitaria
On-line version ISSN 2007-9621Print version ISSN 0188-6266
Acta univ vol.25 n.2 México Mar./Apr. 2015
https://doi.org/10.15174/au.2015.690
Ciencias biológicas, agropecuarias y del medio ambiente
El área de distribución de las especies: revisión del concepto
Geographical distribution of the species: a concept review
Carlos Alberto Maciel-Mata*, Norma Manríquez-Morán*, Pablo Octavio-Aguilar*, Gerardo Sánchez-Rojas*
* Centro de Investigaciones Biológicas, Área Académica de Biología, Universidad Autónoma del Estado de Hidalgo (UAEH). Km 4.5 de la Carretera Pachuca-Tulancingo, Col. Taxistas, Mineral de la Reforma, Hidalgo, apartado postal 69-1, Pachuca, Hidalgo, C.P. 42184. Tel.: (771) 7172000, ext. 6663; fax: 771-7172112. Correo electrónico: camacielmata@yahoo.com.mx
Recibido: 2 de diciembre de 2014.
Aceptado: 9 de marzo de 2015.
Resumen
El área de distribución de las especies es un concepto importante en la biología, sin embargo, existen casos en los que no se ha interpretado adecuadamente. Se considera que utilizar un término unificado de especie puede ayudar a clarificar el concepto de área de distribución, pues se incorpora la idea de dimensión espacial al señalar que las especies son linajes metapoblacionales que evolucionan separadamente. El área de distribución se define como la fracción del espacio geográfico donde una especie está presente e interactúa de manera no efímera con el ecosistema. La presencia o ausencia de éstas en el espacio geográfico está definida por factores biogeográficos, fisiológicos, así como ecológicos. A pesar de ser un atributo difícil de estimar, se han descrito algunos patrones referentes a los tamaños, formas y límites del área de distribución. En la actualidad existen métodos que permiten hacer hipótesis certeras acerca del espacio de la distribución de las especies.
Palabras clave: Concepto área de distribución de las especies; linaje metapoblacional; implicaciones del área de distribución; patrones; métodos de aproximación.
Abstract
The geographical distribution is an important concept in biological sciences, however in some cases it has been interpreted inadequately. We consider that the unified species concept can help to clarify the geographical distribution concept, since incorporate the spatial dimension because the species are a separately evolving metapopulation lineage. the geographical distribution is defined as that fraction of the geographical space where a species is present and interacts in unephemeral way with the ecosystem. The presence or absence of the species in the geographic space is defined by biogeography, physiology, and ecological factors. Geographical distribution is an attribute difficult to estimate, nevertheless, it has described some patterns concerning to size, shape and boundaries. Currently, there are some methods that allow to carry out spatially explicit accurate hypothesis about the geographical distribution of the species.
Keywords: Geographic distribution concept; metapopulation lineage; geographic distribution implications; patterns; methods to approximation.
INTRODUCCIÓN
El área de distribución geográfica, entendida como el lugar donde una especie puede ser localizada, es un atributo difícil de estimar (Grinnell, 1917). Si bien, desde los primeros naturalistas de la época antigua se reconoció que existía variación de las condiciones ambientales en las que habitaban determinados grupos taxonómicos, fue hasta las primeras expediciones del siglo XVII que se evidenció una discontinuidad en la distribución de las especies a lo largo del planeta y se enfatizó en reconocer las limitantes para su dispersión (Arroyo, Carrión, Hampe & Jordano, 2004).
Existe una gran cantidad de trabajos a diferentes escalas acerca de la distribución de las especies en ciertos grupos biológicos, donde se documentan los patrones, las formas, los tamaños y el solapamiento del área de dicha distribución. Sólo por citar algunos ejemplos: Hall (1981) para mamíferos de Norteamérica, Smith & Taylor (1950)para los reptiles de México, Pennington & Sarukhán (2005) sobre los árboles tropicales de México y Orme et al. (2006) para las aves del mundo. No obstante, también se sabe que el área de distribución de las especies cambia con el tiempo; por ejemplo, el jaguar (Panthera onca) hace 10 000 años tenía su límite geográfico al norte de su área de distribución en el paralelo 36°, ubicado a la mitad de Estados Unidos de América, actualmente se considera que el límite norte está en el paralelo 32°, localizado en la frontera sur de Estados Unidos con México (Brown & López, 2001), por lo que ese fenómeno espacial es dinámico.
La estimación de la distribución espacial, como una variable de respuesta, permite formular preguntas: ¿qué procesos determinan la ubicación de una especie en un sitio?, ¿se distribuyen de la misma manera a lo largo del tiempo?, ¿es posible hacer predicciones sobre su distribución futura?, ¿qué información nos proporciona una distribución?, ¿qué relación guarda la historia de vida de una especie con la historia geológica del lugar donde habita? Para responder estas preguntas será necesario estudiar la forma, tamaño, conectividad y dinámica temporal de las áreas de distribución, de lo cual se encarga la biogeografía. Hasta el momento, se han descrito algunos patrones cuantitativos referentes al tamaño, forma, límites, sobre-posiciones, estructura, así como la relación entre la distribución y la historia geográfica de un área (Zunino & Zullini, 2003).
Distribución y especie
El área de distribución de una especie sugiere la presencia de ésta en un espacio geográfico; en este contexto, el concepto especie resulta esencial para definir operativamente las características de dicha área. Se han propuesto varias definiciones para especie (Frankham et al., 2012): i) biológico: poblaciones naturales con entrecruzamiento potencial reproductivamente aisladas de otros grupos (Mayr, 1942), ii) evolutivo: un linaje único descendente que mantiene su identidad y que posee su propia tendencia evolutiva (Wiley, 1978) y iii) filogenético: el grupo diagnosticable más pequeño de organismos individuales dentro de los cuales hay un patrón parental de ancestría y descendencia (Cracraft, 1983).
El debate respecto a la conceptualización de especie radica en que se resaltan más las diferencias que los elementos comunes entre conceptos (Donoghue, 1985). De Queiroz (2005) señala que el problema es que las definiciones se basan en una de varias propiedades adquiridas durante el proceso de especiación que no se adquieren al mismo tiempo ni en un orden regular, tal como la distinción fenética, incompatibilidad reproductiva, distinción ecológica y reciprocidad monofilética, entre otros. A partir de esta observación, y con el fin de eliminar los problemas generados por el excesivo número de conceptos, se propone el término unificado de especie (De Queiroz, 2007), que se refiere a las especies como linajes metapoblacionales que evolucionan separadamente. Se señala que "los linajes no necesariamente tienen que ser fenéticamente distinguibles, diagnosticables, monofiléticos, intrínsecamente aislados en lo reproductivo, ecológicamente divergentes, o cualquier otra cosa para ser considerado especie: los linajes únicamente tienen que estar evolucionando separadamente de otros linajes" (De Queiroz, 2007). En esta propuesta, De Queiroz (2007) sigue tomando en cuenta las propiedades fundamentales de los otros conceptos, que sirven como criterios y evidencias operacionales para evaluar la separación de los linajes (figura 1). Es probable que el debate respecto al concepto de especie continúe, sin embargo, la propuesta unificada de De Queiroz (2007) resuelve de buena manera el conflicto; además, ofrece con objetividad una propuesta para la cuantificación operativa de la "especie" como unidad y, en consecuencia, de los fenómenos que ocurren en relación con ella, como en este caso, el fenómeno del área de distribución, ya que al considerar a la especie como un linaje se incluye la dimensión temporal, y al contemplar la dinámica metapoblacional inevitablemente incorpora la dimensión espacial.
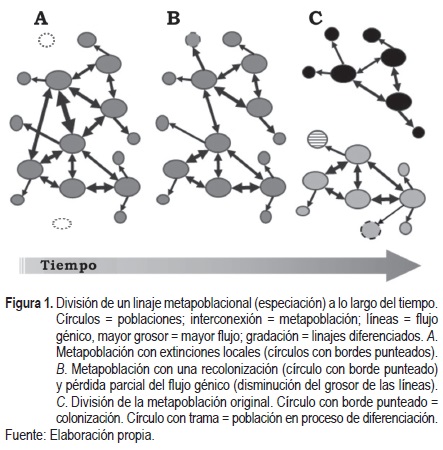
Concepto de área de distribución de las especies
El área de distribución de las especies es "aquella fracción del espacio geográfico donde una especie está presente e interactúa en forma no efímera con el ecosistema" (Zunino & Palestrini, 1991). El concepto involucra no sólo el lugar, sino también la forma en como la especie se presenta, es decir, "de manera no efímera con el ecosistema". Ocasionalmente se obtienen registros únicos y aislados a varios kilómetros del área de distribución conocida para una especie, lo cual no significa que deban ser considerados como parte de la distribución, sobre todo cuando la explicación a estos hallazgos sea de tipo antropogénico (Baldo, Borteiro, Brusquetti, García & Prigioni, 2008) o simplemente sea un hecho aleatorio. Este contexto implica necesariamente la dimensión temporal del concepto. Por el contrario, si el registro correspondiera a un grupo de organismos con repercusión sobre el acervo genético de la especie y con utilidad en la exploración de hipótesis dentro de la ecología y la biología de la conservación (Wiens et al., 2010), entonces dicho registro sí podría ser considerado como parte del área de distribución (Zunino, 2000).
Aun cuando el área de distribución puede ser un concepto concreto, involucra procesos y/o patrones verdaderamente complejos. Por ejemplo, toda distribución experimenta una contracción y expansión espacial a lo largo del tiempo, dinámica influenciada por la interacción de factores biológicos, ecológicos y biogeográficos (Zunino & Zullini, 2003). Por lo anterior, resulta complicado calcular con exactitud el área de distribución de una especie, puesto que es un fenómeno dinámico. Además, los métodos utilizados para aproximarse al conocimiento del área dan como resultado una estimación momentánea, la cual debe ser considerada más como una hipótesis que como una representación precisa de la realidad. Los métodos utilizados han evolucionado desde la "mano alzada" o "a ojo" (Rapoport, 1975), pasando por el método cartográfico (Cartan, 1978) o el método areográfico (Rapoport, 1975), llegando hasta los métodos basados en modelos probabilísticos de distribución de las especies (Guisan & Zimmermann, 2000).
Distribución y nicho
La presencia o ausencia de las especies y la forma en que se distribuyen en un espacio geográfico se definen por factores históricos, ecológicos y fisiológicos que varían a lo largo de la distribución, sometiendo a las especies a diferentes condiciones bióticas y abióticas. En relación con dichos factores, se ha desarrollado el concepto denominado nicho ecológico, alrededor del cual gira y se unifica toda la teoría ecológica (Milesi & López, 2005). El concepto nicho ecológico ha cambiado enfrentando distintas interpretaciones y discrepancias en cuanto a su estimación. Sin embargo, una de las conceptualizaciones más claras es la que hace Hutchinson (1957), quien señaló que el nicho ecológico es un hipervolumen multidimensional donde se concentra un conjunto de condiciones bióticas y abióticas en las que una especie es capaz de persistir y mantener un tamaño poblacional estable. Señaló, además, que al interior de este espacio se distinguen el nicho fundamental y el nicho realizado; el nicho fundamental refiere a las condiciones abióticas en las cuales una especie puede vivir; mientras que el nicho realizado está constituido por las condiciones ambientales existentes en el área más las interacciones biológicas (figura 2). De acuerdo con Pulliam (2000), una especie se presentará en los sitios donde las condiciones bióticas y abióticas le permitan mantener o incrementar su abundancia. Dicha presencia podrá ser tan amplia como su nicho fundamental lo sea, y estará ausente cuando la interacción con otras especies le signifique un desplazamiento, por lo tanto el área de distribución resultante es en consecuencia el nicho realizado. La presencia de una especie depende también de las limitantes históricas o de dispersión, por lo que una especie no siempre se presenta en todas las áreas potenciales.

Basado en el concepto de nicho ecológico de Hutchinson (1957), Maguire Jr (1973)desarrolló el concepto de centroide de nicho ecológico, el cual señala que el centroide es un punto donde convergen la media de las distintas variables o factores que determinan la presencia de una especie, punto en el cual se establece una dinámica de alta natalidad y mortalidad reducida. La consecuencia demográfica de esto es que las características de historia de vida de una especie, y por tanto la densidad poblacional, varían con base en la distancia ecológica relativa a este centroide (Yañez-Arenas, Martínez-Meyer, Mandujano & Rojas-Soto, 2012).
Implicaciones de la distribución de una especie
Fisiológicas
La distribución de los individuos de una especie a lo largo de los ecosistemas está limitada, en primer lugar, debido a sus restricciones fisiológicas ante múltiples factores ambientales (De Candolle, 1855; Good, 1931; Mac Arthur, 1972). Algunos grupos se distribuyen en ambientes determinados, por ejemplo, los órdenes Cetacea y Sirenia (Mammalia) habitan exclusivamente en ambientes acuáticos (Torres, Esquivel & Ceballos, 1995), mientras que los primates y Chiroptera (Mammalia) habitan en ambientes terrestres (Wilson & Reeder, 2005); de la misma forma, otros taxones habitan preferentemente en climas templados montañosos, como es el caso de los géneros Pinus (Alba-López, González-Espinoza, Ramírez-Marcial & Castillo-Santiago, 2003; Rzedowski, 1978) y Quercus (Encina & Villarreal, 2002; Rzedowski, 1978), mientras que otros prevalecen en climas áridos, como es el caso de la mayoría de las especies del género Yucca (Lujan, 1980).
Entonces, el área de distribución de cada especie se restringe dada su tolerancia ambiental, producto de distintos procesos evolutivos que han moldeado a los organismos y que, en consecuencia, han determinado su presencia a ciertos espacios (Wiens & Graham, 2005). Un ejemplo de segregación fisiológica por adaptación local son los organismos ectotermos (McCain, 2010), en ellos la temperatura corporal depende de la temperatura ambiental, controlando todo su metabolismo e involucrando el mantenimiento somático, el crecimiento y la reproducción (Huey, 1982;Huey & Stevenson, 1979). Particularmente se puede mencionar a la lagartija de vientre anaranjado Liolaemus pictus argentinus, ampliamente distribuida en la Patagonia, Argentina; esta lagartija responde significativamente a los gradientes térmicos altitudinales de manera que en ambientes más fríos el animal hiberna por más tiempo. Esto conlleva una limitación temporal en la actividad diaria (forrajeo) con mayor inversión de tiempo y energía en termorregular, lo que deriva en cambios en los atributos de su historia de vida, principalmente baja fecundidad y/o alteraciones en el ciclo reproductor anual (Gutiérrez, Krenz & Ibargüengoytia, 2010), limitando la presencia de la especie en lugares más fríos.
Por otro lado, cuando una población experimenta tasas de natalidad e inmigración mayores a las tasas de mortalidad y emigración, se espera un incremento poblacional que puede traducirse en un aumento en el área de distribución, ya que hay un excedente de población que puede colonizar más áreas. Sin embargo, la magnitud del incremento depende de otra condicionante intrínseca: la capacidad de dispersión (Gaston, 1996a). Algunas especies necesitan vectores para dispersarse (Okubo & Levin, 1989), otras utilizan sus propios medios para hacerlo (Beehler & Pruett-Jones, 1983), siempre en relación con la talla de los individuos, así como con el medio que utilizan para desplazarse (agua, viento o tierra), generando un potencial de dispersión diferencial (Lester, Ruttenberg, Gaines & Kinlan, 2007).
Las limitaciones fisiológicas dependen directamente de las condiciones ambientales, siendo las principales la temperatura y la humedad. Acorde con las necesidades de cada especie, existe una compleja interacción entre los intervalos ambientales y factores intrínsecos poblacionales, como el establecimiento, la sobrevivencia y la reproducción (Huntley, Berry, Cramer & Mcdonald, 1995; Pearson & Dawson, 2003). Conocer la manera en como las variables ambientales influyen sobre la presencia de las especies en el espacio geográfico favorece la exploración de teorías ecológicas y evolutivas, ligadas sobre todo al concepto de nicho ecológico (Soberón & Peterson, 2005), además de la predicción certera sobre la distribución de las especies (Peterson & Soberón, 2012). Sin embargo, obtener información ambiental no siempre es sencillo. Gracias al desarrollo de herramientas, como los modelos de distribución y los sistemas de información geográfica, se han podido hacer estimaciones de tipo evolutivo-ecológico (Elith et al., 2006).
Por otro lado, muchas especies tienden a retener aspectos de su nicho fundamental a lo largo del tiempo evolutivo, lo que se conoce como conservadurismo de nicho (Soberón & Miller, 2009). Este proceso se refleja en el área de distribución de las especies, sobre todo cuando están emparentadas, de manera que a mayor relación filogenética, las características del área de distribución serán parecidas (Peterson, Soberón & Sánchez-Cordero, 1999). Esto puede explicarse precisamente con el conservadurismo de nicho, ya que al ocurrir el proceso de cladogénesis, es decir, la división de un linaje en dos, es posible que las características del área de ambos linajes sean similares dado un cambio relativamente lento de sus requerimientos abióticos como producto de una inercia filogenética (Wiens & Graham, 2005). Por ejemplo, Ricklefs & Latham (1992), al comparar las áreas de distribución de varias herbáceas de zonas templadas, señalan que especies del mismo género, pero que habitan en continentes distintos, poseen tamaños de área similares, y sugieren que esto es producto de una estasis evolutiva de las características ecológicas que determinan su distribución.
El área de distribución de las especies en ocasiones puede verse afectada por el cambio climático global, ocasionado por el incremento de alrededor de 0.7 °C en la temperatura del último siglo (Intergovernmental Panel on Climate Change [IPCC], 2007), repercutiendo básicamente en su localización espacial (Holt, 1990; Parmesan, 1996; Pounds, Fogden & Campbell, 1999; Sinervo et al., 2010), aunque dichos cambios suceden de manera muy lenta (Petitpierre et al., 2012).
Las posibles modificaciones que el cambio climático pudiera estar generando sobre el área de distribución están en función de los límites de tolerancia fisiológica de las especies, lo que se denomina amplitud de nicho (Broennimann et al., 2006). De manera que una especie con una amplitud de nicho extensa puede presentar una disminución de su área de distribución si esas condiciones se vuelven raras en el futuro; por el contrario, si una especie posee un nicho muy estrecho puede expandir su área de distribución si dichas combinaciones se vuelven comunes (Vié, Hilton-Taylor & Stuart, 2009).
Por otro lado, cuando las especies conservan su área de distribución ante el cambio climático puede estar involucrada una respuesta adaptativa o de aclimatación fisiológica, ajustándose rápidamente al cambio ambiental y del paisaje (Peterson et al., 2001). Por ejemplo, las especies Rana temporaria, Pelophylax esculentus, Epidalea calamitia, Lissotriton vulgaris, L. helveticus y Triturus cristatus, distribuidas al sur de Inglaterra, presentaron cambios temporales en su actividad reproductora con relación a la temperatura anual de 1978 a 1994, observando que un incremento en la temperatura ambiental promueve una oviposición temprana en estos anfibios (Beebee, 1995). Este tipo de ajustes en los ciclos reproductores como respuesta al cambio climático también se han registrado en el reino vegetal. Por ejemplo, varias angiospermas del hemisferio norte presentaron floraciones tempranas en respuesta al incremento en la temperatura invernal y primaveral observada durante la década de los años ochenta (Myneni, Keeling, Tucker, Asrar & Nemani, 1997). Tanto en el caso de los anfibios de Inglaterra como el de las plantas del hemisferio norte, los mecanismos adaptativos relacionados con los eventos reproductores han favorecido la permanencia de las especies en sus áreas de distribución, a pesar de las modificaciones en los regímenes ambientales.
Si las especies no se adaptan rápidamente o si tienen un intervalo de tolerancia restringido, éstas deberán desplazarse en el espacio geográfico para encontrar condiciones ambientalmente idóneas, dando lugar a un proceso de colonización/extinción (Foden et al., 2007). Dicho proceso ha sido documentado por Gaston & Blackburn (2002) para un ensamble de aves en Gran Bretaña. Las aves fueron censadas a lo largo de varios años (1968-1972 y 1988-1991) y gracias a ello se pudieron estimar las tasas de colonización y de extinción locales. Los autores señalan que las aves con áreas de distribución pequeñas y con mayor capacidad de dispersión son capaces de colonizar con mayor frecuencia, mientras que las aves con menor talla y poblaciones pequeñas tienen mayor tasa de extinción, en ambos casos como respuesta al cambio en las condiciones ambientales.
Cuando las especies están limitadas para desplazarse o para responder de manera favorable ante los cambios ambientales, se presenta una disminución del área de distribución hacia aquellos sitios que le resulten prósperos, incrementando su riesgo de extinción. La disminución de un área de distribución queda evidenciada cuando se compara la distribución pasada (construida a partir del registro fósil o con los registros obtenidos de décadas anteriores) contra la distribución presente (derivada de los registros actuales) para una especie.
Al respecto, anteriormente se mencionaba el caso del jaguar Panthera onca que en poco menos de 10 000 años ha pasado de tener una distribución continental, con excepción de Canadá y Alaska, a una distribución más reducida en porciones aisladas de México, Centro y Sudamérica (Brown & López, 2001). No obstante, la disminución en la distribución de las especies no sólo se observa en amplios periodos de tiempo, es posible detectar esta respuesta en periodos cortos. Por ejemplo, la biznaga roja (Ferocactus pilosus), distribuida en el desierto chihuahuense, ha registrado una disminución en su área de distribución de alrededor del 50% durante los últimos 100 años, asociada con el calentamiento global (Ballesteros, 2008). En el caso de las lagartijas del género Sceloporus, distribuidas en México, alrededor del 12% de las poblaciones de 48 especies del género se han extinto en poco más de 30 años (1975-2008), situación también asociada con el cambio climático (Sinervo et al., 2010).
Finalmente, algunas especies presentan un incremento en su área de distribución como producto de un cambio favorable de las condiciones ambientales, lo que les permite desplazarse por sus propios medios a sitios donde antes estaban ausentes. Estas especies se pueden dividir en dos grupos: por un lado, las especies nativas que amplían su distribución a sitios donde antes no se les encontraba sin tener impactos adversos sobre la biodiversidad, y por otro lado, las especies invasoras, aquellas que ajustan su área de distribución y que tienen un impacto negativo sobre la biodiversidad, la economía y la salud comunitaria (Low, 2008). En lo general, ambos tipos de especies comparten algunas características: a) amplio intervalo de tolerancia climática, b) eficiencia en el uso de recursos, c) tasas reproductivas altas, d) maduración temprana, e) eficacia de dispersión y f) resistencia a condiciones extremas como el fuego o la congelación (Hellmann, Byers, Bierwagen & Dukes, 2008). Como ejemplo, el escarabajo descortezador, Dendroctonus ponderosae, ha sido favorecido por el calentamiento global afectando en los últimos años un número importante de hectáreas de bosques de pino en América del Norte, lo que no ocurría dadas las bajas temperaturas que se presentaban en esa región (Logan & Powell, 2001).
Ecológicas
El ambiente biótico es un conjunto de factores que determinan con mayor precisión la localización de las especies en el espacio geográfico; algunos de ellos son: las especies competidoras, depredadoras y patógenas, la disponibilidad de recursos y la dinámica demográfica de las poblaciones (HilleRisLambers, Harsch, Ettinger, Ford & Theobald, 2013; McGill, Enquist, Weiher & Westoby, 2006; Soberón, 2007).
Como se ha señalado, las poblaciones tienen tasas de natalidad, mortalidad y migración diferenciadas a lo largo del área de distribución, lo que genera una dinámica metapoblacional conocida como fuente-vertedero: aquellas poblaciones con tasas de crecimiento poblacional positivas son consideradas como fuente, y aquellas con tasas de crecimiento poblacional negativas como vertedero (Pulliam, 1988).
Una consecuencia de esta dinámica es que se puede registrar una densidad poblacional diferencial a lo largo del área de distribución de una especie. Una de las primeras hipótesis que se propusieron para explicar este fenómeno señala que la abundancia de los individuos es mayor en el centro del área de distribución de una especie y que hacia los márgenes la abundancia disminuye (Brown, 1984). Hoy en día existe una hipótesis más fundamentada, y es la relación que se da de acuerdo con su posición relativa al centroide de nicho, de manera que las poblaciones experimentan una densidad mayor conforme más próximas se encuentren al centroide y viceversa (Martínez-Meyer, Díaz-Porras, Peterson & Yáñez-Arenas, 2013), es decir, basado en las características bióticas y abióticas del ambiente y no de un lugar geográfico en particular.
Existen fenómenos complejos que ocurren únicamente en el margen del área de distribución de las especies, dada la influencia de cambios en los regímenes climáticos, establecimiento o ruptura de barreras de dispersión, presencia o ausencia de competidores y la degradación ambiental de origen antropogénico, fenómenos que actúan simultáneamente en lo que se conoce como efecto de borde (Brown & Lomolino, 1998). Las respuestas a estos factores pueden ir desde una "extinción/desaparición local", hasta una "recolonización" después de que la especie desapareció de una zona determinada (Holt, 2003; Kirkpatrick & Barton, 1997). Estas extinciones y recolonizaciones se presentan tanto a escala ecológica como evolutiva, y se traducen en reducciones e incrementos del área de distribución, aunque sólo se pueden visualizar en un momento de la historia de las especies.
Al inicio, cuando surge una especie, las poblaciones suelen experimentar incrementos y decrementos, tanto en el número de individuos como en su distribución. Generalmente, la especie prevalece dependiendo de las condiciones bióticas y abióticas a las que se enfrenta y se considera establecida cuando la variación en la densidad poblacional es menor. A partir de este punto, las poblaciones incrementan su densidad, en la medida que las condiciones tanto climáticas como ecológicas les resultan favorables; una alteración significativa en estas condiciones trae como consecuencia una desaceleración en el ritmo del crecimiento poblacional. Si las condiciones desfavorables prevalecen podría ocurrir un descenso drástico de la densidad, lo que propicia la extinción de la especie (Anderson, 1985). Cada una de las fases del crecimiento poblacional (establecimiento, crecimiento y disminución) es consecuencia de la abundancia de recursos, lo que guarda relación con el tamaño del área de distribución de una especie (Gaston, 1996b; Hanski, 1982) y la capacidad de dispersión de la misma (Brown, 2003). Al inicio, en la etapa de establecimiento, el área de distribución se restringe a espacios muy localizados con densidades relativamente bajas, pero conforme aumenta dicha densidad, el área tiende a ser cada vez mayor hasta alcanzar un área máxima, misma que se transforma en pequeños parches antes de desaparecer (Brown, Stevens & Kaufman, 1996).
Se ha explorado la relación entre el tamaño del área de distribución y la edad evolutiva de las especies usando el tiempo de divergencia, calculado a partir de datos moleculares, para seis grupos monofiléticos de aves. El trabajo presenta evidencias que sugieren que el área de distribución de estas especies se expande rápidamente después de la divergencia, en relación directa con el potencial de dispersión de estas aves. Sin embargo, después de la expansión ocurre una declinación gradual del área de distribución de los taxones asociadas con su edad (Webb & Gaston, 2000).
Biogeográficas
Si se considera un clado integrado por varias especies, es posible reconocer que no todas se originaron al mismo tiempo. En este sentido, los tamaños del área de distribución tienen relación con esta diferencia en el tiempo o, en otras palabras, con la longevidad del clado, de manera que las especies más antiguas suelen mostrar áreas de distribución más amplias que aquéllas de aparición reciente (Brown et al., 1996; Willis, 1922).
Viranta (2003), al trabajar con un grupo de mamíferos (Hypercarnívoros) del Mioceno Medio y Tardío, encuentra una asociación entre el tiempo de aparición de estas especies y su distribución geográfica, de modo que las especies de reciente aparición poseen un área de distribución restringida, misma que se va ampliando conforme aumenta su longevidad. Sin embargo, es posible que algunas especies de aparición antigua presenten áreas de distribución relativamente pequeñas debido a dos factores. Por un lado, estas especies podrían estar restringidas geográficamente, limitando la expansión de su área de distribución (Brown, 2003), o bien, que algunas de las poblaciones se encontraron sometidas a condiciones restrictivas provocando la especiación en zonas concretas de forma alopátrida, dando origen a una nueva especie con una distribución geográfica puntual y fragmentando el área original ocupado por la especie parental (Bridle & Vines, 2006). Por otro lado, las especies se distribuyen sobre el terreno geográfico, el cual sufre cambios a lo largo del tiempo de mayor o menor magnitud. Estos cambios transforman las características del área de distribución de las especies, particularmente el tamaño. En la mayoría de los casos, la aparición de una barrera geográfica separa algunas poblaciones distribuidas en el área donde ocurre la transformación, lo que facilita eventos de vicarianza que, a su vez, favorecen la especiación (Peterson et al., 1999; Whitaker, Grogan & Taylor, 2003). Un ejemplo de cómo las barreras geográficas impactan sobre la distribución de las especies es el caso de la amapola amarilla Hunnemannia fumariifolia, que se distribuye en el desierto chihuahuense y en la que existen evidencias para señalar que la divergencia de los clados principales ocurrieron entre el Pleistoceno Temprano y el Mioceno Medio (2000 - 20 000 millones de años, respectivamente). Sin embargo, durante la última gran glaciación del Cuaternario, el flujo génico estuvo limitado, de manera que la especie tuvo una distribución conformada por una serie de poblaciones separadas dada la compleja topografía de la Sierra Madre Oriental y el eje volcánico transmexicano (Ruiz-Sánchez, Rodríguez-Gómez & Sosa, 2012).
Características del área de distribución
Antes de profundizar en la dinámica del área de distribución de una especie, es importante resaltar que existe una serie de factores que influyen en la caracterización de dicha área. Inicialmente esta caracterización resulta complicada por el hecho de querer trasladar un fenómeno que se presenta tridimensionalmente en la naturaleza a un "terreno plano y bidimensional", lo cual elimina el efecto de la elevación en algunos puntos del terreno, modificando las distancias y en consecuencia su interpretación (Zunino & Zullini, 2003).
Otro factor a considerar es la "confiabilidad" de la fuente de los datos con los cuales se trabaja una hipótesis de distribución. Las propuestas del área de distribución de una especie se realizan con los registros de observaciones directas de los organismos, o bien, con los registros de organismos recolectados en campo y depositados en colecciones científicas. En la actualidad es posible acceder a dichos registros, e incluso incrementarlos, gracias a desarrollos tecnológicos (Sistemas de Información Geográfica) que facilitan el manejo de la información, pero esto no elimina posibles sesgos relacionados con las ambigüedades taxonómicas, la precisión en la ubicación geográfica, errores en el muestreo o de identificación taxonómica (Soberón & Peterson, 2004). Una propuesta del área de distribución de una especie hecha con errores de este tipo disminuirá la calidad de la información presentada (Noguera-Urbano & Escalante, 2014; Rowe, 2005). Las ambigüedades taxonómicas se deben a la falta de pericia por parte del personal encargado de hacer la determinación de los ejemplares y/o por problemas taxonómicos no resueltos para ciertas especies, situación que se ha venido resolviendo gracias a las nuevas técnicas moleculares de las que se apoya la sistemática (Carranza & Amat, 2005). En ocasiones, la resolución de las ambigüedades taxonómicas deriva en el reconocimiento de especies nuevas, lo que a su vez conlleva a modificaciones en el área de distribución de las "especies originales" involucradas (Pearman, D'Amen, Graham, Thuiller & Zimmermann, 2010). Como ejemplo, se puede citar el caso de los tritones del complejo Triturus pygmaeus, distribuidos en una gran porción de la península ibérica. Los integrantes del complejo se dividían en dos subespecies: T. pygmaeus pygmeus y T. p. marmoratus, que luego fueron reconocidas formalmente como dos especies: Triturus pygmaeus y T. marmoratus (Dorda & Esteban, 1986). La distribución de ambos tritones está separada por las montañas del sistema central de la península ibérica (T. marmoratus al norte y T. pygmaeus al suroeste), con excepción de Sierra de Gata y Sierra de Guadarrama, donde T. marmoratus es la única especie presente (García-París, Arano & Herrero, 2001). Al predecir la distribución, se nota una discrepancia entre los modelos obtenidos con las especies por separado y el modelo conjunto. Cuando se modeló la distribución de manera conjunta, se observó una sobre-predicción, que sugiere la presencia de este complejo en zonas donde ninguna de las dos especies ha sido registrada. Por el contrario, al modelar las distribuciones por separado, se obtienen predicciones más apegadas a lo obtenido con los registros de cada una. Además de la evidente diferencia cualitativa en tamaño y forma entre ambas predicciones, no es posible distinguir entre los requerimientos ambientales particulares de cada especie, así como el potencial impacto del cambio climático sobre su distribución (Romero, Olivero, Márquez, Báez & Real, 2014).
Asumiendo la dinámica espacial en la distribución de una especie, principalmente como producto de variaciones ambientales, respuestas demográficas y transformaciones en la geografía, es importante considerar el momento en el cual se realiza una aproximación a la distribución, es decir, "el factor tiempo". Si bien, la distribución geográfica de una especie no se transforma significativamente al paso de unos días, se pueden evidenciar algunas diferencias al contrastar la distribución a lo largo del tiempo, tanto evolutivo como ecológico; por ejemplo, entre la distribución actual y la distribución de décadas pasadas, o incluso con la distribución en el pasado a partir del registro fósil (Fortin et al. , 2005). Por tal motivo debe existir congruencia entre los datos contemplados para un trabajo y el momento en el cual se plantea explorar un determinado problema; es decir, no se puede analizar la distribución actual de una especie con datos que corresponden a otro momento, ya sea un conjunto de años previo a un evento que modificó la composición ambiental del lugar, o bien, de otro tiempo geológico (Arundel, 2002).
En cuestiones de temporalidad, es prudente considerar el fenómeno de la migración, ya que, a nivel poblacional, conlleva la posibilidad de intercambios temporales de individuos provenientes de una o varias poblaciones. Estos cambios pueden ser motivados por un descenso en la temperatura invernal, disponibilidad fluctuante de alimento o confluencia de individuos en cierta fase reproductora para búsqueda de parejas. Durante la estancia temporal suelen presentarse algunos eventos reproductivos, particularmente el apareamiento o la crianza de los neonatos (Dingle & Drake, 2007). Esta ausencia/presencia temporal de las especies migratorias debe manejarse con especial atención en el momento de caracterizar su área de distribución. Generalmente las zonas donde los organismos buscan refugios invernales, no reproductivos o de crianza, se excluyen como parte de la distribución de la especie (Zunino & Zullini, 2003).
Los factores temporales cobran mayor importancia cuando se considera la "escala" de revisión de una distribución. Un análisis muy fino estaría registrando a cada individuo dentro de una porción del área total de distribución, visualizando aspectos como la etología del organismo, el uso de percha, ámbito hogareño, etcétera, lo cual se convertiría en "uso de hábitat" más que en distribución (Chave, 2013). Por otro lado, si el análisis se realiza desde una resolución más gruesa, se podrían analizar aspectos poblacionales más apropiados para revisar la distribución como fenómeno (Guisan & Zimmermann, 2000; Hengeveld, 1987; Wiens, 1989).
Patrones del área de distribución
Una vez contemplados y superados los retos que ofrecen los factores mencionados anteriormente (bidimensionalidad, confiabilidad, tiempo y escala), es posible aproximarse a describir los patrones de distribución de las especies.
Tamaños del área de distribución
El tamaño del área de distribución de una especie está directamente relacionado con el tamaño de su ámbito hogareño, el cual resulta de las interacciones entre el ambiente y el entendimiento del mismo (mapa cognitivo) por parte de algún organismo, particularmente animales, lo que puede definirse como el conocimiento que un individuo posee de su entorno y que decide recorrer para realizar sus actividades normales como la búsqueda de alimento, apareamiento o cuidado de las crías (Powell & Mitchell, 2012). Entender el ámbito hogareño de las especies facilita la comprensión de la compleja relación que existe entre la densidad poblacional y la distribución individual de una especie animal, ya que tiene consecuencias fundamentales en varios procesos ecológicos, como la regulación poblacional, selección de hábitat, dinámicas presa-depredador y la estructura de las comunidades, procesos que indudablemente repercuten sobre el área de distribución de los animales (Börger, Dalziel & Fryxell, 2008).
En la relación ámbito hogareño/área de distribución, Brown et al. (1996) han descrito dos vertientes. La primera, que el tamaño del área de distribución de una especie es muy similar al tamaño de su ámbito hogareño y que, en consecuencia, están constituidas por una población única. Esta situación puede presentarse en dos grupos de especies: 1) aquellas con amplia movilidad, como algunos peces pelágicos, aves marinas o ballenas, por ejemplo, el del rorcual azul Balaenoptera musculus brevicauda (Branch et al., 2007), subespecie que presenta una distribución continua localizada alrededor de la Antártida, con una magnitud de varios miles de kilómetros; 2) aquellas especies con ámbitos hogareños muy pequeños y, en consecuencia, con una distribución muy limitada, por ejemplo, el pez ciprinodóntido Cyprinodon diabolis, endémico del "agujero del Diablo", en el Parque Nacional del Valle de la Muerte, Nevada, Estados Unidos de América, que cuenta con un área de distribución de menos de 100 m2 (Miller, 1948), o como el caso de varias especies de milpiés de la clase Diplopoda, las cuales suelen presentar áreas de distribución altamente restringidas, siendo con frecuencia endémicas de cuevas, montañas, valles o islas (Golovatch & Kime, 2009).
La segunda vertiente propuesta por Brown et al. (1996) refiere que el área de distribución de una especie es muchas veces mayor al ámbito hogareño, tal como sucede con la mayoría de los mamíferos, saurópsidos, anfibios y peces (Powell & Mitchell, 2012). Como ejemplo, se puede citar el caso del ratón mexicano de los volcanes, Neotomodon alstoni, especie que tiene una distribución a lo largo del eje volcánico transmexicano, pero un ámbito hogareño de apenas 0.0032 km2 (Canela-Rojo & Sánchez-Cordero, 1984).
Un análisis de las dimensiones de las áreas de distribución al interior de un clado de especies filogenéticamente cercanas permite visualizar: i) que la mayoría de las especies presentan áreas de distribución restringidas, mientras que las especies que poseen un área de distribución amplia son pocas; ii) que las áreas de distribución son similares en aquellas especies filogenéticamente cercanas (Brown, 2003).
Otro patrón encontrado en las áreas de distribución está en función de la masa corporal de los individuos, principalmente en vertebrados, de modo que a mayor masa corporal de la especie, su área de distribución tiende a incrementarse (Brown et al., 1996). Por ejemplo, en mamíferos se ha encontrado que la relación es mayor en carnívoros que en omnívoros y herbívoros; algo similar ha sido reportado en aves, es decir, que la relación entre la masa corporal y el área de distribución es mayor en aves carnívoras que en herbívoras (Harestad & Bunnel, 1979).
Finalmente, si se considera la ubicación geográfica de las áreas de distribución, es posible observar un par de tendencias. La primera se refiere a su ubicación con respecto a la latitud; bajo este entendido, Stevens (1989) señala que el área de distribución de una especie es mayor conforme se va localizando a latitudes más altas, relación que se presenta en muchos grupos taxonómicos del centro y norte de América (plantas, moluscos marinos, peces costeros y de agua dulce, anfibios, escamados y mamíferos). Una de las explicaciones que Stevens (1989) ofrece es la influencia de las variaciones climáticas, en el sentido de que a mayor latitud mayores son los intervalos de los regímenes climáticos a lo largo del año (estacionalidad); por lo tanto, las grandes áreas de distribución de las especies localizadas en altas latitudes son una consecuencia de una ventaja selectiva de aquellos individuos con una gran tolerancia climática, necesaria para la explotación exitosa de dichos lugares. Por el contrario, en las especies tropicales o cercanas al Ecuador, una amplia tolerancia climática no le representa una ventaja mayor. Apunta, además, que en los trópicos el conjunto de condiciones climáticas y los cambios de microhábitats son muy variables en espacios relativamente pequeños (espacio ecológico), es decir, no existe el suficiente espacio físico para soportar una gran población con una tolerancia micro-climática; por lo tanto, las especies que habitan altas latitudes tienen una menor restricción en el uso del hábitat, y en consecuencia su distribución puede tener una mayor extensión que las especies de bajas latitudes.
La segunda tendencia sobre la ubicación de las áreas de distribución se refiere a la localización de las especies con relación a la altitud, de tal forma que aquellas especies que se localizan en altitudes mayores presentan un área de distribución menor y, por el contrario, las especies localizadas en altitudes bajas poseen un área de distribución mayor, tendencia registrada para distintos grupos taxonómicos como plantas, mamíferos, saurópsidos, insectos y anfibios distribuidos en centro y norte América (Stevens, 1992). Esto puede ser explicado porque el área habitable disponible en las zonas de menor altitud es mayor, pero, además, es posible que esté en combinación con el mismo fenómeno que ocurre en el patrón de "área de distribución/latitud" (Stevens, 1989); es decir, existe una variabilidad en la amplitud de las condiciones climáticas en un intervalo altitudinal, de manera que en altitudes mayores los intervalos en los regímenes climáticos se incrementan pero con una superficie espacial menor (espacio geográfico), sitios donde la selección nuevamente favorece a aquellas especies que pueden explotar con éxito dichas condiciones climáticas.
Formas del área de distribución
En muy pocas ocasiones los organismos presentan una distribución continua en la totalidad de su área de distribución. La mayoría de las especies están constituidas por una serie de poblaciones discontinuas con gradientes de interconexión, que va desde poblaciones completamente aisladas hasta poblaciones panmíticas, donde todos los individuos tienen la capacidad de entrecruzarse dentro y entre poblaciones. El nivel intermedio de flujo génico está representado por una dinámica metapoblacional (Sánchez-Rojas & Gallina, 2007) (figura 3). En la periferia, las poblaciones tienden a estar más aisladas con respecto a las poblaciones centrales (Brown, 1984). Una distribución continua hace referencia a la ausencia de una interrupción espacial donde el flujo génico entre todos los individuos es posible, por lo que puede ser considerada como una sola población; esta distribución es típica de especies de origen reciente (Webb & Gaston, 2000) o con ámbito hogareño amplio, por ejemplo Balaenoptera musculus brevicauda (Branch et al., 2007). En distribución discontinua existe una división espacial que genera un intercambio condicionado de genes, de tal modo que a menor distancia entre los parches mayor es el flujo génico, a mayor movilidad de los organismos menor es la diferenciación entre poblaciones, a mayor tiempo de intercambio mayor es la similitud en frecuencias fenotípicas y alélicas de las poblaciones (Avise, 2004). Por último, en la distribución disyunta referida a poblaciones tan distantes que la posibilidad de flujo génico es limitada o nula, las diferencias en la composición genética dan lugar a especiación incipiente o una estructura genética poblacional significativa. Todo esto con relación al flujo génico, distancias de dispersión, movilidad, tamaño de los organismos, barreras geográficas y al tiempo que las poblaciones han permanecido aisladas (Scoble & Lowe, 2010).
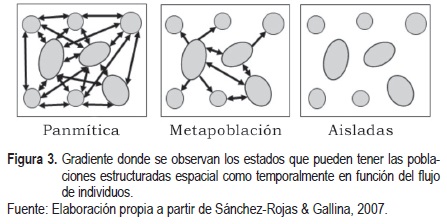
Los límites del área de distribución
Anteriormente se han mencionado los aspectos que determinan la presencia o ausencia de las especies sobre el espacio geográfico, aunque es importante señalar que los límites de las áreas nunca son estáticos, en cada zona constantemente ocurren avances y retrocesos evidentes, incluso en el tiempo ecológico, por lo que se consideran extremadamente dinámicos. Esto se debe a que en las zonas de frontera la especie experimenta condiciones menos favorables para su tolerancia, y resultan ser los lugares con las presiones bióticas más altas (Holt & Keitt, 2005; Kirkpatrick & Barton, 1997).
Darwin (1859) fue el primero en reunir evidencia para argumentar que los límites del área de distribución de las especies varían latitudinalmente en función de los cambios en los factores bióticos y abióticos. A partir de esas observaciones otros autores han profundizado en la exploración de los fenómenos que limitan las áreas de distribución de las especies. Por ejemplo, Dobzhansky (1950) ha propuesto que los factores que delimitan el área de distribución de las especies en latitudes tropicales corresponden a las interacciones bióticas, principalmente la depredación y la competencia. Esto es posible si se contempla que las condiciones climáticas en estas zonas son más estables, mientras que las interacciones bióticas son más fuertes y diversas en este tipo de ambientes. Por otro lado, Mac Arthur (1972) señala que en latitudes altas los límites del área de distribución corresponden a la interacción con factores abióticos, en particular las restricciones fisiológicas y el estrés físico, ya que los intervalos en los regímenes climáticos son más amplios y las interacciones bióticas son reducidas dada la baja diversidad biológica registrada en estas zonas. Es evidente la existencia de una mayor amplitud de las variables climáticas en latitudes templadas, lo cual se traduce en un estrés fisiológico para las especies de estas zonas; con ello se ve afectada la adecuación de los organismos, situación que generalmente se ve contrarrestada con adaptaciones, mismas que requieren un gasto energético importante (Kaufman, 1995).
Actualmente, las especies no sólo se distribuyen donde históricamente han evolucionado, sino que existen algunas que han colonizado sitios diferentes como consecuencia de superar tanto las barreras o los accidentes geográficos, así como las grandes distancias que les impedían acceder a otros lugares propicios para sí mismas. Uno de los ejemplos que demuestran esta situación es el caso de las especies invasoras no nativas, especialmente cuando la invasión se deriva de alguna actividad antropogénica (Baldo et al., 2008), o bien, de algún evento meteorológico extremo (Low, 2008). Se sabe que algunas especies de peces exóticos invaden nuevos sitios durante ciclones o inundaciones producto de lluvias atípicas (Low, 1999), como en el caso de la carpa Cyprinus carpo, que en 1974 expandió su área de distribución en el sureste de Australia, resultado de las inundaciones que ocurrieron en ese año (Low, 2008).
¿Cómo estimar el área de distribución de una especie?
Uno de los pasos más importantes en el momento de estudiar las áreas de distribución de las especies se refiere a la elección del método con el cual se va a construir una propuesta de este tipo. Los métodos para delimitar el espacio donde se distribuye una especie han cambiado significativamente (figura 4), llegando incluso a desarrollar modelos para explorar teorías ecológicas (Austin, 2002). La complicación mayor en ellos está en definir los límites del área de distribución; es importante señalar que una nube de puntos sobre un mapa, que refieren a las localidades donde se ha registrado a una especie tal, no representa su área de distribución (Mota-Vargas & Rojas-Soto, 2012). Originalmente, las áreas de distribución se construían en un mapa tomando como referencia la localización de registros puntuales y trazando polígonos alrededor de ellos, de manera que se generaban mapas dicotómicos donde se indicaba directamente la ausencia o presencia de la especie en cuestión (Rapoport, 1975; Zunino & Zullini, 2003). Algunos ejemplos son el método de mano alzada o el método areográfico (figura 4). Hoy en día, los avances tecnológicos computacionales, el desarrollo de sistemas de información geográfica, así como la facilidad de acceso a bases de datos (por ejemplo, Global Biodiversity Information Facilities [GBIF]), han permitido el desarrollo de métodos de modelación de la distribución de las especies con mayor detalle (Guisan & Thuiller, 2005).
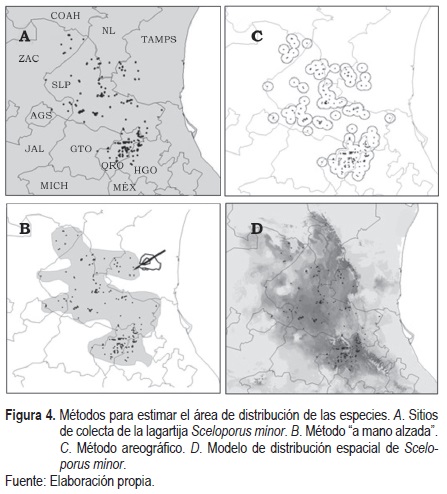
Uno de los métodos más recientes para determinar las áreas de distribución son los llamados modelos de distribución de las especies (Mateo, Felicísimo & Muñoz, 2011) o conocidos también como modelos de nicho ecológico (Peterson, 2001), por estar basados en este concepto propuesto por Hutchinson (1957). En lo general, los modelos de distribución de las especies son una representación cartográfica de la idoneidad ambiental para una especie (Guisan & Zimmermann, 2000) (figura 4d). A pesar de la gran variedad de algoritmos utilizados en la construcción de modelos de distribución, la mayoría sigue un método muy similar: se utilizan registros puntuales de presencia/ausencia de una especie, se incluye además información de variables de tipo climáticas o ambiental y mediante algún algoritmo o criterio se delimita el área de distribución con base en la información derivada del área conocida (registros puntuales), o bien, de la relación que existe entre dichos registros y las variables climáticas o ambientales asociadas a dichos puntos, de esta relación se pueden pronosticar sitios que pueden representar potencialmente la distribución de una especie (Peterson, 2001).
Los modelos de distribución potencial pueden ser divididos en dos grandes grupos, diferenciados por los métodos de obtención de la información. Por un lado, existen los modelos probabilísticos, basados en el remuestreo sistemático de los datos para inferir la probabilidad de ocurrencia de una especie sobre el espacio geográfico. Una de las técnicas que se han utilizado para construir este tipo de propuestas son los modelos de Montecarlo, basados en Cadenas de Markov (Sargeant, Sovada, Slivinski & Johnson, 2005; Wu & Huffer, 1997). Por otro lado, los modelos multivariados se construyen a partir de registros eventuales de una especie. De acuerdo con Mateo et al. (2011), este tipo de técnicas se subdividen, a su vez, en: i) técnicas descriptivas: que solamente utilizan datos de presencia e información geográfica o climática, en muchas de ellas utilizan algoritmos matemáticos, y como ejemplos de estas técnicas se encuentran BIOCLIM (Busby, 1986), DOMAIN (Walker & Cocks, 1991) o Expectation Maximization (EM) (Ward, Hastie, Barry, Elith & Leathwick, 2008); ii) técnicas discriminantes: son aquéllas que construyen modelos a partir de datos de presencia y ausencia de las especies, todas utilizan algoritmos matemáticos para obtener un clasificador que representa directa o indirectamente la idoneidad de un sitio para la presencia de una especie en función de la información climática o ambiental de los sitios registrados; como ejemplos de este tipo de técnicas están los algoritmos Classification and Regression Trees (CART) (Breiman, Freidman, Olshen & Stone, 1984), Canonical Correspondence Analysis (CCA) (Guisan, Weiss & Weiss, 1999), Artificial Neural Network (ANN) (Pearson, Dawson, Berry & Harrison, 2002), Multivariate Adaptative Regression Splines (MARS) (Friedman, 1991), Support Vector Machines (SVM) (Vapnik, 1995), GAM (Hastie & Tibshirani, 1986), y MaxEnt (Phillips, Anderson & Schapire, 2006); y, iii) técnicas mixtas: son aquéllas que emplean tanto algoritmos descriptivos como discriminantes (aunque también pueden generar sus propias pseudo-ausencias). Además, realizan modelos iterativos para obtener un modelo de consenso; las técnicas de este tipo más empleadas son Desktop-Genetic Algorithm for Ruleset Predictions (GARP) (Stockwell & Peters, 1999) y Open Modeller-Genetic Algorithm for Ruleset Predictions (OM-GARP) (Elith et al., 2006).
Uno de los problemas al calcular el área de distribución de una especie con modelos multivariados a partir de atributos ambientales, es que ocasionalmente la predicción que se obtiene (nicho fundamental) resulta mayor o menor a la distribución verdadera (nicho realizado); es decir, algunos algoritmos tienden a sobre-predecir los modelos, mientras otros tienden a sobre-ajustarlos (Soberón & Peterson, 2005). Debido a esta problemática, se recomienda que al momento de ubicar áreas donde se predice la presencia de la especie, pero sin registros dentro o cercanos, se realice la corroboración en campo; de esta forma su interpretación tendrá mejores resultados que si sólo se generalizara el modelo de manera automática. Todos estos modelos de estimación han resultado útiles para abordar problemáticas de conservación (Martínez-Meyer, Peterson, Servín & Kiff, 2006), cambio climático (Anderson, 2013), biogeografía (Raxworthy et al., 2003) o del sector salud (Haverkost, Gardner & Peterson, 2010) para áreas concretas.
CONCLUSIÓN
La distribución de las especies como fenómeno dinámico espacio-temporal
El área de distribución es un atributo que resume la historia evolutiva, ecológica y las necesidades fisiológicas de una especie. Evidentemente, el concepto siempre polémico de especie está ligado al de distribución geográfica. La aproximación del concepto de especie propuesta por De Queiroz (2007) resulta ser un elemento integrador, pues incluye de forma parcial la idea de la distribución al mencionar que las especies son linajes de metapoblaciones, lo que incluye necesariamente la dimensión espacial, pues las poblaciones que la componen deben estar localizadas en el espacio geográfico, y la dimensión temporal al considerar que son linajes que han evolucionado de forma paulatina. Adicionalmente, el análisis del área de distribución puede ayudar a delimitar si se está hablando de una o más especies. Sin duda, los avances tecnológicos generan modelos para la distribución de las especies, asunto que, a su vez, permite un crecimiento acelerado de este campo, abriendo las puertas a una nueva rama de las ciencias: la biogeografía predictiva (Lavergne, Mouquet, Thuiller & Ronce, 2010). Sin embargo, es necesario definir estos modelos como herramientas, más que resultados de un algoritmo, con un propósito concreto.
AGRADECIMIENTOS
Los autores agradecen al Posgrado en Ciencias en Biodiversidad y Conservación de la Universidad Autónoma del Estado de Hidalgo (UAEH) y al Consejo Nacional de Ciencia y Tecnología (Conacyt) por la beca otorgada a Carlos Maciel Mata para estudios de Doctorado (360257). También se extiende un agradecimiento a un par de revisores anónimos cuyas sugerencias contribuyeron a mejorar sustancialmente el manuscrito. Finalmente, se agradece al Proyecto Fomix-Conacyt-Hidalgo 2012-01191908 "Diversidad Biológica del estado de Hidalgo" (tercera etapa).
REFERENCIAS
Alba-López, M. P., González-Espinosa, M., Ramírez-Marcial, N. & Castillo-Santiago, M. A. (2003). Determinantes de la distribución de Pinus spp. en la altiplanicie central de Chiapas, México. Boletín de la Sociedad Botánica de México, 73, 7-15. [ Links ]
Anderson, S. (1985). The theory of range-size (RS) distribution. American Museum Novitates, 2833, 1-20. [ Links ]
Anderson, R. P. (2013). A framework for using niche models to estimate impacts of climate change on species distribution. Annals of the New York Academy of Sciences, 1297, 8-28. doi: 10.1111/nyas.12264 [ Links ]
Arroyo, J., Carrión, J. S., Hampe, A. & Jordano, P. (2004). La distribución de las especies a diferentes escalas espacio-temporales. En F. Valladares (Ed.), Ecología del bosque mediterráneo en un mundo cambiante (pp. 27-67). Madrid: Ministerio de Medio Ambiente, EGRAF. [ Links ]
Arundel, S. T. (2002). Modelling climate limits of plants found in Sonoran Desert packrat middens. Quaternary Research, 58(2), 112-121. doi:10.1006/qres.2002.2349 [ Links ]
Austin, M. P. (2002). Spatial prediction of species distribution: an interface between ecological theory and statistical modelling. Ecological Modelling, 157(2-3), 101-118. [ Links ]
Avise, J. (2004). Molecular markers, natural history and evolution. Sunderland: Sinauer Associate Press. [ Links ]
Baldo, D., Borteiro, C., Brusquetti, F., García, J. E. & Prigioni, C. (2008). Reptilia, Gekkonidae, Hemidactylus mabouia, Tarentola mauritanica: Distribution extension and anthropogenic dispersal. Check List, 4(4), 434-438. [ Links ]
Ballesteros Barrera, C. (2008). Efecto del cambio climático global en la distribución de especies del desierto chihuahuense (tesis de doctorado). Universidad Nacional Autónoma de México: México. [ Links ]
Beebee, T. J. C. (1995). Amphibian breeding and climate. Nature, 374, 219-220. [ Links ]
Beehler, B. & Pruett-Jones, S. G. (1983). Display dispersion and diet of birds of paradise: a comparison of nine species. Behavioral Ecology and Sociobiology, 13(3), 229-238. [ Links ]
Bórger, L., Dalziel, B. D. & Fryxell, J. M. (2008). Are there general mechanisms of animal home range behaviour? A review and prospects for future research. Ecology Letters, 11 (6), 637-650. doi: 10.1111/j.1461-0248.2008.01182.x [ Links ]
Branch, T. A., Stafford, K. M., Palacios, D. M., Allison, C., Bannister, J. L., Burton, C. L. K., Cabrera, E., Carlson, C. A., Galletti-Vernazzani, B., Gill, P. C., Hucke-Gaete, R., Jenner, K. C. S., Jenner, M. N. M., Matsuoka, K., Mikhalev, Y. A., Miyashita, T., Morrice, M. G., Nishiwaki, S., Sturrock, V. J., Tormosov, D., Anderson, R. C., Baker, A. N., Best, P. B., Borsa, P., Brownell Jr., R. L., Childerhouse, S., Findlay, K. P., Gerrodette, T., Ilangakoon, A. D., Joergensen, M., Kahn, B., Ljungblad, D. K., Maughan, B., McCauley, R. D., McKay, S., Norris, T. F., Oman-Whale and Dolphin Research Group, Warneke, R. M., Rankin, S., Samaran, F., Thiele, D. & Van Waerebeek, K. (2007). Past and present distribution, densities and movements of blue whales Balaenoptera musculus in the Southern Hemisphere and northern Indian Ocean. Mammal Review, 37(2), 116-175. doi: 10.1111/j.1365-2907.2007.00106.x [ Links ]
Breiman, L., Friedman, F., Olshen, R. & Stone, C. (1984). Classification and regression trees. Pacific Grove: Wadsworth and Brooks. [ Links ]
Bridle, J. R. & Vines T. H. (2006). Limits to evolution at range margins: when and why does adaptation fail? Trends in Ecology and Evolution, 22(3), 140-147. doi:10.1016/j.tree.2006.11.002 [ Links ]
Broennimann, O., Thuiller, W., Hughes, G. O., Midgley, G. F., Alkemade, J. R. M. & Guisan, A. (2006). Do geographic distribution, niche property and life form explain plants' vulnerability to global change? Global Change Biology, 12(6), 1079-1093. doi: 10.1111/j.1365-2486.2006.01157.x [ Links ]
Brown, J. H. (1984). On the relationship between abundance and distribution of species. The American Naturalist, 124(2), 255-279. [ Links ]
Brown, J. H. (2003). Macroecología. México: Fondo de Cultura Económica. [ Links ]
Brown, J. H., Stevens, G. C. & Kaufman, D. M. (1996). The geographic range: size, shape, boundaries, and internal structure. Annual Review of Ecology, Evolution and Sistematics, 27, 597-623. [ Links ]
Brown, J. H. & Lomolino, M. V. (1998). Biogeography. Sunderland: Sinauer Associates, Inc. Publishers. [ Links ]
Brown, D. E. & López, G. C. A. (2001). Borderland Jaguars. Utah: The University of Utah Press. [ Links ]
Busby, J. R. (1986). Bioclimate prediction system (BIOCLIM). User's manual version 2.0. Canberra: Australian Biological Resources. [ Links ]
Canela-Rojo, M. A. & Sánchez-Cordero, V. (1984). Patrón del área de actividad de Neotomodon a. alstoni (Rodentia: Cricetinae). Anales del Instituto de Biología serie Zoología, 55(2), 285-306. [ Links ]
Cartan, M. (1978). Inventaires et cartographies de répartition d'espéces: faune et flore. París: CNRS. [ Links ]
Carranza, S. & Amat, F. (2005). Taxonomy, biogeography and evolution of Euproctus (Amphibia: Salamandridae), with the resurrection of the genus Calotriton and the description of a new endemic species from the Iberian Peninsula. Zoological Journal of the Linnean Society, 145(4), 555-582. [ Links ]
Chave, J. (2013). The problem of pattern and scale in ecology: what have we learned in 20 years? Ecology Letters, 16(1), 1-13. doi: 10.1111/ele.12048 [ Links ]
Cracraft, J. (1983). Species concept and speciation analysis. Current Ornithology, 1, 159-187. [ Links ]
Darwin, C. (1859). On the origins of species by means of natural selection. London: Murray. [ Links ]
De Candolle, A. P. (1855). Géographie botanique raisonnée: ou, Exposition des faits principaux et des lois concernant la distribution géographique des plantes de lépoque actuelle. París: V. Masson. [ Links ]
De Queiroz, K. (2005). Different species problems and their resolution. BioEssays, 27, 1263-1269. [ Links ]
De Queiroz, K. (2007). Species concepts and species delimitation. Systematic Biology, 56(6), 879-886. doi: 10.1080/10635150701701083 [ Links ]
Dingle, H. & Drake, V. A. (2007). What is migration? BioScience, 57(2), 113-121. [ Links ]
Dobzhansky, T. (1950). Evolution in the tropics. American Scientist, 38, 209-221. [ Links ]
Donoghue, M. J. (1985). A critique of the biological species concept and recommendations for a phylogenetic alternative. The Bryologist, 88(3), 172-181. [ Links ]
Dorda, J. & Esteban, M. (1986). Evolution and subspeciation of Iberian Triturus marmoratus. En Z. Rocek (Ed.), Studia Herpetologica (pp. 159-164). Prague: Charles University. [ Links ]
Elith, J., Graham, C. H., Anderson, R. P., Dudík, M., Ferrier, S., Guisan, A., Hijmans, R. J., Huettmann, F., Leathwick, J. R., Lehmann, A., Li, J., Lohmann, L. G., Loiselle, B. A., Manion, G., Moritz, C., Nakamura, M., Nakazawa, Y., Overton, J. McC., Peterson, A. T., Phillips, S. J., Richardson, K. S., Scachetti-Pereira, R., Schapire, R. E., Soberón, J., Williams, S., Wisz, M. S. & Zimmermann, N. E. (2006). Novel methods improve prediction of species' distributions from occurrence data. Ecography, 29(2), 129-151. [ Links ]
Encina, D. J. A. & Villarreal, Q. J. A. (2002). Distribución y aspectos ecológicos del género Quercus (Fagaceae), en el estado de Coahuila, México. Polibotánica, 13, 1-23. [ Links ]
Foden, W., Midgley, G. F., Hughes, G., Bond, W. J., Thuiller, W., Hoffman, M. T., Kaleme, P., Underhill, L. G., Rebelo, A. & Hannah. L. (2007). A changing climate is eroding the geographical range of the Namib Desert tree Aloe through population declines and dispersal lags. Diversity and Distributions, 13(5), 645-653. doi: 10.1111/j.1472-4642.2007.00391.x [ Links ]
Fortin, M. J., Keitt, T. H., Maurer, B. A., Taper, M. L., Kaufman, D. M. & Blackburn, T. M. (2005). Species' geographic range and distributional limits: pattern analysis and statistical issues. Oikos, 108(1), 7-17. [ Links ]
Frankham, R., Ballou, J. D., Dudash, M. R., Eldridge, M. D. B., Fenster, C. B., Lacy, R. C., Mendelson, J. R., Porton, I. J., Ralls, K. & Rider, O. A. (2012). Implications of different species concepts for conserving biodiversity. Biological Conservation, 153, 25-31. doi:10.1016/j.biocon.2012.04034 [ Links ]
Friedman, J. H. (1991). Multivariate adaptive regression splines. Annals of Statistics, 19, 1-141. [ Links ]
García-París, M., Arano, B. & Herrero, P. (2001). Molecular characterization of the contact zone between Triturus pygmaeus and T. marmoratus (Caudata: Salamandridae) in central Spain and their taxonomic assessment. Revista Española de Herpetología, 15, 115-126. [ Links ]
Gaston, K. J. (1996a). Species range size distribution: patterns, mechanism and implications. Trends in Ecology and Evolution, 11(5), 197-200. [ Links ]
Gaston, K. J. (1996b). The multiple forms of the interspecific abundance - distribution relationships. Oikos, 76(2), 211-220. [ Links ]
Gaston, K. J. & Blackburn, T. M. (2002). Large scale dynamics in colonization and extinction for breeding birds in Britain. Journal of Animal Ecology, 71(3), 390-399. [ Links ]
Good, R. D. (1931). A theory of plant geography. The New Phytologist, 30, 149-171. [ Links ]
Golovatch, S. I. & Kime, R. D. (2009). Millipede (Diplopoda) distributions: A review. Soil Organisms, 81(3), 565-597. [ Links ]
Grinnell, J. (1917). The niche-relationships of the California Thrasher. Auk, 34, 427-433. [ Links ]
Gutiérrez, J., Krenz, J. D. & Ibargüengoytia, N. I. (2010). Effect of altitude on thermal responses of Liolaemus pictus argentines in Argentina. Journal of Thermal Biology, 35, 332-337. doi:10.1016/j.jtherbio.2010.07.001. [ Links ]
Guisan, A., Weiss, S. B. & Weiss, A. D. (1999). GLM versus CCA spatial modeling of plant species distribution. Plant Ecology, 143, 107-122. [ Links ]
Guisan, A. & Zimmermann, N. E. (2000). Predictive habitat distribution model in ecology. Ecological Modelling, 135, 147-186. [ Links ]
Guisan, A. & Thuiller, W. (2005). Predicting species distribution: offering more than simple habitat models. Ecology Letters, 8(9), 993-1009. doi: 10.1111/j.1461-0248.2005.00792.x. [ Links ]
Hall, E. R. (1981). The mammals of North America. New York: John Wiley and Sons. [ Links ]
Hanski, I. (1982). Dynamics of regional distribution: the core and satellite species hypothesis. Oikos, 38, 210-221. [ Links ]
Harestad, A. S. & Bunnel, F. L. (1979). Home range and body weight: A reevaluation. Ecology, 60, 389-402. [ Links ]
Hastie, T. & Tibshirani, R. (1986). Generalized additive models. Statistical Sciences, 1(3), 297-318. [ Links ]
Haverkost, T. R., Gardner, S. L. & Peterson, A. T. (2010). Predicting the distribution of a parasite using the ecological niche modeling, GARP. Revista Mexicana de Biodiversidad, 81, 895-902. [ Links ]
Hellmann, J. J., Byers, J. E., Bierwagen, B. G. & Dukes, J. S. (2008). Five potential consequences of climate change for invasive species. Conservation Biology, 22(3), 534-543. doi:10.1111/j.1523-1739.2008.00951.x. [ Links ]
Hengeveld, R. (1987). Scales of variation: their distribution and ecological importance. Annales Zoologici Fennici, 24, 195-202. [ Links ]
HilleRisLambers, J., Harsch, M. A., Ettinger, A. K., Ford, K. R. & Theobald, E. J. (2013). How will biotic interactions influence climate change-induced range shifts? Annals of the New York Academic of Science, 1297, 112-125. doi: 10.1111/nyas.12182. [ Links ]
Holt, R. D. (1990). The microevolutionary consequences of climate change. Trends in Ecology and Evolution, 5(9), 311-315. [ Links ]
Holt, R. D. (2003). On the evolutionary ecology of species' range. Evolutionary Ecology Research, 5, 159-178. [ Links ]
Holt, R. D. & Keitt, T. H. (2005). Species' borders: a unifying theme in ecology. Oikos, 108, 3-6. [ Links ]
Huey, R. B. (1982). Temperature, physiology, and the ecology of reptiles. En C. Gans & F. H. Pough (Eds.), Biology of reptilian (pp. 25-91). London: Academic Press. [ Links ]
Huey, R. B. & Stevenson, R. D. (1979). Integrating thermal physiology and ecology of ectotherms: a discussion of approaches. American Zoology, 19, 357-366. [ Links ]
Huntley, B., Berry, P. M., Cramer, W. & Mcdonald, A. P. (1995). Modelling present and potential future ranges of some European higher plants using climate response surfaces. Journal of Biogeography, 22(6), 967-1001. [ Links ]
Hutchinson, G. E. (1957). Concluding remarks. Cold Spring Harbor Symposia of Quantitative Biology, 22, 415-427. [ Links ]
Intergovernmental Panel on Climate Change (IPCC) (2007). Climate change 2007: The Physical Science Basis. Contribution of working group I to the Fourth Assessment Report of the Intergovernmental Panel on Climate Change. Cambridge: Cambridge University Press. [ Links ]
Kaufman, D. M. (1995). Diversity of New World Mammals: Universality of the latitudinal gradients of species and Bauplans. Journal of Mammalogy, 76(2), 322-334. [ Links ]
Kirkpatrick, M. & Barton, N. H. (1997). Evolution of a species' range. The American Naturalist, 150(1), 1-23. [ Links ]
Lavergne, S., Mouquet, N., Thuiller, W. & Ronce, O. (2010). Biodiversity and climate change: Integrating evolutionary and ecological responses of species and communities. Annual Review of Ecology, Evolution and Systematics, 41, 321-350. doi: 10.1146/annurev-ecolsys-102209-144628. [ Links ]
Lester, S. E., Ruttenberg, B. I., Gaines, S. D. & Kinlan, B. P. (2007). The relationship between dispersal ability and geographic range size. Ecology Letters, 10(8), 745-758. doi: 10.1111/j.1461-0248.2007.01070.x. [ Links ]
Logan, J. A. & Powell, J. A. (2001). Ghost forest, global warming and the mountain pine beetle (Coleoptera: Scolytidae). American Entomologist, 47(3), 160-172. [ Links ]
Low, T. (1999). Feral Future: the untold story of Australia's exotic invaders. Chicago: University of Chicago Press. [ Links ]
Low, T. (2008). Climate change and invasive species: a review of interactions. Canberra: Biological Diversity Advisory Committee. [ Links ]
Lujan, I. P. (1980). Geographic distribution of the genus Yucca. Cactus and Succulent Journal, 52(6), 277-281. [ Links ]
Mac Arthur, R. H. (1972). Geographical Ecology. Patterns in the distribution of species. New York: Harper and Row. [ Links ]
Maguire Jr., B. (1973). Niche response structure and the analytical potentials of its relationships to the habitat. American Naturalist, 107(954), 213-246. [ Links ]
Martínez-Meyer, E., Díaz-Porras, D., Peterson, A. T. & Yáñez-Arenas, C. (2013). Ecological niche structure and rangewide abundance patterns of species. Biology Letters, 9. [ Links ]
Martínez-Meyer, E., Peterson, A. T., Servín, J. I. & Kiff, L. F. (2006). Ecological niche modelling and prioritizing areas for species reintroductions. Oryx, 40(4), 411-418. doi:10.1017/S0030605306001360. [ Links ]
Mateo, G. R., Felicísimo, A. M. & Muñoz, J. (2011). Modelos de distribución de las especies: una revisión sintética. Revista Chilena de Historia Natural, 84(2), 217-240. [ Links ]
Mayr, E. (1942). Systematics and the origin of the species. New York: Columbia University Press. [ Links ]
McCain, C. M. (2010). Global analysis of reptile elevational diversity. Global Ecology and Biogeography, 19, 541-553. [ Links ]
McGill, B. J., Enquist, B. J., Weiher, E. & Westoby, M. (2006). Rebuilding community ecology from functional traits. Trends in Ecology and Evolution, 21(4), 178-185. doi:10.1016/j.tree.2006.02.002. [ Links ]
Milesi, F. A. & López, C. L. (2005). El concepto de nicho ecológico en ecología aplicada: del nicho al hecho hay mucho trecho. Ecología Austral, 15(2), 131-148. [ Links ]
Miller, R. R. (1948). The cyprinodont fishes of The Death Valley system of eastern California and southwestern Nevada. Miscellaneous Publications of the Museum of Zoology University of Michigan, 68, 1-155. [ Links ]
Mota-Vargas, C. & Rojas-Soto, O. R. (2012). The importance of defining the geographic distribution of species for conservation: The case of the bearded wood-partridge. Journal of Nature Conservation, 20(1), 10-17. doi:10.1016/j.jnc.2011.07.002. [ Links ]
Myneni, R. B., Keeling, C. D., Tucker, C. J., Asrar, G. & Nemani, R. R. (1997). Increased plant growth in the northern high latitudes from 1981 to 1991. Nature, 386, 698-702. [ Links ]
Noguera-Urbano, E. A. & Escalante, T. (2014). Datos geográficos de los murciélagos (Chiroptera) en el Neotrópico. Revista de Biología Tropical, 62(1), 201-215. [ Links ]
Okubo, A. & Levin, S. A. (1989). A theoretical framework for data analysis of wind dispersal of seed and pollen. Ecology, 70(2), 329-338. [ Links ]
Orme, C. D. L., Davies, R. G., Olson, V. A., Thomas, G. H., Ding, T.-S., Rasmussen, P. C., Ridgeley, R. S., Stattersfield, A. J., Bennett, P. M., Owens, I. P. F., Blackburn, T. M. & Gaston, J. K. (2006). Global patterns of geographic range size in Birds. PLoS Biology, 4(7), 1276-1283. doi: 10.1371/journal.pbio.0040208. [ Links ]
Parmesan, C. (1996). Climate and species' range. Nature, 382, 765-766. [ Links ]
Pearman, P. B., D'Amen, M., Graham, C. H., Thuiller, W. & Zimmermann, N. E. (2010). Within-taxon niches structure: niche conservatism, divergence and predicted effects of climate change. Ecography, 33(6), 990-1003. [ Links ]
Pearson, R. G. & Dawson, T. P. (2003). Predicting the impacts of climate change on the distribution of species: are the bioclimate envelope models useful? Global Ecology and Biogeography, 12, 361-371. [ Links ]
Pearson, R. G., Dawson, T. P., Berry, P. M. & Harrison, P. A. (2002). SPECIES: A spatial evaluation of climate impact on the envelope of species. Ecological Modelling, 154(3), 289-300. [ Links ]
Pennington, T. & Sarukhán, J. (2005). Árboles tropicales de México. Manual para la identificación de las principales especies. México: Fondo de Cultura Económica. [ Links ]
Peterson, A. T. (2001). Predicting species geographic distributions based on ecological niche modeling. The Condor, 103(3), 599-605. [ Links ]
Peterson, A. T., Sánchez-Cordero, V., Soberón, J., Bartley, J., Buddemeier, R. W. & Navarro-Singüenza, A. G. (2001). Effects of global climate change on geographic distributions of Mexican Cracidae. Ecological Modelling, 144(1), 21-30. [ Links ]
Peterson, A. T. & Soberón, J. J. (2012). Species distribution modeling and ecological niche modeling: getting the concepts right. Natureza & Conservagao, 10(2), 102-107. [ Links ]
Peterson, A. T., Soberón, J. J. & Sánchez-Cordero, V. (1999). Conservatism of ecological niche in evolutionary time. Science, 285(5431), 1265-1267. [ Links ]
Petitpierre, B., Kueffer, C., Broennimann, O., Randin, C., Daehler, C. & Guisan, A. (2012). Climatic niche shifts are rare among terrestrial plant invaders. Science, 335(6074), 1344-1348. [ Links ]
Phillips, S. J., Anderson, R. P. & Schapire, R. P. (2006). Maximum entropy modeling of species geographic distributions. Ecological Modelling, 190, 3-4. doi:10.1016/j.ecolmodel.2005.03.026. [ Links ]
Pounds, J. A., Fogden, M. P. L. & Campbell, J. H. (1999). Biological response to climate change on a tropical mountain. Nature, 398, 611-615. [ Links ]
Powell, R. A. & Mitchell, M. S. (2012). What is a home range? Journal of Mammalogy, 93(4), 948-958. doi:10.1644/11-MAMM-S-177.1. [ Links ]
Pulliam, H. R. (1988). Sources, sinks, and population regulation. The American Naturalist, 132(5), 652-661. [ Links ]
Pulliam, H. R. (2000). On the relationship between niche and distribution. Ecology Letters, 3(4), 349-361. [ Links ]
Rapoport, H. E. (1975). Areografía: estrategias geográficas de las especies. México: Fondo de Cultura Económica. [ Links ]
Raxworthy, C. J., Martínez-Meyer, E., Horning, N., Nussbaum, R. A., Schneider, G. E., Ortega-Huerta, M. A. & Peterson, A. T. (2003). Predicting distribution of known and unknown reptile species in Madagascar. Nature, 426, 837-841. [ Links ]
Ricklefs, R. E. & Latham, R. E. (1992). Intercontinental correlation of geographical ranges suggest stasis in ecological traits of relict genera to temperate perennial herbs. The American Naturalist, 139(6), 1305-1321. [ Links ]
Romero, D., Olivero, J., Márquez, A.L., Báez, J. C. & Real, R. (2014). Uncertainty in distribution forecast caused by taxonomic ambiguity under climate change scenarios: a case study with two newt species in mainland Spain. Journal of Biogeography, 41(1), 111-121. doi:10.1111/jbi.12189. [ Links ]
Rowe, R. J. (2005). Elevational gradient analyses and the use of historical museum specimens: a cautionary tale. Journal of Biogeography, 32(11), 1883-1897. doi:10.1111/j.1365-2699.2005.01346.x. [ Links ]
Ruiz-Sánchez, E., Rodríguez-Gómez, F. & Sosa, V. (2012). Refugia and geographic barriers of populations of the Desert poppy, Hunnemannia fuma-riifolia (Papaveraceae). Organisms Diversity and Evolution, 12(2), 133-143. doi:10.1007/s13127-012-0089-z. [ Links ]
Rzedowski, J. (1978). Vegetación de México. México: Limusa. [ Links ]
Sánchez-Rojas, G. & Gallina, S. (2007). Metapoblaciones, el reto en la biología de la conservación: el caso del venado bura en el Bolsón de Mapimí. En G. Sánchez-Rojas & A. Rojas-Martínez (Eds.), Tópicos en sistemática, bio-geografía, ecología y conservación de mamíferos (pp. 115-124). Hidalgo: Universidad Autónoma del Estado de Hidalgo. [ Links ]
Sargeant, G. A., Sovada, M. A., Slivinski, C. C. & Johnson, D. H. (2005). Markov Chain Monte Carlo estimation of species distributions: a case study of the swift fox in western Kansas. Journal of Wildlife Management, 69(2), 483-497. [ Links ]
Scoble, J. & Lowe, A. J. (2010). A case for incorporating phylogeography and landscape genetics into species distribution modelling approaches to improve climate adaptation and conservation planning. Diversity and Distribution, 16(3), 343-353. doi:10.1111/j.1472-4642.2010.00658.x. [ Links ]
Sinervo, B., Méndez-De la Cruz, F., Miles, D. B., Heulin, B., Bastiaans, E., Villagrán-Santa Cruz, M., Lara-Reséndiz, R., Martínez-Méndez, N., Calderón-Espinosa, M. L., Mesa-Lázaro, R. N., Gadsden, H., Ávila, L. J., Morando, M., De la Riva, I. J., Victoriano-Sepúlveda, P., Duarte-Rocha, C. F., Ibargüengoyta, N., Aguilar-Puntriano, C., Massot, M., Lepetz, V., Oksanen, T. A., Chapple, D., Bauer, A., Branch, W., Clobert, J. & Sites Jr., J. W. (2010). Erosion of lizard diversity by climate change and altered thermal niches. Science, 328(5980), 894-899. [ Links ]
Smith, H. M. & Taylor, E. H. (1950). An annotated checklist and key to the reptiles of Mexico exclusive of the snakes. Bulletin of the United States National Museum, 199, 1-253. [ Links ]
Soberón, J. (2007). Grinnellian and Eltonian niches and geographic distribution of species. Ecology letters, 10, 115-123. doi:10.1111/j.1461-0248.2007.01107.x. [ Links ]
Soberón, J. & Miller, C. P. (2009). Evolución de los nichos ecológicos. Miscelánea Matemática, 49, 83-99. [ Links ]
Soberón, J. & Peterson, A. T. (2004). Biodiversity informatics: managing and applying primary diversity data. Philosophical Transactions of The Royal Society of London B, 359, 689-698. doi:10.1098/rstb.2003.1439. [ Links ]
Soberón, J. & Peterson, A. T. (2005). Interpretation of models of fundamental ecological niches and species' distributional areas. Biodiversity Informatics, 2, 1-10. [ Links ]
Stevens, G. C. (1989). The latitudinal gradient in geographic range: How so many species coexist in the tropics. The American Naturalist, 133(2), 240-256. [ Links ]
Stevens, G. C. (1992). The elevational gradient in altitudinal range: an extension of Rapoport's latitudinal rule to altitude. The American Naturalist, 140(6), 893-911. [ Links ]
Stockwell, D. & Peters, D. (1999). The GARP modelling system: Problems and solutions to automated spatial prediction. International Journal of Geographical Information Science, 13(2), 143-158. [ Links ]
Torres, G. A., Esquivel, M. C. & Ceballos, G. (1995). Diversidad y conservación de los mamíferos marinos de México. Revista Mexicana de Mastozoología, 1, 22-43. [ Links ]
Vapnik, V. (1995). The nature of statistical learning theory. New York: Springer-Verlag. [ Links ]
Vié, J. C., Hilton-Taylor, C. & Stuart, S. N. (2009). Wildlife in a Changing World- An Analysis of the 2008 IUCN Red List of Threatened Species. Switzerland: IUCN, Gland. [ Links ]
Viranta, S. (2003). Geographical and temporal ranges of middle and late Miocene Carnivores. Journal of Mammalogy, 84(4), 1267-1278. doi:10.1644/BJK-035. [ Links ]
Walker, P. A. & Cocks, K. D. (1991). HABITAT: A procedure for modelling a disjoint environmental envelope for a plant or animal species. Global Ecology and Biogeography Letters, 1(4), 108-118. [ Links ]
Ward, G., Hastie, T., Barry, S., Elith, J. & Leathwick, J. R. (2008). Presence-only data and the EM algorithm. Biometrics, 65, 554-563. doi:10.1111/j.1541-0420.2008.01116.x. [ Links ]
Webb, T. J. & Gaston, K. J. (2000). Geographic range size and evolutionary age in birds. Proceedings of the Royal Society of London, 267, 1843-1850. doi:10.1098/rspb.2000.1219. [ Links ]
Whitaker, R. J., Grogan, D. W. & Taylor, J. W. (2003). Geographic barriers isolate endemic populations of Hyperthermophilic Archaea. Science, 301(5635), 976-978. [ Links ]
Wiens, J. A. (1989). Spatial scaling in ecology. Functional Ecology, 3(4), 385-397. [ Links ]
Wiens, J. J., Ackerly, D. D., Allen, A. P., Anacker, B. L., Buckley, L. B., Cornell, H. V., Damschen, E. I., Davies, T. J., Grytnes, J. A., Harrison, S. P., Hawkins, B. A., Holt, R. D., McCain, C. M. & Stephens, P. R. (2010). Niche conservatism as an emerging principle in ecology and conservation biology. Ecology Letters, 13(10), 1310-1324. doi:10.1111/j.1461-0248.2010.01515.x. [ Links ]
Wiens, J. J. & Graham, C. H. (2005). Niche conservatism: integrating evolution, ecology, and conservation biology. Annual Review of Ecology, Evolution and Systematics, 36, 519-539. doi:10.1146/annurev.ecolsys.36.102803.095431. [ Links ]
Wiley, E. O. (1978). The evolutionary species concept reconsidered. Systematic Biology, 27(1), 17-26. [ Links ]
Willis, J. C. (1922). Age and area: A study in geographical distribution and origin of species. Cambridge: Cambridge University Press. [ Links ]
Wilson, D. E. & Reeder, D. M. (2005). Mammal's species of the world: a taxonomic and geographic reference. Baltimore: The Johns Hopkins University Press. [ Links ]
Wu, H. & Huffer, F. W. (1997). Modelling the distribution of plant species using the autologistic regression model. Environmental and Ecological Statistics, 4, 49-64. [ Links ]
Yañez-Arenas, C., Martínez-Meyer, E., Mandujano, S. & Rojas-Soto, O. (2012). Modelling geographic patterns of population density of the white-tailed deer in central Mexico by implementing ecological niche theory. Oikos, 121(12), 2081-2089. doi:10.1111/j.1600-0706.2012.20350.x. [ Links ]
Zunino, M. (2000). El concepto de área de distribución: algunas reflexiones teóricas. En F. Martín-Piera, J. J. Morrone & A. Melic (Eds.), Hacia un proyecto CYTED para el inventario y la estimación de la diversidad entomológica en Iberoamérica: PrIBES-2000 (pp. 79-85). Zaragoza: m3m: Monografías Tercer Milenio. [ Links ]
Zunino, M. & Palestrini, C. (1991). El concepto de especie y la biogeografía. Anales de Biología, 17(Biología Animal,6), 85-88. [ Links ]
Zunino, M. & Zullini, A. (2003). Biogeografía: la dimensión espacial de la evolución. México: Fondo de Cultura Económica. [ Links ]














