Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Acta universitaria
On-line version ISSN 2007-9621Print version ISSN 0188-6266
Acta univ vol.25 n.1 México Jan./Feb. 2015
https://doi.org/10.15174/au.2014.646
Variación fitoplanctónica en un lago urbano del municipio de Cuernavaca, Morelos, México
Seasonal phytoplanktonic variation in an urban lake from Cuernavaca, Morelos, Mexico
Judith García-Rodríguez*, F. Isela Molina-Astudillo*, Elizabeht Miranda-Espinoza**, Martha B. Soriano-Salazar***, Migdalia Díaz-Vargas*
* Laboratorio de Hidrobiología, Centro de Investigaciones Biológicas, Universidad Autónoma del Estado de Morelos. Río Pánuco núm. 41, Col. Vista Hermosa, Cuernavaca, Morelos, México, C.P. 62290. Correo electrónico: garciarj@uaem.mx
** Facultad de Ciencias Biológicas, Universidad Autónoma del Estado de Morelos. Av. Universidad núm. 1001, Col. Chamilpa, Cuernavaca, Morelos, México, C.P. 62209.
*** Laboratorio de Acuicultura, Centro de Investigaciones Biológicas, Universidad Autónoma del Estado de Morelos. Río Pánuco núm. 41, Col. Vista Hermosa, Cuernavaca, Morelos, México, C.P. 62290. Tel.: (777) 3162354.
Recibido: 21 de junio de 2014
Aceptado: 15 de octubre de 2014
Resumen
El presente trabajo se realizó en el lago del Parque Alameda de la Solidaridad en el municipio de Cuernavaca, Morelos, México. Se tomaron muestras en tres sitios del lago para determinar la variación y abundancia del fitoplancton durante las cuatro estaciones del año. Se determinó la temperatura, transparencia, oxígeno disuelto, pH y nutrientes (nitratos, amonio y fósforo). Se reconocieron 30 especies, las Chlorophyceae fueron las más abundantes y con mayor número de especies. Las abundancias más altas se registraron durante invierno y primavera. Oocystis solitaria y Leptolyngbya sp. fueron las especies dominantes por sus altas abundancias (> 1x106 org/ml). La variación de la ficoflora del lago presentó una sucesión temporal, presentándose especies frecuentes, temporales y raras o esporádicas. La abundancia, riqueza específica y las especies del fitoplancton, así como los valores obtenidos de los nutrientes, señalan al lago como un sistema hipertrófico.
Palabras clave: Lago urbano; fitoplancton; variación; abundancia.
Abstract
The following investigation took place in the lake Parque Alameda de la Solidaridad in Cuernavaca Morelos. Samples at three sites in the lake were taken to determine the variation and abundance of phytoplankton during the four seasons the year. Temperature, transparency, oxygen, pH and nutrients (nitrates, amonium and phosphorous) were determined. Thirty species were recognized, the Chlorophyceae were the most abundant and with the higher number of species. The higher abundances of all the period were in spring and winter. Oocystis solitaria and Leptolyngbya sp. were the predominant species with abundances higher than (> 1x106 org/ml). The variation of phycoflora in the lake, showed a temporal succession in frequent, seasonal, occasional and rare species. The phytoplankton species richness and abundance, as well nutrients concentrations showed the lake as a hypertrophic system water body.
Keywords: Urban lake; phytoplankton; variation; abundance.
INTRODUCCIÓN
Los lagos urbanos son ecosistemas acuáticos muy importantes que han sido construidos con diferentes fines. Estos lagos no sólo brindan bienestar a la población humana, sino, aunado a lo anterior, permiten el establecimiento de diferentes hábitats en medio de la ciudad para las especies que logran adaptarse, tanto acuáticas como terrestres, migratorias o residentes, incrementando su valor paisajístico. Sin embargo, han recibido poca atención en los estudios limnológicos (Elías, Navarrete, Fernández & Contreras, 2006). Considerando que están situados en la ciudad, permiten el desarrollo de diversas actividades humanas en el perilago, lo que ha propiciado un proceso de eutrofización, ocasionado por el incremento notable de nutrientes y materia orgánica, promoviendo un incremento excesivo de fitoplancton y de la turbidez en el agua y la disminución del valor recreativo y estético del lago y su entorno (Quirós, 2007).
Por lo tanto, los lagos urbanos destinados principalmente para la recreación humana, y que de manera indirecta permiten el establecimiento de diferentes grupos de flora y fauna, son de importancia en la generación de conocimiento básico a través de las condiciones abióticas y de la composición del fitoplancton presente, ya que por medio de ellos se provee de información para un mejor manejo de estos sistemas. Por esta razón, el presente trabajo tiene como objetivo conocer la composición y variación del fitoplancton, así como algunas variables abióticas del lago urbano del Parque Alameda de la Solidaridad, con la finalidad de obtener información para un mejor manejo de estos sistemas.
Área de estudio
El presente estudio se llevó a cabo en el lago urbano del Parque Alameda de la Solidaridad localizado en el municipio de Cuernavaca, en el estado de Morelos, México. Cuernavaca se ubica geográficamente entre los 18° 49' 07" N y 99° 10' 03" O a una altitud de 1510 m (figura 1) (Instituto Nacional para el Federalismo y el Desarrollo Municipal [INAFED], 2013).

De acuerdo con la clasificación climática de Köppen, modificada por García (1988), Cuernavaca cuenta con dos tipos de climas subhúmedos A(C): el intermedio de los subhúmedos y el más húmedo de los subhúmedos. La temperatura media anual oscila entre los 18 ºC y 22 ºC, con una precipitación media anual entre los 1000 mm a los 1500 mm. Los meses más calurosos son abril y mayo, con temperaturas de 24 ºC a 28 ºC; el mes más frío corresponde a enero, con temperaturas de 18 ºC a 20 ºC.
El lago del Parque Alameda de la Solidaridad se ubica al este de la ciudad de Cuernavaca (figura 2); se localiza entre los 18° 56' 32" N y 99° 13' 52" O a una altitud de 1459 m. Presenta una profundidad de 1.20 m. Tiene 70 m de largo y 20 m de ancho (figura 2).

Este parque fue creado a finales de los años noventa del siglo XX, como un parque de recreación. En la periferia del lago se ubican plantas ornamentales, como palmeras (Areca sp., Veitchia sp. y Syagrus sp.), bugambilias (Bougainvillea glabra y B. spectabilis) y jazmines (Jasminum sp.); y árboles como ficus (Ficus benjamina) y jacarandas (Jacaranda mimosifolia). Los peces presentes en el lago son del tipo forrajero (Poecilia maylandi) y carpas (Carassius auratus), al igual que patos (Anas platyrhynchos domesticus y A. clypeata).
MATERIAL Y MÉTODOS
Los muestreos se realizaron de noviembre de 2012 a agosto de 2013, considerando las estaciones del año: otoño (noviembre), invierno (febrero), primavera (mayo) y verano (agosto). Se seleccionaron tres sitios de recolecta en el lago; dos en la zona litoral (S1 y S2) y una en la zona limnética (S3) (figura 3). Para la recolecta del material biológico se tomaron muestras directas de superficie, empleando botellas de plástico blanco con capacidad de 250 ml, preservándose con acetato lugol. Las variables físicoquímicas del agua se midieron in situ y la transparencia a nivel de superficie, empleando un disco de Secchi, la temperatura y el oxígeno disuelto utilizando un oxímetro HI 9146 marca HANNA y el pH con un potenciómetro digital Combo marca HANNA. En el laboratorio se determinaron nitratos por reducción de cadmio, amonio por el método de Nessler y fósforo con el método del ácido ascórbico, usando un laboratorio portátil HACH. La cuantificación del fitoplancton se llevó a cabo empleando un microscopio invertido Wild M-40, de acuerdo con lo propuesto por Uthermöhl (1958), utilizando cámaras de sedimentación de 10 ml (Wetzel & Likens, 2000). Para el reconocimiento de las especies se emplearon las siguientes claves taxonómicas: Bourrelly (1972), Komárek & Fott (1983), Prescott (1962); Prescott, Croasdale, Vinyard & Bicudo (1981) y Prescott, Bicudo & Vinyard (1982). Además de trabajos especializados, como los de Fanés (2008); Novelo (2011; 2012a y 2012b); Ortega-Mayagoitia & Rojo (2000) y bases de datos electrónicas, como Guiry & Guiry (2012); Kelly et al. (2013); Spaulding, Lubinski & Potapova (2010). El número de células se expresó en organismos por mililitro (org/ml).

Una vez obtenidos los resultados, y con la finalidad de conocer si existieron diferencias significativas entre las abundancias fitoplanctónicas, las variables fisicoquímicas y nutrientes de manera temporal y estacional, se utilizó un análisis de varianza (ANOVA) empleando el paquete estadístico XLSTAT2009.
RESULTADOS
Fitoplancton
El análisis de varianza aplicado (ANOVA) señaló que se presentaron diferencias significativas (p < 0.05) entre las estaciones del año, pero no entre los sitios de muestreo (p > 0.05).
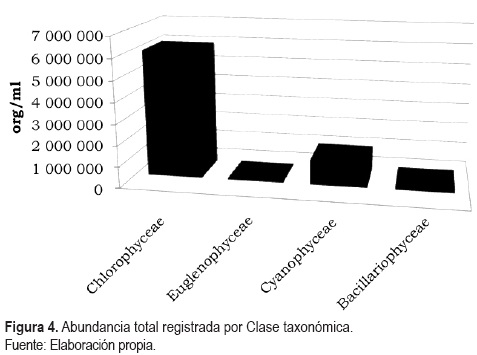
Se reconocieron 30 especies incluidas en 22 géneros. Para la Clase Chlorophyceae se reconocieron 17 especies, siete para Bacillariophyceae, cuatro para Cyanophyceae y dos para Euglenophyceae (tabla 1). Los valores de densidad registrada por Clase taxonómica fueron mayores para las clorofíceas con 6 046 488 org/ml, seguida de las cianofíceas con 1 188 576 org/ml, las bacilariofíceas y euglenofíceas presentaron las densidades más bajas con 188 710 org/ml y 53 014 org/ml, respectivamente (figura 4).

La abundancia por estación del año muestra que la Clase Chlorophyceae presentó los valores más altos durante invierno y primavera, con 1 809 720 org/ml y 4 061 952 org/ml, respectivamente; las abundancias más bajas se registraron durante otoño e invierno. Para Cyanophyceae, la abundancia más alta se registró durante primavera con 1 186 848 org/ml, con abundancias bajas durante otoño y verano, en invierno no se registró material biológico de este grupo. Las Bacillariophyceae presentaron los datos más altos durante primavera, con 145 584 org/ml, con valores más bajos en invierno y verano. Las Euglenophyceae sólo estuvieron presentes en verano, con una abundancia de 53 014 org/ml (figura 5).

Con respecto a la sucesión estacional y abundancia específica del fitoplancton, se puede señalar que hubo diferencias durante las distintas épocas del año, destacando Oocystis solitaria y Leptolyngbya sp. con la mayor abundancia durante el estudio, con valores superiores a 1 org/ml x 106 org/ml, presentándose en cuatro y dos de las estaciones del año, respectivamente. Para el resto de las especies, aunque algunas estuvieron presentes durante todo el estudio, sus abundancias fueron menores a los 117 860 org/ml (tabla 2).
En cuanto a la variación de la ficoflora, se observó una sucesión temporal en el lago, presentándose especies frecuentes como Oocystis solitaria, Desmodesmus obliquus, D. communis, Scenedesmus acuminatus, Pandorina sp. y Chlorogonium sp., especies temporales como Desmodesmus sp., Scenedesmus acuminatus cf. var. acuminatus, Pediastrum boryanum var. boryanum, Monoraphidium contortum, Leptolyngbya sp., Cyclotella meneghiniana, Cocconeis placentula, C. pediculus y Euglena sp. y especies raras o esporádicas como Pediastrum borianum, Pinnularia sp. y Planothidium lanceolata (tabla 2). Entre las especies dominantes, O. solitaria presentó las abundancias más altas (> 1 org/ml x 106 org/ml); los máximos se presentaron en primavera, disminuyendo drásticamente para verano; en otoño e invierno los valores superan los 22 000 org/ml. D. communis registró las abundancias más altas en primavera y verano, con valores mínimos en otoño e invierno. Pandorina. mostró abundancias máximas en otoño y primavera (de 1400 org/ml a 3700 org/ml), presentando abundancias menores en invierno y verano. Chlorogonium. se registró a partir de invierno hasta verano con densidades considerables, siendo menos abundante el resto del tiempo. Dentro de las especies temporales, M.contortum sólo se presentó en primavera y verano, correspondiendo para la primera estación las abundancias más altas (> de 32 000 org/ml), disminuyendo drásticamente en verano, con abundancias menores a 400 org/ml. Leptolyngbya fue la segunda especie con mayor abundancia en el lago, después de O. solitaria, sólo se presentó en primavera y verano, y es en primavera donde se registraron los valores más altos (> 1 org/ml x 106 org/ml) y en verano los más bajos (< de 900 org/ml). Cyclotella meneghiniana se registró en otoño y verano, con las mayores abundancias en otoño. Cocconeis placentula y C. pediculus se presentaron únicamente en invierno y primavera, en invierno las densidades fluctuaron entre 144 org/m y 720 org/ml, aumentando considerablemente durante la primavera entre 89 000 org/m y 56 000 org/ml, respectivamente. Dentro de estas especies destaca Euglena sp., únicamente presente en verano con densidades de 45 000 org/ml. Entre las especies raras o esporádicas, Pediastrum boryanum fue la que presentó la mayor abundancia dentro de éstas, con 516 org/ml presente únicamente en invierno (tabla 2).
De manera general, el fitoplancton del lago es dominado por la Clase Chlorophyceae en diversidad, abundancia y distribución, tomando en cuenta que de las 17 especies reconocidas, 12 estuvieron presentes en dos o más estaciones del año, y 11 de éstas en los tres sitios de muestreo (tabla 2).
Variables fisicoquímicas
Los valores más altos de temperatura del agua se registraron durante verano en los tres sitios de muestreo, con una temperatura promedio en esta estación del año de 26.7 °C; el valor mínimo se observó durante el invierno en los tres sitios de muestreo, con un promedio de 17.6 °C. La transparencia del agua fue mayor en verano, el valor mínimo se presentó en primavera en los tres sitios de muestreo. Las mayores concentraciones de oxígeno disuelto se registraron durante el otoño; los valores mínimos se presentaron durante la primavera con un promedio de 5.7 mg L-1. El pH en verano fue el valor más bajo registrado en los tres sitios; en invierno se registró el valor más alto (tabla 3).
Con respecto a los resultados de los nutrientes, los nitratos mostraron un patrón de variación con valores más altos durante otoño, presentándose los valores más bajos durante verano. Las concentraciones registradas por sitio de muestreo fueron relativamente homogéneas. El amonio mostró concentraciones con poca variación durante otoño-invierno, disminuyendo en primavera, para finalmente incrementar durante verano, correspondiendo a los valores más altos (tabla 3).
Para el fósforo total, se observó un patrón de variación con dos periodos de baja concentración durante otoño y primavera, y de incremento durante invierno y verano. Las concentraciones que se registraron entre los sitios de muestreo fueron similares, observándose cambios en sus valores durante las diferentes estaciones del año, como se muestra en la tabla 3.
DISCUSIÓN
La flora ficológica del lago presentó una mayor diversidad para las Chlorophyceae y Bacillariophyceae, acompañadas en menor grado por la ficoflora asociada con las Clases Cyanophyceae-Euglenophyceae. Las clorofíceas son consideradas las más importantes en los ambientes dulceacuícolas debido a su alta tolerancia, lo que les permite desarrollarse en diversos hábitats, constituyendo en general el grupo mejor representado del fitoplancton, seguidas por las diatomeas (Huber, Novoa & Martínez, 2011). Esto coincide con trabajos realizados en diversos cuerpos de agua lénticos someros (Bazán, 2010; Becerra, 2009; Huber, 2010; Izaguirre et al., 2004; O'Farrell, Sinistro, Izaguirre & Unrein, 2003), y asímismo con lo registrado en el presente estudio.
La riqueza específica registrada para este lago fue baja, considerando la obtenida en otros lagos artificiales (Nogueira & Leandro-Rodríguez, 1999; Novoa, Luque, Lombardo & Martínez, 2006; Oliva, Rodríguez, Lugo & Sánchez, 2008); sin embargo, se señala que en los ambientes acuáticos enriquecidos con un aporte artificial de nutrientes presentan una diversidad menor que la registrada en sistemas no alterados (Comas, Novelo & Tavera, 2007). El lago del Parque Alameda de la Solidaridad es un sistema que recibe aportes externos significativos tanto de nutrientes como de materia orgánica originados por el arrastre durante la temporada de lluvias, por lo que es considerable su baja diversidad algal, tal como lo señalan los autores anteriores.
La abundancia total registrada supera los 7 org/ml x 106 org/ml, contribuyendo principalmente a estos valores los grupos Chlorophyceae y Cyanophyceae. En estudios realizados en otros lagos urbanos las abundancias totales superan lo obtenido en este estudio, pero coinciden en que los grupos más representados son las clorofíceas (principalmente Volvocales y Chloroccocales) y las cianofíceas, y mencionan que las altas abundancias están dadas por la condición de hipertrofia que presentan este tipo de sistemas (Oliva et al., 2008; Tavera, Novelo & Comas, 2000).
En invierno y primavera se registraron las mayores abundancias; para los lagos someros se señala que los picos más altos de abundancia se presentan en primavera, y que son debidos en gran parte por las condiciones ambientales que se presentan durante esta estación, coincidiendo parcialmente con lo observado para el lago en este estudio. El máximo de abundancia registrado en primavera se debió a un florecimiento o bloom de dos especies Oocystis solitaria (Cloroficea) y Leptolyngbya (Cianofícea). A este respecto se menciona que un florecimiento se presenta cuando existen acumulaciones masivas de una o dos especies coexistentes de algas (González, Ortaz, Peñaherrera & Matos, 2004), y que son comunes en los sistemas lénticos bajo condiciones de alta insolación, altas temperaturas y estabilidad en la columna de agua, condiciones que se presentaron en esta estación para el lago Solidaridad. En invierno, la mayor abundancia correspondió a una sola especie clorococal (O. solitaria), circunstancia que también fue observada por Oliva et al. (2008) en el lago urbano Tezozomoc, donde durante el invierno las especies más abundantes también correspondieron a las clorococales. Las abundancias totales por clase taxonómica y por estación de muestreo son muy semejantes, considerando que esta condición es debida a las características ambientales que son muy homogéneas en el lago.
González et al. (2004) y Oliva et al. (2008) mencionan que para lagos con condiciones de hipertrofia los grupos taxonómicos dominantes son Chlorophyceae (Chlorococcales y Volvocales), Cyanophyceae (Chroococcales, Oscillatoriales y Nostocales), Euglenophyceae (Euglenales y Trachelomonadales) y Bacillariophyceae (principalmente especies de los géneros Cyclotella y Aulacoseira); la flora algal del lago coincide en un 88% con lo señalado por estos autores. Las especies presentes en este estudio han sido registradas en diversos cuerpos de agua de condiciones eutróficas e hipertróficas. Oocystis solitaria y Cyclotella meneghiniana han sido citadas por Zafar (1986) y Becerra (2009), en lagos desde oligotróficos hasta hipertróficos. Leptolyngbya fue aislada de tres lagos urbanos de la Ciudad de México considerados eutróficos (Pineda-Mendoza, Martínez-Jerónimo, Garduño-Solórzano & Olvera-Ramírez, 2011). Monoraphidium griffithii ha sido citada por Comas (1996), y en los canales de Xochimilco por Tavera et al. (2000) en condiciones eutróficas. Pandorina. y Pediastrum boryanum son mencionadas por Temponeras, Kristiansen & Moustaka-Gouni (2000) para cuerpos de agua con niveles de eutrofia a hipertrofia. Cocconeis placentula, Coelastrum reticulatum, Scenedesmus acuminatus, Pediastrum simplex, Euglena y Trachelomonas fueron reconocidas por Becerra (2009) en los lagos del Dique considerados como sistemas hipertróficos. Se puede señalar que la ficoflora reconocida en el presente estudio es acorde con varias de las especies registradas para otros sistemas acuáticos con condiciones hipertróficas, por lo que se sugiere que estas especies son indicadoras de condiciones hipertróficas.
La temperatura presentó un patrón de incremento durante la primavera y verano, y de disminución en el invierno, lo cual muestra una relación de este parámetro con las diferentes estaciones del año. Naselli-Flores (2000) refiere que la variación del fitoplancton responde a las fluctuaciones de la temperatura y a la variable asociada, que es la cantidad de radiación solar. Tal situación se ve reflejada en el presente estudio, donde los valores de abundancia se incrementaron en primavera con el aumento de la temperatura, que influye directamente en la actividad fotosintética y el crecimiento del fitoplancton. La transparencia del agua tuvo una relación inversa con las abundancias registradas, considerando que al aumentar la abundancia la transparencia disminuyó, y por el contrario, la transparencia fue alta durante la época de lluvias por dilución. Esto hace suponer que los cambios en la transparencia de Secchi son básicamente de origen biogénico (fitoplancton). Wetzel (2001) menciona que esta situación es una característica de lagos eutróficos. Asimismo, Novoa et al. (2006) señalan que la alta concentración de algas que se presenta durante los meses estivales reduce la transparencia del agua, lo que coincide con lo observado en el presente trabajo.
El oxígeno disuelto en el lago presentó poca variación de una estación a otra; se menciona que el aumento en la cantidad de oxígeno disuelto está dada por la actividad fotosintética (Becerra, 2009), los valores registrados de oxígeno disuelto no coinciden con los valores más altos de abundancia, probablemente se debe a que se están llevando a cabo procesos de oxidación de materia orgánica. Esta misma situación fue registrada por Oliva et al. (2008) en un lago urbano hipertrófico, quienes obtuvieron valores altos de oxígeno cuando sus valores de abundancia fueron bajas y datos de oxígeno bajos cuando sus abundancias fueron altas. Respecto al pH del agua se menciona que está relacionado con las variaciones estacionales de temperatura y turbidez (Moñino-Ferrando, Moreno-Ostos & Cruz-Pizarro, 2006), y a su vez la cantidad de luz recibida influye sobre el patrón de abundancia y variación espacial y temporal del fitoplancton. Tal situación se ve reflejada en este estudio, donde los valores de abundancia se incrementaron en primavera con el aumento de la temperatura y el pH, valores que afectan y reflejan directamente a la intensidad de la actividad fotosintética.
Con respecto a los nutrientes en el lago Solidaridad, las concentraciones mayores de nitratos fueron observadas en las épocas donde no hay precipitación pluvial o es escasa. Se considera que las condiciones propias del periodo permiten la concentración de este nutriente, por lo cual no se considera limitante. En el lago se presenta un intervalo entre 0.61 mg L-1 a 16.4 mg L-1, valores superiores a los registrados en otros lagos urbanos: Lago Tezozomoc de 0 mg L-1 a 5.0 mg L-1 (Oliva et al., 2008). El amonio registró valores altos para el fitoplancton de acuerdo con Nedoma et al. (1993) (en Tavera, 1996), quienes mencionan concentraciones entre 0.015 mg L-1 -0.020 mg L-1; asimismo, se menciona que para aguas superficiales un valor óptimo de amonio es de 0.06 mg L-1 para el crecimiento algal e incremento de la productividad primaria (Marshall, 1991), los valores registrados para el lago Solidaridad son mayores a lo antes citado, asimismo los valores obtenidos para este nutriente en otros lagos urbanos son altos (Oliva et al., 2008; Verver, 2005). Por otro lado, se señala que la alta descomposición de la materia orgánica incrementa los niveles de amonio, y que es característico de sistemas altamente eutróficos (Quiros, 2003); respecto al señalamiento anterior, se puede mencionar que en verano se evidencia una intensa descomposición orgánica, dadas las altas concentraciones de amonio para esta época; el grupo de las Euglenophyceae sólo se registró en verano, y se cita que muchas especies de esta Clase se desarrollan en aguas ricas en materia orgánica en descomposición y que diversas especies del género Euglena se encuentran entre las más tolerantes a condiciones de polución (Becerra, 2009), situación que podría explicar el desarrollo de Euglenophyceas en esta estación del año. Estudios sobre los requerimientos nutricionales de las algas hacen énfasis en que el fósforo es determinante para el crecimiento del fitoplancton, y que es liberado por los procesos de descomposición y excreción de la biota. Los niveles de fósforo en este lago van de 1.08 mg L-1 a 8 mg L-1, lo cual indica que el lago presenta altas concentraciones de este nutriente. Nedoma et al. (1993) (en Tavera 1996) mencionan que los fitoplancteres requieren valores de 0.01 mg L-1 para su crecimiento de manera óptima. El fósforo total es un nutriente importante empleado para referir el estado trófico de un sistema acuático; al respecto, Wetzel (2001) señala que valores superiores a 0.1 mg L-1 de fósforo indican sistemas hipertróficos. Lampert & Sommer (1997) refieren valores de 0.03 mg L-1-0.10 mg L-1 para ecosistemas eutróficos, y Vollenweider (1983) indica concentraciones de 0.025 mg L-1 a 0.080 mg L-1 para sistemas eutróficos, por lo cual el lago Alameda de la Solidaridad se considera un sistema hipertrófico.
Finalmente, las altas concentraciones de nutrientes observadas en el lago del Parque Alameda de la Solidaridad son el resultado de diversos factores que propician esta alta acumulación: aporte continuo de nutrientes desde el perilago originado por diversas actividades antrópicas, la permanencia del agua por grandes periodos de tiempo, debido a que tiene poco o ningún recambio de agua, la poca profundidad que presenta el lago y por la presencia de fauna (patos, perros y peces), cuyas excretas son vertidas indirectamente o directamente al lago, lo cual se ve reflejado en las variaciones del fitoplancton durante el estudio. La flora algal presente en el lago Alameda de la Solidaridad es similar a la presente en otros lagos urbanos con características de hipertrofia.
REFERENCIAS
Bazán, G. I. (2010). Estudios ficológicos en el sistema léntico de La Arocena (Departamento Maracó), La Pampa, Argentina (Tesis de doctorado). Universidad Nacional del Río Cuarto: Río Cuarto, Argentina. [ Links ]
Becerra, C. L. E. (2009). Catálogo fitoplanctónico de los lagos del Dique, municipio de Xalapa, Veracruz, México (Tesis de licenciatura). Universidad Veracruzana: Veracruz, México. [ Links ]
Bourrelly, P. (1972). Les algues d'eau douce. Initiation a la systematique. Les algues verdes. I. N. Boubée et Cie., Paris. [ Links ]
Comas, A., Novelo, E. & Tavera, R. (2007). Coccal green algae (Chlorophyta) in shallow ponds in Veracruz, México. Archiv für Hydrobiologie Supplement /Algological Studies, (24), 29-69. [ Links ]
Comas, G. A. (1996). Las Chlorococcales dulceacuícolas de Cuba. Berlin: Biblioteca Phicologica. J. Crammer. [ Links ]
Elías, F. G., Navarrete, S. N. A., Fernández, G. J. L. & Contreras, R. G. (2006). Crecimiento, abundancia y biomasa de Poecilia reticulata en el lago urbano del parque Tezozomoc de la Ciudad de México. Revista Chapingo. Serie Ciencias Forestales y del Ambiente, 12(2), 156-159. [ Links ]
Fanés, T. I. (2008). Estudios taxonómicos en algas verdes cocales del sur de España (Tesis de doctorado). Universidad de Granada: Granada, España. [ Links ]
García, E. (1988). Modificaciones al sistema de clasificación climática de Köppen. México: Instituto de Geografía-Universidad Nacional Autónoma de México. [ Links ]
González, E. J., Ortaz, M., Peñaherrera, C. & Matos, M. L. (2004). Fitoplancton de un embalse tropical hipereutrófico (Pao-Cachinche, Venezuela): abundancia, biomasa y producción primaria. Interciencia, 29(10), 548-555. [ Links ]
Guiry, M. D. & Guiry, G. M. (2012). AlgaeBase. World-wide electronic publication. Galway: National University of Ireland. Recuperado el 8 de marzo de 2014 de http://www.algaebase.org [ Links ]
Google maps (2014a). Parque Alameda de la Solidaridad. Recuperado el 26 de septiembre de 2014 de www.google.com.mx/maps/place/Parque+Alameda+de+la+Solidaridad/@18.6855951,-99.2808294,267032m/data=!3m1!1e3!4m2!3m1!1s0x85cddf8736b932cb:0x815fab06925030d?hl=es [ Links ]
Google maps (2014b). Parque Alameda de la Solidaridad. Recuperado el 26 de septiembre de 2014 de www.google.com.mx/maps/@18.9181852,-99.1922233,764m/data=!3m1!e3 [ Links ]
Huber, M. P. (2010). Distribución temporal del fitoplancton de una laguna del sur de la provincia de Córdoba y su relación con las variables ambientales (Tesis de licenciatura en Ciencias Biológicas). Universidad Nacional del Río Cuarto: Río Cuarto, Argentina. [ Links ]
Huber, M. P., Novoa, M. D. & Martínez de Fabricius, A. L. (2011). Fitoplancton de una laguna endorreica de uso recreacional (Córdoba, Argentina). Biológicas, 13(1), 24-33. [ Links ]
Instituto Nacional para el Federalismo y el Desarrollo Municipal (INAFED) (2013). recuperado el 23 de abril de 2014 de http://www.inafed.gob.mx/work/enciclopedia/EMM17morelos/municipios/17007a.html
Izaguirre, I., O'farrell, I., Unrein, F., Sinistro, R., Dos Santos, A. M. & Tell, G. (2004). Algal assemblages across a Wetland, from a shallow lake to relictual oxbow lakes (Lower Paraná River, South America). Hydrobiologia, 511(1-3), 25-36. [ Links ]
Kelly, M. G., Bennion, H., Cox, E. J., Goldsmith, B., Jamieson, J., Juggins, S., Mann, D. G. & Telford R. J. (2013). Common freshwater diatoms of Britain and Ireland: an interactive key. Environment Agency, Bristol. Recuperado el 24 de febrero de 2014 de http://craticula.ncl.ac.uk/EADiatomKey/Html/index.html [ Links ]
Komárek, J. & Fott. B. (1983). Das Phytoplankton des Süsswasser Systematik und Biologie. 7. Teil: Chlorophyceae (Grünalgen) Ordnung: Chlorococcales. In Elster. H.-J. & Ohle, W. (Eds), Die Binnengewässer. Begründet von August Thienemann, Stutgart. [ Links ]
Lampert, W. & Sommer, U. (1997). Limnoecology: the ecology of Lakes and Streams. New York: Oxford Univ. Press. [ Links ]
Marshall, D. W. (1991). Biología de las algas. Enfoque fisiológico. México: Limusa. [ Links ]
Moñino-Ferrando, A., Moreno-Ostos, E. & Cruz-Pizarro, L. (2006). Phytoplankton patchiness in two shallow waterbpdies. Limnetica, 25(3), 809-820. [ Links ]
Naselli-Flores, L. (2000). Phytoplankton assemblages in twenty-one environmental factors. Hydrobiologia. 424, 1-11. Sicilian reservoirs: relationships between species composition and environmental factors. Hydrobiologia, 424, 1-11. [ Links ]
Nogueira, I. S. & Leandro-Rodríguez, N. C. (1999). Algas planctônicas de um lago artificial do jardín botânico Chico Mendes, goiânia, goiás: florística e algumas considerações ecológicas. Revista Brasileira de Biologia, 59(3), 377-395. [ Links ]
Novelo, E. (2011). Cyanoprokaryota J. Komárek. Flora del Valle de Tehuacán-Cuicatlán. México: Instituto de Biología-Universidad Nacional Autónoma de México. [ Links ]
Novelo, E. (2012a). Chlorophyta Pascher. Flora del Valle de Tehuacán-Cuicatlán. México: Instituto de Biología-Universidad Nacional Autónoma de México. [ Links ]
Novelo, E. (2012b). Bacillariophyta Hustedt. Flora del Valle de Tehuacán-Cuicatlán. México: Instituto de Biología-Universidad Nacional Autónoma de México. [ Links ]
Novoa, M. D., Luque, M. E., Lombardo, D. & Martínez de Fabricius, A. L. (2006). Estudio ficológico de lagos urbanos artificiales del sur de la provincia de Córdoba. Boletín de la Sociedad Argentina de Botánica, 41(3-4), 203-231. [ Links ]
O'Farrell, I., Sinistro, R., Izaguirre, I. & Unrein, F. (2003). Do steady state assemblages occur in shallow lentic environments from wetlands? Hydrobiologia, 502(1-3),197-209. [ Links ]
Oliva, M. M. G., Rodríguez, R. A., Lugo, V. A. & Sánchez, R. M. R. (2008). Composición y dinámica del fitoplancton en un lago urbano hipertrófico. Hidrobiológica, 18, 1-13. [ Links ]
Ortega-Mayagoitia, E. & C. Rojo. (2000). Fitoplancton del Parque Nacional Las Tablas de Daimiel. III. Diatomeas y clorofitas. Anales del Jardín Botánico de Madrid, 58(1), 17-37. [ Links ]
Pineda-Mendoza, Martínez-Jerónimo, F., Garduño-Solórzano, G. & Olvera-Ramírez, R. (2011). Caracterización morfológica y molecular de cianobacterias filamentosas aisladas de florecimientos de tres lagos urbanos eutróficos de la Ciudad de México. Polibotánica, 3, 31-50. [ Links ]
Prescott G. W. (1962). Algae of the western great lakes area. (Revised edition). USA, 977 p. W. M. C. Brown Co. Pub. Dubuque. [ Links ]
Prescott, G. W., Bicudo, C. E. D. & Vinyard, W. C. (1982). A synopsis of North American Desmids (Part II. Desmidiaceae: Placodermae. Section 4. Lincoln). Nebraska: University of Nebraska Press. [ Links ]
Prescott, G. W., Croasdale, H. T., Vinyard, W. C. & Bicudo, C. E. (1981). A Synopsis of North American Desmids (Part. I. Desmidiaceae: Placodermae. Section 3. Lincoln and London). Nebraska: University of Nebraska Press. [ Links ]
Quirós, R. (2003). The relationship between nitrate and ammonia concentrations in the pelagic zone of lakes. Limnetica, 22, 37-50. [ Links ]
Quirós, R. (2007). Manejo y recuperación de lagos urbanos. Facultad de Agronomía. Universidad de Buenos Aires (documento de trabajo del Área de Sistema de Producción acuáticas, núm. 6). Argentina: Facultad de Agronomía-Universidad de Buenos Aires. [ Links ]
Spaulding, S. A., Lubinski, D. J. & Potapova, M. (2010). Diatoms of the Unites States. Recuperado el 24 de febrero de 2014 de http://westernsdiatoms.colorado.edu [ Links ]
Tavera, R. (1996). Phytoplankton of the tropical Lake Catemaco (Ph. D. Thesis), University of South Bohemia: Ceské Budejovice, Czech Republic. [ Links ]
Tavera, R., Novelo, E. & Comas, A. (2000). Chlorococcalean algae (s.l.) from the ecological Park of Xochimilco, México. Algological Studies, 100, 65-94. [ Links ]
Temponeras, M., Kristiansen, J. & Moustaka-Gouni, M. (2000). Seasonal variation in phytoplankton composition and physicalchemical features of the shallow Lake Doirani, Macedonia, Greece. Hydrobiologia, 424, 109-122. [ Links ]
Uthermöhl, H. (1958). Zur Cervolkommung der quantitativen phytoplankton methodik. Mitt. Int. Ver. Theor. Angew. Limnol. (9), 39. [ Links ]
Verver y Vargas, G. J. (2005). Dinámica espacio-temporal de los parámetros físicos y químicos y su relación con la clorofila a en un lago urbano eutrófico (Tesis de licenciatura), FES, Iztacala, UNAM: México. [ Links ]
Vollenweider, R. A. (1983). Eutrophication. Notes distributed during the II Meeting of the Regional Project on the Eutrophication of Tropical Lakes. Cepis: Brazil. [ Links ]
Wetzel, R. G. (2001). Limnology. Lake and river ecosystems (3ra. edition). San Diego, Ca. EEUU: Academic Press. [ Links ]
Wetzel, R. G. & Likens, G. E. (2000). Limnological analyses. New York: Springer. [ Links ]
Zafar, A. R. (1986). Seasonality of phytoplankton in some South Indian lakes. Hydrobiologia, 138, 177-187. [ Links ]














