INTRODUCCIÓN
La contaminación de los cuerpos de agua se ha convertido en el problema más común en el mundo. Diariamente nos enfrentamos a la escasez de agua y su constante contaminación tanto en áreas rurales como urbanas. Una gran variedad de materiales y sustancias, tanto de origen natural como sintético, contaminan los cuerpos de agua. Proteger el agua de la contaminación es fundamental para preservar la vida de los ecosistemas acuáticos y la salud de los seres humanos que dependen de ella. El consumo de agua contaminada, así como la ingesta de peces o productos agrícolas regados con agua de baja calidad atentan contra la salud de los seres humanos (Reyes et al. 2020).
Los contaminantes que afectan la calidad del agua son muy diversos, uno de los más comunes son los metales pesados (MP). Los MP, como el cobre, son persistentes, es decir, que pueden permanecer en el ambiente sin ser degradados. Esto supone que, una vez en el agua, se vuelven parte de ella convirtiéndose en un riesgo permanente para la salud de los ecosistemas y de las personas. Las fuentes de contaminación pueden ser, entre otras, procesos mineros, efluentes domésticos e industriales y residuos de productos agrícolas (Najafpour et al. 2020). El cobre es considerado como micronutriente esencial en bajas concentraciones (Bost et al. 2016), sin embargo en las plantas, a concentraciones elevadas, es capaz de producir lesiones en las raíces, inhibir el crecimiento radicular e interrumpir la germinación de esporas (Sağlam et al. 2016). Asimismo, en los peces puede alterar la regulación del sodio y en los mamíferos producir daños en el hígado (Nantasanti et al. 2015). En los seres humanos la exposición al cobre, por encima de los límites máximos permisibles puede causar náuseas, vómitos, calambres estomacales o diarrea. Según la Norma Oficial Mexicana NOM-127-SSA1-2021 (SSA 2021), el límite de cobre permitido para agua de consumo humano es de 2.0 mg/L (este límite se refiere a su concentración total en el agua, la cual incluye los sólidos suspendidos y los disueltos). Según la Organización Mundial de la Salud (OMS) el cobre es un nutriente necesario para el buen funcionamiento de muchos sistemas enzimáticos pero la exposición del cobre en el agua, por encima de los límites señalados, puede tener efectos gastrointestinales agudos, como ya se mencionó.
Otro tipo de contaminante común en las aguas superficiales y subterráneas es el flúor (Haldar et al. 2020). Usualmente este contaminante se encuentra por encima de los límites permisibles en aguas residuales de complejos industriales, agua potable e incluso en alimentos comunes (Tovar et al. 2016). Según la Norma Oficial Mexicana NOM-127-SSA1-2021, para que el agua sea de consumo humano, el límite permisible de fluoruros es de 1 mg/L, sin embargo, la OMS recomienda 1.5 mg/L como el valor de referencia para el fluoruro en el agua potable. Si la concentración es aún mayor puede generarse daño severo en el hígado y los riñones (ATSDR 2021). La enfermedad más conocida que se debe a la toxicidad del flúor es la fluorosis dental. Además de esta enfermedad, la afinidad de este elemento con otros sistemas del organismo humano incide en afectaciones al cerebro, por su neurotoxicidad, y altera la producción de hormonas en diferentes glándulas (Salazar 2012). Un estudio realizado por la OMS en la India y China mostró un aumento del riesgo en efectos óseos por la ingesta total de fluoruro por encima de 6.0 mg/d (PAHO 2013).
La contaminación del agua es generada por el desarrollo de actividades antrópicas y la generación de residuos sólidos, por ello se requieren alternativas para disminuir su impacto negativo. Los residuos inorgánicos suelen tener la mayor atención debido a su lento proceso de degradación, sin embargo, no debe dejarse de lado a los residuos orgánicos que, por sus características, pueden ser reutilizados como materia prima en otros procesos.
La cáscara de cacahuate es un residuo agroindustrial que se produce a gran escala. Sus aplicaciones se han enfocado en la generación de energía (Perea-Moreno et al. 2018), complemento como alimento de ganado porcino (Jaramillo 2019), mejoramiento de propiedades físicas en concretos (Gupta y Kashani 2021), medio para cultivo de hongos (Philippoussis y Diamantopoulou 2011) y la obtención de carbón activado como material adsorbente (Georgin et al. 2016). La cáscara de cacahuate tarda en degradarse debido al alto contenido de lignina y bajo contenido de nitrógeno (Jaramillo 2019). A pesar de los múltiples usos de este residuo su destino final son los rellenos sanitarios y en el peor caso, los ríos, lagos o basureros clandestinos.
Por sus características químicas y físicas su uso como material adsorbente es una alternativa económica para la remediación de aguas contaminadas (Zhu et al. 2009). La literatura reporta la aplicación de la cáscara de cacahuate después de un proceso de pirólisis, es decir, como carbón activado para la remoción de contaminantes como los colorantes orgánicos (Georgin et al. 2016), metales pesados (Cai et al. 2018) y plaguicidas (Zhou et al. 2016), entre otros. En su estado natural, su aplicación es poco común; en un trabajo previo de nuestro grupo (Toledo-Jaldin et al. 2020) fue utilizado como soporte de nanopartículas magnéticas para la formación de un compuesto aplicado en la remoción de plaguicidas.
En este sentido, el presente trabajo pretende evaluar la capacidad de adsorción de la cáscara de cacahuate, en su forma natural, como material adsorbente de dos tipos de contaminantes en secuencia, con lo que se le daría un uso doble al mismo material. Inicialmente, la cáscara de cacahuate, preparado como material adsorbente, fue utilizado para remover Cu desde soluciones acuosas. El residuo generado en el proceso de adsorción de cobre se sometió a un proceso de secado para ser aplicado como material adsorbente en la remoción de flúor. De esta forma, el mismo material es utilizado en dos procesos de adsorción de dos contaminantes diferentes. Las características del material antes y después del proceso de adsorción se analizan a detalle mediante espectroscopía infrarroja por trasformada de Fourier (FT-IR), MEB y XPS.
MATERIALES Y MÉTODOS
La cáscara de cacahuate fue obtenida de un mercado local en el Estado de México, México. El material se secó al sol por cinco días. Después de este tiempo, las cáscaras se molieron en un molino de granos con una potencia de 150 W. El material molido se tamizó para utilizar aquellas partículas de tamaño 0.841 mm (este material fue etiquetado como CN). El material debió someterse a dos procesos de lavado con el objetivo de eliminar las impurezas que pudiera presentar. El lavado busca homogeneizar el material lo más posible y liberar espacios o poros si fuera el caso. El primer lavado fue con agua caliente y el segundo con una solución de NaOH (0.05 M). Ambos lavados se hicieron durante 24 h y con una agitación magnética de 200 rpm. Después se separó el material por filtración a gravedad y se secó durante 24 h a 50 °C. El material lavado con agua caliente se etiquetó como CA y el material lavado con NaOH como COH.
El ensayo de adsorción de los iones de cobre se llevó a cabo a temperatura ambiente, en un sistema de lotes. Se pusieron en contacto 2 g del material (CA o COH) con 200 mL de una solución de cobre de 400 mg/L. Se tomaron muestras de la solución anterior (1 mL) a 0.25, 0.5, 1, 2, 4, 6, 8, 16, 18, 20, 22, 24 y 48 h para determinar la concentración de Cu2+ después del contacto. A las muestras tomadas se les añadió hidróxido de amonio en equivalencia 1:1 de una solución de concentración 1.0 M para la formación de complejos de amonio para su determinación por espectrofotometría UV-Vis (VE-5100UV, marca Velab). La lectura fue a una longitud de onda de 600 nm. Con la curva de calibración, es posible establecer la concentración de iones cobre en solución después de estar el material en el proceso de adsorción.
La concentración final de iones de cobre por gramo de material adsorbente, de cada una de las muestras tomadas a diferentes tiempos, se utilizó para graficar el comportamiento cinético contra el tiempo de contacto (qt vs. t). Diferentes modelos cinéticos (pseudo primer orden, pseudo segundo orden y Elovich) fueron aplicados a los datos experimentales para determinar el tiempo de equilibrio del proceso y para describir el tipo de adsorción de los iones de cobre sobre la cáscara de cacahuate.
Con el tiempo de equilibrio obtenido de los modelos cinéticos, se elaboran las isotermas de adsorción a temperatura ambiente. Para ello, 0.05 g de CA y COH (por separado) se pusieron en contacto con 5 mL de soluciones de iones de cobre a distintas concentraciones (100, 150, 200, 250, 300, 400, 500, 600, 700 y 800 mg/L). Una vez transcurrido el tiempo que se determinó previamente como tiempo de equilibrio se separó la solución del material adsorbente por filtración. La determinación de los iones de cobre no adsorbidos se realizó nuevamente con la adición de hidróxido de amonio, la formación de complejos y la ayuda de un espectrofotómetro. Los datos experimentales fueron utilizados para graficar las isotermas de adsorción y para determinar la cantidad máxima adsorbida de iones de cobre por gramo de material adsorbente. Para determinar la cantidad máxima adsorbida se aplicaron los modelos de Langmuir, Freundlich, Sip y Redlich Peterson.
Una vez determinada la capacidad máxima de adsorción de iones de cobre para COH, el material obtenido del proceso de adsorción (RCOH) se utilizó para realizar las pruebas de adsorción de fluoruros.
Para ello se pesaron 0.05 g de RCOH y 10 mL de una solución de fluoruros de 3 mg/L, las mezclas se agitaron a temperatura ambiente en un intervalo de 5 min a 24 h. Cada una de las mezclas se separó por filtración. La fase líquida fue utilizada para identificar la concentración de fluoruros remanente después de cada tiempo de contacto. Para ello se utilizó un electrodo específico (ISE301F) con una solución amortiguadora (TISAB II) para eliminar las interferencias.
La gráfica de la cinética de adsorción de los fluoruros se obtuvo de la misma forma que para la adsorción de iones de cobre. La gráfica qt vs. t, con la aplicación de los modelos cinéticos, permitió determinar el tiempo de equilibrio y describir el comportamiento del sistema.
La isoterma de adsorción se obtuvo siguiendo el mismo procedimiento antes descrito para la adsorción de iones de cobre, pero a partir de concentraciones iniciales de 1 a 30 mg/L. Los mismos modelos matemáticos se aplicaron para la adsorción de fluoruros.
En todas las pruebas de adsorción se controló el pH de las soluciones antes y después del proceso. Todas las pruebas se llevaron a cabo por triplicado con el fin de establecer reproducibilidad y valores de desviación estándar para cada prueba.
La caracterización de los materiales antes y después de los lavados, así como antes y después de la adsorción de Cu2+ y F- se realizó por FTIR, MEB y XPS.
RESULTADOS Y DISCUSIÓN
Caracterización de los materiales
La cáscara de cacahuate natural o CN presentó un color marrón, después de ser sometida al proceso de lavado con agua siguió manteniendo el mismo color, sin embargo, una leve decoloración se observó en el material cuando fue lavado con la solución de NaOH.
Las micrografías obtenidas del análisis por MEB se presentan en la figura 1. En el material CN se observó una superficie heterogénea, formada por pequeñas láminas o escamas sobrepuestas entre sí (Fig. 1a). Después de los procesos de lavado descritos en la metodología se presentaron algunas diferencias morfológicas en la cáscara de cacahuate. En las imágenes de microscopía de los materiales CA y COH (Fig. 1b y 1c) se observa la presencia de poros, no visibles en el material CN. Se cree que cuando se realizaron los lavados se removieron impurezas en el material CN y por tanto quedó expuesta su estructura porosa.

Fig. 1 Microscopía electrónica de barrido de cáscara de cacahuate: a) sin lavar, b) después del pretratamiento con agua caliente y c) después del lavado con una solución de NaOH.
Se considera que el lavado con la solución de NaOH es más agresivo con el material CN debido a la decoloración que este sufrió y que se mencionó anteriormente. Se sabe que este hidróxido reacciona con grupos funcionales presentes en materiales lignocelulósicos y por ende podría influir positivamente en la generación de mayor cantidad de sitios activos superficiales. La micrografía de este material (Fig. 1c) muestra en su superficie los poros, pero también se observó formas diferentes de poros tipo cavidades, es decir, como cuencas.
Estas diferencias morfológicas podrían influir en la remoción de los contaminantes, ya que la adsorción es un proceso estrechamente ligado a la superficie de los materiales, así como a su heterogeneidad superficial. El material COH se considera un material heterogéneo porque existen diferentes grupos funcionales en su superficie, los cuales actúan como sitios de adsorción.
Los espectros FT-IR de las muestras CA y COH (Fig. 2), presentaron señales características de lignina, hemicelulosa y celulosa presentes en el material (Lazzari et al. 2018). La interacción de la solución del NaOH con el material CN generó cambios en el material COH que se pueden corroborar con la disminución de ciertas señales en el espectro de FT-IR del mismo. Las señales entre 3000 y 3600 cm-1 se asociaron a la vibración del enlace O-H de la celulosa y la hemicelulosa. La disminución de esta banda en COH, se debió a que el NaOH reaccionó con los grupos funcionales mencionados, esto mismo se reporta en trabajos donde se busca extraer la celulosa con soluciones acuosas (Abdel-Halim et al. 2014).

Fig. 2 Espectroscopia de infrarrojo con transformada de Fourier de la cáscara de cacahuate después de los pre-tratamientos de lavado.
A 2335 y 2360 cm-1 las bandas se relacionaron a la vibración O-C-O, grupo presente en los tres componentes principales de los materiales lignocelulósicos (Bhaduri et al 2016). La banda a 1638 cm-1 correspondió a la vibración del enlace carbonilo C=O de aldehídos, alquenos y ésteres (Georgin et al. 2016) que disminuyen debido a la ruptura de este enlace como consecuencia del lavado con NaOH. La banda a 1509 cm-1 pudo asociarse a grupos fenólicos (Figueredo et al. 2017), así como la señal intensa a los 1030 cm-1 se relacionó con la vibración de estiramiento C-O (Bhaduri et al 2016) vinculada a la exposición de grupos funcionales de la celulosa.
La caracterización con MEB se realizó únicamente para el material de COH antes y después de la adsorción de iones de cobre y flúor. Posterior al proceso de adsorción de Cu2+ y F-, la caracterización permitió observar un aumento en la porosidad y heterogeneidad del material COH con respecto a CN (Fig. 3a y 3c). El mapeo químico mostró una distribución no homogénea de Cu2+ adsorbido (Fig. 3b). Se observó una distribución en donde los iones cobre se adsorbieron en mayor cantidad, sobre todo en zonas cercanas a poros, sin embargo, quedaron zonas en donde la adsorción de los iones de cobre fue baja o prácticamente nula, estas zonas son completamente lisas. De acuerdo con el mapeo químico existen zonas con mayor concentración de grupos superficiales que otras, esto por la morfología irregular del material. También se puede observar que los iones de cobre no se distribuyen en toda la superficie del material, lo que dejó sitios de adsorción libres que pudieron ser aprovechados para la adsorción de otro tipo de contaminante como el fluoruro. En la figura 3d se observa la distribución de Cu2+ y F- en la superficie del material. Se percibe que la presencia del ion Cu2+ aparentó estar en mayor proporción que la de F-. Sin embargo, al no ser una técnica cuantitativa, no fue posible determinar la proporción exacta de Cu2+ y F-. Observando el mapeo químico del material después de la adsorción de F- (Fig. 3d), es posible inferir que los iones flúor ocuparon los sitios de adsorción que dejaron vacíos los iones de cobre, sin embargo, también existió interacción de los iones cobre con el F- de acuerdo con los resultados obtenidos por XPS.

Fig. 3 Micrografía y mapeo químico del material COH después de la adsorción de Cu2+ (a, b) y después de la adsorción de F- (c, d).
En la primera etapa de adsorción las soluciones de cobre mantuvieron un pH entre 4.5 y 5.0, lo que confirma la presencia de iones Cu de acuerdo con el diagrama de especiación. Los resultados del análisis de Cu 2p3/2 en el espectro de XPS (Fig. 4) señalaron que en su mayoría el ion cobre se adsorbió en diferentes especies como óxidos e hidróxidos metálicos. Las señales de 935 y 934 eV se atribuyeron a Cu (OH)2, sin embargo, la señal a 932 eV se asignó a Cu2O (Kwon et al. 2015). Las señales en O 1s corroboraron lo antes mencionado; la señal a 531.4 eV se asoció al enlace Cu-O en el Cu2O mientras que 534.7 eV se asignó a la interacción Cu-O, en la formación del Cu (OH)2. Las señales a 532.2 y 533.9 eV, corresponden al oxígeno unido a las cadenas de celulosa y lignina de la cáscara de cacahuate. La señal de 533.1 eV, se debió a la presencia de agua en el material (Chiba et al. 2000). Todas estas señales son de la adsorción de Cu2+ en la cáscara de cacahuate.
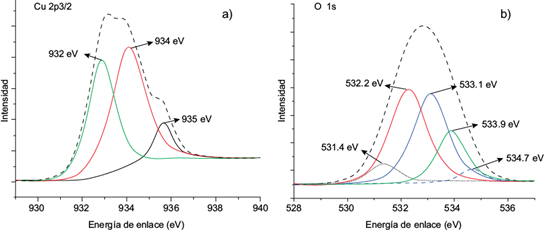
Fig. 4 Deconvolución gausiana de los picos del Cu 2p3/2 (a) y O 1s (b) obtenidos de los espectros de la superficie del material COH después de realizada la adsorción de Cu2+.
Para el proceso de adsorción de F-, se realizó la caracterización por XPS (Fig. 5). Los resultados obtenidos sugirieron que el F- interactúo con los iones cobre, previamente adsorbido en la superficie del material COH. Las señales a 684.6 y 686.7 eV se asociaron a la interacción Cu-F, mientras que 683.7 eV se debió al enlace Na-F (Mao et al. 2020) o a la presencia de iones sodio en el material, mismo que provino del pretratamiento con la solución de NaOH.

Fig. 5 Deconvolución gausiana de los picos del F (a) 1s y Cu 2p3/2 (b) obtenidos de los espectros de la superficie del material COH después de realizada la adsorción de Cu2+ y F-.
Sin embargo, también existe la posibilidad que la adsorción del F- se diera por interacciones de puente de hidrógeno con los grupos funcionales de la lignina, la celulosa y la hemicelulosa.
Como conclusión, se determinó que la adsorción se dio por la interacción con los grupos funcionales del material lignocelulósico y también por los nuevos sitios de adsorción formados por la adsorción del Cu2+, por lo que todos estos sitios pueden ser aprovechados para remover otro tipo de contaminante. Asimismo, la propuesta es una alternativa que mitiga el exceso de residuos de cáscara de cacahuate, convirtiéndolo en material adsorbente para remover contaminantes del agua.
Cinéticas de adsorción de Cu2+ y F-
Las soluciones de Cu2+ y F- preparadas mostraron valores de pH iniciales de 4.0 y 5.42 respectivamente. En cada uno de los procesos de adsorción se controló el pH desde el inicio y hasta el final del contacto. Estos datos pueden observarse en los cuadros I y II juntamente con los datos de qt y qads utilizados para la obtención de las gráficas de las cinéticas (Fig. 6) e isotermas de adsorción, respectivamente.
CUADRO I DATOS DE qt, DESVIACIÓN ESTÁNDAR s, pH FINAL DE LAS CINÉTICAS DE ADSORCIÓN DE Cu2+ Y F- CON LOS MATERIALES CA, COH Y COH-Cu.
| Adsorción de Cu2+ con CA | Adsorción de Cu2+ con COH | Adsorción de F- con COH-Cu 2+ | ||||||
| qt (mg/g) | σ (10-2) | pH | qt (mg/g) | σ (10-2) | pH | qt (mg/g) | σ (10-2) | pH |
| 0.20 | 0.90 | 3.92 | 3.83 | 1.57 | 4.13 | 0.52 | 3.09 | 5.43 |
| 4.01 | 0.19 | 4.01 | 6.22 | 3.46 | 4.01 | 0.69 | 9.01 | 5.46 |
| 5.17 | 6.96 | 4.03 | 7.69 | 7.24 | 4.14 | 0.96 | 9.39 | 5.46 |
| 6.84 | 4.35 | 3.95 | 9.02 | 2.04 | 4.04 | 1.05 | 6.12 | 5.45 |
| 8.57 | 7.23 | 4.03 | 9.75 | 0.96 | 4.05 | 1.17 | 8.64 | 5.52 |
| 10.33 | 18.66 | 4.10 | 11.23 | 12.10 | 4.11 | 1.26 | 5.35 | 5.55 |
| 11.83 | 15.30 | 4.01 | 12.50 | 25.52 | 4.14 | 1.42 | 10.4 | 5.61 |
| 12.67 | 23.07 | 4.11 | 13.33 | 13.32 | 4.02 | 1.43 | 4.38 | 5.69 |
| 13.33 | 21.99 | 4.13 | 14.50 | 22.99 | 3.91 | 1.42 | 6.84 | 5.73 |
| 13.67 | 13.60 | 3.98 | 14.83 | 21.57 | 3.98 | 1.42 | 2.04 | 5.76 |
| 13.33 | 13.66 | 3.92 | 15.33 | 14.59 | 4.01 | 1.42 | 2.78 | 5.41 |
CUADRO II DATOS DE qm, DESVIACIÓN ESTÁNDAR s, pH FINAL DE LAS ISOTERMAS DE ADSORCIÓN DE Cu2+ Y F- CON LOS MATERIALES CA, COH Y COH-Cu.
| Adsorción de Cu2+ con CA | Adsorción de Cu2+ con COH | Adsorción de F- con COH-Cu 2+ | ||||||
| qm (mg/g) | s (10-2) | pH | qm (mg/g) | s (10-2) | pH | qm (mg/g) | s (10-2) | pH |
| 10.17 | 15.50 | 3.92 | 12.20 | 9.06 | 4.09 | 1.20 | 0.0065 | 5.45 |
| 12.12 | 8.73 | 3.91 | 16.31 | 15.98 | 4.13 | 1.27 | 0.0037 | 5.48 |
| 13.17 | 17.11 | 3.92 | 21.21 | 23.54 | 4.09 | 130 | 0.0114 | 5.43 |
| 14.08 | 22.24 | 4.02 | 22.49 | 17.78 | 4.03 | 1.40 | 0.0073 | 5.51 |
| 15.69 | 17.29 | 4.10 | 24.83 | 16.36 | 4.12 | 1.45 | 0.0146 | 5.58 |
| 16.71 | 18.35 | 4.14 | 27.72 | 22.12 | 4.09 | 1.53 | 0.0087 | 5.53 |
| 17.79 | 16.58 | 4.03 | 28.48 | 20.83 | 4.13 | 1.58 | 0.0151 | 5.43 |
| 18.11 | 23.85 | 4.09 | 28.88 | 31.41 | 4.01 | 1.60 | 0.0079 | 5.58 |
| 18.30 | 15.50 | 4.12 | 29.06 | 22.26 | 4.02 | 1.66 | 0.0076 | 5.64 |
| 1.63 | 0.0071 | 5.69 | ||||||

Fig. 6 Cinética de adsorción de Cu2+ sobre CA (a), sobre COH (b) y adsorción de F- sobre COH-Cu2+(c)
El tiempo de equilibrio para la adsorción de Cu2+ en los materiales CA y COH fue de 16 h, que es donde se consiguió la saturación en ambos materiales. Para el material CA el modelo que se ajustó mejor fue el de pseudo primer orden, mientras que para el material COH, el mejor modelo fue el de segundo orden o Elovich (Cuadro III). De acuerdo con el ajuste de cada modelo, se puede concluir que para el material CA el proceso de adsorción de iones de cobre se llevó a cabo por el proceso de fisiadsorción, mientras que para el material COH, se llevó a cabo por quimiadsorción en una superficie heterogénea.
CUADRO III PARÁMETROS CINÉTICOS DE LOS MODELOS DE ADSORCIÓN APLICADOS.
| Modelos | Parámetros | Adsorción de Cu2+ | Adsorción de F- | |
| CA | COH | COH-Cu | ||
| Pseudo primer orden | qt (mg/g) | 13.8 | 13.9 | 1.34 |
| K1 (min-1) | 0. 304 | 0.187 | 2.72 | |
| R2 | 0.969 | 0.826 | 0.841 | |
| RSS | 5.78 | 22.5 | 0.147 | |
| X2 | 0.643 | 2.50 | 1.64E-2 | |
| Pseudo segundo orden | qt (mg/g) | 17.2 | 15.9 | 1.42 |
| K2 (g/mg·h) | 2.64E-2 | 1.12E-2 | 2.86 | |
| R2 | 0.968 | 0.921 | 0.955 | |
| RSS | 5.80 | 10.2 | 4.14E-2 | |
| X2 | 0.644 | 1.14 | 0.462E-2 | |
| Elovich | a | 4.69 | 14.0 | 57.4 |
| b | 0.221 | 0.302 | 5.78 | |
| R2 | 0.959 | 0.978 | 0.934 | |
| RSS | 7.63 | 2.90 | 6.17E-2 | |
| X2 | 0.848 | 0.322 | 0.686E-2 | |
qt: adsorción de contaminante en tiempo t, K1: constante de pseudo primer orden, K2: constante de pseudo segundo orden, a: velocidad inicial de adsorción, b: constante de desorción durante el experimento, R2: coeficiente de determinación, RSS: suma de cuadrados residuales, X2: distribución chi-cuadrado.
Los valores de las constantes del modelo de Elovich, para el material COH, indicaron que el proceso de adsorción se favoreció más que el de desadsorción, ya que el valor de a fue mayor que el valor de b.
En el material CA prevalece el proceso de fisiadsorción y se debe a que cuando se lavó la cáscara de cacahuate con agua caliente no se eliminó por completo las impurezas y se quedaron obstruyendo el paso de los iones Cu2+ a los grupos funcionales. Por lo que este ion queda susceptible a ser adsorbido tanto por el material adsorbente como por las impurezas.
Se sabe que cuando las soluciones de NaOH tienen una alta concentración pueden llegar a alterar la estructura de los materiales lignocelulósicos, pero en concentraciones idóneas, ayudan a limpiar la superficie e incluso exponer, en cierta medida, los grupos funcionales del material. Debido a esto el material COH mostró procesos de quimiadsorción de los iones Cu2+, ya que formó enlaces de carácter químico, como lo mostró la caracterización por XPS.
La adsorción de fluoruros sobre el material que previamente adsorbió Cu2+ en su superficie se presentó como quimiadsorción por la interacción del F- con el Cu2+; al aplicar los modelos a los datos experimentales, el mejor ajuste fue el del modelo de pseudo segundo orden. De acuerdo con la cinética el tiempo de equilibrio para la adsorción de F- fue de 6 h, menor que el del Cu2+, posiblemente porque material fue previamente utilizado en el proceso de adsorción de iones Cu2+, por lo que los nuevos sitios activos estaban más accesibles. Asimismo, el F- tiene un radio iónico menor que el cobre, lo que permite una mayor difusión en los poros del material.
El valor de la constante de velocidad (K2) del modelo de pseudo segundo orden indicó que el proceso de adsorción de Cu2+ en el material COH fue el más lento (Cuadro III), el tiempo de equilibrio que se estableció fue de 16 h, como ya se mencionó.
Isotermas de adsorción de Cu2+ y F-
Las capacidades de adsorción, determinadas por el modelo de Langmuir, fueron de 16.9 y 31.1 mg/g para el CA y para el COH, respectivamente (Cuadro IV). Esta diferencia en las capacidades de adsorción pudo deberse a que en el material CA no estuvieron disponibles todos los sitios de adsorción.
CUADRO IV PARÁMETROS OBTENIDOS DE LOS MODELOS MATEMÁTICOS DE ISOTERMA DE ADSORCIÓN DE Cu 2+ Y F- CON LOS MATERIALES CA, COH Y COH-Cu.
| Modelos | Parámetros | Adsorción de Cu2+ | Adsorción de F- | |
| CA | COH | COH-Cu | ||
| Langmuir | qm (mg/g) | 16.9 | 31.1 | 1.60 |
| b (L/mg) | 7.78E-2 | 2.11E-2 | 7.64 | |
| R2 | 0.623 | 0.976 | 0.942 | |
| RSS | 22.2 | 5.24 | 2.70E-3 | |
| X2 | 3.18 | 0.873 | 3.00E-4 | |
| Freundlich | 1/n | 0.169 | 0.256 | 6.49E-2 |
| KF (mg/g)(L/mg)1/n | 6.17 | 6.05 | 1.35 | |
| R2 | 0.961 | 0.931 | 0.989 | |
| RSS | 2.27 | 15.0 | 1.46E-2 | |
| X2 | 0.324 | 2.50 | 1.63E-3 | |
| Sip | qm (mg/g) | 10.6 | 32.3 | 2.36 |
| KLF | 5.83E-3 | 2.95E-2 | 1.33 | |
| 1/n | 0.171 | 0.896 | 0.176 | |
| R2 | 0.955 | 0.972 | 0.988 | |
| RSS | 2.29 | 5.01 | 2.66E-3 | |
| X2 | 0.382 | 1.00 | 3.33E-4 | |
| Redlich Peterson | K | 20.2 | 22.7 | 15.9 |
| a | 32.6 | 37.6 | 11.7 | |
| b | 0.831 | 0.744 | 0.938 | |
| R2 | 0.955 | 0.917 | 0.988 | |
| RSS | 2.27 | 15.1 | 0.271E-2 | |
| X2 | 0.378 | 3.01 | 3.37E-4 | |
qm: capacidad máxima de adsorción, b: constante de Langmuir, 1/n: intensidad de la adsorción, KF: constante de Freundlich, K: constante de Langmuir-Freundlich, K: constante de Redlich Peterson, a: constante de isoterma, b: constante de isoterma, R2: coeficiente de determinación, RSS: suma de cuadrados residuales, X2: distribución chi-cuadrado.
El modelo de Sip, es una combinación de los modelos de Freundlich y Langmuir, por lo que, si el valor de 1/n se aproxima a 0, tendría un mejor ajuste a Freundlich, pero si el valor de 1/n se aproxima a 1, el mejor ajuste sería a Langmuir. Así, para el sistema de adsorción de cobre el modelo de Freundlich mostró un buen ajuste porque el valor de 1/n fue próximo a 0.
A diferencia del proceso desarrollado en el material COH, donde el valor de 1/n fue próximo a 1 y por tanto se ajustó mejor al modelo de Langmuir; además la adsorción se dio en monocapa y se asumió que ocurrió sobre una superficie homogénea. Esta homogeneidad está asociada a los grupos funcionales del material. Sin embargo, los grupos funcionales de la celulosa, la hemicelulosa y la lignina son en su mayoría -OH y la interacción de este grupo funcional con el Cu2+ se evidenció por XPS.
El material COH mostró una mayor capacidad de adsorción de iones de cobre, razón por la cual fue escogido para las pruebas de adsorción de fluoruros. El objetivo principal era conocer las potencialidades de este material para ser reutilizado en un nuevo proceso. El mejor ajuste matemático se obtuvo con el modelo de Freundlich que señala que el material es heterogéneo. En este caso, la heterogeneidad del material está relacionada con la distribución de los grupos funcionales y el Cu2+ adsorbido en la superficie. Aplicando el modelo de Langmuir se determinó que el material reutilizado COH-Cu tiene una capacidad de adsorción de 1.6 mg/g frente a fluoruros. Este resultado es menor que el reportado para otros materiales, sin embargo, es importante considerar que esos materiales sólo se utilizaron una vez o que se reciclan buscando remover el mismo contaminante. Por esta razón se pudo concluir que el material COH-Cu presentó una razonable capacidad de adsorción considerando su naturaleza de material reciclado. Es probable que la capacidad de adsorción de este material frente a los fluoruros se incremente notablemente si se utiliza antes de la remoción de cobre, vale decir, como material nuevo. Sin embargo, eso dejaría de lado el objetivo principal de nuestro estudio. Por tanto, se concluye que la cáscara de cacahuate es un residuo económico que puede utilizarse como material adsorbente en el proceso de remoción de dos contaminantes en serie con resultados satisfactorios.
CONCLUSIONES
De los dos lavados a los que se sometió la cáscara de cacahuate, el de la solución de NaOH resultó ser el más eficiente ya que limpió los poros de impurezas por lo que hubo mayor cantidad de sitios activos y se logró una mayor remoción de iones de cobre de las soluciones acuosas. Hay que destacar que el material no se saturó por completo, lo que permitió su reutilización para la remoción del F-.
La distribución de iones de flúor en el material con cobre adsorbido ocurrió en toda la superficie, es decir que el Cu2+ y los sitios de adsorción libres del cacahuate permitieron al F- adherirse al material a través de interacciones por puente de hidrógeno. En este proceso intervinieron los sitios de adsorción característicos de la celulosa, la hemicelulosa y la lignina. Se concluye que la cáscara de cacahuate es un material de bajo costo que puede no sólo ser utilizado para la remoción de cobre sino también en un segundo proceso como material adsorbente de otro contaminante distinto, como lo es el F-.











 nueva página del texto (beta)
nueva página del texto (beta)


