INTRODUCCIÓN
El uso indiscriminado de plaguicidas se ha convertido en un problema a escala local y mundial. Las personas que manejan estas substancias se encuentran continuamente expuestas a los ingredientes activos y coadyuvantes que potencializan su actividad, los cuales llegan a causar intoxicaciones que generan desde signos y síntomas puntuales agudos hasta secuelas y efectos crónicos (Bejarano-González 2017). De acuerdo con Boedeker et al. (2020), cerca de 385 millones de casos de intoxicación aguda no intencionada por plaguicidas ocurren en el mundo, incluidas 11 000 muertes. Además, se estima que alrededor de 25 millones de trabajadores agrícolas en el mundo sufren algún tipo de envenenamiento ocupacional asociado al manejo de plaguicidas (IPEN 2009). En México, la Dirección General de Epidemiología reportó 2893 casos de intoxicaciones agudas por plaguicidas en 2018 (SSA 2021). Actualmente los plaguicidas más utilizados y responsables del mayor número de intoxicaciones agudas son de tipo organofosforado (OF), sobre todo en poblaciones expuestas ocupacionalmente (Sánchez-Guerra et al. 2011, Daza-Arana et al. 2019). Además de las intoxicaciones agudas, diversos estudios han demostrado efectos crónicos en la salud humana después de la exposición crónica a estos compuestos, tales como incremento de alteraciones neurofisiológicas, endocrinas, inmunológicas (Virú-Loza 2015) y hematológicas (Moura-Rodrigues et al. 2020). Los OF actúan principalmente sobre el sistema nervioso central inhibiendo la acetilcolinesterasa, lo cual resulta en acumulación de acetilcolina en las uniones colinérgicas con la subsecuente sobreexcitación de receptores muscarínicos y nicotínicos de la acetilcolina, produciendo efectos neurotóxicos como mareos, pérdida de conciencia, convulsiones y neuropatías retardadas, entre otros (Naughton y Terry 2018). La desulfuración oxidativa es una de las primeras reacciones de biotransformación que ejercen los microsomas hepáticos sobre los plaguicidas OF. De esta reacción se generan compuestos oxonificados, “oxones”, los cuales se caracterizan por poseer una mayor toxicidad en comparación con sus compuestos padres; por ejemplo, el malaoxon, paraoxon, clorpirifos-oxon son mejores inhibidores de la acetilcolinesterasa en comparación con el malatión, paratión y clorpirifos, respectivamente (Jokanović 2001). Una de las enzimas claves en la hidrólisis de estos compuestos oxonificados es la paraoxonasa 1 (PON1), la cual transforma los metabolitos oxónicos en compuestos más polares que pueden ser eliminados por la orina (Furlong et al. 2010, Mackness y Mackness 2013), de manera que esta enzima es una molécula que protege al sistema nervioso contra la neurotoxicidad de dichos compuestos (She et al. 2012, Ayhan et al. 2017).
La PON1 es un miembro de una familia multigénica que incluye PON2 y PON3 (Costa et al. 2013). Esta glucoproteína es sintetizada en el hígado y excretada al torrente sanguíneo asociada a lipoproteínas de alta densidad (HDL). Su acción biológica endógena es la hidrólisis de lipoproteínas de baja densidad (LDL) oxidadas, por lo cual es considerada como una enzima antioxidante (Shunmoogam et al. 2018). Existen diferentes factores con la capacidad para modular la actividad de PON1, entre los que destacan los de tipo extrínseco como la dieta, medicamentos, hábitos tabáquicos y alcohólicos, así como la exposición a contaminantes ambientales, y los intrínsecos del sujeto como sexo biológico, edad y polimorfismos genéticos (Fridman et al. 2011). Los individuos que están continuamente expuestos a plaguicidas tienden a presentar niveles bajos de PON1 (Herrera-Moreno et al. 2021) y tienen mayor predisposición a desarrollar enfermedades cardiovasculares (Moreno-Godínez et al. 2018, Ponce-Ruiz et al. 2020), así como síntomas de intoxicación aguda (Ceja-Gálvez et al. 2020). La PON1 se ha descrito como una vía importante de detoxificación de plaguicidas OF y recientemente se ha propuesto como un biomarcador de susceptibilidad a los efectos por la exposición a OF, ya que se ha observado una disminución de las actividades arilesterasa (AREasa) e hidrolasa del 4-clorometil-fenil-acetato (CMPAasa) de PON1 en poblaciones ocupacionalmente expuestas a estos compuestos (Richter et al. 2008, Araoud et al. 2010, Bernal-Hernández et al. 2014).
Por otro lado, la exposición de tipo ocupacional a OF en México se asocia con múltiples actividades como la agricultura en campos abiertos e invernaderos, campañas sanitarias para erradicar las enfermedades transmitidas por vectores, control de plagas urbanas, actividades de jardinería y fabricación, formulación o importación de plaguicidas (Martínez-Valenzuela y Gómez-Arroyo 2007). Los fumigadores o aplicadores regulares de plaguicidas son una población especialmente vulnerable por el alto riesgo de exposición que implica su trabajo, debido al manejo de productos concentrados y diluidos, la producción de diversas formulaciones desde su preparación hasta su aplicación durante la jornada laboral, y la frecuencia de uso en diferentes periodos de aplicación (Herrera-Moreno et al. 2018). En México, las enfermedades transmitidas por vectores se han incorporado a la agenda de prioridades de atención debido a la incidencia e impacto sobre la morbilidad y mortalidad. Las campañas para reducir las poblaciones de vectores trasmisores de enfermedades como dengue, chikungunya, zika, paludismo, chagas, oncocercosis y alacranismo se realizan principalmente a través del control químico, utilizando plaguicidas (CENAPRECE 2017). Estas acciones pueden magnificarse por la incidencia de las enfermedades anteriormente mencionadas o por factores climatológicos. Con este panorama, los fumigadores urbanos son una población vulnerable por el riesgo de exposición que implica su actividad laboral y los efectos en su salud. El objetivo de este trabajo fue evaluar los niveles de PON1 y su relación con los factores de riesgo que pueden modificar su concentración en una población de fumigadores urbanos del sector salud en el estado de Guerrero.
MATERIALES Y MÉTODOS
Se invitó a participar a trabajadores del sector salud en el área de control de vectores, pertenecientes a las regiones Acapulco, Centro, Costa Grande y Costa Chica del estado de Guerrero (Fig. 1). La población fue informada sobre los objetivos generales del estudio y su participación fue voluntaria mediante la firma de una carta de consentimiento informado. Como criterios de inclusión se consideraron que fueran empleados del área de control de vectores, que aplicaran plaguicidas y que fueran mayores de edad. Se incluyó un grupo testigo de trabajadores del sector salud, pareados por edad, que no realizan actividades relacionadas con el uso de plaguicidas.
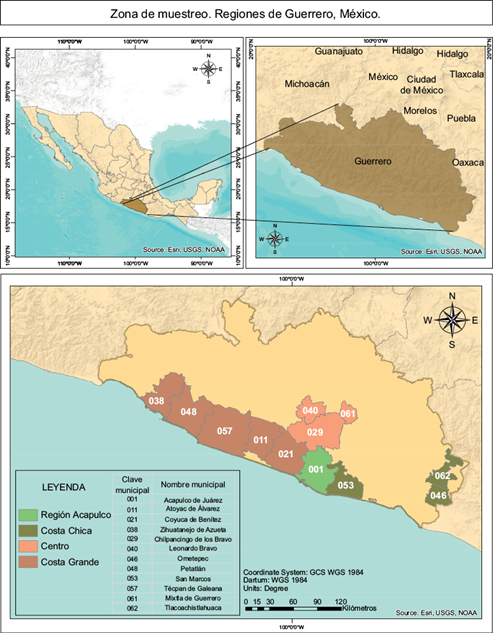
Fig. 1 Ubicación de las regiones donde realizan sus actividades laborales los fumigadores participantes en el estudio.
Aplicación del cuestionario
A cada participante se le aplicó un cuestionario estructurado para conocer sus características generales y antropométricas, estilo de vida, vivienda y hábitos de salud, así como para caracterizar la exposición a plaguicidas y condiciones laborales (años de exposición, duración de jornada laboral, plaguicidas utilizados y uso de equipo de protección personal [EPP]).
Obtención de la muestra biológica
Se obtuvieron muestras de sangre por punción venosa con el sistema Vacutainer (Becton, Dickinson) en tubos sin anticoagulante (5 mL) y se obtuvo el suero para la cuantificación de la concentración de PON1.
Concentración de los niveles de PON1
Las concentraciones de PON1 se midieron con un kit de enzimoinmunoanálisis de adsorción (ELISA) de doble anticuerpo (SEA243Hu; Cloud One, Texas, EU). Se utilizó una placa de 96 pocillos recubierta de anticuerpo específico para PON1. Se siguieron las instrucciones del fabricante; se adicionaron a los pocillos 100 μL de los estándares y de las muestras séricas, que posteriormente se incubaron a 37 ºC durante 1 h; la placa se lavó tres veces usando PBS (buffer de fosfatos salinos; pH: 7.0). Se adicionaron 100 μL de reactivo A y se incubó la muestra a 37 ºC por 30 min. Se realizó un segundo lavado de tres tiempos y se adicionaron 100 μL de reactivo B para incubarse por 30 min a 37 ºC. Se realizó un tercer lavado de cinco tiempos con 350 mL de buffer y se adicionaron 90 μL de sustrato TMB (peroxidasa de rábano). La placa se incubó durante 20 min a 37 ºC. Para detener la reacción enzima-sustrato se adicionaron 50 μL de solución de paro. Finalmente se leyó la absorbancia a 450 nm utilizando un lector de multiplacas Multiskan Go (Thermo Fisher). Las concentraciones séricas de PON1 fueron estimadas utilizando una curva de calibración con los estándares de 3.12, 6.25, 12.5, 25, 50 y 100 ng/mL.
Análisis estadísticos
Se integró una base general de datos con las variables obtenidas en las encuestas y los datos analíticos. Se realizó un análisis estadístico descriptivo de las características antropométricas de la población, incluyendo el cálculo de medias y porcentajes. Se consideraron estadísticamente significativos los valores de p < 0.05. Se utilizó la prueba U de Mann-Whitney para comparar el rango medio de las concentraciones de PON1 entre los grupos de estudio. Se realizó un análisis de componentes principales (PCA) para determinar las variables que explican una mayor variación en el estudio. Todas las variables fueron transformadas para cumplir con los supuestos paramétricos y posteriormente estandarizadas. Las variables binarias se consideraron como variables ficticias. Se consideraron aquellas variables que explicaran la mayor variación en los primeros dos componentes para los análisis posteriores (Greenacre y Primicerio 2013). Se evaluó el efecto de cada variable empleando modelos lineales generalizados (GLM) asumiendo una distribución gaussiana (Crawley 2013). A continuación, se utilizó la función “dregde” del paquete MuMIn para crear combinaciones de hasta dos variables explicativas y el modelo nulo. Se ordenaron los modelos utilizando el criterio de información de Akaike (AIC) corregido para muestras pequeñas (AICc) y se seleccionaron los modelos con una diferencia AICc < 2 como aquellos mejor asociados a los datos (Burnham y Anderson 2002). Por último, se analizó el efecto relativo de cada variable utilizando una aproximación de información teórica y una inferencia de multimodelos. Para ello, se seleccionó un subgrupo de modelos que tuvieran el 95 % de probabilidad de contener el mejor modelo. Estos modelos fueron seleccionados usando la suma de pesos Akaike (wi) hasta Σwi < 0.95. Se usaron los pesos Akaike de cada modelo para calcular la importancia relativa y los parámetros promedio de cada variable explicativa (Burnham y Anderson 2002). Todos los análisis se realizaron utilizando los paquetes estadísticos SPSS y RStudio.
RESULTADOS
Características generales de la población
En el estudio participaron 113 individuos: 67 fumigadores del sector salud del estado de Guerrero y 46 individuos como grupo testigo. La mediana de edad fue de 37 años para el grupo de fumigadores. El 81 % de los fumigadores fueron del género masculino. El nivel de escolaridad promedio de este grupo fue de preparatoria (48 %). Los fumigadores presentaron una media de índice de masa corporal (IMC) de 29.6 ± 5.2, y de éstos el 31 % presentó sobrepeso de acuerdo con los puntos de corte de la OMS (2021) (Cuadro I). Los participantes laboran en cuatro de las siete regiones que conforman el estado de Guerrero, siendo en su mayoría pertenecientes a las regiones Centro (n = 36), Costa Chica (n = 23) y Costa grande (n = 8) (Fig. 1).
CUADRO I CARACTERÍSTICAS GENERALES DE LA POBLACIÓN DE ESTUDIO.
| Fumigadores (n = 67) | Testigos (n = 46) | Valor p | |
| Edad (años)* | 37 (31-46) | 31 (23-46) | 0.040 |
| Género | |||
| Masculino (n/%) Femenino (n/%) |
54/81 13/19 |
46/100) 0 |
0.001 |
| IMC (kg/m2)** Bajo peso (n/%) Peso normal (n/%) Sobrepeso (n/%) Obesidad tipo I (n/%) Obesidad tipo II (n/%) Obesidad mórbida (n/%) |
29.6 ± 5.2 1/1.5 13/19.3 21/31.3 20/30 11/16.4 1/1.5 |
27.81 ± 6.2 0 11/23.9 21/45.7 11/23.9 3/6.5 0 |
0.098 |
| Escolaridad*** Primaria (n/%) Secundaria (n/%) Preparatoria (n/%) Licenciatura (n/%) Posgrado (n/%) |
4/6 15/22.3 32/48 15/22.3 1/1.4 |
3/6.6 5/10.9 13/28.3 24/52.1 1/2.1 |
0.019 |
| Hábito tabáquico (n/%)*** | 17/57 | 13/43 | 0.730 |
| Consumo de alcohol (n/%)*** | 49/57 | 37/43 | 0.790 |
*Los datos representan la mediana (percentiles 25-75). El valor de p se estimó mediante U de Mann-Whitney.
**Los datos representan la media ± desviación estándar. El valor de p se estimó mediante la prueba t de Student. El índice de masa corporal (IMC) se categorizó de acuerdo con la OMS (2021).
***Los datos representan la frecuencia absoluta (frecuencia porcentual). El valor de p se estimó mediante χ2.
Características de la exposición a plaguicidas
Los fumigadores llevan en promedio seis años dedicados a esta actividad, aunque hay fumigadores que tienen hasta 41 años de antigüedad laboral; aplican plaguicidas en promedio 6.3 horas diarias en una jornada laboral de 7.8 horas. El 52 % de los fumigadores tenían ≤ 7 días de haber fumigado. Para realizar su trabajo, los componentes del EPP que refirieron fueron: guantes, cubrebocas o mascarilla, camisa/overol, botas especiales y gafas; el 45 % de los participantes refirió utilizar de uno a dos componentes del EPP, siendo el cubrebocas el elemento más utilizado. Cabe aclarar que el 39 % no utiliza ningún elemento del EPP (Cuadro II).
CUADRO II CONDICIONES LABORALES Y CARACTERÍSTICAS DE LA EXPOSICIÓN A PLAGUICIDAS EN LOS FUMIGADORES ESTUDIADOS.
| n = 67 | Medida de tendencia central y dispersión |
| Tiempo laborando en el trabajo actual (años)* | 6 (0.2-41) |
| Jornada laboral (horas) | 7.86 ± 0.35 |
| Tiempo fumigando/día (horas) | 6.33 ± 2.53 |
| Fecha de ultima aplicación de plaguicidas** | |
| ≤ 7 días > 7días | 34 (52) 32 (48) |
| Equipos de protección utilizados al fumigar** | |
| No utiliza 1-2 equipos 3-4 equipos ≥ 5 equipos | 26 (39) 30 (45) 9 (13) 2 (2) |
*Los datos representan la mediana (rangos: mínimo - máximo). **Los datos representan la n(%).
Plaguicidas utilizados en actividades de fumigación para control de vectores
Los fumigadores refirieron que los compuestos más utilizados para las actividades de fumigación urbana en el estado de Guerrero durante los años que llevan laborando son los insecticidas. De éstos, los más empleados pertenecen al grupo de los carbamatos (38 %), seguido de los organofosforados (32 %), bioplaguicidas (16 %), piretroides (10 %), organoclorados (1 %), y otros (3 %). De acuerdo con la clasificación de la OMS (2020), el 61 % de los plaguicidas utilizados por los fumigadores pertenecen al grupo “II” considerados como moderadamente peligrosos, el 31 % pertenecen al grupo “III” considerados ligeramente peligrosos, y sólo el 8 % es clasificado como altamente peligroso, (Cuadro III y Fig. 2).
CUADRO III PLAGUICIDAS UTILIZADOS POR LOS FUMIGADORES Y SUS CARACTERÍSTICAS TOXICOLÓGICAS SEGÚN LA OMS (2020).
| Ingrediente activo | Grupo químico | Toxicidad | n (%) |
| Temefos | Organofosforado | III | 79 (32%) |
| Diclorvos | Ib | ||
| Malatión | III | ||
| Clorpirifos | II | ||
| Bendiocarb | Carbamato | II | 95 (38%) |
| Proporxur | II | ||
| Bacillus turingensis | Bioplaguicida | III | 39 (16%) |
| Esbioaletrina/Permetrina | Piretroide | II | 25 (10%) |
| Lamdacialotrina | II | ||
| Deltrametrina | II | ||
| Cipermetrina | II | ||
| DDT | Organoclorado | II | 2 (1%) |
| Otros | 8 (3%) | ||
| Total | 248 (100%) |
Ib: altamente peligroso, II: moderadamente peligroso, III: ligeramente peligroso, DDT: diclorodifeniltricloroetano.
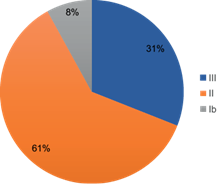
Fig. 2 Frecuencia de uso de plaguicidas en la población de estudio de acuerdo con la clasificación de peligrosidad de la OMS (2020). Ib: altamente peligrosos; II: moderadamente peligrosos; III: ligeramente peligrosos.
Sintomatología asociada con la exposición a plaguicidas
Los principales síntomas reportados por los fumigadores participantes fueron: irritación de la mucosa nasal y bucal, picor ocular, estomatitis, rinitis y tos (24 %); fatiga (12 %); cefalea (10 %); mareo (9 %); irritación de la piel (7 %); náusea (5 %); dificultad para respirar (5 %); temblores (5 %); alteración del sueño (4 %); opresión en el pecho (4 %); calambres (4 %), y otros síntomas (11 %) (Fig. 3).
Concentración de PON1
De acuerdo con la prueba estadística U de Mann-Whitney para comparar el rango medio de las concentraciones de PON1, se observó que hubo diferencias significativas entre grupos (p < <0.05), siendo mayores en el grupo de fumigadores (21.20 ng/mL [mínimo: 10.2 ng/mL; máximo: 29.2 ng/mL]) respecto al grupo testigo (18.70 ng/mL [mínimo: 6.0; máximo: 29.9 ng/mL]) (Fig. 4). Con base en el análisis de PCA y del modelo lineal generalizado, en la figura 5 se observan la importancia y los efectos relativos de los factores de riesgo sobre las concentraciones de PON1. En este sentido, la variable que tuvo mayor efecto positivo y significativo fue el número de plaguicidas que utiliza la población (NP). Las variables que tuvieron un efecto negativo significativo fueron el índice de masa corporal (IMC), antecedentes de diabetes (AD) y consumo de alcohol (CA).
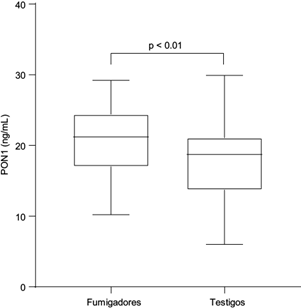
Fig. 4 Concentraciones de paraoxonasa 1 (PON1) en la población de estudio. El inicio de la caja representa el percentil 25, la línea media el percentil 50 y el final de la caja el percentil 75. La barra de error inferior representa el valor mínimo y la barra de error superior indica el valor máximo. El valor de p se estimó utilizando la prueba U de Mann-Whitney.
DISCUSIÓN
Los plaguicidas son compuestos químicos utilizados en la agricultura y para el control de vectores transmisores de enfermedades. En esta última actividad, son utilizados en programas operativos y actividades básicas por el Departamento de Control de Vectores en México (CENAPRECE 2017), siendo los fumigadores urbanos los responsables de llevar a cabo dichas tareas; por lo tanto constituyen una población vulnerable por el uso constante de diferentes productos fumigantes.
Por otro lado, la PON1 es una proteína cuya función es detoxificar al organismo de metabolitos oxónicos de los OF (Furlong et al. 2010, Cerón et al. 2014), por lo que se ha reportado que resulta afectada en grupos que continuamente utilizan productos OF como fumigantes (Sato et al. 2016). Así, el objetivo de este trabajo fue investigar la concentración de PON1 y su relación con los factores de riesgo en una población de fumigadores urbanos en el estado de Guerrero, México. Los resultados mostraron que la concentración de PON1 sérica fue diferente en los grupos de estudio, siendo el grupo de fumigadores el que presentó mayor concentración de PON1 (21.2 ng/mL) con relación al grupo testigo (18.7 ng/mL). Además, los resultados demuestran que algunos factores intrínsecos y extrínsecos de los individuos, como IMC, consumo de alcohol, antecedentes de diabetes y número de plaguicidas utilizados pueden modificar la concentración de PON1 en la población afectada (Fig 5).
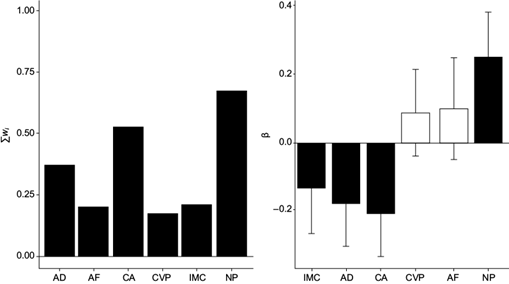
Fig. 5 Importancia y efectos relativos de las variables sobre las concentraciones de la paraoxonasa 1 (PON1) en fumigadores de las regiones del estado de Guerrero, México. La suma de los pesos Akaike (∑wi) representa la importancia de cada variable. Los efectos de cada variable fueron calculados al promediar los parámetros (β) de cada modelo en que aparecieron. Las barras representan el error estándar incondicional y las columnas en color negro indican que las variables tienen un efecto significativo sobre PON1, mientras que las columnas blancas indican que esa variable no tuvo efecto significativo. IMC: índice de masa corporal; AD: antecedentes de diabetes; CA: consumo de alcohol; CVP: consumo de vitaminas y complementos alimenticios; AF: años que llevan fumigando; NP: número de plaguicidas utilizados.
La población refirió utilizar principalmente plaguicidas de tipo carbamato seguidos de plaguicidas OF para el control de vectores transmisores de enfermedades. Estos datos concuerdan con otros estudios publicados (Benítez-Trinidad et al. 2018) y con lo autorizado por el Centro Nacional de Programas Preventivos y Control de Enfermedades (CENAPRECE), organismo encargado de conducir e implementar los programas sustantivos para la prevención y control de enfermedades transmitidas por vectores en 2018. Es importante resaltar que la población de estudio utiliza bioplaguicidas formulados a partir de Bacillus thuringensis y Sacharomyces spinoza para el control de vectores. Al respecto, el uso de bioplaguicidas se ha implementado como una nueva forma de combatir las plagas, disminuyendo el impacto ambiental y los efectos tóxicos de los plaguicidas químicos (Silveira et al. 2018).
Por otro lado, el grupo de estudio refirió llevar laborando seis años en promedio (0.2-41 años), con jornadas laborales cercanas a 7.8 h diarias y aproximadamente 6 h de fumigación. Ante esta aplicación constante e intensificada, durante el periodo de lluvias pueden aumentar las repercusiones en la salud de la población, debido a que las áreas consideradas en este estudio son principalmente tierras bajas correspondientes a las regiones Costa Grande, Acapulco y Costa Chica, donde predominan los climas cálidos y subhúmedos que se caracterizan por una marcada estacionalidad de lluvias en verano, temperatura media anual mayor de 22º C y alta saturación de humedad atmosférica (Urban et al. 2014). Esto explica que los factores climáticos tengan una influencia directa en la intensificación de las actividades de fumigación urbana y en las medidas de protección que utilizan los fumigadores en el trabajo de campo.
Además, se ha reportado que sujetos crónicamente expuestos a plaguicidas muestran una actividad de PON1 reducida en comparación con las personas no expuestas (Araoud et al. 2010). Se ha identificado que realizar actividades directamente asociadas con la aspersión de plaguicidas disminuye la actividad de PON1 (Xotlanihua-Gervacio et al. 2019), lo cual sugiere que el impacto negativo sobre la actividad de PON1 está directamente relacionado con la duración de la jornada laboral asociada a la aspersión de plaguicidas.
Los síntomas más frecuentes referidos por la población de estudio fueron irritación de la mucosa nasal y bucal, debilidad/fatiga, dolor de cabeza y mareo, síntomas que han sido reportados en otros estudios (Do Nascimento et al. 2017, Muñoz-Quezada et al. 2017, Hutter et al. 2021). Desde el punto de vista biológico, esto es plausible debido a que el mecanismo de acción de los plaguicidas de tipo OF y carbamato consiste en la inhibición de la acetilcolinesterasa (Nagaraju et al. 2014), lo que altera los receptores muscarínicos y nicotínicos responsables de la sintomatología aguda que se presenta en casos de intoxicación aguda (Virú-Loza 2015).
Cabe destacar que el 45 % de la población expuesta utiliza de uno a dos componentes del EPP, mientras que el 39 % no utiliza ningún elemento. En este sentido, se muestra que más del 50 % de los plaguicidas utilizados pertenecen al grupo II, considerados moderadamente tóxicos, el 31 % pertenecen al grupo III, considerados ligeramente tóxicos, y el 8 % están clasificados como altamente tóxicos de acuerdo con la clasificación de la OMS (2020). Cabe resaltar que esta clasificación es contradictoria, ya que el malatión está clasificado como ligeramente peligroso, en tanto que el clorpirifos y el DDT están clasificados como moderadamente peligrosos (OMS 2020), a pesar de que diversos estudios han reportado numerosos efectos adversos a la salud por exposición crónica a estos plaguicidas (Darwiche et al. 2018, Mie et al. 2018, Badr 2020, La Merrill et al. 2020). De ahí la necesidad de contar con mayor evaluación del riesgo y destacar la importancia de utilizar el EPP adecuado y completo durante las jornadas de fumigación para evitar intoxicaciones agudas y/o crónicas con el tiempo de exposición.
En este estudio se observó que las concentraciones de PON1 difirieron entre grupos, siendo mayor en los fumigadores (mediana = 21.2 ng/mL) respecto al grupo testigos (mediana = 18.7 ng/mL) (Fig. 4). Nuestra hipótesis a priori consideraba que las concentraciones de PON1 serían menores en el grupo de fumigadores; sin embargo, las concentraciones de PON1 pueden verse afectadas por factores intrínsecos y extrínsecos al individuo. Al respecto, los resultados obtenidos sugieren que las concentraciones de PON1 podrían ser modificadas en función del número de plaguicidas utilizados (NP), así como la antigüedad laboral (AF) en la población estudiada (Fig. 5). Otra posibilidad es que ante la presencia de oxones en el organismo se promueva una mayor síntesis de PON1, como un mecanismo compensatorio que podría resultar en la hidrólisis de estos compuestos. Xotlanihua-Gervacio et al. (2019) también reportaron la influencia de factores externos e internos sobre la actividad de PON1. Estos resultados muestran la necesidad de realizar nuevos estudios que permitan caracterizar la influencia de otras variables internas, tales como determinar el genotipo y fenotipo de PON1, así como factores epigenéticos que han demostrado modular la capacidad funcional de PON1 (Costa et al. 2013).
En cuanto a los factores de salud, se observó que los fumigadores con antecedentes de diabetes (AD) presentaron concentraciones bajas de PON1. Al respecto, la PON1 está unida a las HDL y es la responsable de ejercer su función antiaterogénica y cardioprotectora, ya que ayuda a reducir la oxidación de LDL (Fridman et al. 2011). Por lo tanto, ante enfermedades como la diabetes y trastornos cardiovasculares, la PON1 está disminuida (Moreno-Godínez et al. 2018). Además, el 61 % de los fumigadores tiene sobrepeso, factor que disminuye las concentraciones de PON1. Éste es un factor de riesgo para el desarrollo de enfermedades cardiovasculares incluida la enfermedad coronaria (Seres et al. 2010, Sánchez-Arias et al. 2016).
También se observó que las concentraciones de PON1 aumentaron en los fumigadores que refirieron consumir complejos multivitamínicos, principalmente vitaminas del complejo B y ácido fólico. Esto podría deberse a que la variación individual de la actividad de PON1 se atribuye al consumo de vegetales y suplementos dietéticos, por ejemplo el consumo de extractos y/o zumos de frutos ricos en antioxidantes y polifenoles. Asimismo, el consumo de vitaminas C y E incrementan la actividad de paraoxonasa y arilesterasa de PON1 (Mata et al. 2012, Lou-Bonafonte et al. 2015, 2017). Por otra parte, se ha reportado que el consumo de 10 a 30 g de alcohol al día incrementa la actividad de PON1, en comparación con los individuos que consumen de 0.1 a <10 g de alcohol al día, mientras que el consumo de más de 30 g al día de alcohol se asoció con reducción de la actividad de PON1 (Gruppen et al. 2018).
En el presente estudio encontramos que el número de plaguicidas utilizados (NP) y los años de fumigación (AF) incrementaron la concentración de PON1, aunque la segunda variable no lo hizo de manera significativa, sugiriendo que existen factores de riesgo ocupacional que podrían generan una variación considerable en las concentraciones de PON1, como se ha observado en otros estudios (Seung et al. 2012, Costa et al. 2013). Los resultados obtenidos indican la existencia de factores de riesgo adicionales que deben ser considerados cuando se evalúen políticas de riesgo a la salud ligado al uso de plaguicidas. Si bien las variables de ocupación laboral representan un riesgo para la salud de los trabajadores, los hábitos de salud son de gran relevancia en la variación de las concentraciones de la enzima.
CONCLUSIONES
En este estudio encontramos que la concentración de PON1 es modificada por diversos factores intrínsecos y extrínsecos del individuo, como exposición laboral. Estos hallazgos deben de ser considerados para estimar el riesgo a la salud de las personas expuestas a plaguicidas de manera ocupacional y ambiental con el fin de establecer consideraciones y recomendaciones sobre el uso de estos productos. Su impacto también debe valorarse en escalas temporales más amplias y con seguimientos en periodos de alta y baja exposición para identificar las variables que afectan no solamente la concentración de PON1, sino también su actividad.











 nueva página del texto (beta)
nueva página del texto (beta)



