INTRODUCCIÓN
Los productos obtenidos a partir de fuentes renovables, como los residuos agroindustriales o materias primas de bajo costo, son de especial interés debido a que permiten aminorar el impacto ambiental reduciendo fuentes de contaminación o bien los costos en el tratamiento y disposición de dichos residuos en la industria. En décadas anteriores se ha buscado una oportunidad de aprovechamiento tanto de residuos como de materias primas que no cumplen con los requerimientos necesarios para procesos industriales. Un ejemplo de esto es la cebada maltera, la cual debe cumplir con especificaciones y parámetros para ser utilizada en el proceso de malteo dentro de la producción de cerveza, ya que éste es su único mercado en el país (Aguilar y Schwentesius 2004). En México, de acuerdo con la Organización de las Naciones Unidas para la Alimentación y la Agricultura (FAO 2018), desde hace varias décadas se incrementó la producción de cebada maltera. Según datos del Servicio de Información Agroalimentaria y Pesquera (SIAP 2018) hasta fines de 2017, los principales estados productores de cebada maltera fueron Guanajuato (369 176 t), Hidalgo (240 283 t), Tlaxcala (87 351 t), Puebla (84 615 t) y el Estado de México (50 836 t), representando el 37, 24, 9, 8.4, y 5 % de la producción nacional, respectivamente.
De acuerdo con la norma NMX-FF-043-SCFI-2003 (SEECO 2003), una cebada de buena calidad debe cumplir con varias especificaciones: humedad (11.5 y 13.5 %), germinación mínima (85 %), grano dañado (máximo 10 %), peso hectolítrico mínimo (de 56 y 58 kg/hL para cebada de seis y dos hileras, respectivamente), y parámetros como color, olor y tamaño, los cuales son dependientes de las condiciones medioambientales que prevalecen durante el desarrollo y maduración del grano. Sin embargo, en México, cada año grandes cantidades de cebada que no cumplen con dichas especificaciones y parámetros son rechazadas por la industria maltera. Esta cebada de baja calidad no tiene prácticamente otro nicho de mercado, y suele ser utilizada como alimento para ganado (Aguilar y Schwentesius 2004).
Por otra parte, diversos tipos de residuos agroindustriales con alto contenido de celulosa, hemicelulosa, xilano, lignina y pectina, como el bagazo de caña, residuos de uva, cáscara de avena y trigo, entre otros, se han utilizado como sustratos para la producción y evaluación de sistemas enzimáticos, principalmente aquellos que son inducibles como las celulasas (Botella et al. 2005), las xilanasas, las proteasas (Oliveira et al. 2006), las pectinasas (Castilho et al. 2000) y las lipasas (Godoy et al. 2009). En el caso de la cebada es posible aprovechar el almidón, que representa en promedio 53 % del peso del grano (Vasanthan y Hoover 2009), para obtener productos de valor agregado como enzimas amilolíticas de importancia industrial.
Djekrif et al. 2015 reportaron que levaduras como Cryptococcus, Trichosporon, Saccharomycopsis, Lipomyces, Candida, Rhodotorula, Clavispora, Filobasidium y Aureobasidium producen enzimas amilolíticas tales como α-amilasas, glucoamilasas, glucosidasas, pululanasas y ciclodextrinasas, a partir de diferentes sustratos, y pueden ser aplicadas en la industria de la sacarificación del almidón. Aureobasidium pullulans produce al menos cuatro tipos de enzimas amilolíticas extracelulares usando diferentes sustratos para su inducción (Saha et al. 1993).
A continuación, se describen: la glucoamilasa exoenzima que hidroliza los enlaces α-1,4 y α-1,6 para liberar D-glucosa a partir de almidón y polisacáridos similares (Sauer et al. 2000); la α-glucosidasa, una exoenzima que hidroliza los enlaces α-1,4, liberando glucosa, de manera menos eficiente que la glucoamilasa (Tomasik y Horton 2012); la β-glucosidasa, una endoenzima que hidroliza los enlaces β-glucosídicos de la estructura interna del almidón, liberando glucosa como principal producto (Hayashi et al. 1999); y la α-amilasa, una endoenzima que cataliza la hidrólisis de los enlaces α-1,4 glucosídicos en almidón, liberando productos de bajo peso molecular como glucosa, maltosa y maltotriosa (Demirkan et al. 2005). Las enzimas amilolíticas son de gran importancia en aplicaciones biotecnológicas, no sólo en la sacarificación de almidón, sino en diferentes industrias como la textil y la papelera (Gupta et al. 2003, Rana et al. 2013).
Por lo anterior, el objetivo de este trabajo fue la producción de enzimas amilolíticas usando la levadura A. pullulans a partir de almidón de cebada de baja calidad como sustrato y su aplicación en la sacarificación de almidón proveniente de distintas fuentes, en diferentes condiciones de temperatura, tiempo y concentración de sustrato para la producción de glucosa.
MATERIALES Y MÉTODOS
Aislamiento de almidón a partir de granos de cebada
La cebada (Hordeum vulgare) de baja calidad se obtuvo con un productor local en el estado de Hidalgo, México. La etapa de limpieza consistió en retirar las impurezas de mayor tamaño (piedras, restos florales, otros granos, etc.). Posteriormente se realizó un proceso de perlado, el cual consistió en hacer pasar el grano de cebada por una licuadora industrial durante 50 s, para retirar la cascarilla y obtener un grano íntegro. El aislamiento de almidón se realizó de acuerdo con Wang y Wang (2004), con algunas adecuaciones. La harina de cebada se obtuvo con un molino para granos y especias, ajustando la apertura de los discos para obtener un polvo ligeramente granulado, que fue macerado con hidróxido de sodio (NaOH) al 0.1 % a una relación de 1:2 (m/v) durante 18 h a 4 ºC, para remover las proteínas y lípidos que se encuentran unidos a los gránulos de almidón y favorecer la separación (Uthumporn et al. 2012). La mezcla se hizo pasar por los tamices núm. 100 y 200 US lavando con agua destilada en cantidad necesaria para retirar todo el almidón. La suspensión obtenida se centrifugó 15 min a 9240 g y 4 ºC; a partir del pellet se separó el almidón, se secó a 30 ºC por 24 h en un horno y se mantuvo a temperatura ambiente en un contenedor sellado (Bello et al. 2010).
Finalmente, se aplicó un pretratamiento con ácido clorhídrico (HCl) al 6 % para favorecer la hidrólisis durante las cinéticas de crecimiento. Se mezcló el almidón de cebada y HCl en una relación de 1:3 (p/v), se ajustó el pH a 5.5 y se mantuvo en agitación durante 6 h. Se centrifugó descartando el sobrenadante en las mismas condiciones descritas anteriormente, se dejó secar a temperatura ambiente, se molió en mortero y se conservó a temperatura ambiente para su posterior uso.
Microorganismo y condiciones de cultivo a nivel matraz
La cepa de la levadura Aureobasidium pullulans usada para la producción de enzimas amilolíticas fue ATCC®15233™. Para la propagación, se formuló un medio de cultivo ajustando la cantidad de almidón de cebada y fuente de nitrógeno (NH4Cl) para obtener tres relaciones carbono: nitrógeno (C:N) de 8, 15 y 20; adicionalmente, el medio contenía la siguiente composición en g/L: 5 extracto de levadura, 0.2 MgSO4·7H2O, 0.3 KH2PO4, 5 CaCO3 y 0.001 tiamina. Los experimentos se realizaron en matraces Erlenmeyer con 250 mL de medio, se inocularon con células obtenidas de una placa de la levadura en medio agar papa dextrosa (PDA, por sus siglas en inglés) incubada a 30 ºC, 24 h, recuperando las células, y se ajustaron en solución salina estéril a una cuenta celular de 5 × 107 células/mL. Los matraces se incubaron orbitalmente a 180 rpm a 30 ºC, pH 5.5. Se tomaron muestras cada 12 h, para realizar el conteo celular durante 48 h. El crecimiento celular se cuantificó microscópicamente por duplicado en la cámara de Neubauer, diluyendo las muestras del medio de cultivo en solución salina, seguida de una agitación vigorosa en orden de evitar la sedimentación celular (Dinorín et al. 2015).
Condiciones de cultivo a nivel reactor
Las fermentaciones se realizaron en un reactor de 7 L Biostat® A Plus (Sartorius). El medio de cultivo tenía la siguiente composición en g/L: 50 almidón de cebada, 8.6 NH4Cl, 5 extracto de levadura, 0.2 MgSO4·7H2O, 0.3 KH2PO4, 5 CaCO3 y 0.001 tiamina. Las condiciones de operación del reactor fueron 4 L de medio, 30 ºC, agitado a 600 rpm, 1.0 vvm (volumen de aire por volumen de medio por minuto) y pH 5.5 controlado automáticamente con ácido fosfórico e hidróxido de sodio. El inóculo del reactor (5 % v/v) se preparó a partir de una placa de PDA, inoculando 5 × 105 células/ml a un matraz de 1.0 L con 200 mL de medio líquido basado en el almidón de cebada descrito anteriormente, incubando durante 18 h a 200 rpm, 30 ºC. Se tomaron muestras cada 3 h para los análisis de crecimiento celular y actividades enzimáticas.
Obtención del extracto enzimático
A las 30 h de fermentación se cosechó todo el cultivo y se centrifugó durante 15 min a 9240 g y 4 ºC para eliminar las células y el almidón residual. El sobrenadante se filtró con una membrana de 0.45 µm y posteriormente ultrafiltrado, con una membrana de 50 kDa. El extracto liofilizado (0.016 mBar, -52 ºC) fue utilizado como fuente enzimática en ensayos posteriores. La concentración de proteína en el extracto enzimático fue determinada por el método de Lowry et al. (1951) usando como referencia albúmina de suero bovino (BSA) para generar la curva de calibración con un coeficiente de correlación de 0.9998.
Análisis de actividad enzimática de A. pullulans
Determinación de la actividad de glucoamilasa
Para determinar la actividad de glucoamilasa se preparó una mezcla de reacción que contenía 1 mL de una solución de 10 g/L de almidón soluble en una solución amortiguadora de acetato, 0.2 mol/L, pH 4.5 y 0.1 mL de extracto enzimático. Se incubó a 60 ºC por 30 min, se centrifugó 7 min, 9240 g y 4 ºC. La concentración de glucosa se determinó en un analizador bioquímico (2700 Select, Yellow Springs Instruments) con base en el método de la glucosa oxidasa. Una unidad de actividad de glucoamilasa se definió como la cantidad de enzima requerida para liberar 1 µmol de azúcares reductores (glucosa) por minuto en las condiciones de ensayo (Li et al. 2007a).
Determinación de la actividad de α-amilasa
El ensayo se realizó con una mezcla de reacción de 250 µL de solución amortiguadora de acetato 0.2 mol/L, pH 4.5, 250 µL de p-nitrofenil-α-D-maltósido, 0.002 mol/L (Sigma Aldrich®) y 50 µL de extracto enzimático. Se incubó durante 30 min a 70 ºC; la reacción se detuvo adicionando 1 mL de carbonato de sodio (Na2CO3) 2 mol/L y el nitrofenol liberado se midió por absorción a 410 nm. Una unidad α-amilasa fue definida como la concentración de enzima que libera 1 µmol de nitrofenol por minuto en la mezcla de reacción bajo las condiciones de ensayo (Silva et al. 2005).
Determinación de la actividad α-glucosidasa
Se realizó con una mezcla de reacción de 250 µL de solución amortiguadora de acetato 0.2 mol/L, pH 4.0, 250 µL de p-nitrofenil α-D-glucopiranósido 0.005 mol/L (Sigma Aldrich®) y 50 µL de extracto enzimático. Después de incubarse a 60 ºC por 30 min, la reacción se detuvo adicionando 1 mL de Na2CO3, 2 mol/L y el nitrofenol liberado se midió por absorción a 410 nm. Una unidad α-glucosidasa fue definida como la concentración de enzima que libera 1 µmol de nitrofenol por minuto en la mezcla de reacción en las condiciones de ensayo (Saha et al. 1993).
Determinación de la actividad β-glucosidasa
Para determinar dicha actividad se preparó una mezcla de reacción de 250 µL de solución amortiguadora de acetato 0.2 mol/L, pH 4.5, 250 µl p-nitrofenil-β-D-glucopiranósido 0.004 mol/L (Sigma Aldrich®) y 50 µL de extracto enzimático. Después de incubar a 60 ºC por 30 min, la reacción se detuvo adicionando 1 mL de Na2CO3, 2 mol/L y el color se midió a 410 nm. Una unidad de β-glucosidasa fue definida como la concentración de enzima que libera 1 µmol de nitrofenol por minuto en la mezcla de reacción en las condiciones de ensayo (Ribeiro et al. 2007).
Ensayos de sacarificación de almidón
Para evaluar la actividad de las enzimas amilolíticas producidas por A. pullulans, se realizaron ensayos de sacarificación usando almidón de cebada (AC) obtenido en este trabajo, almidón soluble (AS) de papa (S2004, Sigmal-Adrich®) y almidón de maíz (AM) de la empresa Ingredion. La mezcla de reacción consistió en 1 mL de solución de almidón y 100 µL de extracto enzimático con 0.84 mg/mL de proteína; se incubó a 60 ºC durante 30 min, agitándose a 200 rpm. Se centrifugó durante 10 min, 9240 g y 4 ºC. El extracto enzimático liofilizado fue disuelto con una solución amortiguadora de acetato 0.2 mol/L, pH de 4.5 y agua destilada. En todas las etapas del experimento se determinó la concentración de glucosa mediante el analizador bioquímico. Se usó el programa estadístico Statgraphics Plus v. 4.0 y se estableció para todos los análisis la significancia p < 0.05. Se realizaron análisis de varianza y comparaciones de rangos múltiples (Fisher) para elegir las condiciones más adecuadas de hidrólisis.
Los experimentos se realizaron de la siguiente manera: en la primera etapa se usó una concentración de 10 g/L para los tres almidones aplicando tres tratamientos. En el primero se usó como disolvente un amortiguador de acetato 0.2 mol/L, pH 4.5, debido a que se han reportado amilasas que tienen mayor actividad enzimática en un rango de pH ácido. En el segundo se usó agua destilada desionizada, pH 7.0, para comparar la actividad a pH no controlado y porque esta condición se usa a nivel industrial durante el proceso de sacarificación de almidón (Bentley 1999). En el tercer tratamiento, usando ambos disolventes, se determinó el efecto del ion Ca2+ al adicionar Ca2Cl2 (0.1 mol/L), del cual se ha reportado que tiene un rol importante en la estabilidad estructural y, por lo tanto, en la actividad enzimática de muchas amilasas (Ghollasi et al. 2013). Una vez seleccionadas las mejores condiciones de hidrólisis con una concentración de 10 g/L de almidón, en la segunda etapa se aplicó un proceso de gelatinización para favorecerla, incubando el almidón a 100 ºC durante 90 min, con agitación a 200 rpm. Posteriormente se desarrolló la reacción de hidrólisis, y se comparó la concentración de glucosa obtenida al usar almidón gelatinizado y sin gelatinizar (Bentley 1999, Konsula et al. 2004). En la tercera etapa se aumentó la concentración de almidón a 50, 100, 200 y 400 g/L, incubando a 30 min y 24 h, en las condiciones ya mencionadas, para determinar si aumenta la concentración de glucosa producida; se ha reportado que es posible gelatinizar una solución de almidón con 30-40 % de sólidos para posteriormente realizar la licuefacción (Bentley 1999).
Análisis de los productos de hidrólisis por cromatografía en capa fina
Los productos de sacarificación del almidón fueron analizados por cromatografía en capa fina (TLC, por sus siglas en inglés). Las mezclas de reacción de los diferentes experimentos de sacarificación se centrifugaron 10 min, a 9240 g y 4 ºC. Posteriormente, 1 µL de cada muestra se depositó en una placa de sílice 60 F254 (Merck). Se utilizó como testigo el almidón sin enzima correspondiente en cada caso (AC, AS y AM). El sistema de elución se preparó con butanol-etanol-agua-ácido acético (4:4:2:0.5 v/v/v/v), y se utilizó glucosa como estándar. Los productos fueron revelados rociando la placa con ácido sulfúrico en metanol al 10 % (v/v) y calentando a 100 ºC en un horno hasta la aparición de manchas de revelado (“spots” en inglés) de color café que indican la presencia de glucosa (Sarian et al. 2012).
RESULTADOS Y DISCUSIÓN
Aislamiento de almidón a partir de granos de cebada
Para obtener el almidón a partir de los granos de cebada, se realizó una extracción por molienda húmeda que implica la obtención de una suspensión (de color blanco) durante los lavados. La suspensión de almidón centrifugada presentó dos fases: café en la parte superior y blanca en la parte inferior. La fase café se debe al contenido de proteínas, fibra y gluten, mientras que la fase blanca corresponde al almidón (Vasanthan y Hoover 2009). Estas dos fases se forman debido a la diferencia de densidades de gluten hidratado (1.1 g/mL) en comparación con el almidón (1.5 g/mL), lo que facilita su separación al formar una pastilla. Los rendimientos de la etapa de limpieza y de extracción del almidón se presentan en los cuadros I y II, respectivamente. El rendimiento de 29 % de almidón del presente estudio es comparable al reportado por Quintos et al. (2009), quienes obtuvieron 35.9 y 30.2 % a partir de la cebada variedad Esmeralda Apan perlada y sin perlar, respectivamente, y de la variedad Esmeralda Almoloya 33.8 % perlada y 28.4 % sin perlar. Por otro lado, se considera moderado respecto a Prieto et al. (2009), quienes reportaron 60 % de rendimiento con cebada de buena calidad, utilizando cloruro de mercurio para favorecer la separación. Estos resultados indican que al tratarse de cebada de baja calidad podría ser materia prima potencial para obtener otros productos de interés.
CUADRO I RENDIMIENTOS OBTENIDOS EN LA ETAPA DE LIMPIEZA A PARTIR DE CEBADA
| Peso inicial (kg) | Peso grano (kg) | Rendimiento (%) | Peso grano (kg) | Peso harina (kg) | Rendimiento (%) | Rendimiento total (%) |
| 2.5 | 2.08 | 83.2 | 2.08 | 2.06 | 99 | 84 |
Evaluación del crecimiento de A. pullulans a nivel matraz
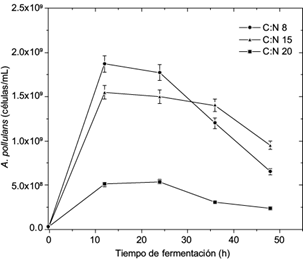
Las cinéticas de crecimiento de A. pullulans se desarrollaron en cultivos a nivel matraz en medio líquido ajustado a tres diferentes relaciones C:N, con el objetivo de generar biomasa. En la figura 1 se observa el comportamiento cinético de A. pullulans para las relaciones C:N 20, 15 y 8. A las 12 h la densidad celular (células/mL) fue de 5.37 × 108, 1.55 × 109 y 1.87 x 109 respectivamente. Se observó que posteriormente el crecimiento celular disminuye. Generalmente cuando se requiere propagar un cultivo a nivel reactor se debe de escoger la condición en que se obtenga un mejor crecimiento (cuentas celulares) en un tiempo adecuado. En las condiciones analizadas, la relación C:N 8 a las 12 h cubre esta característica y es la que se utilizó para el cultivo en reactor; se obtuvo con una concentración de 50 g/L de almidón de cebada y 8.6 g/L de NH4Cl. Las relaciones de C:N 15 y 20 presentaron un 15 y 71 % menor cantidad de células a las 12 h.
Cultivo a nivel reactor de A. pullulans
La figura 2 muestra la cinética de crecimiento a nivel reactor, así como las diferentes actividades enzimáticas: glucoamilasa, α-amilasa, α-glucosidasa y β-glucosidasa. En el cuadro III se presentan las actividades máximas alcanzadas en la fermentación. Al tratarse de enzimas inducibles, se observó que su producción inicia desde las primeras horas de la fermentación. Se aprecia una actividad importante glucoamilasa después de las 10 h, que se incrementa conforme avanza el tiempo de fermentación, mostrando la máxima actividad a las 15 h con 193 U/mL. Li et al. (2007b) evaluaron A. pullulans N-13d con almidón soluble (10 g/L) y reportaron una actividad máxima de 10 U/mL a las 32 h, la cual se mantuvo constante hasta las 72 h. Goyal et al. (2005) reportan con Bacillus sp. I-3 actividades de glucoamilasa de 90 y 181 U/mL usando almidón soluble y almidón de maíz, respectivamente, mientras que con amilosa y amilopectina determinaron 0.34 y 0.47 U/mL, respectivamente.
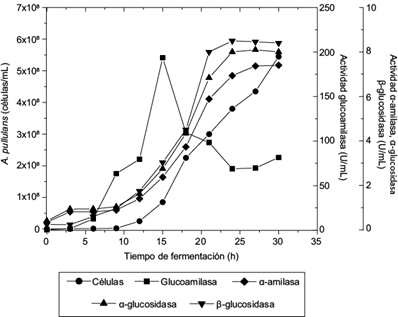
Fig. 2 Cinética de crecimiento de Aureobasidium pullulans ATCC15233 y actividad enzimática de glucoamilasa, α-glucosidasa, β-glucosidasa y α-amilasa en cultivos en lote a nivel reactor
CUADRO III ACTIVIDADES MÁXIMAS DE ENZIMAS AMILOLÍTICAS PRODUCIDAS POR Aureobasidium pullulans
| Enzimas | Actividad enzimática (U/mL) | Tiempo de fermentación (h) |
| Glucoamilasa | 193 | 15 |
| α-glucosidasa | 8.1 | 24-30 |
| β-glucosidasa | 8.5 | 24 |
| α-amilasa | 7.4 | 30 |
En cuanto a la producción de glucosidasas, la figura 2 muestra que la producción de α-glucosidasa coincide con el crecimiento de A. pullulans. La máxima producción fue de las 24 a las 30 h (valor promedio de 8.1 U/mL), lo cual coincide con la fase estacionaria. Hasta la fecha sólo en el trabajo de Saha et al. (1993) se reporta la producción de una α-glucosidasa por A. pullulans NRRL Y12974. Estos investigadores obtuvieron actividades de 2.14, 0.77 y 1.59 U/mL en almidón, amilosa y amilopectina, respectivamente, todos a una concentración de 10 g/L.
La producción de β-glucosidasa coincidió con el crecimiento y mostró su actividad máxima a las 24 h con 8.5 U/mL (figura 2). Este valor es mayor que el reportado por Saha et al. (1993), quienes obtuvieron una actividad de 0.27 U/mL al evaluar A. pullulans NRRL Y12974 con salvado de maíz como sustrato a 10 g/L. Ribeiro et al. (2008) evaluaron A. pullulans ER-16 usando salvado de trigo a 10 g/L, obtuvieron una actividad de 1.3 U/mL. Respecto a la producción y actividad de α-amilasa, en la misma figura se observa que a las 30 h presentó su mayor actividad con 7.4 U/mL, mostrando un perfil similar a las glucosidasas. Sólo Saha y Bothast (1993) reportaron haber obtenido una producción de α-amilasa por A. pullulans NRRLY12794 con 0.47 U/mL de actividad, en fermentación en sustrato sólido y cuatro días de proceso.
Por lo anterior, la producción de enzimas amilolíticas por A. pullulans ATCC15233 al usar almidón de cebada de baja calidad como sustrato es adecuada, debido a que la actividad de estas enzimas fue superior a la que se ha reportado hasta el momento para dicha levadura. Cabe mencionar que la comparación se hace con diferentes cepas. Esto sugiere que el almidón de cebada de baja calidad puede ser utilizado como sustrato potencial para la producción de productos de valor agregado como las enzimas.
Sacarificación enzimática de almidones de maíz, soluble y de cebada
En la primera etapa se usaron dos medios de reacción, un amortiguador de acetato 0.2 mol/L y agua destilada sin la adición de Ca2+ y con la adición de Ca2+ en la mezcla de reacción (Fig. 3a). Para el almidón de cebada (AC), la sacarificación fue aparentemente mejor con el amortiguador de acetato (efecto significativo, p < 0.05) y en presencia de Ca2+, siendo la concentración máxima de glucosa obtenida de 3.84 g/L. Para el caso del almidón soluble (AS) fue mejor la condición de agua destilada Ca2+, obteniéndose 0.84 g/L de glucosa. Respecto a el almidón de maíz (AM), se determinó diferencia significativa (p < 0.05) entre los cuatro tratamientos, obteniéndose la máxima concentración de glucosa de 0.4 g/L al usar agua y Ca2+. En la figura 3b se presenta el análisis de TLC, donde se demuestra que el producto de reacción mayoritario fue glucosa para cada fuente de almidón. Konsula et al. 2004 reportaron una α-amilasa producida por Bacillus subtilis que aumentó su actividad relativa de 84.6 a 96 % en presencia de Ca2+ (0.8 mol/L) a 60 ºC. En el presente trabajo la combinación del amortiguador de acetato con Ca2+ fue estadísticamente mejor. Sin embargo, se decidió usar agua y Ca2+ como medio de reacción en los siguientes experimentos debido a que el agua es utilizada a nivel industrial durante el proceso de sacarificación de almidón (Bentley 1999).

Fig. 3 Hidrólisis enzimática de almidón de diferentes fuentes (10 g/L). (a) Almidón de cebada (AC), almidón soluble (AS) y almidón de maíz (AM), con agua y amortiguador de acetato (pH 4.5), con y sin adición de Ca2+. (b) Análisis de los productos por cromatografía en capa fina. M: marcador (glucosa)
En la segunda etapa se utilizó la suspensión de almidón gelatinizado y sin gelatinizar a 10 g/L (Fig. 4a). Se observa que, para almidón de cebada, el almidón gelatinizado no favorece el porcentaje de hidrólisis y se determinó que no hay diferencia significativa; se obtuvieron 3.2 y 3.1 g/L de glucosa para almidón gelatinizado y sin gelatinizar, respectivamente. En la figura 4b se corrobora que la glucosa es el producto principal de la hidrólisis. Respecto al almidón soluble, se produjeron 2.9 y 0.6 g/L de glucosa usando almidón gelatinizado y sin gelatinizar, respectivamente, lo cual representa una hidrólisis mayor con una diferencia significativa (p < 0.05) al gelatinizar el almidón soluble.

Fig. 4 Hidrólisis enzimática de almidón de diferentes fuentes (10 g/L). (a) Almidón de cebada (AC), almidón soluble (AS) y almidón de maíz (AM), en un sistema acuoso, usando almidón gelatinizado y sin gelatinizar, con adición de Ca 2+. (b) Análisis de los productos por cromatografía en capa fina. M: marcador (glucosa)
Finalmente, para el almidón de maíz se produjeron 2.6 y 0.23 g/L a partir de almidón gelatinizado y sin gelatinizar, respectivamente. Estos resultados indican que el tratamiento de gelatinización favoreció la hidrólisis de AS y AM, incrementado la susceptibilidad a la degradación enzimática en comparación con sus formas nativas, es decir, sin gelatinizar, lo cual es congruente con reportes previos (O’Brien y Wang 2008). Por ejemplo, al gelatinizar almidón de papa y arroz, se aumentó la concentración de azúcares reductores liberados de 17 a 29 mg/mL y de 14 a 24 mg/mL, respectivamente (Konsula et al. 2004).
En la tercera etapa se aumentó la concentración de los diferentes almidones a 50, 100, 200 y 400 g/L, al adicionar Ca2+ con un proceso de gelatinizado (Fig. 5). Los resultados demuestran que, para almidón de cebada, la mejor condición se obtuvo a 30 min de reacción y 50 g/L con 8.7 % de hidrólisis, siendo menor con 100 g/L (6.5 %), 200 g/L (6.7 %) y 400 g/L (5.98 %). Al evaluarse el tiempo de reacción de 24 h se determinó que éste no favorece la hidrólisis de manera importante, ya que se registraron aumentos únicamente de 3.2, 1.62, 0.42 y 0.26 % para 50, 100, 200 y 400 g/L, respectivamente (Fig. 5b). Para almidón soluble a 30 min de reacción y 50 g/L se obtuvo 7.32 % de hidrólisis; conforme se aumentó la concentración la hidrólisis disminuyó, obteniéndose los siguientes porcentajes de hidrólisis: 4.09 % (100 g/L), 2.46 % (200 g/L) y 1.89 % (400 g/L) (Fig. 5a). Sin embargo, cuando el tiempo de reacción fue de 24 h, la hidrólisis se incrementó en 47.9, 27.9, 13.9 y 7.0 % para 50, 100, 200 y 400 g/L, respectivamente (Fig. 5b).
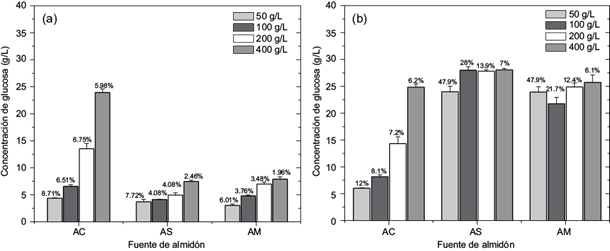
Fig. 5 Hidrólisis enzimática de almidón: almidón de cebada (AC), almidón soluble (AS) y almidón de maíz (AM), en un sistema acuoso, usando almidón gelatinizado en diferentes concentraciones, con Ca 2+. La reacción se realizó durante (a) 30 min y (b) 24 h. Se indican los porcentajes de hidrólisis para cada fuente de almidón
Con relación al almidón de maíz, a 30 min de reacción se obtuvieron los siguientes porcentajes de hidrólisis: 6.0, 3.7, 3.4 y 1.9 % con 50, 100, 200 y 400 g/L, respectivamente (Fig. 5a). A las 24 h la hidrólisis tuvo un efecto significativo positivo, aumentando 42, 21.7, 12.4 y 6.0 % para 50, 100, 200 y 400 g/L, respectivamente (Fig. 5b). El gránulo de almidón de maíz presenta una estructura más compleja en comparación con el almidón de cebada y el almidón soluble proveniente de papa (Naguleswaran et al. 2013), por lo que se requiere de mayor tiempo de reacción para favorecer la hidrolisis, como se observó en este ensayo. El análisis por TLC indicó que la glucosa es el producto principal de la hidrólisis (Fig. 6).

Fig. 6 Análisis de los productos de hidrólisis por cromatografía en capa fina: almidón de cebada (AC), almidón soluble de papa (AS) y almidón de maíz (AM), a 24 h en diferentes concentraciones. M: marcador (glucosa) (1:50, 2:100, 3:200 y 4:400 g/L); T: testigo
En general, para los tres almidones la hidrólisis aumentó cuando se incrementó de 10 a 50 g/L; sin embargo, para concentraciones superiores a 100 g/L no se observó algún efecto, lo que sugiere que la viscosidad es más alta al aumentar la concentración del almidón gelatinizado, ocasionando que la velocidad de agitación sea insuficiente para favorecer el mezclado y la interacción entre la enzima y el sustrato. Además, es posible que se haya producido inhibición por sustrato. Observaciones similares se reportaron para almidón de yuca (Ruiz et al. 2011). Cabe mencionar que la hidrólisis entre los almidones depende principalmente de sus diferencias estructurales (relación amilosa-amilopectina), que los hacen más o menos susceptibles a las enzimas (Naguleswaran et al. 2012).
Las enzimas amilolíticas producidas por A. pullulans presentan ventajas debido a que hidrolizan almidón a 60 ºC, temperatura menor a las reportadas en procesos de sacarificación (90 ºC) (Bentley 1999), además de que se obtiene glucosa como principal producto de reacción. Más aún, al ser un extracto crudo (es decir, sin que se aplique algún método de purificación) la sacarificación se puede realizar en una etapa, en comparación con los procesos industriales. En éstos, después de las etapas de gelatinización y licuefacción del almidón, la sacarificación se realiza en dos fases con enzimas purificadas y en secuencia: primero una α-amilasa (primera fase, con dextrinas y oligómeros como principales productos de reacción) y posteriormente glucoamilasas (segunda fase, con glucosa como principal producto de reacción) (van der Maarel et al. 2002). Por ello el uso de extractos de amilasas de A. pullulans podría disminuir el tiempo y costo de los procesos de sacarificación.
CONCLUSIONES
Con base en los resultados anteriores, las cosechas de cultivos como cebada que no cumplan con los requisitos para la alimentación del ganado y la industria alimentaria, pueden considerarse como materia prima de bajo costo para la obtención de productos de valor agregado como enzimas amilolíticas. En el presente trabajo el almidón de cebada de baja calidad fue aprovechado como materia prima para la producción de enzimas amilolíticas por A. pullulans (glucoamilasa, α-glucosidasa, β-glucosidasa y α-amilasa) y mostraron capacidad para hidrolizar almidón de cebada, almidón soluble y almidón de maíz en condiciones que se aplican en procesos industriales de sacarificación.











 nueva página del texto (beta)
nueva página del texto (beta)