INTRODUCCIÓN
A nivel mundial, se ha considerado a México como uno de los principales países productores de plomo (Pb) (Flores y Albert 2004, Flores et al. 2012), con un 75 % de su producción destinada a la fabricación de baterías. Aunque en el país se dispone de pocos datos sobre la producción secundaria de Pb, se conoce que ésta supera la producción primaria. Así, el país ha autorizado 21 plantas para reciclar 864 003 t/año de baterías de Pb (OK-FC 2011). Estas empresas generan problemas de contaminación por Pb en los suelos circundantes (Flores y Albert 2004). En el proceso de fundido de las placas de Pb se genera un residuo sólido llamado “escoria” que contiene principalmente PbO, FeO, Na2O, C, CaO, SiO2, ZnO, MgO y SO3, los cuales representan un riesgo para la salud humana y el ambiente (Coya et al. 2000, Penpolcharoen 2005, de Andrade-Lima y Bernárdez 2011). La búsqueda de plantas hiperacumuladoras y de bacterias resistentes a metales pesados que promuevan el crecimiento vegetal y productoras de sideróforos ha generado grandes expectativas para la remoción de metales pesados a partir de suelos contaminados (Rajkumar et al. 2010, Covarrubias et al. 2015). Existen reportes de bacterias que presentan resistencia a Pb, como Bacillus megaterium, Pseudomonas marginalis, Citrobacter freundii, Ralstonia metallidurans, Burkholderia cepacia y Pseudomonas putida (Levinson y Mahler 1998, Roane 1999, Borremans et al. 2001, Pérez et al. 2015). Algunas bacterias pueden sintetizar metabolitos secundarios como ácido indol-3-acético (AIA), ácido giberélico (GA3), zeatina, y ácido abscísico, entre otros, los cuales tienen un efecto positivo sobre el desarrollo de las plantas (Karadeniz et al. 2006, Vega et al. 2016). Las rizobacterias productoras de sideróforos proporcionan nutrimentos, especialmente hierro, a las plantas; además, los sideróforos producidos por estas bacterias en la rizósfera se unen a iones de metales pesados, mejorando la disponibilidad para las plantas (Nair et al. 2007, Rajkumar et al. 2010, Velásquez et al. 2011, Sessitsch et al. 2013). Los sideróforos forman complejos estables con cationes divalentes metálicos ambientalmente importantes como el Cd, Cu, Ni, Pb y Zn (Ahmed y Holmström 2014). Los sideróforos producidos por Pseudomonas azotoformans pueden remover hasta le 92.8 % del arsénico (As) presente en un suelo contaminado (Nair et al. 2007).
El objetivo de este trabajo fue aislar y caracterizar in vitro bacterias rizosféricas del suelo que circunda a una empresa recicladora de plomo (Pb) con tolerancia a Pb(NO3)2 y con capacidad de producir ácido indol-3-acético (AIA) y sideróforos.
MATERIALES Y MÉTODOS
Muestreo de suelo
El aislamiento de bacterias rizosféricas alrededor de la empresa recicladora de Pb se realizó mediante el muestreo de 14 sitios en dirección de los cuatro puntos cardinales y en función del viento dominante de la zona (noreste-suroeste), a distancias de 50, 150 y 300 m de la planta recicladora de Pb, con excepción del sur y del este, donde sólo se muestreo a 50 m por tener colindancia con otras empresas. Se tomó 1 kg de suelo rizosférico de las especies de plantas predominantes en el sitio, huizache (Acacia farneciana) y mezquite (Prosopis glandulosa). Las 14 muestras se etiquetaron y colocaron en bolsas de polietileno y se mantuvieron a 4 ºC hasta su respectivo análisis.
Determinación de Pb total en suelo
El contenido de Pb total se cuantificó por triplicado en las 14 muestras de suelos homogeneizadas y secadas a 70 ºC hasta alcanzar peso contante (Díaz et al. 1996). Una muestra de 500 mg se colocó en tubos de digestión de 50 mL (TECATORTM), con 15 mL de ácido nítrico al 98 % y ácido perclórico (5:1 v/v). Las muestras se digirieron a 120 ºC (1016 Digestor 40TM, TECATORTM) durante 3 h hasta alcanzar 1 mL. La solución obtenida se llevó a un volumen de 50 mL con agua desionizada y el contenido de Pb se determinó por espectrometría de emisión atómica de plasma acoplado inductivamente (ICP-AES) (IRIS Interpid II Model XDL, Thermo Electron Corporation, Franklin, MA, USA) siguiendo las instrucciones del método EPA-6010 (USEPA 2007).
Aislamiento bacteriano
El conteo de la población bacteriana se realizó por triplicado en las 14 muestras de suelos homogeneizadas. Una muestra de 10 g de suelo se agregó a 90 mL de una solución de fosfatos (g/L): 0.2 KH2PO4, y 0.8 K2HPO4, a pH 7.0, la cual se mantuvo en agitación a 100 revoluciones por minuto (rpm)/30 min (Mauricio et al. 2010). Posteriormente se realizaron diluciones seriadas hasta 10-3 y se procedió a la siembra en placas con medio mineral M9 modificado con la composición siguiente (g/L): 6.0 Na2HPO4, 3.0 KH2PO4, 1.0 NH4Cl, 0.5 NaCl, 0.5 extracto de levadura y 10 glucosa; además se incluyeron (mL/L): 2.0 MgSO4·7H2O 1 M, 0.1 CaCl4 0.1 M, y 0.1 tiamina a una concentración de 1 mg/mL (esterilizado por filtración 0.2 µm), pH 7 (Sambrook y Green 2012). El medio mineral M9 sin la adición de Na2HPO4 y con la adición de Pb(NO3)2 0.3 mM (Massadeh et al. 2005) se utilizó para estimar la población bacteriana tolerante a Pb(NO3)2. Las placas se incubaron a 28 ºC por 48 h. El total de bacterias aeróbicas cultivables se determinó como unidades formadoras de colonia (UFC)/g de suelo como lo describen Brim et al. (1999). Colonias que crecieron en medio mineral M9 con Pb(NO3)2 y presentaron morfología macroscópica diferente fueron aisladas y purificadas por estría hasta obtener cepas puras. Éstas se almacenaron a -70 ºC en medio Luria-Bertani (LB) (g/L): 10 bactotriptona, 5 extracto de levadura, 10 NaCl (Atlas 2010) con glicerol 50 % y 0.3 mM de Pb(NO3)2.
Selección de aislados bacterianos
De los aislados obtenidos se seleccionaron aquellos que presentaron tolerancia a Pb(NO3)2 0.3 mM, positivos a la prueba de Salkowski y para el medio cromo azurol S (CAS) agar, que sirven para determinar la producción de AIA y de sideróforos, respectivamente.
Identificación de aislados bacterianos
Para la identificación de los géneros bacterianos seleccionados se procedió a cultivar los aislados en medio LB por 48 h de incubación. Se tomó una alícuota de 3 mL que fue centrifugada a 7000 rpm/5 min. La pastilla obtenida se utilizó para la extracción del ácido desoxirribonucleico (ADN) usando el kit ZR fungal/bacterial DNA kitTM (Zymo research) de acuerdo con las condiciones establecidas por el fabricante. El ADN genómico purificado se almacenó a -20 ºC. Los aislados bacterianos rizosféricos se identificaron amplificando el gen 16S ARN ribosomal mediante la técnica de la reacción en cadena de la polimerasa (PCR) con los oligos fD1 (5´-CCGAATTCGTCGACAACAGAGTTTGATCCTGGCTCAG-3´) y rD1 (5´-CCCGGGATCCAAGCTTAAGGAGGTGATCCAGCC-3´), los cuales amplifican aproximadamente 1600 pb de la región ribosomal (Mauricio et al. 2010). La PCR se llevó a cabo en un volumen de 51 μL en las siguientes condiciones: 48 µL Platinum PCR Supermix (Invitrogen), 1 μL de cada primer (fD1 y rD1) (50 ng/μL) y 1 µL de ADN purificado. La amplificación se llevó a cabo en un termociclador (Eppendorf, Mastercycler Gradient). Las condiciones para la PCR fueron las siguientes: 94 ºC (5 min), 35 ciclos a 94 ºC (50 s), 58 ºC (50 s), y 72 ºC (60 s) y finalmente a 72 ºC durante 5 min.
Los productos amplificados se corrieron en un gel de agarosa 1.5 % cargándose 3 μL del producto de la PCR y 0.5 μL del amortiguador de carga 6x (invitrogen). Se utilizó un marcador de peso molecular de 1 kb ADN Ladder (Fermentas). El gel se corrió a 85 voltios (V) durante 45 min y posteriormente se visualizó en un transiluminador de luz ultravioleta (UV). Los productos amplificados de los diferentes aislados se removieron del gel y se purificaron usando el kit Illustratm GFXTM PCR DNA, Gel Band Purification Kit (GE Healthcare), siguiendo las instrucciones del fabricante. El producto purificado y concentrado (30 ng/μL) se envió al laboratorio de secuenciación del Centro de Investigación y de Estudios Avanzados del Instituto Politécnico Nacional (CINVESTAV-IPN), Unidad Irapuato. Para el análisis de las muestras se utilizó el método de la cadena dideoxi terminal (Sanger et al. 1977), en un secuenciador automático de ADN (ABI 37300xl DNA, PE Applied Biosystems, INC.). Los resultados de las secuencias se analizaron en la base de datos del National Center for Biotechnology Information (NCBI) GenBank a través del programa BLAST (http://blast.ncbi.nlm.nih.gov/Blast.cgi), buscando identidad (≥ 99 %) con cepas tipo reportadas. Las secuencias obtenidas con mayor similitud se alinearon con el método de alineación múltiple Muscle del programa MEGA versión 5.05 (Tamura et al. 2011). Para la construcción del árbol filogenético, se utilizó el método de Neighbor-Joining (NJ) (Saitou y Nei 1987), con valores de bootstrap de 1000 unidades y un máximo de parsimonia. Una cepa de Pseudomonas sp. se utilizó como grupo externo.
Cuantificación de AIA
Los aislados bacterianos tolerantes a Pb se cultivaron por 24 h en 3 mL de medio líquido Czapek. De cada preinóculo (1 × 106 UFC/mL) se inocularon 100 µL en tubos de ensayo con 15 mL del mismo medio, suplementado con 200 µg L-triptófano/mL (Sigma, USP). Los cultivos se incubaron en oscuridad con agitación (120 rpm) a 28 ºC durante 3 días. Posteriormente, 1 mL de cada cultivo se centrifugó a 7000 rpm/5 min. Al sobrenadante se le adicionaron 2 mL de reactivo de Salkowski (50 mL HClO4 35 % + 1 mL FeCl3 0.5 M). La reacción se incubó en oscuridad por 30 min a temperatura ambiente. La cuantificación de AIA se determinó a una longitud de onda de 530 nm en un espectrofotómetro de microplaca µQuant. Este ensayo se realizó con tres réplicas independientes. La absorbancia del cromógeno de indol se transformó a través de una curva patrón con diferentes concentraciones de AIA (0, 10, 20, 30, 40 y 50 µg AIA/mL) (Sigma) (Tsavkelova et al. 2007).
Medición de sideróforos
La producción de sideróforos en las cepas se realizó en un medio gelificado específico CAS-agar propuesto por Schwyn y Neilands (1987). El medio CAS-agar es la combinación de cuatro soluciones preparadas independientemente: a) solución indicadora de Fe-CAS (solución 1): 10 mL FeCl3 1 mM disuelto en HCl 10 mM, 50 mL de una solución CAS (1.21 mg/mL), esta última se añadió lentamente a 40 mL de una solución (1.82 mg/mL) de bromuro de hexadeciltrimetilamonio (HDTMA por sus siglas en inglés); b) solución amortiguadora (solución 2): disolución de 30.24 g PIPES (ácido piperazina-N,N’-bis[2-etanosulfónico]) en 750 mL de una solución salina: 0.3 g KH2PO4, 0.5 g NaCl y 1.0 g NH4Cl a pH 6.8, aforada a 800 mL, adicionando 15 g agar; c) solución 3: 2 g glucosa, 2 g manitol, 493 mg MgSO4, 11 mg CaCl2, 1.17 mg MnSO4, 1.4 mg H3BO3, 0.04 mg CuSO4, 1.2 mg ZnSO4 y 1.0 mg Na2MoO4 en 70 mL de agua destilada; d) la soluciones se esterilizaron a 15 psi, después se mezclaron y al final se adicionaron 30 mL de una solución de casaminoácidos 10 % (p/v) esterilizada por filtración (solución 4) (Alexander and Zuberer 1991).
Identificación de sideróforos
Para identificar la naturaleza química de los sideróforos de cada cepa bacteriana seleccionada, una concentración aproximada de 1 × 106 UFC/mL se inoculó en tubos de ensayo con 15 mL de medio succinato (g/L): 6.0 K2HPO4, 3.0 KH2PO4, 1.0 (NH4)2SO4, 0.2 MgSO4·7H2O, 4.0 C4H4Na2O4·6H2O, a pH 7.0. Después se incubaron con agitación (120 rpm) a 28 ºC por 3 días (Nair et al. 2007). Posteriormente los tubos se centrifugaron a 7000 rpm/5 min, recuperándose el sobrenadante en el cual se identificó la naturaleza química de los sideróforos (hidroxamato, catecolato y carboxilato) producidos por los aislados bacterianos de acuerdo con Baakza et al. (2004).
Hidroxamato
Ensayo con cloruro férrico (FeCl 3 )
A 1 mL del sobrenadante filtrado se le agregó 1 mL de FeCl3 2 % p/v. La formación de una coloración rojo púrpura indicó presencia de sideróforos; asimismo, una señal de 420 nm a 450 nm indicó sideróforos del tipo hidroxamato. Las muestras se analizaron en un espectrofotómetro de radiación ultravioleta (UV) visible VARIAN modelo CARY 3E (Baakza et al. 2004).
Prueba con tetrazolium
En un tubo eppendorf de 1.5 mL se colocó aproximadamente 1 µg de sales de tetrazolio y 1-2 gotas de NaOH 2 M. Después se añadió 1 mL del sobrenadante filtrado. La presencia de sideróforos del tipo hidroxamato generó un viraje instantáneo a rojo oscuro (Baakza et al. 2004).
Posteriormente, la producción de hidroxamato se cuantificó en una alícuota de 100 µL de un inóculo de 1 × 106 UFC/mL de cada cepa bacteriana, la cual se colocó en tubos de ensayo con 15 mL del medio de cultivo BAz a pH 5.7 durante 3 días a 28 ºC y 120 rpm. Los tubos de ensayo se centrifugaron a 7000 rpm/5 min, recuperándose el sobrenadante. El hidroxamato se cuantificó utilizando una curva de calibración con concentraciones (0, 0.1, 1.0 y 10 µg/mL) de sideróforo del tipo hidroxamato de ferroxamina mesilato (SIGMA ALDRICH). Estas soluciones se sometieron a la prueba del FeCl3, y su absorbancia se leyó a 420 nm en un espectrofotómetro de radiación UV visible (VARIAN, CARY 3E) (Baakza et al. 2004, de los Santos et al. 2012).
Catecolato
Ensayo con cloruro férrico (FeCl 3 )
Se agregó 1 mL de FeCl3 2 % a 1 mL de sobrenadante. La señal indicó, en un espectrofotómetro de radiación UV visible VARIAN modelo CARY 3E (Baakza et al. 2004) a 495 nm, la existencia de sideróforos del tipo catecolato.
Prueba de Arnow
A 1 mL del sobrenadante se le agregaron 0.1 mL de HCl 5 M, 0.5 mL de un reactivo que contenía 10 g de NaNO2 y 10 g de Na2MoO4 disueltos en 50 mL de agua destilada. Después del vire a color amarillo se le agregaron 0.1 mL de NaOH 10 M, con lo cual se obtuvo una coloración roja. Finalmente se adicionó agua destilada hasta obtener un volumen de 5 mL, y se procedió a medir la absorbancia a 515 nm en un espectrofotómetro de radiación UV visible VARIAN modelo CARY 3E (Baakza et al. 2004).
Carboxilato
Ensayo espectrofotométrico
A 1 mL de sobrenadante se le agregaron 1 mL de CuSO4 250 µM y 2 mL de amortiguador de acetato a pH 4. La solución se leyó en una longitud de onda de 190 nm a 280 nm en un espectrofotómetro de radiación UV visible VARIAN modelo CARY 3E (Baakza et al. 2004).
Concentración mínima inhibitoria (CMI) a Pb(NO3)2
La tolerancia de cada aislado bacteriano al Pb(NO3)2, estimada como concentración mínima inhibitoria (CMI), se determinó por el crecimiento celular bacteriano (densidad óptica, DO 595 nm) en medio LB modificado (g/L): 2.5 bactotriptona y 1.2 extracto de levadura a pH 6 (Levinson y Mahler 1998), suplementado con diferentes concentraciones de Pb(NO3)2: 0, 0.1, 0.3, 0.6, 0.9, 1.2, 1.5 y 1.8 mM (Roane 1999). Cada tubo con 10 mL de medio LB modificado se inoculó con 100 µL de un preinóculo bacteriano con 1 × 106 UFC/mL y se incubó por triplicado durante 3 días a 28 ºC y 120 rpm.
Análisis estadístico
Los datos de las variables de interés se analizaron mediante el procedimiento estándar de análisis de varianza (ANDEVA) con el paquete estadístico SPSS v. 22. Asimismo, la diferencia significativa para la separación de medias de los tratamientos se realizó por la prueba de Duncan al 5 % de probabilidad.
RESULTADOS Y DISCUSIÓN
Distribución de Pb total en suelo
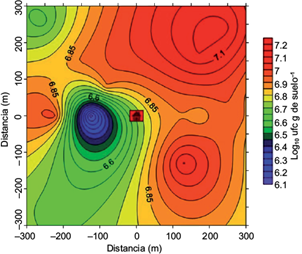
Los resultados de Pb total en los diferentes puntos de muestreo se presentan en el cuadro I. En general, las concentraciones más altas de Pb se registraron en muestras ubicadas a los 50 y 150 m al suroeste de la empresa recicladora de Pb, en tanto que a los 300 m la concentración de Pb baja en los diferentes puntos muestreados. Esto indica que el contaminante disminuye en función de la distancia a la empresa. Resultados similares se han reportado en otros trabajos (Farago et al. 1999, Cala y Kunimine 2003).
CUADRO I CONCENTRACIÓN DE Pb TOTAL EN LOS DIFERENTES PUNTOS DE MUESTREO EN TORNO A LA EMPRESA RECICLADORA DE Pb
| Ubicación | Distancia (m) | Pb total (mg/kg) |
| Norte | 50 | 42.6 |
| 150 | 45.5 | |
| 300 | 15.2 | |
| Sur | 50 | 29.1 |
| Este | 50 | 81.4 |
| Oeste | 50 | 44.8 |
| 150 | 42.2 | |
| 300 | 33.3 | |
| Noreste | 50 | 60.0 |
| 150 | 110.3 | |
| 300 | 29.4 | |
| Suroeste | 50 | 447.3 |
| 150 | 149.0 | |
| 300 | 35.9 |
Población bacteriana rizosférica
Los resultados de la población bacteriana en torno a la empresa recicladora de Pb se presentan en la figura 1. La población bacteriana total fue de aproximadamente 7.0 log10 UFC/g de suelo, mientras que la población tolerante a Pb(NO3)2 0.3 mM fue de 6.0 log10 UFC/g de suelo, lo cual equivale a una tolerancia de la población del 86 % (Fig. 1). Cabe resaltar que el punto a 50 m al suroeste de la empresa recicladora de Pb presentó mayor contenido de Pb total (447 mg/kg), a partir del cual la población bacteriana disminuyó en comparación con los otros puntos de muestreo (Figs. 1 y 2). Al respecto, se ha reportado que en suelos contaminados con Pb se reduce la ibiomasa microbiana (Konopka et al. 1999, Akmal et al. 2005); además, se modifica la composición de las comunidades microbianas (Frey et al. 2006), lo cual favorece a las especies tolerantes a metales, mientras que las especies sensibles decrecen (Roane 1999).
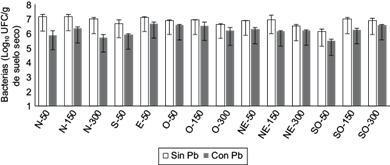
Fig. 1 Barras de color negro población bacteriana tolerante a 0.3 mM Pb(NO3)2 en los diferentes puntos de muestreo (N = norte, S = sur, O = oeste, E = este, NE = noreste, SO = suroeste) en torno a la empresa recicladora de Pb. Valores promedio de tres réplicas ± desviación estándar. UFC = unidades formadoras de colonias
Selección de aislados bacterianos rizosféricos
Los resultados de los aislados bacterianos seleccionados por su capacidad metabólica de interés se presentan en el cuadro II. En total se obtuvieron 150 aislados con tolerancia a Pb(NO3)2 0.3 mM. Se seleccionaron cinco cepas del suelo rizosférico circundante a la empresa recicladora de Pb y dos aislados provenientes de la escoria de Pb estabilizada con mediana y alta producción de AIA; asimismo, se seleccionaron cinco aislados con producción de sideróforos (Cuadro II).
CUADRO II CEPAS BACTERIANAS SELECCIONADAS EN LOS DIFERENTES PUNTOS DE MUESTREO ALREDEDOR DE LA EMPRESA RECICLADORA DE Pb, ASÍ COMO DE LA ESCORIA ESTABILIZADA DE Pb
| Aislado | Género bacteriano con 100% de identidad | Reacción positiva a la prueba de Salkowski | Reacción positiva en el medio CAS-agar | Tolerantes [Pb(NO3)2 0.3 mM] |
| L121 | Bacillus | + | - | + |
| EE50* | Bacillus | + | - | + |
| EE35* | Bacillus | + | - | + |
| L139 | Agrobacterium | + | - | + |
| L14 | Bacillus | + | - | + |
| L138 | Curtobacterium | + | + | + |
| L23 | Arthrobacter | + | + | + |
| L2 | Streptomyces | - | + | + |
| L48 | Streptomyces | - | + | + |
| L67 | Streptomyces | - | + | + |
*Proveniente de la escoria de Pb estabilizada, CAS: cromo azurol S.
Identificación de bacterias seleccionadas
La identificación de los aislados bacterianos seleccionados se presenta en las figuras 3 y 4. Los aislados mostraron identidad alta con los géneros Streptomyces, Arthrobacter, Curtobacterium, Bacillus y Agrobacterium. Los aislados L2, L48 y L67 se agruparon dentro del género Streptomyces (100 % identidad), mientras que los aislados L23 y L138 mostraron 100 % de identidad con los géneros Arthrobacter y Curtobacterium, respectivamente. Los aislados EE50, EE35, L14 y L121 presentaron identidad del 100 % con el género Bacillus y el aislado L139 mostró identidad del 100 % con Agrobacterium (Fig. 4).

Fig. 3 Amplificación del gene 16S ARNr (aproximadamente 1600 pb) de los aislados bacterianos seleccionados en los diferentes puntos de muestreo en torno a la planta recicladora de Pb. De izquierda a derecha, columna 1: patrón de peso molecular; columna 2: aislado 2; columna 3: aislado 48; columna 4: aislado 139; columna 5: aislado 35; columna 6: aislado 121; columna 7: aislado 50; columna 8: aislado 23; columna 9: aislado 14; columna 10: aislado 67; columna 11: aislado 138
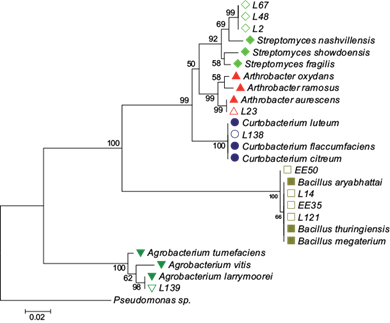
Fig. 4 Árbol filogenético de las secuencias parciales del gen 16S ARNr de los aislados bacterianos seleccionados en los diferentes puntos de muestreo en torno a la empresa recicladora de Pb. Rombos verdes, cepas L67, L48 y L2 correspondientes al género Streptomyces ; triángulos rojos, cepa L23 correspondiente al género Arthrobacter ; círculos azules, cepa L138 correspondiente al género Curtobacterium; cuadros cafés, cepas EE50, L14 y L121 correspondientes al género Bacillus ; triángulos verdes, cepa L139 correspondiente al género Agrobacterium
Producción de AIA y sideróforos por las cepas bacterianas seleccionadas
Los resultados de la producción de AIA y sideróforos de las cepas bacterianas seleccionadas se presentan en los cuadros III y IV, así como en la figura 5. La producción de AIA fue variable; así, la cepa L23 Arthrobacter sp. produjo 8.1 µg AIA/mL mientras que la cepa L121 Bacillus sp. produjo 60.6 µg AIA/mL. En este sentido, Tsavkelova et al. (2007) reportaron cepas de Burkholderia sp. y Bacillus sp. con producción de AIA en el orden de 3.0 y 58.0 µg/mL en medio de cultivo Czapek, respectivamente. Así mismo, Gómez et al. (2012) obtuvieron dos cepas Halomonas sp. y Xanthomonas sp. que producían AIA de 64 y 37.7 ppm, respectivamente. Al respecto, con base en la producción de AIA in vitro, las rizobacterias se agrupan en: a) bajas productoras (1 a 10 μg/mL); b) medianas productoras (11 a 20 μg/mL), y c) altamente productoras (21 a 30 μg/mL) (Khalid et al. 2004). Considerando dicha clasificación, cinco de las cepas seleccionadas en este trabajo presentaron alta producción de AIA (Cuadro III).
CUADRO III PRODUCCIÓN DE ÁCIDO INDOL-3- ACÉTICO (AIA) Y TOLERANCIA A Pb POR LAS CEPAS BACTERIANAS SELECCIONADAS DE LOS DIFERENTES PUNTOS DE MUESTREO EN TORNO A LA EMPRESA RECICLADORA DE Pb
| Cepas | Ácido indol-3- acéticoa (µg/mL) | Toleranteb [Pb(NO3)2] |
| Bacillus sp. L121 | 60.6 ± 16.42 a | 1.3 |
| Bacillus sp. EE50 | 44.6 ± 5.56 b | 1.8 |
| Bacillus sp. EE35 | 43.0 ± 2.98 bc | 1.5 |
| Agrobacterium sp. L139 | 36.6 ± 0.85 c | 1.5 |
| Bacillus sp. L14 | 33.9 ± 0.69 c | 0.6 |
| Curtobacterium sp. L138 | 12.5 ± 0.46 d | 1.0 |
| Arthrobacter sp. L23 | 8.1 ± 0.27 d | 1.4 |
aProducción de AIA al tercer día del crecimiento bacteriano en medio Czapeck; bconcentración mínima inhibitoria de Pb en medio Luria-Bertani (LB) modificado. Diferentes letras en cada fila indican diferencia estadística significativa (Duncan, α = 0.05). Valores promedio de tres réplicas ± desviación estándar
CUADRO IV PRODUCCIÓN DE SIDERÓFOROS TIPO HIDROXAMATO Y TOLERANCIA A Pb POR LAS CEPAS BACTERIANAS SELECCIONADAS
| Cepa | Hidroxamatoa (µg/mL) | Toleranteb [Pb(NO3)2] |
| Streptomyces sp. L2 | 0.052 ± 0.01 a | 1.5 |
| Streptomyces sp. L48 | 0.034 ± 0.03 ab | 1.5 |
| Streptomyces sp. L67 | 0.050 ± 0.02 a | 1.5 |
| Curtobacterium sp. L138 | 0.049 ± 0.00 a | 1.0 |
| Arthrobacter sp. L23 | 0.020 ± 0.00 b | 1.4 |
aProducción de hidroxamato en las diferentes cepas; bconcentración mínima inhibitoria a Pb en medio LB modificado. Diferentes letras en cada fila indican diferencia estadística significativa (Duncan, α = 0.05). Valores promedio de tres réplicas ± desviación estándar

Fig. 5 Prueba cualitativa de producción de sideróforos de los géneros bacterianos seleccionados en los diferentes puntos de muestreo en torno a la empresa recicladora de Pb, en medio CAS-Agar. (a) L2, Streptomyces sp., (b) L138, Curtobacterium sp., (c) L23, Arthrobacter sp.
En relación con la producción de sideróforos, las cepas L2, L48 y L67, que corresponden al género Streptomyces spp., presentaron cualitativamente un halo de color naranja mayor que las cepas L138 Curtobacterium sp. y L23 Arthrobacter sp., como indicador de reacción positiva de producción de sideróforos. Al respecto, Schwyn y Neilands (1987) mencionan que cuando un quelante fuerte remueve el Fe del colorante indicador, su color cambia de azul a naranja; por lo tanto, un halo de color naranja alrededor de las colonias bacterianas en medio CAS-Agar indica excreción de sideróforos (Fig. 5).
Con relación a la naturaleza química de los sideróforos producidos por las cepas bacterianas, indican que son del tipo hidroxamato (Cuadro V), uno de los sideróforos más comunes producidos por bacterias (Suárez y Reyes 2002, Lacava et al. 2008). En contraste, se observaron resultados negativos para los tipos catecolato y carboxilato (Cuadro V). La producción de hidroxamato por las cepas L2, L48, L67 del género Streptomyces spp., L138 Curtobacterium sp. y L23 Arthrobacter sp. fue entre (0.02-0.054 µg/mL) (Cuadro IV). Ensayos sobre la cinética de producción de sideróforos realizados al tercer día de crecimiento, indican que Pseudomonas azotoformans produce 1.46 µg/mL de sideróforos del tipo hidroxamato (Nair et al. 2007), mientras que Burkholderia cepacea produce 0.2 µg/mL de hidroxamato (de los Santos et al. 2012).
CUADRO V PRUEBAS CUALITATIVAS PARA IDENTIFICAR LA NATURALEZA QUÍMICA DEL TIPO DE SIDERÓFOROS PRODUCIDOS POR LAS CEPAS BACTERIANAS SELECCIONADAS
| Cepas | Sideróforo | ||||
| CASa | FeCl3 b | Hidroxamatob | Catecolatob | Carboxilatob | |
| Streptomyces sp. L2 | + | + | + | - | - |
| Streptomyces sp. L48 | + | + | + | - | - |
| Streptomyces sp. L67 | + | + | + | - | - |
| Curtobacterium sp. L138 | + | + | + | - | - |
| Arthrobacter sp. L23 | + | + | + | - | - |
Escala arbitraria correspondiente a cambios colorimétricos, donde (+) cambio colorimétrico positivo y (-) sin cambio colorimétrico, provenientes de tres réplicas en medios de cultivo específicos en incubación a 28 ºC por 3 días. aProducción de sideróforos en medio cromo azurol S (CAS-agar); bcultivos en medio succinato
En relación con la capacidad de las cepas bacterianas seleccionadas para tolerar Pb (CMI) (Cuadros III y IV) se observó una amplia variabilidad. La cepa L14 Bacillus sp. presentó la menor tolerancia (0.6 mM) mientras que la cepa EE50 Bacillus sp. presentó la mayor tolerancia a Pb(NO3)2 (1.8 mM). Existen reportes de cepas bacterianas aisladas de suelo contaminado con metales pesados que presentan diferentes niveles de resistencia a Pb en medio líquido, como Bacillus megaterium y Pseudomonas marginalis, las cuales resisten 0.6 y 2.5 mM Pb(NO3)2, respectivamente (Roane 1999). Asimismo, Citrobacter freundii resiste una concentración de 7 mM Pb(NO3)2 en medio LB-agar (Levinson y Mahler 1998). Comparativamente, las cepas bacterianas seleccionadas en el presente trabajo presentaron mediana y alta tolerancia a Pb.
CONCLUSIONES
El suelo que circunda a la empresa recicladora de plomo estudiada presenta concentraciones de Pb total catalogadas como medianas a altas, y la concentración de este metal disminuye conforme se aleja del núcleo de contaminación. Existen bacterias rizosféricas en torno a la empresa tolerantes a Pb, con capacidades metabólicas para producir ácido indol-3-acético de hasta 60 μg/mL, así como sideróforos. Estos resultados indican que existe un potencial bacteriano proveniente del suelo rizosférico circundante a la empresa recicladora de Pb, para aprovecharse en futuros trabajos de fitorremediación de estos suelos contaminados, los cuales presentan un riesgo latente para la población residente al interior de la empresa y cerca de este foco de contaminación por la dispersión de los polvos.











 nueva página del texto (beta)
nueva página del texto (beta)