INTRODUCCIÓN
Actualmente existe una elevada producción de colorantes sintéticos ya que son utilizados en diversas áreas como la fotográfica, cosmética, del papel, optoelectrónica, teñido de tejidos biológicos, textil, etc. (Freeman y Mock 2012). Del total de colorantes producidos, del 65-70 % son colorantes azo (Gupta y Suhas 2009). Sin embargo, su eliminación representa un problema ambiental debido a que los tratamientos biológicos convencionales no son eficientes en el proceso de degradación de estos compuestos. Lo anterior provoca que al descargarse a diferentes cuerpos de agua, disminuyen la penetración de la luz solar afectando la actividad fotosintética, con la consecuente disminución o agotamiento del oxígeno disuelto, dañando seriamente a las especies acuáticas presentes (Saratale et al. 2011).
Se han utilizado diferentes tratamientos para la remoción de colorantes en efluentes acuosos, entre ellos se encuentran la degradación fotoquímica, ozonización, reactivo de Fenton, fotocatálisis con TiO2, degradación electroquímica, etc. (Srinivasan y Viraraghavan 2010, Oller et al. 2011). Sin embargo, estos métodos tienen algunos inconvenientes como: 1) Una incompleta oxidación de los colorantes generando subproductos como aldehídos, cetonas, ácidos orgánicos e inorgánicos (Robinson et al. 2001). 2) Altos costos para generar ozono y electricidad (Xu et al. 1999). 3) Generación de lodos provenientes de sales de hierro y la inversión en su tratamiento y disposición (Anjaneyulu et al. 2005).
Del mismo modo, la remoción de colorantes mediante el empleo de hongos, bacterias y levaduras requiere condiciones estériles para un desempeño adecuado, lo cual difícilmente se puede mantener en un efluente real (Gupta y Suhas 2009, Solís et al. 2012, Ortiz-Monsalve et al. 2017).
Por otro lado, se han utilizado biopolímeros como la quitina, el quitosano, la xantana y el alginato de sodio nativos y funcionalizados (Bhatnagar y Sillanpää 2009, Lozano-Álvarez et al. 2009, Sadeghi-Kiakhani et al. 2013, Ghorai et al. 2014, Haldorai y Shim 2014, Mittal et al. 2014 y Karadag et al. 2016). Sin embargo, la funcionalización incrementa el costo de producción y disminuye su biodegradabilidad. El alginato de sodio (ALG), es un polisacárido proveniente de algas cafés y bacterias, es utilizado en la industria farmacéutica, de alimentos, de pinturas, etc. como agente espesante y estabilizante. Este compuesto consta de monómeros de β-D-manuronato y α-L-guluronato unidos por enlaces glucosídicos (1→4). La adición de Ca+2 a una disolución de ALG produce un gel de alginato de calcio, ALG (Ca) (Draget 2009). En este reporte se utiliza dicha propiedad para remover diferentes colorantes azo y se propone una relación entre la estructura del colorante y la eficiencia de remoción por el ALG. Lo anterior proporcionaría una metodología sencilla para definir aproximadamente entre dos o más colorantes azo, cuál de ellos se removerá con mayor eficiencia al utilizar ALG en medio acuoso. Lo cual es de interés ambiental, dada la variabilidad de estructuras de estos colorantes presentes en descargas de agua contaminada.
MATERIALES Y MÉTODOS
El rojo directo 80 (RD80), rojo congo (Rcongo), rojo de metilo (Rmetilo) y el ALG fueron adquiridos de Sigma-Aldrich. El NaOH, HCl, NaCl y CaCl2 son de marca J.T. Baker.
Estudios de espectroscopía ultra violeta visible
Se obtuvieron bajo las siguientes condiciones:
Efecto del pH
Se prepararon disoluciones acuosas de cada colorante (1x10-5M) a diferentes valores de pH (4-12) y se obtuvo su espectro de absorción ultra violeta visible (UV-visible).
Efecto de la concentración del colorante en presencia y ausencia del ALG
Se prepararon disoluciones de cada colorante a diferentes concentraciones (5-100 mg/L) en las condiciones de pH y fuerza iónica (F.I.) con mayor eficiencia de remoción para cada colorante. Lo anterior se realizó en ausencia y en presencia del ALG al 1 % peso volumen (p/v) para observar el efecto de este polímero en la agregación del colorante. En el caso de este experimento y el siguiente, se modificó el paso de luz de la celda para ajustar la absorbancia al límite máximo de detección del espectrofotómetro, por ende, la absorbancia no es lineal con la concentración de colorante.
Estudios de espectroscopía de absorción en el infrarrojo medio con transformada de Fourier (FTIR) y de dispersión Raman
Se preparó el producto ALG-colorante (Ca) en polvo, de acuerdo con lo reportado previamente por Jáuregui-Rincón et al. (2011). Los estudios de espectroscopía de absorción en el infrarrojo medio con transformada de Fourier (FTIR) se realizaron en un equipo Jasco modelo 4600 series en modo de reflectancia total atenuada (4000-600 cm-1) con una ventana de diamante. Para la obtención del espectro Raman (2000-400 cm-1) se utilizó un equipo MicroRaman system modelo Renishaw 1000.
Optimización de las condiciones de remoción de colorantes
Se prepararon disoluciones de colorante que incluyeran al ALG hidratado (concentración final de 0.5 % p/v) y se les ajustó los valores de pH y F.I. para cada colorante, de tal manera que los valores de concentración y volumen finales fueron 100 mg/L y 100 mL respectivamente (Jáuregui-Rincón et al. 2011). Debido a la baja solubilidad mostrada por el Rmetilo a valores de pH inferiores a 7, los valores de pH utilizados fueron 7, 9.5 y 12 con una F.I. de 0.1 M, 0.5 M y 0.9 M. Tras la gelificación con 30 mL de CaCl2 al 5 % p/v, se aforó con agua destilada a 200 mL. Después de reposar 24 h en la oscuridad, el sobrenadante se centrifugó a 9000 g (20 min). La concentración del colorante se determinó por espectroscopía UV-visible en un espectrofotómetro Thermo Scientific modelo Evolution 201 (todos los experimentos se realizaron por triplicado).
El porcentaje de remoción se obtuvo con la fórmula:
Donde:
Ci y Ce son las concentraciones inicial y final del colorante (mol/L), respectivamente.
Obtención de las isotermas de adsorción
Se prepararon disoluciones de colorante con diferentes concentraciones (0-2000 mg/L) con los valores de pH y F.I. ajustados de acuerdo con lo obtenido en el apartado anterior y se adicionó el ALG (0.5 g). Posteriormente se gelificó con CaCl2 al 5 % p/v y se cuantificó la concentración de colorante como se describió previamente (ver sección anterior).
Aplicación del modelo de Zimm-Bragg a las isotermas experimentales
La aplicación de este modelo a los datos experimentales se realizó de la misma manera como previamente lo hicieron Lozano-Álvarez et al. (2009) y Jáuregui-Rincón et al. (2011). Se determinó el parámetro qe (cantidad de colorante en moles removida por mol de ALG) mediante la siguiente fórmula:
Dónde:
Ci y Ce se definieron anteriormente, V= volumen de colorante (L) y m = masa de ALG (mol).
Los parámetros teóricos del modelo de Zimm-Bragg (1959) se obtuvieron utilizando el paquete estadístico R (Core 2013), introduciendo la función de este modelo y los valores iniciales de los parámetros K u y U para iniciar el proceso de optimización. Dicho proceso utilizó la siguiente función como parámetro de optimización:
Dónde: βi son los valores experimentales obtenidos en la isoterma experimental y βt son los valores teóricos obtenidos por el proceso de optimización.
El paquete finalizó el proceso de optimización cuando el valor de L fue mínimo. Finalmente se obtuvieron los valores de K u y U para cada sistema, el coeficiente de determinación (R2) y el error relativo promedio.
RESULTADOS Y DISCUSIÓN
Estudios de espectroscopía ultravioleta visible
La presencia de grupos funcionales como el hidroxilo (-OH), el amino (-NH2) y el carboxilo (-COOH) en colorantes azo produce diferentes efectos al cambiar el pH. En el caso del RD80 se observa un equilibrio tautomérico azo-hidrazona, que favorece a la forma hidrazona cuando el -OH se encuentra en posición orto con respecto al grupo azo (Ozen et al. 2007, Abbott et al. 2011) (Fig. 1). Lo anterior se evidencia por la banda localizada en 530 nm (pH = 4) hasta 540 (pH = 11) en el espectro ultravioleta visible del RD80. Más aún, Oakes y Gratton (1998) reportaron la existencia de un “anión común” a valores de pH entre 12 y 14, que para el RD80 está ubicado en 545 nm.
La formación de agregados tipo H de colorantes azo debido al apilamiento de sus anillos aromáticos se ha manifestado como un desplazamiento hipsocrómico en el λmax del espectro UV-visible del colorante (Karukstis et al. 2002, Song et al. 2017). En este sentido el espectro UV-visible del RD80 a pH = 12 fue similar a diferentes concentraciones (5-200 mg/L, datos no mostrados), sugiriendo que no existió una agregación inducida por el incremento en la concentración de este colorante. Adicionalmente el espectro UV-visible del RD80 a pH = 12 fue similar en presencia y ausencia del ALG en disolución acuosa (λmax = 545 nm) (Fig. 2 a-b), indicando que el RD80 presenta el mismo grado de agregación en ambos casos y que la fuerza de interacción entre ellos es tal que no afecta la estructura electrónica del RD80. Esto contrasta con lo observado por Pal y Mandal (1990), donde se encontró que la adición de alginato de potasio “fragmentó” los agregados de pinacianol y se observó un desplazamiento batocrómico de su λmax.

Fig. 2 Espectro de absorción electrónica del DR80 (a) y del producto ALG-DR80 (b), ambos en disolución acuosa y del gel de ALG-DR80 (Ca) (c). En el recuadro superior derecho se muestran a detalle los espectros (b) y (c)
Por otra parte, la adición de CaCl2 al ALG-RD80, formó el gel de ALG-RD80 (Ca) y ocurrió un desdoblamiento en los máximos ubicados en λmax = 516 nm y λmax = 545 nm hasta λmax = 526 nm y λmax = 558 nm respectivamente (ver recuadro superior derecho, Fig. 2). Esto sugiere que la adición de Ca+2 a la disolución de ALG-RD80 atrae las moléculas del RD80 (que poseen carga negativa a pH = 12), favoreciendo la desagregación del RD80 adsorbido al ALG. Sin embargo, al formarse el gel de ALG-RD80 (Ca) tales moléculas son “atrapadas” dentro de él y en consecuencia la concentración del RD80 en la disolución acuosa disminuye (Lozano-Alvarez et al. 2015).
Se ha reportado que moléculas de colorante azo más grandes, con anillos aromáticos extendidos y grupos funcionales que favorecen su planaridad, forman agregados más estables como consecuencia del apilamiento π-π (Oakes y Dixon 2004). La figura 1 muestra que el RD80 cumple con estas características, peso molecular (PM)= 1373.07 g/mol, contiene cuatro grupos fenilo y dos naftilo, resultando en la formación de agregados de RD80 cuya existencia sólo se evidencia al producirse el ALG-RD80 (Ca).
Los espectros UV-visible del Rcongo en disolución acuosa (1x10-5 M) a valores de pH = 4 presentan un color azul morado debido a la protonación de este colorante que posee un pKa = 4.1 (Sabnis 2007). Lo anterior da como resultado las formas quinoide y azonio reportadas por Elhaddaoui et al. (1992), Bonancea et al. (2006) y Barkauskas et al. (2011), que se manifiestan como una banda con λmax = 515 nm y un hombro ancho que se extiende hasta los 800 nm. A pH = 6, λmax se desplaza hasta 498 nm (disolución naranja), debido a la existencia de la forma neutra que incluye al grupo azo en su estructura (Movahedi et al. 2009). Incrementos posteriores en el pH resultan en una λmax = 498 nm, observándose cambios ligeros en la intensidad debido a la desprotonación del Rcongo. Sólo hasta llegar a un pH = 12 se observa un pequeño cambio en λmax, (494 nm). El Rcongo tiende a apilarse en concentraciones de NaCl superiores al 0.3 % (0.05 M) (Han et al. 2008). Experimentalmente se utilizó una F.I. mayor para obtener los espectros UV-visible (F.I. = 0.1 M), lo cual sugiere que existe una agregación de las moléculas del Rcongo por interacción π-π de sus grupos naftilo, concordando con la formación de estructuras supramoleculares reportadas por Skowronek et al. (1998). Lo anterior se corroboró al observar un desplazamiento hipsocrómico de λmax = 488 nm (5 mg/L) hasta λmax = 485 nm (100 mg/L) a pH = 12. Los espectros UV-visible del Rcongo en presencia y en ausencia del ALG resultaron muy semejantes. Lo anterior sugiere que este polisacárido no promueve una agregación adicional del Rcongo a pH = 12, por la repulsión existente entre ambas moléculas, evitando que las moléculas del colorante se agreguen en la superficie molecular del ALG.
La adición del ion Ca+2 a la disolución de ALG-Rcongo ocasionó un desplazamiento batocrómico desde λmax = 485 nm a λmax = 488 nm, sugiriendo una desagregación del Rcongo similar a la ocurrida con el RD80, pero con menor intensidad debido a la menor carga negativa del Rcongo comparada con aquella del RD80 (Fig. 1). Es decir, el efecto del Ca+2 promueve una ligera desagregación, pero la formación del gel “atrapa” a las moléculas y agregados del Rcongo aún adsorbidos a la superficie molecular del ALG. Lo anterior favorece la retención de este colorante en el producto ALG-Rcongo (Ca), resultando una eficiencia de remoción del 99.7 % (similar a la encontrada con el RD80 = 99.9 %, ambos a pH = 12 y F.I. = 0.1 M).
Se obtuvieron espectros UV-visible del Rmetilo de experimentos similares a los realizados con los otros colorantes. Park et al. (2004) han reportado que en el intervalo de pH = 4 a 6 existen los mayores cambios en la distribución electrónica del Rmetilo y que se deben a la existencia de las especies aniónica y protonada de este compuesto, dado que su pKa es de 5.02 (García-Heras et al. 2005). Experimentalmente se encontró que valores menores y mayores a este pH produjeron espectros de absorción electrónica muy diferentes, a pH = 4, λmax = 525 nm (disolución color rojo) y a pH = 6, λmax = 431 nm (disolución color naranja). Incrementos posteriores en el pH disminuyeron la intensidad del color de la disolución sin un cambio importante en λmax por el predominio de la forma aniónica del colorante.
Cuando se puso en contacto al ALG con el Rmetilo (5-100 mg/L), se observó que los espectros UV-visible fueron semejantes a los obtenidos solamente con el colorante (λmax = 431 nm), sugiriendo que el Rmetilo tiene poca tendencia a agregarse y que el ALG no promueve su agregación. Esto indica que las interacciones entre ambas moléculas son débiles (puentes de hidrógeno e interacciones hidrofóbicas) (Blackburn 2004) y que aunque existe una interacción electrostática entre el grupo amino terciario del Rmetilo con los grupos carboxilo del ALG, no es detectable por espectroscopía UV-visible. Tras la adición del ion Ca+2, no hubo cambios en λmax (431 nm), indicando que la formación del ALG-Rmetilo (Ca) tiene poco efecto en el espectro de absorción electrónica, por la agregación mínima del Rmetilo en dicho compuesto.
Estudios de espectroscopía FTIR y dispersión Raman
Para entender de manera más profunda la interacción del ALG con los colorantes, se obtuvieron espectros de absorción FTIR y Raman. El cuadro I incluye las señales espectroscópicas más relevantes del RD80, ALG (Ca) y el ALG-RD80 (Ca). Este cuadro muestra que los grupos hidroxilo presentes en el RD80 forman puentes de hidrógeno (banda ancha centrada en 3390 cm-1), lo cual dificulta encontrar las vibraciones ν(N-H) del grupo amida y ν(C-H) de los anillos aromáticos de este colorante. Sin embargo, las vibraciones ν(C=O) del grupo amido (1647 cm-1) y ν(C=N) (1565 cm-1) indican que el tautómero hidrazona está presente en este colorante (Schrader 1995). Por otra parte, la vibración ν(C-O) típica de un alcohol aromático presente en 1000 cm-1 sugiere que la forma azo del RD80 también está presente en estado sólido (Silverstein et al. 2015).
CUADRO I DATOS DE ESPECTROSCOPÍA DE ABSORCIÓN EN EL INFRARROJO MEDIO CON TRANSFORMADA DE FOURIER (FTIR) Y RAMAN DE LOS COMPUESTOS ALGINATO DE CALCIO: ALG (Ca), DR80 y ALG-DR80 (Ca)
| Señales FTIR | ALG (Ca) | DR80 | ALG-DR80 (Ca) | Observaciones |
| ν(OH) | 3285 cm-1 | 3390 cm-1 | 3285 cm-1 | Los puentes de hidrógeno existentes en el DR80 se traslapan con los encontrados en el ALG (Ca) y se incrementa la anchura de la banda. |
| ν(C-H) | 3100 cm-1 | No se detecta | Los puentes de hidrógeno existentes en el ALG (Ca) evitan la detección de esta señal en el ALG-DR80 (Ca). |
|
| νasym(COO) | 1591 cm-1 | 1591 cm-1 | El ambiente químico del grupo carboxilo es muy semejante en el ALG (Ca) y en el ALG-DR80 (Ca). |
|
| νsym(COO) | 1407 cm-1 | 1407 cm-1 | El grupo carboxilo experimenta un “ambiente químico” similar en el ALG (Ca) y en el ALG-DR80 (Ca). |
|
| ν(C-O) | 1028 cm-1 | 1000 cm-1 | 1028 cm-1 | La señal del colorante está inmersa en la del ALG (Ca). |
| ν(C=O) de amida | 1647 cm-1 | No se detecta | La vibración ν(C=O) de la amida del DR80 se traslapa con la señal νasym(COO) del ALG (Ca) |
|
| ν(C=N) de hidrazona | 1565 cm-1 | No se detecta | La vibración ν(C=N) de la amida del DR80 se traslapa con la señal νasym(COO) del ALG (Ca) en el aducto ALG-DR80 (Ca). |
|
| Señales Raman | ||||
| ν(C=C) de grupos fenilo | 1594 cm-1 | 1594 cm-1 | Esta señal confirma la presencia del DR80 en el ALG- DR80 (Ca). |
|
| ν(C=N) de tautómero hidrazona | 1565 cm-1 | 1563 cm-1 | El tautómero hidrazona se encuentra en ambos compuestos (DR80 y ALG- DR80 (Ca)). |
|
| ν(N=N) de tautómero azo | 1448 cm-1 | 1449 cm-1 | El tautómero azo se encuentra en ambos compuestos (DR80 y ALG-DR80 (Ca)). |
|
| ν(-SO3) | 1174 y 1154 cm-1 | 1178 y 1155 cm-1 | Esta señal confirma la presencia del DR80 en el ALG- DR80 (Ca). |
El cuadro I muestra que los espectros del ALG (Ca) y ALG-RD80 (Ca) son muy similares y que las señales características del RD80 descritas anteriormente no se pueden identificar fácilmente en el ALG-RD80 (Ca). Así, los puentes de hidrógeno del RD80 se traslaparon con aquellos generados por los grupos hidroxilo presentes en el ALG (Ca), observándose una banda ancha localizada en 3285 cm-1 en ambos compuestos. Las vibraciones νasym(COO) y νsym(COO) encontradas en 1591 cm-1 y 1407 cm-1 respectivamente, sugieren que el “ambiente químico” experimentado por el grupo carboxilo es similar en ambos compuestos. Sin embargo, la vibración νasym(COO) dificultó observar las vibraciones ν(C=O) y ν(C=N) de la forma hidrazona del RD80. Del mismo modo, la vibración ν(C-O) ubicada en 1028 cm-1 típica de polisacáridos se traslapa con la misma vibración del colorante.
Las señales del espectro Raman del RD80 y el ALG-RD80 (Ca) se incluyen en el cuadro I, cabe mencionar que la fluorescencia mostrada por el ALG (Ca) fue demasiado alta y dificultó la obtención de su espectro Raman. La vibración ν(C=C) de grupos fenilo (1594 cm-1) está presente en ambos compuestos, sugiriendo que el ambiente electrónico de los anillos bencénicos es similar en los dos compuestos. Las señales localizadas en 1565 cm-1 y 1448 cm-1 correspondientes a las vibraciones ν(C=N) y ν(N=N) de las formas hidrazona y azo respectivamente, corroboran su presencia en el colorante en polvo y en el ALG-RD80 (Ca) (Armstrong et al. 1995, Biswas y Umapathy 2000). Adicionalmente, las señales características de los grupos sulfonato del colorante (1174 cm-1 y 1154 cm-1), también se encontraron en el ALG-RD80 (Ca).
El cuadro II resume las señales más importantes de los espectros FTIR y Raman del ALG (Ca), Rcongo y ALG-Rcongo (Ca). Dichas señales muestran que los picos característicos del Rcongo se traslapan con aquellos del ALG (Ca), de tal manera que el espectro del ALG-Rcongo (Ca) es similar al espectro del ALG (Ca). Por ejemplo, la vibración ν(OH) (3290 cm-1) es amplia y dificulta la observación de las señales ν(C-H) de los anillos aromáticos del Rcongo (3075 cm-1) y las señales del grupo amino νasym(N-H) y νsym(N-H) (3460 cm-1 y 3350 cm-1, respectivamente). Del mismo modo, las señales ν(C-N) y δ(N-H) (1346 cm-1 y 1583 cm-1, respectivamente) del grupo amino unido al grupo naftilo, son difíciles de localizar en el espectro del ALG-Rcongo (Ca) debido a que las vibraciones νasym(COO) y νsym(COO) (1595 cm-1 y 1414 cm-1, respectivamente) dificultan su identificación.
CUADRO II DATOS DE ESPECTROSCOPÍA DE ABSORCIÓN EN EL INFRARROJO MEDIO CON TRANSFORMADA DE FOURIER (FTIR) Y RAMAN DE LOS COMPUESTOS ALGINATO DE CALCIO: ALG (Ca), Rcongo y ALG-Rcongo (Ca)
| Señales FTIR | ALG (Ca) | Rcongo | ALG-Rcongo (Ca) | Observaciones |
|---|---|---|---|---|
| ν(OH) | 3290 cm-1 | 3290 cm-1 | Los puentes de hidrógeno debido al grupo hidroxilo se encuentran presentes en el ALG-Rcongo (Ca). | |
| νasym(COO) | 1594 cm-1 | 1595 cm-1 | El “ambiente químico” del grupo carboxilo del ALG es el mismo en el ALG (Ca) y en el ALG-Rcongo (Ca). | |
| νsym(COO) | 1414cm-1 | 1414 cm-1 | El grupo carboxilo experimenta un “ambiente químico” similar en el ALG (Ca) y en el ALG-DR80 (Ca). | |
| ν(C-N) | 1346 cm-1 | No se detecta | La vibración ν(C-N) del grupo amino del Rcongo se traslapa con la señal νsym(COO) del ALG (Ca). | |
| δ(N-H) | 1583 cm-1 | No se detecta | Esta señal está inmersa en la vibración νasym(COO) del ALG (Ca). | |
| ν(C-H) de anillo aromático | 3075 cm-1 | No es detectable | Los puentes de hidrógeno del grupo hidroxilo presentes en el ALG-Rcongo (Ca) evitan encontrar esta vibración. | |
| νasym(N-H) | 3460 cm-1 | No se detecta | La banda amplia debida a los puentes de hidrógeno del grupo hidroxilo presentes en el ALG-Rcongo (Ca) evita detectar estas vibraciones. | |
| νsym(N-H) | 3350 cm-1 | No se detecta | Igual que para el caso de la vibración νasym(N-H). | |
| Señales Raman | ||||
| ν(C=C) de grupos fenilo | 1590 cm-1 | 1592 cm-1 | Esta señal confirma la presencia del Rcongo en el ALG-Rcongo (Ca). | |
| ν(N=N) | 1450 cm-1 | 1450 cm-1 | Esta señal confirma la presencia del grupo azo en el Rcongo y en el ALG-Rcongo (Ca). | |
| ν(-SO3) | 1154 cm-1 | 1156 cm-1 | Esta señal confirma la presencia del Rcongo en el ALG-Rcongo (Ca). | |
Por otro lado, el espectro Raman mostró claramente la presencia del Rcongo en el ALG-Rcongo (Ca). Por ejemplo, la vibración ν(C=C) típica de los grupos fenilo del Rcongo (1590 cm-1), aparece en 1592 cm-1 en el ALG-Rcongo (Ca). Igualmente, la vibración ν(N=N) se encontró en el espectro de ambos compuestos en 1450 cm-1 y los grupos sulfonato del colorante (1154 cm-1), también se encontraron en el ALG-Rcongo (Ca) (1156 cm-1).
El FTIR del Rmetilo indica que se encuentra como sal sódica, debido a las vibraciones νasym(COO) y νsym(COO) ubicadas en 1595 cm-1 y 1441 cm-1, respectivamente. La señal νarom(C-H presente en 3286 cm-1) sugiere la presencia de anillos aromáticos y la vibración ν(C-N) de la amina terciaria aparece en 1362 cm-1. De modo similar a los otros colorantes, algunos grupos funcionales del ALG (Ca) dificultan la detección de las señales correspondientes al Rmetilo. Por ejemplo, la señal originada por la vibración ν(C-H) no se detectó en el espectro del ALG-Rmetilo (Ca) debido a que se encuentra inmersa en la banda típica de la vibración ν(OH) del ALG (Ca). Del mismo modo, los picos característicos del grupo carboxilato del Rmetilo también se traslaparon con las señales del mismo grupo funcional del ALG (Ca). Finalmente, la concentración del colorante en el ALG-Rmetilo (Ca) fue demasiado baja para lograr diferenciar los picos de sus grupos funcionales del ruido presente en su espectro Raman.
Optimización de las condiciones de remoción de colorantes
Los estudios cinéticos realizados previamente con disoluciones de 100 mg/L de colorante (datos no mostrados), indicaron que el equilibrio se alcanza a las dos horas. Además, las constantes de velocidad (K2) obtenidas al aplicar el modelo de pseudo segundo orden (Ho y McKay 1999), fueron las siguientes: 0.1117 g/min mg (RD80), 0.039200 g/min mg (Rcongo) y 0.06077 g/min mg (Rmetilo). Esta información sugiere que la quimioadsorción está involucrada en la remoción de estos colorantes y permitió utilizar un intervalo de tiempo adecuado para los estudios de optimización. La figura 3a muestra la influencia del pH y F.I. en la eficiencia de remoción del RD80. Se observa que al incrementarse el pH, la remoción también lo hace, debido a un incremento en la solubilidad del colorante por la desprotonación de sus grupos ionizables y en consecuencia su interacción con el ALG. Contrariamente, al disminuir la F.I. el ALG remueve más RD80, sugiriendo que aunque existe una repulsión considerable entre las moléculas del RD80 y el ALG, hay interacciones que favorecen la unión entre ellas. Los grupos funcionales existentes en el RD80 (hidroxilo, amido, azo y sulfonato) forman puentes de hidrógeno con los grupos oxhidrilo, carboxilo y con el oxígeno de los enlaces hemiacetálico y glucosídicos del ALG. Adicionalmente, Clark (2011) reportó que la existencia de interacciones hidrofóbicas entre los electrones π de los anillos aromáticos del colorante y los grupos OH de la celulosa promueven una mayor fijación del colorante a este polisacárido. Debido a la semejanza del ALG con la celulosa, es evidente que esta interacción contribuye considerablemente a la unión del RD80 con el ALG. El incremento de electrolitos disminuye la eficiencia de remoción debido a que los iones interaccionan con los grupos funcionales con carga opuesta presentes en el RD80 (sulfonato e hidroxilo desprotonados) y con el carboxilo e hidroxilo desprotonados del ALG, disminuyendo la interacción entre ambas moléculas. Lo anterior arrojó una remoción del 99.9 % a pH = 12 y F.I. = 0.1 M.

Fig. 3 Eficiencia de remoción de colorantes con ALG en función del pH y la fuerza iónica en un ambiente acuoso: a) DR80, b) Rcongo y c) Rmetilo
Cuando se remueve el Rcongo con ALG, la figura 3b sugiere que existen dos zonas en las cuales la capacidad de remoción es máxima: pH bajo (pH = 4) y pH alto (pH = 12). Sin embargo, es importante mencionar que a pH = 4 el Rcongo se precipita, por la proximidad con el pKa = 4.1 de este colorante (Sabnis 2007). En este sentido se podría decir que el ALG no remueve al colorante disuelto, sino al precipitado, lo cual sobreestimaría la eficiencia de remoción y dificultaría el modelado de los datos experimentales. Además, se observó que a valores de F.I. = 0.9 M, una parte considerable del Rcongo se insolubilizó (a pH = 12 y pH = 4 se observó una mayor precipitación), lo cual generó el mínimo observado en la figura 3b a pH de 8.0. Así, el Rcongo sólo permaneció soluble a pH = 8 y pH = 12 con F.I. entre 0.1 M-0.5 M. Por lo tanto se encontró una remoción del 99.7 % a pH = 12 y F.I. = 0.1 M.
Recientemente Vijayaraghavan y Shanthakumar (2016) removieron Rcongo con un extracto algal proveniente de Sargassum sp. que se asemeja al ALG. Sin embargo, al comparar los espectros FTIR del ALG y el extracto algal (Fan et al. 2005, Ҁaykara y Demirci 2006, Lawrie et al. 2007), se puede concluir que son productos distintos con similares eficiencias de remoción. Además, estos investigadores utilizaron al material como agente coagulante, y en nuestro caso, el ALG adsorbe y atrapa moléculas de colorante cuando forma el ALG (Ca) (Lozano-Álvarez et al. 2015). Esto demuestra el potencial de las algas pardas para aportar materiales que remueven colorantes.
El comportamiento del Rcongo fue similar al anterior colorante, a pesar de una alta repulsión entre el ALG y el colorante por el pH básico utilizado. No obstante, la formación de agregados por el Rcongo (cuya geometría es plana), los puentes de hidrógeno entre sus grupos funcionales (azo, amino y sulfonato) y los grupos hidroxilo y carboxilo del ALG además de las interacciones hidrofóbicas entre ambos compuestos, favorecieron una alta remoción del Rcongo. Aunque las moléculas de este colorante son más pequeñas que las del RD80, se agregan de manera muy eficiente (Skowronek 1998), resultando un porcentaje de remoción de 99.7 %.
El efecto del pH y la F.I. en la eficiencia de remoción del Rmetilo es representado en la figura 3c. Se observa que la eficiencia de remoción disminuye al incrementarse el pH, consecuencia de un incremento en la repulsión entre el ALG y el Rmetilo por la desprotonación de estos dos compuestos. Por otra parte, al aumentar la F.I. se observa una disminución en la remoción del Rmetilo, debido a una disminución de la interacción entre las moléculas de colorante y el ALG por una gran cantidad de iones Na+ y Cl-. Además, la figura 3c sugiere que los puentes de hidrógeno entre los grupos funcionales del Rmetilo y el ALG son menos eficientes que los formados por el RD80 y el Rcongo con este biopolímero. Freeman y Mock (2012) reportaron que los grupos sulfonato de diferentes colorantes interaccionan más eficientemente con los grupos hidroxilo del algodón y la celulosa que el grupo carboxilo. Aunque el ALG posee grupos carboxilo, su estructura es abundante en grupos hidroxilo, y se asemeja a estos polisacáridos. Esto explicaría la baja afinidad del Rmetilo por el ALG. Además, el Rmetilo es más pequeño que los anteriores colorantes y tiene menos tendencia a agregarse por la disminución en su planaridad molecular a pH = 7 por la predominancia de la especie aniónica (Park et al. 2004). Lo anterior resulta en un eficiencia de remoción del 14.9 % a pH = 7 y F.I. = 0.1 M.
Obtención de las isotermas de remoción
Los modelos de Langmuir (1916) y Freundlich (1906) han sido utilizados para describir la remoción de colorantes con distintos materiales (Kyzas y Kostoglou 2014). Recientemente Lozano-Álvarez et al. (2009) aplicaron estos modelos y encontraron que dichos modelos no describieron las isotermas experimentales. Por esta razón no se abordó su aplicación a los sistemas estudiados en este trabajo. Zimm y Bragg (1959) propusieron su modelo para describir los cambios conformacionales en proteínas. Recientemente se ha aplicado este modelo para describir la unión de colorantes a ALG y xantana. Dicho modelo considera que las moléculas de colorante se unen a la superficie polimérica y favorecen la unión de moléculas presentes en disolución (fenómeno descrito por K u o constante de nucleación). Del mismo modo, las moléculas de colorante una vez unidas al polímero tienden a formar agregados (situación descrita por U o constante de cooperatividad). Ambos K u y U se obtienen por optimización (Lozano-Álvarez et al. 2009, Jáuregui-Rincón et al. 2011). Estos parámetros determinan el valor de β, que es definida como el número de sitios del polímero ocupados por moléculas de colorante, expresada como una fracción y que está dado por la ecuación:
donde s = K u Ce y Ce representa la concentración de colorante en el equilibrio (mol/L).
Conociendo los valores de U y K u , se obtiene la isoterma teórica y se compara con la obtenida experimentalmente. El cuadro III muestra los valores de K u y U para los diferentes sistemas ALG-colorante y la figura 4 representa las isotermas experimentales y las curvas teóricas respectivas.
CUADRO III CONSTANTES DEL MODELO DE ZIMM-BRAGG PARA LOS DIFERENTES SISTEMAS ALGINATO-COLORANTE ESTUDIADOS
| Sistema | ALG-DR80 (Ca) | ALG-Rcongo (Ca) | ALG-Rmetilo (Ca) |
| K u (Kg/mol) | 275 463.13 | 324 019.41 | 449.00 |
| U | 12.73 | 10.39 | 7.290 |
| R2 | 0.9571 | 0.8700 | 0.6961 |
| ERP | 21.59 | 21.33 | 39.11 |
ERP = error relativo promedio (en porcentaje)
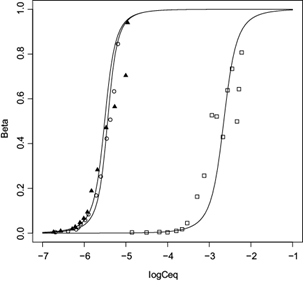
Fig. 4 Datos experimentales e isotermas obtenidas utilizando el modelo de Zimm-Bragg de los sistemas: ALG-DR80 (Ca) (o), ALG-Rcongo (Ca) (▲) y ALG-Rmetilo (Ca) (□)
Se observa que los sistemas ALG-RD80 (Ca) y ALG-Rcongo (Ca) tienen valores de K u y U dentro del mismo orden de magnitud y eso se refleja en sus eficiencias de remoción superiores al 99 %. En contraparte el ALG-Rmetilo (Ca) muestra los valores más pequeños de dichas constantes, observándose que la isoterma experimental y la teórica se encuentran en el intervalo de Ce entre 10-2 y 10-4 M, indicando que en este sistema el ALG remueve menos colorante. Es importante mencionar que el grado de dispersión obtenido en los datos experimentales en todos los sistemas es causado por la desviación de la radiación por el ALG (puesto que es un hidrocoloide) y particularmente en el sistema ALG-Rmetilo (Ca), por la alta sensibilidad del Rmetilo a ligeros cambios de pH.
Considerando a otros colorantes, como el negro directo 22 (DB22), azul directo 1 (DB1), rojo directo 81 (DR81) y naranja de metilo (Nmetilo) (Lozano-Álvarez et al. 2015), se obtuvo el cuadro IV. El RD80 es el colorante de peso molecular mayor, que contiene el mayor número de grupos fenilo, además de poseer dos grupos naftilo, obteniéndose una capacidad de agregación considerable y en un porcentaje de remoción del 99.9 %. Nótese que a pesar de la carga negativa del RD80 a pH = 12, sus grupos funcionales (azo, sulfonato, hidroxilo y amido) forman puentes de hidrógeno con el ALG. El segundo colorante de mayor peso molecular (PM) es el DB22, cuya remoción fue del 99.7 %, debido a que la atracción electrostática fue la principal fuerza de unión en el ALG-DB22 (Ca) y a que contiene dos grupos fenilo y tres grupos naftilo.
CUADRO IV EFICIENCIAS DE REMOCIÓN DE DIFERENTES COLORANTES AZO Y ALGUNAS DE SUS PROPIEDADES FÍSICAS Y QUÍMICAS
| Colorante | Peso molecular (g/mol) | % Remoción | No. de anillos fenilo (F) y naftilo (N) | Grupos funcionales presentes | Carga |
| DR80 | 1373.07 | 99.9 | 4F y 2N | Azo, -SO3, -OH, amido | -8 (pH=12, 0.1M) |
| DB22* | 1083.97 | 99.7 | 2F y 3N | Azo, -SO3, -OH, amido | +2 (pH=4, 0.5-0.9M) |
| Rcongo | 696.66 | 99.7 | 2F y 2N | Azo, -NH2 y -SO3 | -2 (pH=12, 0.1M) |
| DB1* | 992.80 | 64.0 | 2F y 2N | Azo, -NH2 , -SO3y C=O | -6 (pH=12, 0.9M) |
| DR81* | 675.61 | 41.0 | 2F y 1N | Azo, -SO3, -OH, amido | -1 (pH=4, 0.1M) |
| Nmetilo | 327.33 | 48.1 | 2F | Azo, -N(CH3)2, -SO3 | -1 (pH=12, 0.1M) |
| RMetilo | 291.28 | 14.9 | 2F | Azo, -COOH y -N(CH3)2 | Aprox. neutra (pH= 7, 0.1M) |
*Datos tomados de Lozano-Álvarez et al. (2015)
Los datos del cuadro IV indican de manera general que al ir disminuyendo el PM de los colorantes y su capacidad de agregación (dada por la extensión de los anillos aromáticos), su eficiencia de remoción se ve reducida. A excepción del Rcongo que contiene una menor carga, pero una alta planaridad en su geometría molecular (Han et al. 2008) y puede formar estructuras supramoleculares más eficientemente que el DB1 (Roterman et al. 1998). La reducción en el número de anillos aromáticos (Nmetilo y Rmetilo) disminuyó su capacidad de agregación y en consecuencia sus eficiencias de remoción. Más aún, la presencia de un grupo sulfonato en posición para, con respecto al grupo azo en el Nmetilo le permite unirse eficientemente a polisacáridos (Clark 2011). Contrariamente, el Rmetilo posee un grupo carboxilo en posición orto, que lo hace menos afín al ALG, obteniéndose una eficiencia de remoción (14.9 %) menor a la del Nmetilo (48.1 %).
Lo anterior sugiere que la eficiencia de remoción se incrementa a medida que el PM y el número de anillos aromáticos aumentan (dado que la planaridad molecular se favorecerá y se promoverá una alta agregación). Esto se ilustra claramente, si se compara al Rmetilo (PM = 291.28 g/mol y dos grupos naftilo) con el RD80 (PM = 1373.07 g/mol y 4 grupos fenilo y 2 naftilo), cuyas eficiencias de remoción son del 14.9 % y 99.9 % respectivamente. Además una mayor carga positiva promoverá una fuerte atracción hacia el ALG, contribuyendo a una mayor eficiencia de remoción. Esta información permitirá predecir cualitativamente a partir de las estructuras de los colorantes azo, cuál de ellos será removido más eficientemente con el ALG en un ambiente acuoso.
CONCLUSIONES
Existe una relación cualitativa entre las características estructurales de los colorantes azo y su eficiencia de remoción del medio acuoso por el ALG cuando se consideran moléculas con PM que van desde 291.28 g/mol (Rmetilo) hasta PM de 1373.07 g/mol (RD80). Las moléculas con mayor PM, una mayor carga positiva y una eficiente capacidad de agregación, producen valores más altos en su eficiencia de remoción. De acuerdo con esto se puede predecir cualitativamente, a partir de la estructura de los colorantes azo, si un colorante se removerá más eficientemente que otro al utilizar al ALG.
Es necesario seguir generando más información para soportar esta relación de manera más sólida, más aún, la extensión de esta investigación a otros tipos de colorantes como los reactivos, básicos, ácidos, dispersos, etc., ayudará a un entendimiento mayor de las interacciones entre este polisacárido y las moléculas de colorante. Lo anterior permitirá desarrollar la tecnología adecuada para la remoción de colorantes de diferentes efluentes acuosos y disminuirá la contaminación de cuerpos de agua mediante el uso de polímeros biodegradables como el alginato de sodio.











 nova página do texto(beta)
nova página do texto(beta)



