INTRODUCCIÓN
Los gases de efecto invernadero (GEI) han jugado un papel crucial a lo largo de la historia de nuestro planeta. Dichos gases tienen la función de regular la temperatura del planeta al ser almacenados en los océanos (en el caso particular del CO2). Sin la presencia de éstos, la temperatura media de la Tierra sería de -18 ºC en vez de los 15 ºC actuales (Gay y Estrada 2010).
Sin embargo, la tendencia creciente de las concentraciones de GEI claramente tiene efectos graves sobre el planeta, siendo el cambio climático la manifestación más notoria de ellos.
Las actividades antrópicas y el consumo indiscriminado de combustibles fósiles que se ha suscitado desde la Revolución Industrial son algunas de las principales causas del calentamiento global y de los cambios en la composición de la atmósfera, lo cual ha producido cambios irreversibles en los ecosistemas (Meehl et al. 2007).
Los contaminantes atmosféricos no sólo impactan indirectamente la salud de la población, al generar cambios en el clima; también tienen un efecto directo sobre los sistemas respiratorio y circulatorio ocasionado por la exposición a los mismos (Ballester 2005). Además, cierto porcentaje de mortalidad es atribuido a enfermedades producidas por efecto de la contaminación atmosférica.
La proporción de GEI presentes en la atmósfera (Fig. 1) indica que el CO2 es el gas de efecto invernadero más abundante, seguido del CH4. Para mitigar este efecto se ha utilizado la adsorción de estos gases en estructuras nanoporosas. Ejemplos de aplicación de este tipo de métodos se han documentado desde hace tiempo. En algunos estudios se han utilizado zeolitas de poro amplío como las faujasitas (FAU) para retener CO2 (Thang et al. 2014).
Se han realizado estudios en los que se emplea la zeolita sintética 5A para separar CO2 y CH4 de una corriente de gas de relleno sanitario con el propósito de recuperar el CH4 (Mofarahi y Gholipour 2014).
Las zeolitas naturales como las del tipo clinoptilolita (HEU), mordenita (MOR) y erionita (ERI) también han sido evaluadas como adsorbentes de CO2, al igual que arcillas como la caolinita (Quiroz et al. 2016). También se ha estudiado la capacidad de adsorción de H2 en otros materiales como los aluminofosfatos (Jhung et al. 2005).
Otro ejemplo de aplicación de las zeolitas, además de la adsorción de GEI, es la adsorción de hidrocarburos como olefinas, parafinas y tolueno generados por la industria petroquímica y automóviles en zeolitas tipo ZSM-5, silicalita y HY (Migliardini et al. 2015).
Diversos autores han evaluado otras aplicaciones muy importantes de estos minerales, como la capacidad de disminución de crecimiento de colonias bacterianas utilizando zeolitas intercambiadas con cationes (Ag, Cu, Zn) (Rodríguez y Rodríguez 1997, Boschetto et al. 2012), además de su capacidad de remoción de Ag+ (Leyva et al. 2005)
Actualmente, la Asociación Internacional de Zeolitas (IZA, por sus siglas en inglés) ha reportado 394 zeolitas sintéticas, entre las que destacan las de tipo LTA, ZSM-5 y FAU (IZA 2017), además de 35 zeolitas naturales entre las que se incluyen la clinoptilolita (HEU), mordenita (MOR), erionita (ERI), epsitilbita (EPI) y chabazita (CHA), disponibles en yacimientos de México (Hernández et al. 2016a).
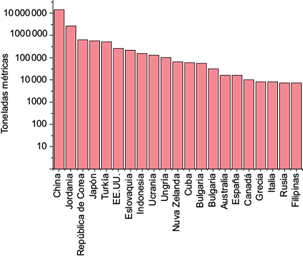
El volumen de zeolitas extraídas en 2012, de acuerdo con los datos reportados (Inglezakis y Zorpas 2012), se muestra en la figura 2. La producción mundial de zeolitas naturales es lo suficientemente grande, ya que sólo China produce más de 107 toneladas por año.
En México, la producción anual de zeolitas varía de 2050 a 2150 toneladas desde 2014. En 2015 Puebla fue el estado con mayor producción a nivel nacional (SGM 2015). Aproximadamente un 33 % de dicha producción es destinado a la industria de la construcción.
Una de las zeolitas más importantes por su abundancia y disponibilidad en México es la del tipo clinoptilolita (Petranovskii y Hernández 2015). Cabe resaltar que ésta es estructuralmente similar a la del tipo HEU, cuya estructura se muestra en la figura 3.
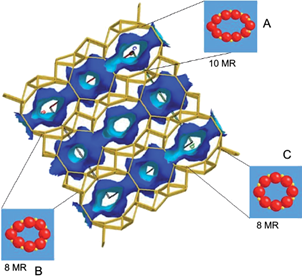
Fig. 3 Estructura de la zeolita heulandita (HEU). A: canal A; B: canal B; C: canal C, y MR: número de miembros en los anillos de la estructura
Dicha zeolita está conformada por tres canales denominados A, B y C, el primero formado por anillos de 10 miembros con amplitud de 0.55 nm y los dos canales B y C por anillos de ocho miembros con amplitudes de 0.41 y 0.34 nm, respectivamente. Los dos primeros corren paralelos al mismo plano mientras que el C es perpendicular a éstos (Mumpton 1960). Ésta zeolita se diferencia de la HEU por su mayor estabilidad térmica, dado que su estructura no colapsa al calentarse a temperaturas superiores a 350 ºC debido a una mayor concentración de Ca en su estructura (Kirov y Filizova 2012).
Como se mencionó anteriormente, una de las principales aplicaciones de las zeolitas es la adsorción debido a la forma elíptica de sus anillos, los cuales son cavidades óptimas para el alojamiento de gases de bajo peso molecular mediante procesos de adsorción (Shang et al. 2012).
La eficiencia de un material como adsorbente está determinada por su superficie específica, por lo que los mejores adsorbentes son materiales altamente porosos, con partículas de tamaño fino y poro pequeño (Thommes et al. 2015).
Por otro lado, en aquellos procesos en los que se requiere un gran volumen de zeolitas, es recomendable utilizar zeolitas naturales debido a que éstas existen en grandes cantidades en el mundo.
Para determinar su pureza y la factibilidad de sus tratamientos purificantes es necesario aplicar técnicas de caracterización, sumándose a esto el hecho de que mientras más conocimiento se tenga del material original se podrán aprovechar de mejor manera sus propiedades (Rouquerol y Rouquerol 2014).
El objetivo del presente trabajo fue evaluar el comportamiento de la capacidad de adsorción de CO2, CH4 y H2 en una zeolita natural mexicana nanoporosa sometida a diferentes modificaciones físicas y químicas.
MATERIALES Y MÉTODOS
La zeolita natural (N) utilizada en este trabajo provino de San Luis Potosí, México, la cual se manejó en un tamaño de malla de 0.3-0.18 mm y se sometió a tratamientos físicos (térmico) y químicos con soluciones de HCl a concentraciones 1N y 2N, las cuales fueron denominadas Z1 y Z2, respectivamente.
Las diferentes muestras obtenidas se caracterizaron mediante difracción de rayos X (DRX) para determinar las fases cristalinas presentes en la estructura de la zeolita, así como para determinar a qué tipo de zeolita pertenece al comparar las señales obtenidas con la base de datos del International Centre for Diffraction Data, compilada en el Powder Diffraction File.
La morfología de las partículas se obtuvo mediante microscopia de barrido de electrones (SEM, por sus siglas en inglés), mientras que la composición química de las zeolitas se determinó mediante espectroscopia de dispersión de energía (EDS, por sus siglas en inglés).
La porosidad de las zeolitas se determinó mediante adsorción de N2 a 77 K. Esta técnica permitió obtener la superficie específica mediante los métodos Langmuir y BET, volumen y diámetro de poro, así como la distribución del tamaño de poro.
La capacidad de adsorción de los gases GEI fue evaluada mediante la técnica de cromatografía de gases, para lo que se utilizó un cromatógrafo Gow-Mac 69-350 equipado con un detector de conductividad térmica (TCD) y He como gas portador.
Los datos obtenidos experimentalmente fueron ajustados a los modelos de adsorción de Langmuir y Freundlich (ecuaciones 1 y 2, respectivamente).
donde a representa la cantidad adsorbida a la presión p, a m es la constante de Langmuir y k p es la capacidad de adsorción en monocapa.
donde a representa a los moles de adsorbato en el sólido a la presión p, K F es la constante de adsorción de Freundlich y n es un factor exponencial.
Los calores isostéricos de adsorción se determinaron mediante la ecuación de Clausius-Clapeyron (ecuación 3), con lo que se determinó el tipo de interacción ocurrida para cada gas.
donde T es la temperatura, p es la presión y -q st es el calor isostérico expresado en (kJ/mol).
RESULTADOS Y DISCUSIÓN
Difracción de rayos X (DRX)
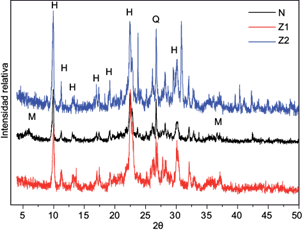
El patrón de DRX (Fig. 4) para las diferentes muestras permitió determinar que esta zeolita corresponde a la clinoptilolita (JCPDS 04-013-6126) con presencia de montmorillonita (JCPDS 29-1498) y cuarzo (JCPDS 3-0427) como materiales acompañantes (Treacy y Higgins 2001). Cabe aclarar que la clinoptilolita es estructuralmente similar a la heulandita, por lo que el estándar con el que se comparan las señales obtenidas corresponde al de esta última.
Se observó que los tratamientos químicos efectuados mejoraron la cristalinidad del material, lo cual se aprecia con mayor agudeza en varias señales como la ubicada en 2θ =30º, además de otras ubicadas en 40 < 2θ < 45 correspondientes al cuarzo. Esto se debe a la remoción de materiales acompañantes tales como arcillas y sílice amorfa por efecto de dichas modificaciones.
Los picos anteriormente mencionados parecen estar agrupados en el patrón de difracción de la muestra natural; sin embargo, a medida que se incrementa la agresividad del tratamiento químico, éstos parecen separarse, haciéndose más distinguibles.
Microscopía de barrido de electrones (SEM)
Las imágenes obtenidas mediante SEM (Fig. 5) mostraron partículas cristalinas de diversas geometrías, lo cual es consistente con la forma aguda de las señales presentadas en el patrón de DRX.
Las micrografías mostradas en la figura 5 permiten observar cristales de dimensiones aproximadas de 1.0 × 1.5 µm, los cuales se aprecian más claramente a medida que se incrementa la agresividad del tratamiento químico.
Espectroscopia de dispersión de energía (EDS)
Los estudios de composición química (Cuadro I) permitieron precisar que esta zeolita corresponde a una clinoptilolita potásica (presente en un 5.1 %). En la muestra original denominada N, los cationes presentaron la siguiente tendencia: CaO > MgO > K2O > Na2O. Además, se observó una relación Si/Al de 5.43, la cual, mediante tratamientos químicos se incrementó a 6.37 para la muestra Z2. Dicho parámetro describe la siguiente tendencia: 2N > 1N > N.
CUADRO I COMPOSICIÓN QUÍMICA DE LAS ZEOLITAS ESTUDIADAS (% EN PESO)
| Muestra | N | Z1 | Z2 |
| SiO2 | 64.6586 | 70.6967 | 72.9848 |
| Al2O3 | 11.9201 | 11.6305 | 11.4480 |
| Fe2O3 | 2.2817 | 1.4928 | 0.7624 |
| CaO | 2.0721 | 2.0111 | 2.4801 |
| MgO | 0.7832 | 0.73 | 0.7010 |
| Na2O | 0.7429 | 0.2633 | 0 |
| K2O | 5.0577 | 2.0613 | 2.4408 |
| Si/Al | 5.4243 | 6.0785 | 6.3753 |
| PxC | 12.4681 | 11.2603 | 9.2302 |
PxC: pérdidas por calcinación
Los tratamientos químicos efectuados mejoraron la relación Si/Al de la zeolita debido a la remoción de aluminio del material. Estos tratamientos tuvieron además el efecto de remover cationes encontrados en los canales de la zeolita (en lo que se conoce como proceso de decationización [Barrer y Makki 1964]), lo que se observa de manera más contundente en el porcentaje de Na presente en la misma, ya que este elemento fue prácticamente removido en su totalidad. Asimismo, se observa una reducción en las pérdidas por calcinación (PxC), lo que indica una mayor estabilidad estructural.
Adsorción de N2
Los estudios de adsorción de N2 a 77 K (Fig. 6) arrojaron isotermas de tipo I-IV de acuerdo con la clasificación de la International Union of Pure and Applied Chemistry, las cuales son características de las zeolitas naturales debido a la presencia de microporos y mesoporos en su estructura, siendo los canales A y B los que contribuyen en mayor medida al volumen adsorbido.
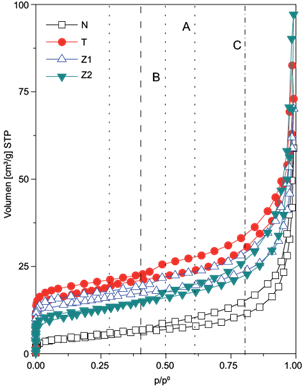
Fig. 6 Isotermas de adsorción de N2 a 77 K en condiciones estándar de temperatura y presión en las zeolitas estudiadas
Se observa, además, la presencia de histéresis tipo H3, la cual se manifiesta en la falta de coincidencia de las curvas de adsorción y desorción. Este comportamiento provoca que se pierda el carácter cíclico de la histéresis, convirtiéndose así en histéresis a baja presión. Esto se debe a que las constricciones que comunican los poros entre si adoptan dimensiones moleculares, similares a los diámetros de moléculas de adsorbato, lo cual indica una adsorción de carácter irreversible.
Este comportamiento abrió además la posibilidad de adsorber de manera irreversible moléculas de dimensiones similares de algunos GEI, como CO2, CH4 y H2, cuyos diámetros cinéticos se muestran en el cuadro II. Se observa que las modificaciones realizadas en la zeolita incrementan su superficie específica, obteniéndose valores máximos de superficie específica y volumen de microporo estimados por la ecuación (1) y el método t, de 83.71 m2/g y 0.015 cm3/g, respectivamente, para la muestra T (Cuadro III).
CUADRO III PARÁMETROS TEXTURALES
| Zta | ASL (m2/g) | ASB (m2/g) | CB | Ast (m2/g) | V∑ (cm3/g) | W0t (cm3/g) | Vmeso (cm3/g) |
| N | 27.77 | 17.35 | 138.8 | 1.927 | 0.090 | 0 | 0.099 |
| T | 83.71 | 59.04 | -143.4 | 32.32 | 0.127 | 0.015 | 0.112 |
| Z1 | 71.44 | 49.91 | -134.9 | 27.28 | 0.107 | 0.013 | 0.094 |
| Z2 | 61.51 | 40.99 | 1307 | 13.13 | 0.149 | 0.006 | 0.143 |
AsL, AsB y Ast: superficies específicas obtenidas mediante los métodos Langmuir, BET y t, respectivamente; CB: constante del método BET; V∑: volumen total de poros; Vmeso: volumen de mesoporos; W0t: volumen de microporos
El incremento en los parámetros de textura en la muestra T respecto a la de origen permite suponer la presencia de materia orgánica en el material, misma que fue calcinada por el tratamiento térmico efectuado.
Los valores de superficie específica y volumen total de poros obtenidos fueron mayores a los que se reportan en otros materiales porosos como las arcillas, donde se han observado superficies específicas de alrededor de 25 m2/g y volúmenes de poro de 0.0385 cm3/g (Quiroz et al. 2016)
La distribución de tamaño de poro fue determinada mediante los métodos Dubinin-Astakhov (D-A) y Barrett-Joyner y Halenda (BJH) (Fig. 7). Los resultados al aplicar la aproximación D-A (Fig. 7a) mostraron homogeneidad en la amplitud de los canales con valores de 0.88 nm a 1.0 nm, similares a los diámetros de los canales de las zeolitas en estudio (Hernández et al. 2016b). Esta teoría supone canales con forma cilíndrica y paralela, y que el llenado de los poros ocurre principalmente en los canales A y B (Fig. 3).
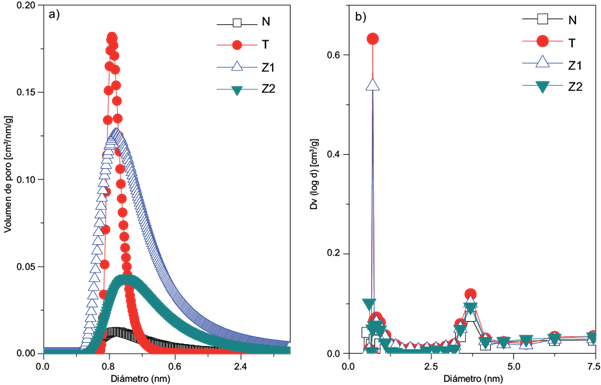
Fig. 7 Distribución de tamaño de poro por los métodos: (a) Dubinin-Astakhov (D-A), (b) Barret-Joyner- Hallenda (BJH)
La distribución del tamaño de mesoporos obtenida de la rama de desorción mediante el método BJH (Fig. 7b) mostró distribuciones bimodales de diámetro de poros ubicadas en 1.43 y 3.69 nm.
Adsorción de GEI
Los experimentos de adsorción de CO2 se realizaron en un intervalo de temperatura comprendido entre los 473 y los 573 K, obteniéndose los resultados presentados en la figura 8. Se observaron cantidades máximas adsorbidas en la muestra N a temperaturas superiores a 548 K, con un valor de 0.101 mmol/g, mientras que a temperaturas inferiores a dicho valor, la muestra Z2 presenta la mayor capacidad de adsorción de CO2 con un valor de 0.076 mmol/g.
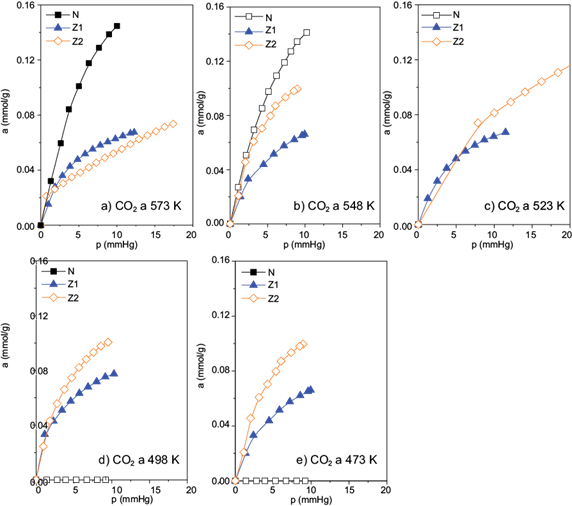
Fig. 8 Isotermas de adsorción de CO2 a diferentes temperaturas: (a) 573 K, (b) 548 K, (c) 523 K, (d) 498 K y (e) 473 K
El cuadro IV muestra la comparación de las cantidades adsorbidas de CO2 a una presión de 5 mmHg. Se observa que a altas temperaturas, la muestra N adsorbe mayores cantidades de CO2, donde se obtuvo un valor máximo de 0.14 mmol/g; sin embargo, al disminuir la temperatura, disminuye la capacidad de adsorción de la zeolita.
CUADRO IV CANTIDADES ADSORBIDAS DE CO2
| T K | N (mmol/g) | Z1 (mmol/g) | Z2 (mmol/g) |
| 573 | 0.101 | 0.049 | 0.038 |
| 548 | 0.095 | 0.046 | 0.076 |
| 523 | - | 0.047 | 0.046 |
| 498 | - | 0.059 | 0.076 |
| 473 | - | 0.047 | 0.076 |
A temperaturas inferiores a 523 K, la muestra Z2 presenta una mayor afinidad hacia dicho gas. Esto se debe a que en la muestra original la porosidad se encuentra bloqueada, por lo que se requiere una mayor actividad de parte del gas adsorbido, lo cual se obtiene a temperaturas más altas.
Los experimentos de adsorción de CH4 y H2 se realizaron en un intervalo de temperaturas de 298 a 373 K. En las isotermas de adsorción de CH4 (Figura 9) se observa una mayor cantidad adsorbida en la muestra Z2 a una temperatura de 348 K, con un valor de 0.104 mmol/g. La muestra N no presentó interacción alguna con este adsorbato; sólo lo hicieron las modificadas químicamente.
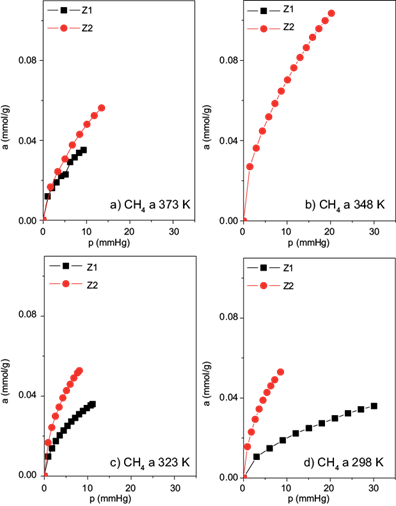
Fig. 9 Isotermas de adsorción de CH4 a diferentes temperaturas: (a) 373 K, (b) 348 K, (c) 323 K y (d) 298 K
Los experimentos de adsorción de H2 se llevaron a cabo en un intervalo de temperaturas de 373 a 298 K; sin embargo, los mejores resultados se presentaron a temperaturas inferiores a 323 K. La figura 10 muestra las isotermas de adsorción obtenidas en dichos experimentos, donde se observa una mayor cantidad adsorbida en la muestra Z2 a 298 K con un valor de 0.084 mmol/g.
El cálculo del calor isostérico permitió determinar el tipo de adsorción ocurrido en cada caso. Los calores isostéricos para adsorción de CO2, presentados en la figura 11, muestran que en las muestras N y Z2 hay una dependencia del calor de adsorción con la cantidad adsorbida, a diferencia de la muestra Z1, donde el calor de adsorción es menos dependiente de dicha variable.
La forma irregular de las curvas sugiere heterogeneidad energética en los sitios de adsorción. Se observa que las curvas de calor de adsorción de CO2 en las tres muestras se encuentran por debajo del calor de licuefacción de dicho gas; por lo tanto, ocurre una adsorción de carácter físico o fisisorción (Sing y Williams 2004).
La curva de calor de adsorción de CH4 (Fig. 12) en la muestra Z1 es superior al calor de licuefacción de dicho gas. Por otro lado, el calor de adsorción de CH4 en la muestra Z2 (Fig. 13) es inferior al calor de licuefacción, con lo cual se puede establecer que este gas se adsorbe de manera física en la muestra Z2 y química en la Z1 (Sing y Williams 2004).
Las curvas de calor de adsorción de H2 para las dos muestras (Figs. 12 y 13) se ubican por encima del calor de licuefacción de dicho gas, con lo que se establece que el H2 se adsorbe de manera química en estas dos zeolitas (Sing y Williams 2004).
Se observa una dependencia del calor de adsorción respecto a la cantidad adsorbida; asimismo, se observa una mayor afinidad hacia el hidrógeno, al obtenerse un mayor valor para el calor de adsorción. Los calores de adsorción promedio se presentan en el cuadro V.
CUADRO V CALORES ISOSTÉRICOS DE ADSORCIÓN DE GASES ADSORBIDOS (qst)
| CO2 (kJ/mol) | CH4 (kJ/mol) | H2 (kJ/mol) | |
| N | -2.839 | ||
| Z1 | -2.379 | 13.845 | 28.841 |
| Z2 | -21.435 | -5.984 | 12.967 |
| SNN-100 | 37.4 | 31 | 8.45 |
| MOF-5 | 12.5 | 19 |
Se observó que la muestra Z2 tuvo una mejor interacción con el CO2 al presentar un calor de adsorción más alto, mientras que la muestra Z1 interactuó mejor con los gases CH4 y H2. A manera de comparación, en el cuadro V se incluyen valores de calores isostéricos de adsorción de gases con efecto invernadero en materiales híbridos SNN-100 y en una estructura metal-orgánica MOF-5 (metal-organic-framework).
El calor de adsorción de H2 observado en la muestra Z1 fue superior al reportado en un material híbrido llamado SNN-100 (Park y Suh 2013). Además, se obtuvieron calores de adsorción de CH4 y H2 superiores a los que se reportan en una estructura metal-orgánica MOF-5 (Farrusseng et al. 2009).
Con base en los resultados de adsorción en estas zeolitas, se advierte que es posible aplicar versiones químicamente modificadas de una zeolita natural de poro pequeño para adsorber gases de efecto invernadero, tales como CO2, CH4 y H2.
La afinidad que las muestras tratadas químicamente presentan hacia el CH4 y el H2 puede deberse a la presencia de H+ en los canales de la zeolita, lo que genera sitios de adsorción con los que éstas moléculas interactúan.
CONCLUSIONES
La zeolita natural proveniente de Escalerillas, San Luis Potosí, fue caracterizada por diferentes técnicas. El patrón de DRX mostró que esta zeolita es una clinoptilolita con presencia de montmorillonita y cuarzo.
Las imágenes obtenidas mediante SEM mostraron cristales de 1.0 × 1.5 µm, mientras que los estudios de EDS determinaron una relación Si/Al de 5.43 y una composición química predominante en potasio.
Los estudios de adsorción de N2 a 77 K presentaron una adsorción irreversible debido a que las amplitudes de los canales de la zeolita adoptaron dimensiones moleculares.
En los estudios de adsorción de gases se observó una mayor capacidad de adsorción de CO2 en la muestra N; sin embargo, los calores de adsorción en las tres muestras fueron inferiores al calor de licuefacción.
En la muestra Z1 se registró adsorción química de CH4 y H2. La muestra Z2 presentó las mayores capacidades de adsorción de ambos gases, 0.103 mmol/g y 0.083 mmol/g para CH4 y H2, respectivamente. En dicha muestra el CH4 se adsorbió de manera física, mientras que el H2 se adsorbió de manera química.
Los resultados de adsorción observados en este trabajo abren la posibilidad de aplicación de la zeolita de Escalerillas, San Luis Potosí, como adsorbente de gases de efecto invernadero, ofreciendo una alternativa más económica al problema de la contaminación atmosférica, ya que esta zeolita es más económica que las zeolitas sintéticas, los carbones activados o los materiales híbridos.











 nueva página del texto (beta)
nueva página del texto (beta)