INTRODUCCIÓN
Los lubricantes usados de motores de automóviles contienen altas concentraciones de hidrocarburos aromáticos policíclicos, compuestos clorados, metales pesados, y otras sustancias provenientes del combustible que resultan potencialmente tóxicas para la biota (Nusetti et al. 2005). Una vez que se han removido del cárter del motor, los lubricantes usados se almacenan, y en algunos casos se vierten de manera directa en los desagües de estaciones de servicios, autolavados y talleres mecánicos, teniendo a los ecosistemas marino-costeros como receptáculo final.
Los poliquetos se han usado frecuentemente como modelos biológicos en estudios ecotoxicológicos, siendo reconocidos como organismos centinelas de contaminación del bento marino (Reish y Gerlinger 1997, Dean 2008). El poliqueto Eurythoe complanata, representante de la familia Amphinomidae, ha sido uno de los más empleados en el desarrollo de protocolos experimentales para evaluaciones de efectos de sustancias xenobióticas (Rodríguez y Escaplés 1996). En esta especie se han estimado efectos de contaminantes sobre marcadores biológicos en condiciones controladas de laboratorio. Por ejemplo, la sobrevivencia y capacidad regenerativa en ejemplares expuestos a Cd y DDT (Reish et al. 1989), alteraciones corporales con concentraciones de Hg (Vásquez-Núñez et al. 2007), inducción de metalotioneínas en presencia de Cu y Zn (Marcano et al. 1996), estrés oxidativo en organismos contaminados con Cu (Nusetti et al. 2001) y aceite usado de motores de vehículos (Nusetti et al. 2005), así como respuestas moleculares e inmunológicas a exposiciones a Cu (Nusetti et al. 1998, Zapata-Vívenes et al. 2005).
Se ha demostrado que las funciones inmunológicas son sensibles a contaminantes químicos, por lo que su uso como biomarcadores resulta potencialmente útil en anélidos (Dhainaut y Scaps 2001). El sistema inmunológico de E. complanata consta de un componente celular (celomocitos), el cual desempeña un papel clave durante los procesos de inflamación, cicatrización de heridas y fagocitosis de patógenos, y de un componente humoral, que comprende actividad bacteriolítica mediada por lisozimas, factores aglutinantes y hemolisinas (Cuvillier-Hoet et al. 2014). Se conoce que las funciones y el balance del sistema inmunitario, tanto en invertebrados como vertebrados, pueden alterarse como resultado de exposición a contaminantes (Nusetti et al. 2004, Zapata-Vívenes et al. 2005, Marcano et al. 2006, Mydlarz et al. 2006).
Los efectos citotóxicos de xenobióticos también pueden estimarse por alteraciones de la estabilidad de membranas lisosomales, y se considera que el grado de desestabilización es proporcional a la magnitud del estrés (Lowe et al. 1995, Weeks y Svendsen 1996). El daño celular se valora mediante la retención de colorantes supravitales, presentándose una relación entre la reducción del tiempo de retención del colorante y el deterioro de las membranas lisosomales en células de organismos impactados por xenobióticos (Fang et al. 2008). Adicionalmente, la aparición de micronúcleos en celomocitos se ha recomendado como biomarcador no específico de genotoxicidad, ya que indica anormalidades nucleares o daños cromosomales acumulados durante su ciclo celular (Dixon et al. 2002).
El crecimiento evaluado a través de los cocientes moleculares proteína/ADN, proteína/ARN y ARN/ADN permite estimar la condición fisiológica de animales en presencia de contaminantes (Acosta y Lodeiros 2003, Zapata-Vívenes et al. 2015). En esta investigación se realizó un bioensayo de exposición a largo plazo, usando una fracción acuosa de lubricantes usados de motores de automóviles (FALUMA) y cadmio para medir la competencia del sistema inmunológico innato (parámetros celulares, fagocitosis y actividad de la lisozima), la estabilidad de las membranas lisosomales y la presencia de micronúcleos en celomocitos, además del crecimiento somático en E. complanata con base en los cocientes entre proteínas, ARN y ADN.
MATERIALES Y MÉTODOS
Organismos
Se recolectaron manualmente ejemplares adultos del poliqueto E. complanata (1.64 ± 0.89 g) mediante buceo autónomo a profundidades de 0 a 5 m en aguas someras de la franja costera de la zona sur del Golfo de Cariaco, en las adyacencias de la ensenada de Turpialito (11º 22’ 30” N, 64º 04’ 50” O). Esta especie es relativamente abundante en la zona y la población de poliquetos no fue afectada por la recolección. Los individuos fueron transportados en envases de aislamiento térmico hasta el laboratorio y posteriormente se aclimataron durante dos semanas en acuarios (un individuo por cada 4 L de agua de mar) con arena tamizada (50 mm), temperatura del agua de 26 ± 1 ºC y con aireamiento continuo. Los organismos se alimentaron con tejidos congelados del cangrejo Carcinus sp. (~200 mg/d/animal).
Ensayo subletal
De manera separada, se expusieron 30 ejemplares por cada tratamiento durante un periodo de 21 días a: 1) una FALUMA al 3 % v/v, 2) 200 µg/L de Cd (fuente CdCl2.5H20) y 3) sólo agua de mar en organismos testigos. El experimento se realizó por triplicado. La sobrevivencia de los organismos fue de un 100 % para ambas sustancias. Los organismos se alimentaron ad libitum 2 h antes de la renovación del sistema (sedimento, agua y xenobióticos). El recambio se realizó cada tercer día para minimizar los efectos de productos de excreción y descomposición de alimentos.
Obtención de celomocitos
Se procedió a recolectar el fluido celómico por punción directa en el celoma usando una jeringa hipodérmica de 1 mL de capacidad, esterilizada, con aguja calibre 20, con un contenido de 0.5 mL agua de mar estéril filtrada a miliporo (45 µm) y 4 mmol/L de ácido etilendiamino-tetraacético (EDTA). El fluido extraído (~0.3 mL) se transfirió posteriormente a tubos de microcentrífuga Eppendorf de 1.5 mL de capacidad, y se mantuvo a una temperatura de 10 ºC. Luego se centrifugó a 1000 g durante 10 min a 4 ºC y se tomó la fracción precipitada, la cual fue resuspendida en 1 mL de agua de mar filtrada con EDTA.
Viabilidad, número total de celomocitos y fagocitosis
La viabilidad se determinó por tinción diferencial con colorante azul de tripano al 0.4 % (Nusetti et al. 1998). Se mezclaron 10 µL de la suspensión final de celomocitos con un volumen igual de azul de tripano, se resuspendió y se contaron las células en un hemocitómetro por microscopia de luz (400×). La viabilidad se expresó como porcentaje de células vivas. El NTC por mL se determinó en los cuatro cuadrantes de la cámara y se calculó de acuerdo con la fórmula NTC × 104/2 (Goven et al. 1994a). Adicionalmente, una concentración de 1 × 106 por mL de celomocitos fue incubada con una suspensión de Saccharomyces cerevisiae a 8 ºC durante 6 h. Se calculó el porcentaje de celomocitos que contenían al menos una levadura o resto de ellas en su citoplasma (Goven et al. 1996).
Lisozima
La actividad de la lisozima se determinó mediante el método propuesto por Goven et al. (1994b). Alícuotas de 40 μL del fluido celómico se dispensaron en pocillos de 5 mm de diámetro en lisoplacas de agarosa al 10 % en un amortiguador de fosfato (pH 7.5-7.8) con contenido de Micrococus lysodeikticus (0.6 mg células/mL) como substrato en placas de Petri. Las placas se incubaron a 24 ºC por 48 h. Los diámetros de las zonas de lisis se midieron y compararon con los producidos por la lisozima de aves estándar (Sigma Chemical).
Ensayo de micronúcleos
Se realizó un fijado de células en una mezcla de metanol y ácido acético (3:1) (UNEP 1999) durante 10 a 15 min. El frotis fue coloreado con Giemsa al 3 % durante 30 min, y lavado posteriormente con agua bidestilada. Se dejó secar a temperatura ambiente. Las observaciones se realizaron con microscopia de luz a 1000× con aceite de inmersión. Se consideró que las células con presencia de micronúcleos (MN) eran aquellas que presentaban núcleos intactos con diámetro cercano a 1/3 del diámetro en contraste con el núcleo principal. Se examinaron alrededor de 1000 células por frotis.
Estabilidad de la membrana lisosomal
Se transfirieron 40 µL de líquido celómico a un portaobjetos y se mantuvieron 15 min en cámara húmeda (en oscuridad). Se colocaron 40 µL de rojo neutro disuelto en dimetil sulfóxido en la lámina durante 15 min. Las observaciones se realizaron al microscopio (400×) cada 15 min por una hora y cada 30 min en las horas subsiguientes (~2 horas). Se registró el tiempo máximo en que las células permanecieron sin alteración. Las observaciones no fueron mayores a 1 min para evitar el sobrecalentamiento de la muestra. Las células se examinaron con relación a las anormalidades estructurales que presentan en el tiempo de retención de rojo neutro, estimándose la proporción de células que presentan el colorante en el citosol (Lowe et al. 1992, 1995).
Cocientes de proteínas, ARN y ADN
El tejido muscular fue homogenizado en proporción 1:10 en buffer salino (NaHPO4/Na2HPO4) a 100 mmol/L. A un mL de extracto homogenizado se le añadió 1 mL de ácido perclórico (APC) al 0.4 N y se dejó reposar por 1 h a 8 ºC. El precipitado se lavó con APC al 0.1 N y se disolvió con KOH al 0.3 N a 37 ºC durante 1 h. Después de este tiempo se extrajo una alícuota para determinación de proteínas por el método de Lowry et al. (1951), usando albúmina de suero de bovino como estándar. El ARN y ADN se separaron mediante precipitación con 1 mL de APC 1 N con centrifugación a 4 ºC, usando el sobrenadante y el precipitado como fuente de ARN y ADN, respectivamente. El precipitado se calentó con APC a 80 ºC por un periodo de 20 min. El ARN se determinó por el método de revelación por orcinol (Cambell y Sargent 1967), y el ADN mediante la reacción de difenilamina (Burton 1956). Se usó como sustancia referencial ARN de levadura (S. cerevicea) y ADN de timo de bovino. Adicionalmente, se estimaron los cocientes de crecimiento instantáneo proteínas/ADN, proteínas/ARN y ARN/ADN (Bulow 1987).
Tasa de crecimiento
Los animales expuestos a FALUMA, Cd y testigos fueron pesados antes y después de cada período de exposición. La tasa de crecimiento se determinó por la ecuación de Martin (1986).
Análisis estadísticos
Para el procesamiento de datos se usó un análisis de varianza simple mediante el programa computarizado STATGRAPHIC PLUS versión 5.1 (ambiente Windows). Para el contraste a posteriori se aplicó una prueba de Bonferroni (Sokal y Rohlf 1979).
RESULTADOS
La viabilidad celular no mostró diferencias significativas en los poliquetos tratados en comparación con los testigos (Fs = 1.69; p > 0.05). Sin embargo, el NTC presentó sus promedios más bajos en los poliquetos expuestos a FALUMA, observándose diferencias significativas en comparación con los organismos expuestos a Cd y los testigos (Fs = 3.94, p < 0.05; Cuadro I). De igual manera, se encontraron diferencias significativas en la actividad fagocítica, la cual mostró un reducido número de fagocitos (1.56 veces) en los poliquetos expuestos a FALUMA (Fs = 6.0, p < 0.05). Sin embargo, la actividad bacteriolítica de lisozimas no fue afectada por los tratamientos de Cd y FALUMA (Fs = 1.57, p > 0.05) (Cuadro I). Se evidenció una frecuencia de 2.4 MN/100 células sólo en los organismos expuestos a FALUMA (Fs = 14.0; p< 0.05). En cambio, el tratamiento con Cd no produjo variaciones en comparación con los organismos testigos (Cuadro I).
CUADRO I VIABILIDAD CELULAR (%), NÚMERO TOTAL DE CELOMOCITOS (NTC × 104), NÚMERO DE FAGOCITOS, ACTIVIDAD DE LISOZIMAS (U/mL) Y FRECUENCIA DE MICRONÚCLEOS (FMN) EN Eurythoe complanata EXPUESTOS A UNA FRACCIÓN ACUOSA DE LUBRICANTES USADOS DE MOTORES DE AUTOMÓVILES (FALUMA) DURANTE 21 DÍAS
| Testigos | Cd | FALUMA | |
|---|---|---|---|
| Viabilidad (%) | 94.33 ± 1.69 | 91.61 ± 3.31 | 89.05 ± 7.77 |
| NTC | 194.5 ± 29.28 | 211.83 ± 23.40 | 172.0 ± 32.26* |
| Fagocitos | 23.84 ± 3.82 | 25.83 ± 4.02 | 16.17 ± 6.88* |
| Lisozima | 0.85 ± 0.05 | 0.86 ± 0.03 | 0.81 ± 0.03 |
| FMN | 0.51 ± 0.20 | 1.12 ± 0.50 | 2.44 ± 0.92* |
*Diferencias estadísticamente significativas al 95 %
El mayor porcentaje de celomocitos con desestabilización en sus membranas lisosomales (DML) se observó en los poliquetos expuestos a FALUMA (Fig. 1), los cuales alcanzaron promedios mayores al 50 % de daño celular en un lapso de 120-180 min. Se encontraron diferencias significativas (Fs = 16.77, p < 0.05) en los tiempos de retención del rojo neutro para cada tratamiento, que fueron de 328.69 min, 191.1 min y 172.91 min para organismos testigos, expuestos a Cd y FALUMA, respectivamente.
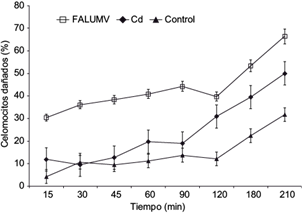
Fig. 1 Porcentaje de celomocitos con membranas lisosomales desestabilizadas en Eurythoe complanata expuestos a una fracción acuosa de lubricantes usados de motores de automóviles (cuadrados vacíos), Cd (diamantes oscuros) y testigos (triángulos oscuros) durante 21 días. La zona punteada muestra la estimación del daño al 50 % de la población de celomocitos. Las extensiones denotan las desviaciones estándares
Los niveles de proteínas expresados con base en ADN (PT/ADN) en organismos expuestos a FALUMA mostraron incremento estadístico (Fs = 5.60, p > 0.05), no así los cocientes proteína/ARN y ARN/ADN (Fig. 2). El crecimiento corporal, con relación a su cambio de masa, no varió estadísticamente entre los organismos tratados (Fs = 2.04, p > 0.05), mostrando promedios de 10.32 ± 2.34, 11.2 ± 4.30 y 8.43 ± 5.49 g para testigos expuestos a Cd y FALUMA, respectivamente.
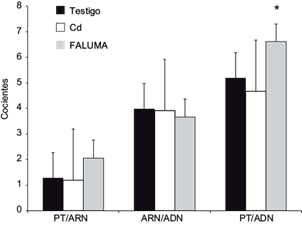
Fig. 2 Cocientes de proteína (PT) y ácidos nucleicos: PT/ARN, ARN/ADN y PT/ADN en Eurythoe complanata expuestos a una fracción acuosa de lubricantes usados de motores de automóviles (FALUMA) y Cd por 21 días. Barras oscuras: organismos testigos; barras vacías: organismos expuestos a Cd; barras grises: organismos expuestos a FALUMA durante 21 días, con sus respectivas desviaciones estándar. Los asteriscos (*) muestran diferencias estadísticamente significativas al 95 %
DISCUSIÓN
Los resultados revelaron que la FALUMA afectó algunas respuestas del sistema de defensa inmunológico-celular, fundamentado en la reducción del NTC y la actividad fagocítica. Adicionalmente, esta mezcla de xenobióticos hidrosolubles promovió la DML y la FMN en celomocitos. La disminución del NTC circundante refleja el efecto de los contaminantes sobre la producción celular por parte de los tejidos celomopoyéticos, lo que podría mermar la disponibilidad de fagocitos para la defensa inmunitaria, aumentando posiblemente los riesgos de infecciones e incidiendo negativamente en la condición de salud de los organismos contaminados.
La fagocitosis mostró una tendencia a disminuir en organismos contaminados con FALUMA. La supresión de la actividad fagocítica pareciera ser una respuesta común en organismos expuestos a xenobióticos orgánicos e inorgánicos. Se ha observado inmunosupresión en distintas especies en presencia de fracciones acuosas de formulaciones de petróleos (Nusetti et al. 2004, Marcano et al. 2006), cobre (Marcano et al. 1997) y herbicidas (Cortesía et al. 2015). Además, se han reportado efectos perjudiciales en distintos invertebrados marinos con exposición crónica a distintas sustancias contaminantes (hidrocarburos aromáticos, pesticidas, bifenilos policlorados, entre otros), los cuales incluyen efectos negativos sobre esta respuesta inmunitaria (Brousseau et al. 2000, Fournier et al. 2000, Sauvé et al. 2002). De igual manera, los eventos de cicatrización de heridas y regeneración tisular, respuestas corporales vinculadas íntimamente con la acción del sistema inmunológico, son alteradas en E. complanata por la presencia de metales pesados (Cd, Cu) y FALUMA (Reish et al. 1989, Nusetti et al. 2005, Zapata-Vívenes et al. 2005).
En invertebrados, el proceso fagocítico es llevado a cabo por celomocitos granulares. Tales células poseen lisosomas que pueden fundirse con las vesículas endosómicas o fagosomas, liberando una diversidad de factores inmunológicos con la finalidad de neutralizar y destruir a los agentes invasores tales como enzimas hidrolíticas, factores microbianos y especies reactivas del oxígeno (Goven et al. 1996). Este mecanismo de defensa inmunológico innato podría verse limitado por daño a las membranas lisosomales, ya sea por acción directa de los contaminantes contenidos en la FALUMA o subproductos de su metabolismo. Se conoce que la FALUMA puede inducir una condición de estrés oxidativo en E. complanata (Nusetti et al. 2005), lo que podría tener como blanco primario las membranas lisosomales de los celomocitos.
La lisozima no presentó variaciones en su actividad en los organismos tratados, garantizando así actividad antimicrobiana. En otras investigaciones se ha demostrado que en E. complanata la actividad de la lisozima es inhibida por Cu, inclusive se altera la capacidad de los celomocitos de formar rosetas secretorias y eritrocíticas (Marcano et al. 1997, Nusetti et al. 1998). Se han reportado observaciones similares para los anélidos terrestres Lumbricus terrestis contaminada con bifenilos policlorados (Rodríguez-Grau et al. 1989, Goven et al. 1994) y E. foetida expuesta a pesticidas organofosforados (Cortesía et al. 2015). Sin embargo, en E. complanata se han observado incrementos en la actividad de lisozima, específicamente cuando las respuestas inmunológicas-celulares se encuentran comprometidas en presencia de Cu (Marcano et al. 1997, Zapata-Vívenes et al. 2005). En el bivalvo P. imbricata, la capacidad fagocítica de los hemocitos y la actividad de la lisozima no son afectadas por contaminación subletal por una fracción acuosa de petróleo pesado (fueloil núm. 6) (Nusetti et al. 2004), aunque su actividad puede ser alterada por la concentración, el tiempo de exposición y el tipo de xenobiótico involucrado.
El sistema de membranas lisosomales en los poliquetos expuestos a FALUMA constituye un blanco subcelular susceptible, en comparación con la dosis usada de Cd. En numerosas investigaciones se ha estimado que el tiempo de retención de rojo neutro (TRRN) en células sanguíneas en invertebrados marinos contaminados varía de 60 a 120 min para alcanzar el 50 % de las células dañadas por el colorante (Nascimento et al. 2002). En anélidos terrestres se ha usado esta técnica para evaluar efectos de clorpirifos y glifosatos en celomocitos de E. fetida andrei, registrándose valores reducidos en los organismos expuestos a ambos agrotóxicos (Ringwood et al. 1998, Casabé et al. 2007, Piola et al. 2013). El TRRN en el camarón Lytopeneaus vannamei puede verse afectado por concentraciones relativamente bajas de Cd, manifestando una relación dosis-respuesta (Chang et al. 2009). La presencia de metales pesados en el mejillón P. viridis también puede afectar este parámetro (Nicholson y Lam 2005, Zhao et al. 2011, Zapata-Vívenes et al. 2012).
La aparición de micronúcleos en los organismos expuestos a FALUMA y Cd es indicio de posibles aberraciones cromosómicas que pueden ocurrir (aunque en baja frecuencia) en los procesos de división celular en los celomocitos, durante las fases de premaduración en los tejidos hematopoyéticos. Este detalle revela el daño genotóxico que puede estimular la mezcla de contaminantes hidrosolubles contenidos en la FALUMA. En otros invertebrados se ha demostrado el efecto que pueden tener fracciones de hidrocarburos en la formación de micronúcleos, por lo que estos organismos son muy eficaces para detectar daños por contaminación en estudios de monitoreo costeros (Fernández et al. 2011).
El incremento en los promedios de la relación PT/ADN sugiere la activación de la síntesis de proteínas en presencia de contaminantes (Zapata-Vívenes et al. 2015). El aumento de la concentración de proteínas puede indicar ajustes moleculares vinculados con la formación de tales macromoléculas para la captación, defensa y desintoxicación contra compuestos metálicos y orgánicos que ingresan en la pared corporal del poliqueto; dentro de éstas se incluyen las metalotioneínas. Al igual que el crecimiento corporal de los poliquetos expuestos a Cd y FALUMA, los cocientes ARN/ADN y proteína/ARN no presentaron cambios, considerando que la condición fisiológica celular no fue afectada por los tratamientos. En otros trabajos no se han encontrado cambios significativos en tales índices de crecimiento en E. complanata (Nusetti et al. 1998), aunque en bivalvos se ha demostrado que tales cocientes se alterados por exposición a metales pesados (Acosta y Lodeiros 2003) y FALUMA (Zapata-Vívenes et al. 2015).
CONCLUSIONES
Se demostró que la fagocitosis, FMN y DML, así como el cociente PT/ADN, son señales sensibles en poliquetos expuestos a FALUMA, no así con relación a la dosis de Cd. El uso de respuestas inmunológicas, genotoxicidad y cocientes moleculares de crecimiento podrían permitir la aplicación de multibiomarcadores en monitoreos ambientales de áreas impactadas por contaminantes.











 nueva página del texto (beta)
nueva página del texto (beta)


