INTRODUCCIÓN
El sistema hidrológico Lerma-Chapala-Santiago es uno de los más importantes de México, con una superficie estimada de 130 000 km2. Se divide en tres cuencas (alta, media y baja) y ocupa parte del Estado de México, Michoacán, Querétaro, Guanajuato y Jalisco. El curso alto del río Lerma (CARL) se ubica en la cuenca alta, en la región hidrológica 18, al este y noreste de la región hidrológica 26. Comprende la vertiente norte de la sierra Nahuatlaca-Matlazinca, así como la vertiente nororiental del Nevado de Toluca. Esta área queda comprendida desde las lagunas de Almoloya hasta 9 km aguas abajo de la presa José Antonio Alzate (GEM 2000 y 2009).
Según la clasificación de Köppen, el CARL presenta un clima C(w2)(w)bi(g), que corresponde a un clima semifrío subhúmedo, está formado por materiales volcánicos del terciario y cuaternario, las rocas aflorantes están representadas por materiales piroclásticos (tobas, aglomerados y brechas) y rocas de origen volcánico (basaltos y andesitas), las cuales por erosión y desintegración han formado arenas, gravas, limos y depósitos lacustres. Los suelos que predominan son tipo feozem gleyco de textura media, vertisoles pélicos de textura fina resultado de la antigua zona lacustre y litosoles con textura media en una fracción de la Sierra Nahuatlaca-Matlazinca (GEM 1993 y 1997).
El valle de Toluca, donde se localiza el CARL, es una zona industrialmente activa con una producción agrícola importante y un acelerado crecimiento urbano e industrial. En esta zona hasta el año 2000 se contaba con 108 plantas de tratamiento para aguas residuales de origen industrial, algunas de las cuales concluyen su tratamiento en las macroplantas como Reciclagua, Toluca-Norte y Toluca-Oriente, con un gasto total de operación de 2470 L/s (GEM 2000, 2002 y 2009).
La zona metropolitana del valle de Toluca (ZMVT) descarga sus aguas residuales en colectores (7 %), campos, pozos de absorción y subsuelo (27 %), canales (31 %) y ríos y arrollos (35 %), de las cuales más de la mitad tributan al río Lerma. Así, este cuerpo de agua se ha convertido en el principal colector de los desechos industriales y domésticos con un alto contenido de materia orgánica, compuestos nitrogenados, metales pesados y otras sustancias químicas tóxicas, que no se degradan fácilmente en condiciones naturales (Tejeda et al. 2006, Zarazúa 2008, Ávila et al. 2011, Zarazúa et al. 2011).
En un ecosistema acuático se puede considerar que existen tres reservorios para los contaminantes que son el agua, el sedimento y la biota, en este sentido los sedimentos son importantes ya que las concentraciones más altas se encuentran generalmente en el agua intersticial o asociadas con la fase sólida de éstos. Por ello, el análisis de los sedimentos juega un papel importante en estudios ambientales ya que son receptores de contaminantes, los cuales no permanecen fijos sino que pueden ser removidos por agentes biológicos y químicos (Hansen et al. 1995, Tarvainen et al. 1997, Pedroza et al. 2010). En general, las sustancias potencialmente tóxicas presentes en el sedimento no producen un efecto tóxico agudo en los organismos bentónicos. La mayoría de los individuos presentan respuestas subletales (deformidades morfológicas, daño en el crecimiento o reproducción), también puede observarse con la presencia de sustancias tóxicas: la movilización de organismos, la bioacumulación y la magnificación (Bryan y Hummerstone 1978, Bryan y Uysal 1978, Luoma y Bryan 1979, Walton et al. 1982, Butterworth et al. 1995).
El estudio de los cuerpos de agua se vuelve más complejo cuando están contaminados, debido a que al interactuar las sustancias antrópicas con las geogénicas, cambian las propiedades físicas y químicas del ecosistema acuático (oxígeno disuelto, pH, temperatura, demanda biológica y química de oxígeno, etc.) que alteran la calidad del agua y pueden representar un riesgo toxicológico. Por ello, es importante conocer cómo la toxicidad de los sedimentos contribuye con la degradación de los cuerpos de agua a través de la valoración de bioensayos de toxicidad (Niffeler et al. 1984).
La medida de toxicidad de las aguas residuales y cuerpos de agua, es una parte importante del monitoreo de la contaminación ambiental ya que permite la incorporación de este parámetro a un marco regulatorio. Durante los últimos años, el bioensayo de toxicidad, distribuido comercialmente como Microtox® se ha utilizado ampliamente para evaluar la toxicidad de muestras ambientales debido a sus bondades en cuanto a sensibilidad, poder discriminante, reproducibilidad y fácil aplicación. El ensayo Microtox® determina la toxicidad aguda en aguas naturales y residuales, así como en muestras sólidas (sedimentos, suelos y sus extractos acuosos), la cual se expresa como la concentración (% o mg/kg) de agentes contaminantes que produce la reducción de 50 % de la luminiscencia inicial también conocida como concentración efectiva media (EC50) de la bacteria marina Vibrio fischeri. El resultado indica que a una mayor concentración hay una menor mortandad de esta bacteria y por lo tanto menor toxicidad de los contaminantes que están presentes en la muestra analizada (Azur 1992, Jennings et al. 2001, Hsieha et al. 2004, Tsiridis et al. 2006). El bioensayo Microtox® ha mostrado mayor sensibilidad y una buena correlación con los resultados obtenidos en peces y en Daphnia magna, siendo desde 1984 una de las pruebas recomendadas por la Agencia de Protección Ambiental (EPA, por sus siglas en inglés) para la evaluación de la toxicidad aguda de muestras de agua (Bennett y Cubbage 1992, Azur 1998, Beelen 2003, Onorati y Mecozzi 2004, Burga-Pérez et al. 2012).
Actualmente en la ZMVT el gran número de industrias asentadas y el enorme crecimiento de la zona urbana han provocado la sobreexplotación de los mantos acuíferos y la contaminación de los cuerpos de agua por aguas residuales y escurrimientos agrícolas (GEM 2000 y 2002). El objetivo del presente trabajo fue evaluar la toxicidad de los sedimentos del curso alto del río Lerma y sus principales tributarios mediante el ensayo Microtox® en dos épocas del año, con el fin de servir de base para la toma de decisiones en el control de la contaminación de este importante sistema hidrológico.
MATERIALES Y MÉTODOS
Área de estudio
El curso alto del río Lerma (CARL) donde se llevó a cabo el presente estudio, se ubica geográficamente entre los paralelos 19º03'40'' y 19º30'21'' de latitud norte y los meridianos 99º26'20'' y 99º38'47'' de longitud oeste (Fig. 1; SMA 2006). Tiene una superficie de 2117.88 km2, una longitud de 50.2 km, una altitud media de 2848 msnm y una pendiente media de 8.54 %. La temporada lluviosa comienza a mediados de mayo y termina a mediados de octubre, con lluvias de verano y un porcentaje de lluvia invernal menor a 5 %, la precipitación media anual supera los 800 mm de lluvia (Díaz et al. 2005).
Muestreo
Se seleccionaron 23 sitios de muestreo: 12 sobre el río (R) y 11 sobre tributarios (T) que descargan al CARL (Fig. 1). Para definir los sitios de muestreo se tomó como base las estaciones de monitoreo establecidas por la Comisión Nacional del Agua y el Centro Interamericano de Recursos del Agua, las cuales se ubican en las principales zonas de afectación a este cuerpo de agua (Fall et al. 2007).
Se realizaron dos muestreos durante un ciclo hidrológico (estiaje y lluvias). Las muestras se tomaron de acuerdo con lo propuesto en la norma mexicana NMX-AA-112-1995-SCFI (SCOFI 1995). El sedimento se tomó del centro de cada sitio con una draga tipo ponar de acero inoxidable y se colocaron en frascos de polietileno de alta densidad con el cuidado de llenarlos totalmente para evitar espacios entre la muestra y la tapa. Debido a que la toxicidad de las muestras puede cambiar con el tiempo se almacenaron a 4 ± 2 ºC para su traslado al laboratorio y se analizaron dentro de las primeras 48 horas.
Análisis físicos y químicos de los sedimentos
A cada muestra de sedimento se le determinó el pH con un potenciómetro marca “Hach” (SCOFI 1984) y el contenido de carbono orgánico total (COT) con un analizador elemental “OI Analytical”. Se seleccionaron estos parámetros ya que pueden influir en la toxicidad y movilidad de los contaminantes (Coz et al. 2008, Karlsson et al. 2010).
Análisis de la toxicidad de los sedimentos por Microtox®
Los sedimentos pueden ser analizados con el ensayo en la fase sólida (SPT, por sus siglas en inglés), el cual fue desarrollado por AZUR® (1998) y ha sido utilizado durante los últimos años en distintos estudios para evaluar toxicidad aguda en sedimentos (Riba et al. 2004, Campisi et al. 2005, Morales-Caselles et al. 2006, Mamindy-Pajany et al. 2011 y 2012, Maranho et al. 2015a, 2015b). El protocolo SPT mide la emisión de la luz de las bacterias después de su incubación en contacto directo con una mezcla de sedimento y NaCl al 2 %.
En este estudio se aplicó el protocolo básico en la fase sólida (BSPT, por sus siglas en inglés), el cual es más simple ya que suprime la filtración e incorpora el contacto directo de las bacterias con las partículas de sedimento, así como con el agua intersticial al medir la emisión de luz cuando la bacteria está aún en contacto con el sedimento, por lo que esta emisión de luz no se ve afectada por las bajas tasas de recuperación de las bacterias (Azur 1998, Casado-Martínez et al. 2006).
Las muestras se analizaron en un equipo Microtox® marca SDI, modelo M500 bajo las siguientes condiciones: A 5 g de sedimento homogeneizado se le adicionaron 20 µL de la cepa Vibrio fischeri (conocida anteriormente como Photobacterium phosphoreum, NRRL B-11177) reconstituida con una solución no tóxica de NaCl al 2 % y se dejó incubar 20 minutos a 5.5 ± 1 ºC. Posteriormente se transfirieron 500 μL a una celdilla de análisis y se leyó a 490 ± 100 nm a una temperatura ambiente de 15 ± 0.5 ºC. A través del programa MTX-Microtox® se obtuvieron los cálculos para determinar la EC50 expresada como la concentración (%) de elementos y/o compuestos que pueden ser inhibitorios de la bioluminiscencia para V. fischeri. El intervalo de confianza considerado fue de 95 % (Azur 1992).
Análisis estadístico
Los datos se procesaron mediante el programa Statgraphics plus V. 5 para obtener los valores promedio, desviación estándar y límites de confianza. Además, se realizó una prueba de normalidad de Shapiro-Wilks. Se aplicó un análisis de varianza para los resultados que presentaron normalidad y uno de Kruskal-Wallis para los no normales entre los sitios y épocas de muestreo. Los diferentes análisis estadísticos se consideraron con un intervalo de confianza de 95 % (α ≤ 0.05).
RESULTADOS Y DISCUSIÓN
Los cuadros I y II muestran los valores de pH y la concentración del COT en los sedimentos correspondientes al lecho del río y sobre los tributarios muestreados. En el caso del pH, sólo los sedimentos de la laguna de Almoloya fueron ligeramente básicos, entre 8.15 y 8.21, mientras que para los demás sedimentos este parámetro varió entre 7.11 y 7.43. La concentración de COT, en el sedimento del lecho del río varió entre 0.8 % y 16.2 % y en los tributarios entre 2.65 % y 10.6 % (Cuadros I y II). Los sedimentos con mayor concentración promedio fueron Almoloya (R1 y R2) y Mezapa (R3 y D2), en tanto que los de menor concentración promedio fueron los de la presa Alzate a su salida y los correspondientes a los ríos Xonacatlán, Santa Catarina, San Lorenzo, Tejalpa y Temoaya.
CUADRO I pH Y CARBONO ORGÁNICO TOTAL DE LOS SEDIMENTOS SOBRE EL RÍO (R) DEL CURSO ALTO DEL RÍO LERMA

CUADRO II pH Y CARBONO ORGÁNICO TOTAL DE LOS SEDIMENTOS DE LOS TRIBUTARIOS (T) AL CURSO ALTO DEL RÍO LERMA

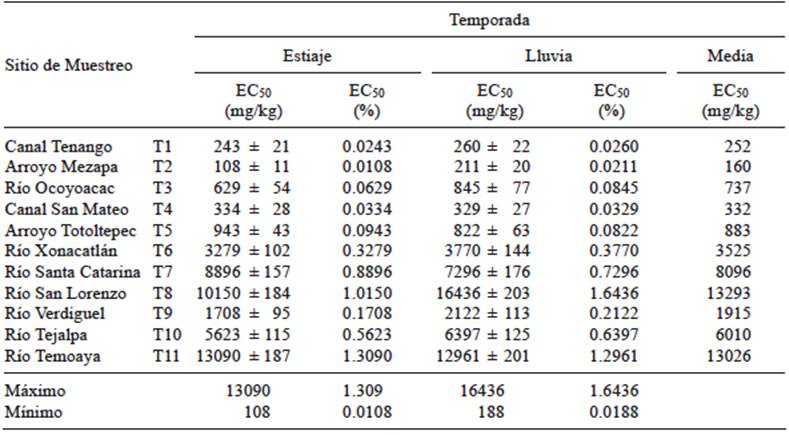
En los cuadros III y IV se muestran los resultados promedio de EC50 de las 23 muestras correspondientes a los sedimentos de río y tributarios al CARL. Para los primeros, la concentración de la EC50 varió entre 139 mg/kg y 3588 mg/kg y para las descargas fue entre 108 mg/kg y 16436 mg/ kg. Existen diferentes criterios para evaluar la toxicidad de los sedimentos debido a la presencia de contaminantes, como metales (Ni, Cu, Zn, As, Cd, Pb) y compuestos orgánicos persistentes (hidrocarburos aromáticos policíclicos y los bifenilos policlorados) que pueden ser inhibitorios del metabolismo de V. fischeri.Kwan y Dutka (1995 y 1996) estandarizaron la prueba de Microtox® para sedimentos considerando los resultados expesados como EC50 en % y los clasificaron en tres grupos: 1) extremadamente tóxicos (EC50 < 0.5 %), 2) moderadamente tóxicos (0.5 < EC50 ≤ 1 %) y 3) no tóxicos (EC50 > 1.0 %). De acuerdo con este criterio todos los sedimentos sobre CARL pueden ser considerados como extremadamente tóxicos al igual que los sedimentos de los tributarios a excepción de los correspondientes a los ríos Santa Catarina, Tejalpa (moderadamente tóxicos), Temoaya y San Lorenzo (no tóxicos). De acuerdo con el criterio de Doe et al. (2005), para valores expresados en mg/kg, si el valor de EC50 es ≤ 1000 mg/kg, entonces los sedimentos se consideran tóxicos, mientras que si el valor es >1000 mg/kg, entonces se consideran no tóxicos. Con base en lo anterior, sólo el sedimento riverino de Temoaya y Presa Alzate (salida) y los de los ríos Xonacatlán, Santa Catarina, San Lorenzo, Verdiguel, Tejalpa y Temoaya se pueden considerar como no tóxicos.
CUADRO III CONCENTRACIÓN EFECTIVA MEDIA (EC50) DE LOS SEDIMENTOS SOBRE EL RÍO (R) DEL CURSO ALTO DEL RÍO LERMA OBTENIDA POR EL MÉTODO DE MICROTOX®

CUADRO IV CONCENTRACIÓN EFECTIVA MEDIA (EC50) DE LOS SEDIMENTOS DE LOS TRIBUTARIOS (T) AL CURSO ALTO DEL RÍO LERMA OBTENIDA POR EL MÉTODO DE MICROTOX®
Los resultados del análisis de varianza de la EC50 en los sedimentos riverinos, muestran que en general las muestras tomadas de los sitios de Temoaya, Presa Alzate (salida) y Almoloya (norte y oriente) son estadísticamente diferentes al resto de los sedimentos (α ≤ 0.05), lo cual puede deberse a que los sitios en la parte intermedia del CARL tienen una fuerte influencia de descargas tanto de origen municipal como industrial. Por otro lado, la laguna de Almoloya recibe un aporte importante de aguas municipales no tratadas de las poblaciones aledañas, presenta una pendiente de sur a norte y una barrera física que impide que el agua fluya hacia lo que es el inicio del río Lerma, por lo que probablemente muchos de los contaminantes se están depositando en esta zona y así, provocan la alteración de la calidad de los sedimentos (Tejeda et al. 2005, 2006, Zarazúa et al. 2011). El resultado de este estudio clasifica a los sedimentos de esta laguna como extremadamente tóxicos, con un pH ligeramente básico, lo cual se puede deber a la naturaleza calcoalcalina de la zona, constituida principalmente por materiales piroclásticos y rocas basálticas (GEM 1993, Díaz et al. 2005). La concentración promedio de COT fue de 15 %, con lo que se rebasó el límite máximo recomendado (10 %) por el Ministerio de Ambiente y Energía de Ontario para la protección de la vida acuática (MEEO 1993). Además, se presentan altas concentraciones de compuestos orgánicos, metales, materia orgánica, nutrientes y un abatimiento de los niveles de oxígeno disuelto (Hinojosa 2006, Carreño 2008, Zarazúa 2008).
Las condiciones físicas y químicas antes mencionadas, pueden ocasionar que la biota que aún habita en esta laguna presente efectos tóxicos de ligeros a severos, como la alteración en la reproducción y en el metabolismo. Lo cual se puede ver reflejado principalmente en la disminución del número de huevos incubados y tiempo de vida, retraso en la maduración sexual y crecimiento, daño enzimático y citológico, hipoxia e incremento de la frecuencia respiratoria (Kubitz et al. 1995, Suedel et al. 1996, Bernet et al. 2004, Hattink et al. 2006, Levesque et al. 2006, Talapatra y Banerjee 2007). A partir del sitio de Mezapa hasta Naucalpan, los sedimentos se clasificaron como extremadamente tóxicos lo cual se puede deber a que esta zona del río está altamente impactada por contribuciones antrópicas, principalmente industriales de diverso origen como metal-mecánico, alimentario, textil, pintura, calzado, plantas de tratamiento, etc. (Zarazúa 2008, Ávila 2011). El pH promedio de estos sedimentos fue de 7.30 y la concentración más alta de COT se presentó en el sitio de Mezapa (10.6 %), lo anterior se debe a que en esta zona ingresan al río desechos orgánicos de origen animal provenientes principalmente de rastros de ganado ovino, bovino, porcino y aves de corral (Zarazúa 2008). Estudios previos reportan en el agua y sedimento de esta zona del CARL, compuestos orgánicos persistentes (COP) entre los cuales se encuentran el nitrobenceno, terfenil, 2 fluorobifenil, fenol d6, 2 fluorofenol, 2,4,6 tribromofenol, entre otros, así como los metales cromo, cobre, zinc y plomo, todos ellos considerados como tóxicos para la biota acuática (Tejeda et al. 2005 y 2006, Zarazúa et al. 2006, Carreño 2008, Zarazúa 2008). Debido a las condiciones fisicas y químicas de este cuerpo de agua, la anoxia, la alta concentración de la demanda química y bioquímica de oxígeno (Hinojosa 2006, Zarazúa 2008), es que los contaminantes orgánicos persistentes y los metales pueden asociarse a otros compuestos y/o elementos, formando compuestos insolubles y así, depositarse en el lecho de los sedimentos con lo que se incrementaría su concentración, enriquecimiento y toxicidad (Coz et al. 2008, Karlsson et al. 2010).
Los sedimentos correspondientes a la presa Alzate, presentaron un pH promedio de 7.2. Respecto al COT se observa una disminución en la concentración en relación con el curso de agua, siendo a la entrada de 6.2 % y a la salida de 0.8 %. Esto se debe a que en este embalse se degrada gran parte de la materia orgánica que transporta el río Lerma, así como a que el sedimento fino, al que está asociado la materia orgánica, es menor a 5 % (Zarazúa 2008). Cabe mencionar que los sedimentos correspondientes a la salida (R12) presentan una concentración de EC50 3.7 veces mayor a los sedimentos de la entrada y centro (R10 y R11), lo que sugiere una mejora en las condiciones de calidad de los sedimentos. Esto ya ha sido observado en estudios anteriores, en los que se concluyó que los sedimentos de esta presa actúan como un área de deposición de contaminantes y nutrientes contenidos en la columna de agua. Así, este embalse actúa como una laguna de estabilización en la que se están llevando a cabo procesos de sedimentación de contaminantes (Ávila et al. 1999, Ávila 2001, Carreño 2008, López et al. 2010, Barceló et al. 2012).
En cuanto a los sedimentos tomados en los tributarios al CARL, desde el canal Tenango hasta el arroyo Tototepec así como los del río Verdiguel, no muestran diferencias estadísticamente significativas entre ellos (α > 0.05). Probablemente estos tributarios transportan aguas residuales de origen industrial con alto contenido de materia orgánica, lo cual se refleja en la concentración del COT que varió entre 6.4 % y 10.6 %. Por otro lado, presentan bajos caudales, entre 0.04 m3/s y 0.36 m3/s, acumulación de residuos sólidos y lirio acuático, lo que favorece la precipitación de compuestos orgánicos e inorgánicos que alteran la calidad de los sedimentos (Hinojosa 2006, Beg y Ali 2008, Ávila et al. 2011, Zarazúa et al. 2011). Sin embargo, los sedimentos de estos tributarios son estadísticamente diferentes a los de los ríos Xonacatlán, Santa Catarina, San Lorenzo, Tejalpa y Temoaya (α ≤ 0.05), que transportan aguas residuales de origen doméstico y tienen caudales promedio entre 0.55 m3/s y 1.88 m3/s, lo que contribuye a disminuir su toxicidad. Cabe mencionar que los sedimentos de estos ríos presentan una toxicidad semejante, es decir, no existen diferencias estadísticamente significativas entre ellos (α > 0.05).
Respecto a la temporalidad, no se observaron diferencias significativas en la toxicidad de los sedimentos entre la época de estiaje y la de lluvia para los sedimentos del río ni para los de los tributarios (α > 0.05). Este resultado concuerda con lo reportado por Tejeda et al. (2006) que indican que no hay diferencia significatitiva temporal en la concentración de metales en el sedimento depositado del CARL, lo cual se debe principalmente al método de muestreo aplicado que no permite la separación de estratos.
El CARL es un cuerpo de agua que debido a las descargas de aguas residuales urbanas e industriales no tratadas que recibe ha sobrepasado su capacidad de asimilación y dilución, por lo que se ha provocado su eutrofización, así como que el índice de calidad para la pesca y protección de la vida acuática sea inaceptable. Dadas las condiciones de bajo caudal y anoxia, es probable que los contaminantes se estén depositando, lo que ocasiona que los sedimentos del CARL se considereren como extremadamente tóxicos. Estas condiciones adversas han propiciado la alteración de las cadenas tróficas y la desaparición de peces, ajolotes y plantas, sobreviviendo solamente aquellos que son altamente resistentes como el lirio acuático (Eichhornia crassipes), lentejilla (Lemna sp.) algunas especies de nematodos, artrópodos, sanguijuelas, gasterópodos, plancton, entre otros (Ávila 2001, Tejeda et al. 2010, Zarazúa et al. 2013).
CONCLUSIONES
De acuerdo con la toxicidad obtenida por Microtox®, los sedimentos del CARL y sus principales tributarios se clasifican como extremadamente tóxicos. Los sedimentos correspondientes a los ríos Santa Catarina y Tejalpa se clasifican como moderadamente tóxicos y los de Temoaya y San Lorenzo se pueden considerar como no tóxicos.
No se observaron diferencias significativas en la toxicidad entre la época de estiaje y la de lluvia para los sedimentos en estudio, sin embargo sí se presentaron diferencias espaciales lo cual refleja la influencia de los aportes de origen principalmente antrópico en la parte media del CARL.
El análisis de la toxicidad de los sedimentos del CARL y sus tributarios refleja una situación ambiental grave y compleja ya que recibe la descarga de más de 52 afluentes de origen antropogénico (aguas industriales y municipales) y natural (arrastres pluviales y fluviales), por lo que este sistema hídrico requiere acciones de prevención, control y remediación de manera prioritaria.











 nueva página del texto (beta)
nueva página del texto (beta)



