INTRODUCCIÓN
La acuacultura en México se ha desarrollado notablemente, en 2013 aportó 38 % del valor comercial de la producción pesquera nacional, equivalente a unos 475 millones de dólares. La tilapia Oreochromis niloticus ha alcanzado un primer lugar entre las especies piscícolas mexicanas con 15 mil ha disponibles para engorda en todo el territorio nacional (CONAPESCA 2013).
La península de Yucatán representa una zona de posicionamiento para la acuacultura mexicana, especialmente por su clima apropiado y su ubicación estratégica para el mercado internacional (Olvera 2010). Sin embargo, en esta región predomina un suelo cárstico muy permeable (Pérez y Pacheco 2004), lo que pone en peligro la sustentabilidad acuícola por la vulnerabilidad del acuífero a los contaminantes. Esto debido a que gran parte de la región posee fuentes subterráneas de agua y las fracturas verticales del subsuelo hace que los contaminantes químicos y microbiológicos presentes en el ambiente, fluyan por lixiviación de una manera más rápida y directa hacia el nivel freático (Buckley et al. 1994, Pacheco-Avila et al. 2004). Esta exposición del recurso hídrico a contaminantes provenientes de diversas fuentes, entre ellas del sector salud, pone en riesgo la inocuidad alimentaria (Sabra y Mehana 2015).
El dengue ocupa desde 2005 el cuarto lugar entre las enfermedades infecciosas prevalentes en México, con regiones de alta susceptibilidad como la península de Yucatán (Altagracia et al. 2012, Barba 2014). En Yucatán, para 2011 y 2012 se superaron los 5000 casos, por lo que esta zona se considera actualmente hiperendémica para esta enfermedad (Salomón et al. 2012, González 2013).
El control del vector del dengue, el mosquito Aedes aegypti, se lleva a cabo por fumigación con diversos piretroides, especialmente con formulaciones comerciales. Como resultado de estas fumigaciones se pueden contaminar cuerpos de agua y por consiguiente, la biodiversidad que ahí habita (Akan et al. 2015).
Se ha documentado que diversos grupos de organismos (no blanco), tanto terrestres como acuáticos, pueden resentir el impacto a la exposición de plaguicidas. Ejemplos de éstos son los insectos acuáticos (Antwi y Reddy 2015), abejorros (Gradish et al. 2012) y mamíferos marinos (Alonso et al. 2012). A pesar de que actualmente hay mucha información sobre el impacto de la exposición a plaguicidas en diferentes grupos de organismos, el impacto negativo en organismos no blanco pudiera estar subestimado (Velíšek et al. 2009a, González 2013).
Actualmente, los piretroides bifentrina y deltametrina, se encuentran en la lista de productos recomendados por el sector salud en México para el combate de insectos vectores de enfermedades (CENAPRECE 2016). En Yucatán, desde 2007, la secretaría de salud ha fumigado continuamente para hacer frente a brotes de dengue, con las fórmulas comerciales Talstar® y Biothrine®, a base de bifentrina y deltametrina, respectivamente, dos de los insecticidas empleados por ese sector (SSA 2010, Jahan y Sadiq 2012, González 2013).
La bifentrina [2-metilbifenil-3-ilmetil (Z)-(1RS, 3RS)-3-(2-cloro-3,3,3-trifluoroprop-1-enil)-2,2-dimetilciclopropanocarboxilato] es un piretroide tipo I, que en los últimos años se ha incrementado su uso, tanto doméstico, como en el control de plagas en agricultura o de vectores en el sector salud (Brander et al. 2016).
La deltametrina [(S)-a-ciano-3-fenoxibenzil (1R,3R)-3-(2,2-dibromvinil)-2,2-dimetilciclo propano-carboxilato], se clasifica como piretroide tipo II y actualmente presenta un amplio uso doméstico, agrícola y para el control de vectores (Prusty et al. 2015, Brander et al. 2016). Se tiene registrado que la deltametrina causó mortandades masivas de Anguilla anguilla en el lago Ballaton, Hungría en los veranos de 1991 y 1995, luego de haberse aplicado este plaguicida en repetidas ocasiones para el control de mosquitos (Kidd y James 1991, Bálint et al. 1995).
En este contexto, las investigaciones sobre el efecto de insecticidas en peces de importancia para la acuacultura aún es escasa (Weston et al. 2011). Esto es relevante al haberse demostrado que los piretroides sintéticos pueden ser tóxicos para los peces (Dobsikova et al. 2006, Sarikaya 2009).
Aunque existen numerosas investigaciones que han documentado los efectos tóxicos agudos o subagudos de la bifentrina y de la deltametrina en peces de importancia comercial, éstos se orientan al estudio en la sustancia en grado técnico y no en formulaciones comerciales (Boateng et al. 2006, Velíšek et al. 2007, Karasu et al. 2009, Hedayati et al. 2012). Yildirim et al. (2006), consideran que las evaluaciones de toxicidad utilizando sólo los principios activos son insuficientes, por lo que deben incluir determinaciones de los efectos tóxicos de las formulaciones comerciales para estimar la acción sinérgica de los aditivos que contienen.
Dadas las perspectivas promisorias de desarrollo de la actividad acuícola en diversas zonas de la península de Yucatán, se requiere realizar investigaciones para conocer el potencial riesgo tóxico de insecticidas en peces de importancia comercial, tanto de los principios activos como de las formulaciones comerciales utilizadas por el sector de salud pública (Dobsikova et al. 2006, de Moraes et al. 2013, Chandrasekara y Premarathna 2016).
Este es el primer trabajo donde se evalúan los efectos tóxicos agudos individuales de Talstar® (a base de bifentrina) y Biothrine® (principio activo, deltametrina) sobre estadios juveniles de la tilapia O. niloticus, usando como criterio de determinación la concentración letal media (CL50).
MATERIALES Y MÉTODOS
Ochocientas tilapias juveniles de la especie O. niloticus (longitud total: 6.34 ± 0.81 cm, peso: 5.14 ± 0.65 g), masculinizadas con 17 α -metil testosterona, se adquirieron en CINVESTAV-Mérida y se aclimataron por 30 días. Los organismos fueron distribuidos en cuatro tinas de plástico de 1000 L, en el área acuícola del Instituto Tecnológico de Tizimín, Yucatán, México. El suministro de aire fue constante y se monitoreó la temperatura (Tº), el oxígeno disuelto (O2) y el pH del agua diariamente con un medidor multiparámetro portátil (Hach, modelo Senson 156). Cada quince días, se tomaron muestras de agua por triplicado, para determinar la dureza total, el amonio y los nitritos. A los peces se les suministró alimento comercial (Tilapia Chow®, 30 % de proteína) ad libitum.
Finalizada la aclimatación, se seleccionaron al azar 540 tilapias para realizar dos bioensayos estáticos de 96 h (Reish y Oshida 1987). Cada uno de los tratamientos constó de 10 peces (longitud total = 8.07 ± 1 cm, peso = 11.2 ± 1.61 g) por pecera de 120 L, por triplicado.
Los peces no se alimentaron desde dos días antes y durante todo el bioensayo para evitar presencia de heces. Se registró la temperatura, el oxígeno disuelto y el pH de las peceras cada hora durante las primeras doce horas y después cada seis horas hasta el término de cada bioensayo.
Preparación de las soluciones y bioensayo preliminar
Las sustancias a evaluar se compraron en un negocio local de productos agropecuarios. Se preparó una solución reserva con las indicaciones del productor, tal cual se presentaron en las hojas de seguridad. Por separado se disolvieron en agua destilada los polvos a hidratar de Talstar® (bifentrina) y Biothrine® (deltametrina), respectivamente, mismos que se colocaron en contenedores de plástico de 10 L. Se tomó una muestra de 10 mL para determinar su concentración por espectrometría y las soluciones a evaluar se prepararon por diluciones repetidas.
Antes de realizar el bioensayo de evaluación, se llevó a cabo una prueba de intervalo de toxicidad, esto es un bioensayo preliminar, en el que se tomaron como referencia los valores registrados en la literatura para estas sustancias.
Cabe destacar que al estar los insecticidas utilizados en forma de polvos para hidratar, así como al haber preparado las disoluciones en agua destilada, no fue necesario incluir en los tratamientos un testigo solvente, solamente un testigo agua (negativos, sin insecticida).
Bioensayo 1: Talstar®
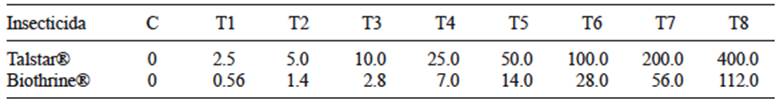
La sustancia analizada fue Talstar® con bifentrina (9 %) como principio activo y 91 % de ingredientes surfactantes y solventes. Se evaluaron ocho concentraciones (2.5 - 400 µg/L) con tres repeticiones cada una. Se utilizó un grupo testigo de agua destilada, sin insecticida (Cuadro I).
Bioensayo 2: Biothrine®
Se utilizó Biothrine® con 2.5 % de deltametrina como principio activo y 97.5 % de ingredientes surfactantes y solventes para evaluar ocho concentraciones (0.56 - 112 µg/L), con tres repeticiones cada una, así como un grupo testigo negativo, al que se le agregó agua destilada (Cuadro I).
Durante los bioensayos se observaron y documentaron los cambios en el comportamiento de los organismos, se registró la hora y el porcentaje de mortalidad, la que se definió como la ausencia de movimiento en branquias y aletas en respuesta a estímulos externos (Zapata y Pedrero 2008). La CL50 se obtuvo mediante el método probit (Finney 1971), con el programa Statgraphics Plus version 5.1.
RESULTADOS
No se observó mortalidad en los peces de los grupos testigo negativo en ambos bioensayos. La temperatura y el pH de los acuarios no variaron significativamente, sólo el oxígeno disuelto presentó una disminución no significativa (p ≤ 0.05) en la mayor concentración agregada del insecticida. Los valores de la calidad del agua (media ± D.E.) se muestran en el cuadro II.
CUADRO II PARÁMETROS FÍSICOS Y QUÍMICOS DEL AGUA EVALUADOS EN LOS BIOENSAYOS DE Oreochromis niloticus EXPUESTOS A TALSTAR® Y BIOTHRINE®

Bioensayo 1: Talstar®
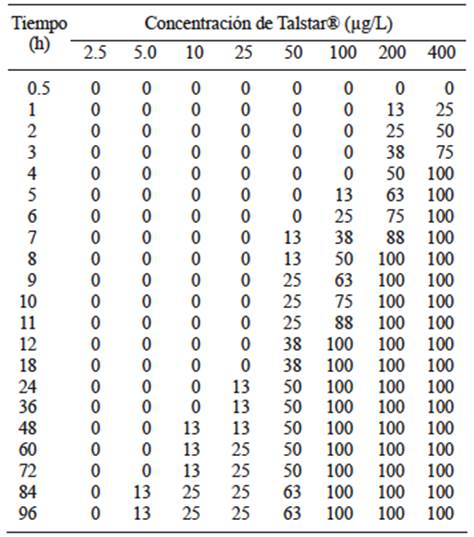
En la evaluación de Talstar®, se observó que los peces nadaban de manera errática y disfuncional a los pocos minutos de haber administrado la mezcla comercial del piretroide bifentrina adicionado con solventes y emulsificantes, especialmente en las mayores concentraciones. La mortalidad se presentó en las dosis más altas en tiempos más cortos. Por ejemplo, para la concentración de 5 µg/L la mortalidad ocurrió a partir de las 84 horas de exposición. En contraste con la concentración más alta (400 µg/L), en la que la mortalidad inició en la primer hora de exposición al piretroide (Cuadro III).
CUADRO III TABLA DE MORTALIDAD DE Oreochromis niloticus POR EFECTO DE TALSTAR® A DIFERENTES HORAS DE LECTURA
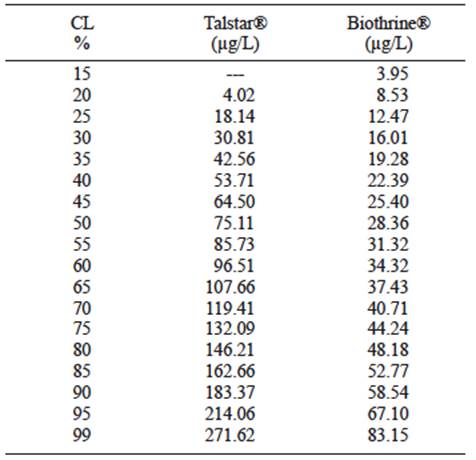
El análisis probit (p ≤ 0.01, X2 = 110.86) reveló que la CL50 de Talstar® (9 % de bifentrina, como ingrediente activo) en O. niloticus fue de 75.11 µg/L a las 96 horas. Los intervalos de confianza menor y mayor al 95 % fueron 58.76 y 96.34 µg/L, respectivamente (Fig. 1, Cuadro IV).
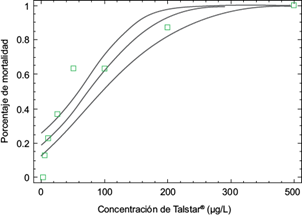
Fig. 1 Curva de la concentración letal 50 96 h (I.C. 95 % = 58.77-96.34, p < 0.01, R2 = 82.07, x2 = 110.86) para Talstar® en Oreochromis niloticus. I.C. = Intervalo de confianza, R2 = coeficiente de determinación, x2 = chi cuadrada
Bioensayo 2: Biothrine®
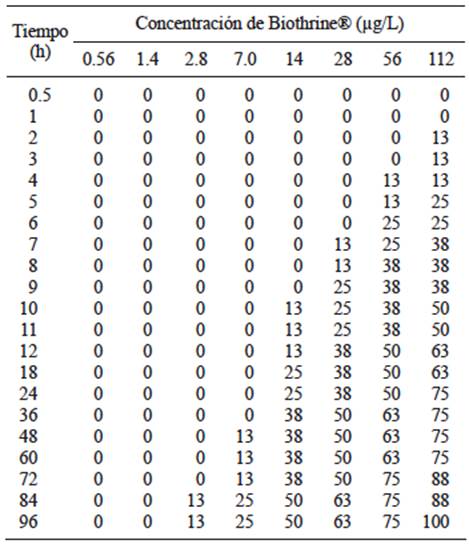
En la evaluación de Biothrine®, también se observó que los peces nadaban de manera errática y disfuncional a los pocos minutos de haber administrado la mezcla comercial, especialmente en las mayores concentraciones. De igual modo que en Talstar®, la mortalidad se presentó en las dosis más altas en tiempos más cortos, mientras que para las dosis menores, la mortalidad sucedió en un tiempo mayor. Por ejemplo, para las dos concentraciones más bajas (0.56 y 1.4 µg/L) no se presentó mortalidad. Respecto a la concentración de 2.8 µg/L, la mortalidad ocurrió a partir de las 84 horas de exposición. En contraste, en la concentración más alta (112 µg/L), la mortalidad inició en la segunda hora de exposición al piretroide (Cuadro V).
El análisis probit (p ≤ 0.01, X2 = 127.1) reveló que la CL50 de Biothrine® (2.5 % de deltametrina, como ingrediente activo) en O. niloticus fue de 28.36 µg/L a las 96 horas. Los intervalos de confianza menor y mayor al 95 % fueron 23.29 y 35.27 µg/L, respectivamente (Fig. 2, Cuadro IV).
DISCUSIÓN
El cultivo de la tilapia está en desarrollo en el sureste de México, pero diversas acciones ponen en riesgo la inocuidad alimentaria de su producción. Una de ellas es el uso indiscriminado de insecticidas piretroides que el sector salud dispersa para hacer frente al mosquito vector del dengue (Sabra y Mehana 2015) y de otras enfermedades emergentes como chikungunya y zika (Gratz 2004, Musso y Nhan 2015).
La deltametrina y la bifentrina son los principios activos de un número cada vez mayor de insecticidas comerciales elegidos para estas fumigaciones con efectos tóxicos no evaluados lo suficiente en especies de importancia para la acuacultura, tanto en el sureste como en otras regiones de México (CENAPRECE 2016). Por ello, la determinación de sus grados de toxicidad se hace necesaria, en especial al incluir los datos de sus formulaciones comerciales (Yildirim et al. 2006, Monte et al. 2016).
Se obtuvo a las 96 horas en ambos insecticiadas, una CL50 de 75.11 µg/L para Talstar® y de 28.36 µg/L para Biothrine®, estas formulaciones comerciales, contienen 91 y 97.5 % de ingredientes surfactantes y solventes, respectivamente.
Velíšek et al. (2007), documentaron una CL50 de 0.02 mg/L a las 96 horas de contacto con el pesticida Decis EW 50® (a base de deltametrina) en la trucha arcoíris (Oncorhynchus mykiss). Velíšek et al. (2009a) registraron una CL50 de 57.5 µg/L a las 96 horas en juveniles de carpa Cyprinus capio expuestas a Talstar®. Ponepal et al. (2010), encontraron un gradiente de toxicidad para este insecticida comercial en percas (Perca fluviatilis) evaluadas a 96, 168 y 336 horas. Datos más recientes han registrado la CL50 de 8.7 µg/L a las 96 horas en Oreochromis mossambicus, expuestas a Trebon®, el cual es un insecticida comercial cuyo principio activo es el piretroide Etofenprox, (Chandrasekara y Premarathna 2016).
A pesar de la falta de un patrón de referencia que permita realizar comparaciones directas de las CL50 obtenidas para Talstar® y Biothrine® con insecticidas comerciales a base de piretroides, incluyendo bifentrina y deltametrina, se puede deducir el riesgo tóxico que presentan esas formulaciones para los organismos acuáticos en la península de Yucatán. Esto, porque para el criterio de Sabra y Mehana (2015), los datos de CL50 obtenidos en este trabajo se sitúan dentro de una escala de peligro, específicamente en un rango extremadamente tóxico (valores entre 10 y 100 µg/L).
Los piretroides producen baja toxicidad en mamíferos y aves, pero en los peces se presenta una mayor susceptibilidad, debido a un desequilibrio entre una alta tasa de absorción branquial y una baja detoxificación hidrolítica (Yang et al. 2014). En especial los peces tienen ciertas deficiencias enzimáticas para hidrolizar los piretroides, además su sistema nervioso es muy sensible y tienen una baja capacidad de metabolizar y eliminar insecticidas (Bradbury et al. 1986, Viran et al. 2003, Aydin et al. 2005).
Los efectos deletéreos en los piretroides se han podido diferenciar en dos grandes subdivisiones para los mecanismos de neurotoxicidad que pueden generar en mamíferos. En el caso de los piretroides tipo I, éstos producen un síndrome de intoxicación T, que se caracteriza por temblores, hiperexcitabilidad y ataxia locomotriz. En contraste, los piretroides tipo II, provocan el síndrome C, donde se presenta coreo atetosis y salivación (Breckenridge et al. 2009).
En este contexto, la bifentrina es un piretroide tipo I que altera los canales de sodio en las terminales de las células nerviosas para despolarizar el funcionamiento pre sináptico (de Moraes et al. 2013). Por otro lado, el mecanismo de toxicidad de la deltametrina piretroide tipo II, ocurre mediante el bloqueo de los canales de sodio de los filamentos nerviosos, lo que alarga la fase de despolarización y resulta en la afectación de los receptores del ácido γ-aminobutírico (GABA) en dicho tejido (El-Sayed y Saad 2007, Anadón et al. 2009).
Entre los daños evidenciados en peces para los piretroides tipo I, como la bifentrina en concentraciones del rango de µg/L, se encuentran alteraciones en la función motriz, cambios adversos en el desarrollo y muerte (Jin et al. 2010). Entre los efectos de los piretroides tipo II, como la deltametrina, se ha argumentado que también afectan la función motriz en concentraciones tan bajas del nivel de ng/L, además de producir efectos neurotóxicos, en el caso del pez cebra, puede reducir la fecundidad y la eclosión (De Micco et al. 2010, Sharma y Ansari 2010).
Se sabe que los piretroides tipo II son más tóxicos que los del tipo I, debido a que los piretroides del tipo II mantienen la inactivación de los canales de sodio durante un tiempo más largo que los compuestos tipo I, lo que imposibilita la generación del potencial de acción (Klaassen y Watkins III 2003, El-Sayed y Saad 2007).
En coincidencia con esta información, podemos destacar que para el presente estudio, el compuesto de Biothrine® (a base de deltametrina, piretroide tipo II) resultó más tóxico para la tilapia que Talstar® (a base de bifentrina, piretroide tipo I) en las condiciones experimentales establecidas.
En nuestro estudio, las principales afectaciones visibles en las tilapias expuestas a ambas mezclas de piretroides fueron: incremento de los movimientos operculares, pigmentación en la piel, pérdida del equilibrio y movimiento errático, siendo más conspicuas a una mayor concentración del insecticida administrado. Estas observaciones coinciden con lo encontrado por otros autores para exposiciones agudas y subagudas de piretroides en peces (El-Sayed y Saad 2007, Velíšek et al. 2009b). Es de resaltar que estas manifestaciones suelen ser irreversibles si el nivel de toxicidad supera el umbral máximo de exposición y acumulación (Herwig 1979).
Aunque los valores de la CL50 para Talstar® y Biothrine® obtenidos en esta investigación son menores a los reportados por otros autores en cuerpos de agua para bifentrina y deltametrina, la exposición de piretroides en peces de ambientes naturales puede producirse por absorción branquial dada la alta lipofilicidad de los insecticidas o a través de la cadena alimenticia (Alonso et al. 2012).
En un estudio realizado en Nigeria, Akan et al. (2015) encontraron rangos de concentraciones entre 0.29 y 1.36 mg/L para bifentrina y entre 0.28 y 1.14 mg/L para deltametrina en agua de río. Ambas concentraciones estuvieron por debajo de los límites permisibles en aguas para la Unión Europea (100 y 50 mg/L para bifentrina y deltametrina, respectivamente).
En la península de Yucatán predominan datos sobre detección de plaguicidas organoclorados y organofosforados en agua y suelo, mientras que son escasos para los piretroides (Ponce-Caballero et al. 2012). A pesar de que se ha argumentado la posibilidad de contaminación de acuíferos por piretroides, las formulaciones comerciales comunes en programas de control de vectores incluyen surfactantes y agentes emulsificantes que podrían favorecer el transporte de los plaguicidas hasta los cuerpos subterráneos de agua y potencializar su persistencia en la cadena trófica (Pawlisz et al. 1998, Schleier III y Peterson 2011, Khalili et al. 2012, Akan et al. 2015).
Para el caso particular de los piretroides, su persistencia es muy corta y su solubilidad en agua es muy baja (1 - 10 µg/L), por lo que se podría sugerir un bajo potencial de contaminación acuática (Coats et al. 1989). No obstante, la forma más utilizada para fumigación y que se eligió en este estudio, es en polvo para hidratar lo que aumenta su disponibilidad en la cadena trófica y podría tener un potencial tóxico hasta nueve veces más que en su grado técnico (Neelima et al. 2016). Lo anterior aunado a un uso indiscriminado, aumenta el riesgo de exposición significativa en organismos de vida silvestre, domésticos o de importancia económica (De Micco et al. 2010, Goulding et al. 2013).
Así, se afirma que la toxicidad de los piretroides se incrementa con temperaturas bajas de agua (Kumaraguru y Beamish 1981, Oros y Werner 2005). Este efecto se atribuye a un mecanismo bioquímico de los peces basado en un aumento en el flujo de la corriente de sodio en las membranas sinápticas a bajas temperaturas (Narahashi et al. 1998).
En el contexto local, esta tendencia dependiente de la temperatura podría tener implicaciones para la acuacultura, ya que en la península de Yucatán prevalecen temperaturas calurosas, en promedio de 26 ± 1 ºC (Vidal-Zepeda 2005). Esto podría incidir en que el potencial de toxicidad por los insecticidas sería de menor impacto para esa actividad, dado el riesgo disminuido por los altos valores de la temperatura ambiental prevaleciente en la región.
Acorde a este planteamiento, y ya que la península de Yucatán se encuentra sobre una gran masa calcárea caracterizada por poseer niveles elevados de CaCO3 (Pérez y Pacheco 2004), también la dureza podría significar un factor amortiguador de la toxicidad por insecticidas piretroides. A este respecto, se conoce que este parámetro puede influir en la toxicidad de los piretroides (Mauck et al. 1976). Esto, porque existen indicios de que algunas enzimas involucradas en el transporte activo en las branquias pudieran inhibirse por los piretroides bajo la influencia de cambios en la dureza del agua y ocasionar un desbalance osmótico (Coats et al. 1989, Dyer et al. 1989). En este sentido, se requieren más estudios para corroborar la influencia de la temperatura y la dureza del agua en el grado de toxicidad por piretroides en peces.
Por último, el uso de piretroides en programas de control del dengue se prioriza por encima de otros insecticidas debido a su mayor fotoestabilidad, a su efectividad contra del mosquito vector y a su menor toxicidad para organismos como aves y mamíferos, pero se ha demostrado efectos nocivos mayores para peces (El-Sayed y Saad 2007). Una alternativa viable se dirige a evaluar la utilidad de extractos vegetales para el control del mosquito, ya que podrían ser menos tóxicos para los peces por considerarse biodegradables (Ghosh et al. 2012, Queen et al. 2014).
CONCLUSIONES
Este es el primer trabajo que evalúa los efectos tóxicos agudos individuales de insecticidas comerciales en especies piscícolas de importancia comercial en la península de Yucatán. Las CL50 de Talstar® (bifentrina) y de Biothrine® (deltametrina) a las 96 horas en O. niloticus fueron de 75.11 µg/L y 28.36 µg/L, respectivamente. Los signos de toxicidad en los peces bajo influencia de ambos insecticidas fueron movimientos erráticos, desbalance e hiperventilación, siendo más evidentes y en menor tiempo, en concentraciones más altas.
Los valores de CL50 obtenidos se consideran extremadamente tóxicos, por lo que se debe alertar dado el potencial efecto contaminante que se podría producir en ambientes naturales como los prevalecientes en la península, así como en condiciones de acuacultura.
Es posible que estos insecticidas no tengan un alto impacto negativo en condiciones de campo dada su mínima adsorción en agua, así como por el amortiguamiento de la temperatura y de la dureza del agua. Aunque la alta lipofilicidad de estos piretroides promueve el potencial de absorción en el tejido adiposo. Además, es importante reconocer que los concentrados emulsionables que se utilizan en estos plaguicidas en el sector salud, favorecen el tiempo de permanencia en la cadena trófica. Los datos obtenidos en este trabajo mediante condiciones controladas, podrían ser de utilidad para estudios futuros que evalúen los efectos de los plaguicidas piretroides, ya sea de formulaciones comerciales o de sus principios activos, en ecosistemas similares a los de la península de Yucatán.
Los datos obtenidos reafirman la necesidad de continuar con la evaluación de los mecanismos de toxicidad de sustancias utilizadas en el sector salud sobre especies piscícolas ya que se tiene la perspectiva de continuar con su uso, aunque el desarrollo del sector en la región prevalezca.











 nueva página del texto (beta)
nueva página del texto (beta)