INTRODUCCIÓN
Las actividades agrícolas en frutales que son ampliamente difundidas en las zonas rurales adyacentes a la ciudad de Mendoza, Argentina, son los cultivos de vid, olivo, ciruelo, almendro, nogal y durazno, entre otros (Censo Frutícola Provincial 2010). Se caracterizan por el uso de mano de obra para aplicar plaguicidas con tecnología simple. Hay una variedad de aproximadamente 1000 sustancias en los principios activos que están disponibles en el mercado nacional (Pórfido et al. 2014). Los diferentes costos económicos, efectividad y poder residual de los mismos, dificulta la posibilidad de identificar desde la oferta en el mercado, cuáles y cuántos plaguicidas se utilizan en la práctica en este tipo de plantaciones, menos aún las combinaciones empleadas por cada trabajador.
En la provincia de Mendoza la exposición a plaguicidas constituye un factor de riesgo para la salud. El Centro de Información y Asesoramiento Toxicológico (CIAT) indica que en 2015, las intoxicaciones por plaguicidas de uso doméstico y uso agrícola fueron la 4ta. y 5ta causa de las consultas por intoxicaciones (Dr. A. Saracco, director CIAT, com. pers.).
El daño al material genético debido al uso de los plaguicidas agrícolas ha sido una preocupación abordada por investigaciones que realizan biomonitoreos de genotoxicidad en trabajadores rurales de distintos países (Hoyos et al. 1996, Holland et al. 2008, Ceppi et al. 2010, Gentile et al. 2012). Las probabilidades de daño en la salud de estos trabajadores y sus familias, pueden aumentar por la exposición durante la aplicación de plaguicidas con o sin maquinaria agrícola, reparación de equipos de pulverización y manejo sanitario de animales de producción (Alavanja et al. 1996). Una exposición laboral a plaguicidas puede producir efectos adversos a la salud dependiendo de las características del factor de riesgo, del nivel/ tipo/ duración de la exposición y de la susceptibilidad individual (Manno et al. 2010). La incidencia de aberraciones cromosómicas (AC), micronúcleos (MN) e intercambio de cromátidas hermanas (ICH) se ha correlacionado positivamente con la duración de la exposición en varias de estas investigaciones (Albertini et al. 2000). El monitoreo biológico ha surgido como una de las áreas más activas de investigación en salud ocupacional. Una ventaja del biomonitoreo para la evaluación de riesgo es la posibilidad de cuantificar la interacción, a largo plazo entre los organismos y los plaguicidas, proveer una medida de la exposición previa y registrar los efectos adversos, así como la susceptibilidad individual a los compuestos químicos del ambiente. Además, puede ser particularmente útil para evaluar y controlar el riesgo de eventos a largo plazo asociados con dichas exposiciones previas (Manno et al. 2010).
El daño al material genético ha sido evidenciado en estudios realizados a trabajadores agrícolas de Argentina, de las provincias de Córdoba y Santa Fe, a través de la evaluación de AC (Mañas et al. 2009a), MN (Gentile et al. 2012) y ensayo cometa (EC) (Simoniello et al. 2008). En esas regiones los principales cultivos son los cereales y oleaginosas, los plaguicidas preferidos han sido los insecticidas cipermetrina, clorpirifos y endosulfán, así como los herbicidas glifosato, atrazina y 2,4-D (Gentile et al. 2012). Tanto las prácticas agrícolas como el modo de aplicación de los plaguicidas, son específicos para ese tipo de cultivos, en los que destaca la fumigación aérea (Lantieri et al. 2009). Los métodos de aplicación pueden variar de una región a otra según el tipo de cultivos y el tipo y cantidad de elementos de protección personal (EPP) utilizados. Esta es una práctica indispensable para la disminución de intoxicaciones agudas y efectos crónicos causados por la exposición a plaguicidas. Bull et al. (2006) indican que el uso de EPP no ha estado bien documentado y que el uso escaso se ha asociado a resultados positivos en la evaluación de blancos finales de genotoxicidad. En la provincia de Mendoza no existen estudios previos que evalúen el nivel de daño genético en trabajadores de fincas frutícolas. Conocer el nivel de daño genético es importante para advertir sobre la posible presencia de pre-lesiones que pueden evolucionar a enfermedades crónicas como diferentes tipos de cáncer, diabetes, alteraciones neurodegenerativas como son Parkinson, Alzheimer, esclerosis amiotrófica lateral, así como defectos de nacimiento y desórdenes reproductivos (Mostafalou y Abdollahi 2013).
En la actualidad, una alta proporción de los alimentos que sustentan la dieta de la comunidad de la provincia de Mendoza proviene de la actividad frutal y hortícola. La región cuenta con alrededor de 1 738 929 hab (Censo Nacional 2010), cuyos requerimientos de alimentos demanda un creciente desarrollo de prácticas agrícolas y personal dedicado a las mismas. La presente situación plantea una relación directa entre los plaguicidas y el riesgo de la estabilidad del genoma de los trabajadores expuestos a ellos. Esta relación está determinada por la característica de los plaguicidas considerados como agentes genotóxicos que ejercen su acción en el material genético de los seres vivos durante exposiciones crónicas a bajas dosis (Bolognesi 2003). Por esta razón, es imprescindible motivar el diseño e implementación de programas estratégicos y políticas de intervención, promoción y educación temprana. Lo anterior para prevenir los riesgos de efectos sobre la salud de los trabajadores con énfasis en la interacción genes- ambiente (Hoyos et al. 1996, Gentile et al. 2012).
Los efectos de la exposición a plaguicidas durante un largo periodo de tiempo a bajas dosis es difícil de evaluar, porque los signos y síntomas en general, no tienen manifestaciones clínicas inmediatas y se presentan en forma tardía. Los biomarcadores de daño genético más utilizados en poblaciones expuestas a plaguicidas son AC, ICH y MN a partir de muestras de sangre periférica y MN en epitelio bucal, así como, EC en sangre periférica (Aiassa et al. 2012, Gómez-Arroyo et al. 2013). El ensayo de MN en células exfoliadas del epitelio bucal no requiere del cultivo de células, por lo tanto además de ser un método mínimamente invasivo y con una obtención de la muestra en forma sencilla, requiere un menor tiempo de realización comparado con los estudios en sangre (Pastor et al. 2003, Martínez-Valenzuela et al. 2009, Bolognesi et al. 2011, Benedetti et al. 2013). Este método permite detectar daño al ADN, inestabilidad cromosómica, muerte celular, el potencial regenerativo del tejido de la mucosa bucal (Thomas et al. 2009), anomalías asociadas con defectos genéticos en el mantenimiento del genoma, envejecimiento acelerado y algunas enfermedades degenerativas. El daño genómico es probablemente la causa fundamental de las enfermedades del desarrollo y neurodegenerativas (Holland et al. 2008, Ceppi et al. 2010). Por sus cualidades, el ensayo de MN permite efectuar biomonitoreos en poblaciones con riesgo de presentar daño genético.
Los objetivos de este estudio fueron determinar el nivel de daño genético en un grupo de trabajadores de plantaciones frutales que han utilizado plaguicidas agrícolas en forma crónica y analizar si existe una correlación con parámetros de la práctica laboral.
MATERIALES Y MÉTODOS
Área de estudio
El grupo humano estudiado residía en el departamento de Maipú, ubicado a 14 km al este de la capital de Mendoza, Argentina, la cual contiene el mayor número de hab/km2 en la provincia. El departamento abarca 717 km2, un área urbana y un área rural predominante cultivada con plantas frutales. La zona de estudio está dividida en superficies de aproximadamente 500 - 1000 m2, rodeadas por calles de tierra sin pavimentar y acequias o cauces de agua utilizados para el riego de los cultivos.
Población de estudio
Un total de 40 personas participaron en el estudio de genotoxicidad. Veinte habitantes del área rural que en sus prácticas agrícolas habituales aplicaban plaguicidas conformaron el grupo expuesto (GE) y 20 habitantes del área urbana fueron incluidos en el grupo testigo o también llamado, de referencia (GR). La planificación de la investigación se realizó considerando las recomendaciones sugeridas por Albertini et al. (2000) para el monitoreo de efectos genotóxicos en humanos: permiso ético, consentimiento informado, codificación de las muestras al ingresar al laboratorio y análisis de las mismas con desconocimiento por parte del operador del origen de las mismas (Albertini et al. 2000). El protocolo de estudio biológico y el formulario de consentimiento fueron aprobados por el comité de ética de la Universidad Juan Agustín Maza. Los participantes del estudio brindaron la siguiente información: cantidad de años que han aplicado plaguicidas agrícolas, frecuencia de uso, tipo de equipos usados en la aplicación, tipo y cantidad de EPP utilizados durante la actividad. Los criterios de inclusión de personas al GE fueron: el uso de plaguicidas en forma habitual en sus prácticas frutícolas, tiempo de trabajo en esta actividad mayor a un año lo cual fue considerado una exposición crónica a plaguicidas según la definición establecida por la Agencia para Sustancias Tóxicas y Registro de Enfermedades (ATSDR, por sus siglas en inglés, 2016), así como ausencia de enfermedades aparentes al momento del muestreo. Los dos grupos fueron homogéneos en edad, género y hábito de fumar. El estudio fue realizado durante 2013 - 2014.
Ensayo de micronúcleos de citoma bucal
Las muestras de epitelio bucal fueron realizadas con el uso de una espátula de plástico para raspar suavemente la cara interna de las mejillas. Previamente, se realizaron tres enjuagues bucales con agua. Las células exfoliadas fueron extendidas sobre portaobjetos limpios, codificados y transportados al laboratorio. El ensayo de microcronúcleos de citoma bucal fue implementado según los protocolos estandarizados y desarrollados por Thomas et al. 2009 y las variaciones técnicas incluidas en Bonassi et al. 2009. Las muestras se fijaron con metanol: ácido acético (3: 1) durante 10 min y coloreados con Giemsa al 10 % en agua destilada. En cada persona se analizaron entre 831 y 2464 células y se reportaron los resultados por cada 1000 células. Las alteraciones nucleares se clasificaron según la fotogalería de Bolognesi et al. 2013. Las siguientes anomalías nucleares fueron analizadas: célula micronucleada (MN) y brote nuclear (brotes) como biomarcadores de daño al ADN, célula binucleada (BN) como biomarcador de defecto en la citocinesis, célula picnótica (PIC), célula condensada (CC), célula cariorréxica (CX) y célula cariolítica (CL) como biomarcadores de muerte celular. Los puentes nucleoplásmicos (Tolbert et al. 1992), cuerpos nucleares unidos al núcleo principal por un delgado filamento, fueron incluidos como “brotes”, de acuerdo con Bolognesi et al. 2013.
Análisis estadístico
Se analizó si existían diferencias estadísticamente significativas en el tipo y frecuencia de alteraciones nucleares entre los grupos GE y GR. Los resultados se presentan como media ± error estándar de la misma (EEM) para cada alteración analizada en cada grupo humano evaluado. Se aplicó primero un análisis de Kolmogorov- Smirnov para reconocer la distribución de los datos en cada una de las categorías de biomarcadores. La comparación de medias se realizó con una prueba t de Student o Mann Whitney, de acuerdo con su tipo de distribución. Los resultados se presentan como media ± error estándar de la misma (EEM). El nivel de significancia fue de p ≤ 0.05. Se evaluó la influencia de factores de confusión (género, edad, hábito de fumar, uso de medicación en forma crónica). Además de parámetros relacionados con la práctica laboral (años que ha aplicado plaguicidas, número de plaguicidas que aplica, equipo de aplicación que utiliza, EPP usados, cantidad de meses/ año en los que aplica plaguicidas). El análisis anterior se realizó sobre cada uno de los biomarcadores del ensayo con un análisis de contingencia y una razón de productos cruzados. Las variables cuantitativas fueron divididas en dos grupos, se escogió como criterio los valores menores y mayores o iguales a la mediana (Simoniello 2011). Se utilizó el programa Graphpad Prism versión 6.0.
RESULTADOS
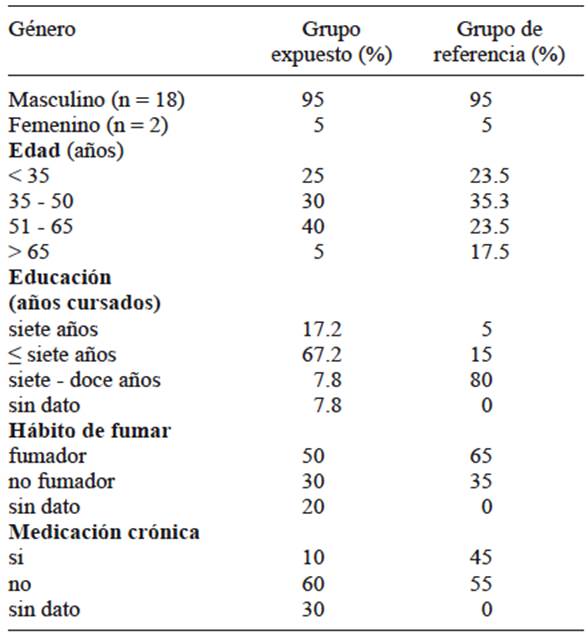
Los dos grupos de estudio estuvieron formados por hombres en su mayoría, con edad promedio de 46.75 ± 3.08 años en el GE y 48.10 ± 3.94 años en el GR (Cuadro I). El nivel de escolaridad fue predominantemente con primaria incompleta para el GE y secundaria incompleta para el GR. El 57 % de las personas en ambos grupos eran no fumadores y no consumían medicación en forma crónica. Entre el GE y el GR se determinó que no existen diferencias estadísticamente significativas en el perfil de la muestra respecto a la variable “edad” (p = 0.653), “hábito de fumar” (p = 0.667) y “consumo de medicación en forma crónica” (p = 0.875).
El GE ha trabajado con plaguicidas agrícolas durante los últimos 15 ± 3.15 años y presentó una media de 9.28 ± 2.08 células micronucleadas/1000 células analizadas (p ≤ 0.01), 2.16 ± 0.75 brotes (p ≤ 0.05) y 7.13 ± 1.05 células binucleadas/1000 células analizadas (p ≤ 0.05; Fig. 1) respecto del GR. La frecuencia de células en proceso de muerte celular: picnóticas (9.90 ± 2.40), células con núcleos condensados (22.75 ± 3.73), cariorréxicas (19.36 ± 6.44) y cariolíticas (21.41 ± 5.74) en el GE no presentaron diferencias significativas respecto al GR (p > 0.05).
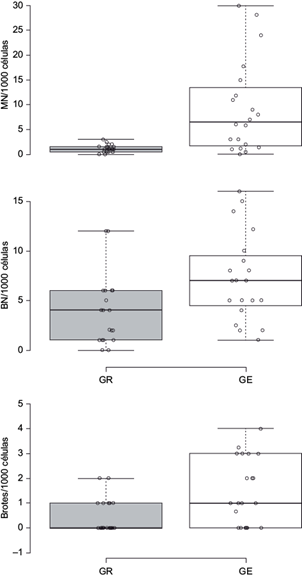
Fig. 1 Alteraciones nucleares observadas en epitelio de la mucosa bucal en aplicadores de plaguicidas agricolas y grupo de referencia MN = micronúcleos, BN = células binucleadas, *** p ≤ 0.01 = células micronucleadas y * p ≤ 0.05 = células con brotes nucleares y células binucleadas/1000 células analizadas, entre grupo expuesto (GE), barras blancas y grupo de referencia (GR) barras grises, n = 20 personas por grupo
Los participantes han fumigado durante estos últimos años las siguientes plantaciones frutales: olivo (31 % de las veces), vid (24 %) duraznero (13 %), almendro (7 %) y otros (9 %). El número de plaguicidas aplicados en este último año varió de 1 a 7 formulaciones (Cuadro II). De un total de 12 plaguicidas mencionados por los trabajadores, los insecticidas fueron los más citados (55.83 %), seguido por los herbicidas (30.54 %) y los fungicidas (13.63 %). Los plaguicidas que los participantes refirieron usar en los últimos dos años fueron: metidatión (nombrado 31% de veces), glifosato (25 %), metoxifenocida (11 %) y en menor proporción (5 % o menos cada uno) imidacloprid, carbosulfán, carbofurán, endosulfán, avemectina, captan, mancozeb. La capacidad genotóxica del glifosato ha sido informada en un estudio previo (Mañas et al. 2009b). Otro trabajo evaluó los efectos a corto y largo plazo del insecticida metoxifenocida en adultos jóvenes de la especie Chrysoperla externa, la cual es un insecto depredador de varias plagas agrícolas en los que la metoxifenocida indujo efectos en los parámetros de reproducción (Villaamil Lepori et al. 2013). Por otro lado, ratones tratados con el plaguicida metamidofos aumentaron la formación de MN en eritrocitos de sangre periférica conforme pasó el tiempo de exposición, lo que indica la genotoxicidad de este organofosforado (Noriega Ortega et al. 2005). Por tanto, ninguno de los tres compuestos referidos con mayor frecuencia por los productores, deberían ser considerados inocuos.
CUADRO II CARACTERÍSTICAS DE LAS PRÁCTICAS AGRÍCOLAS EN EL GRUPO QUE APLICA PLAGUICIDAS
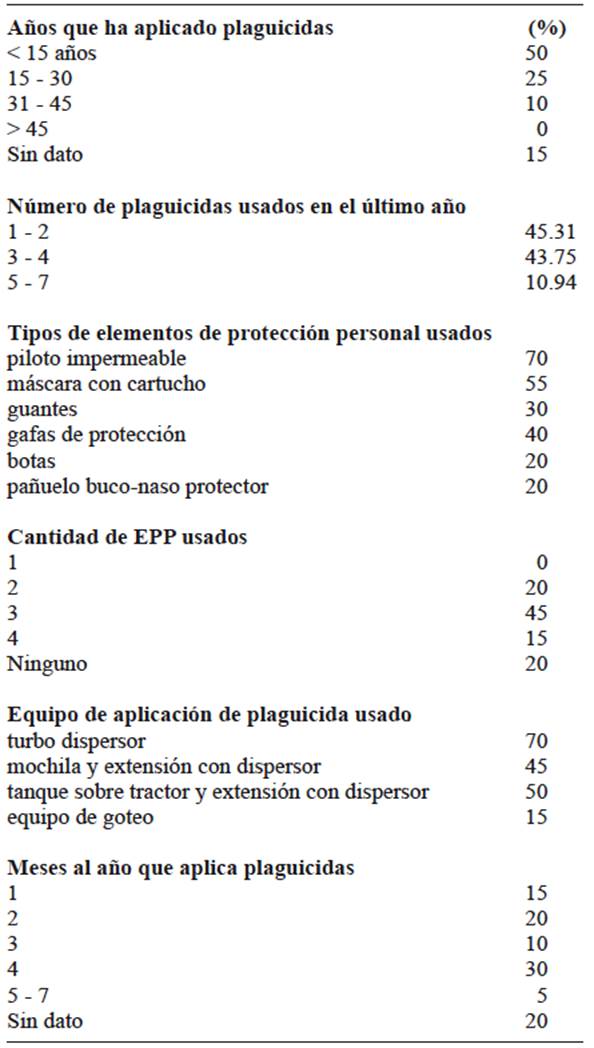
EPP = elementos de protección personal
El 54.25 % de los trabajadores relataron que aplicaban insecticidas y fungicidas con una frecuencia de 3 - 4 meses al año, mientras que 45.75 % la reportó entre 5 - 7 meses al año. En las entrevistas se evidenció que la cantidad de meses que se aplicó cada plaguicida estaba sujeto al manejo personal de cada trabajador en los sistemas productivos o al asesoramiento profesional según indicaciones del producto comercial. El equipo de aplicación de plaguicidas más utilizado por los trabajadores fueron el turbo dispersor cargado sobre una plataforma arrastrada por tractor, seguido por métodos de pulverización manual, como el tanque transportado en una mochila, sobre una plataforma en la que estaba acoplado a una extensión rígida con pico pulverizador o a través de una flecha de descarga manual (Cuadro II). El 65 % de los integrantes del grupo que aplicaba plaguicidas relató que utilizaban al menos 1- 3 EPP, siendo los más usados los pilotos impermeables, máscaras con cartuchos y guantes.
Los factores: género, edad, hábito de fumar, uso de medicación en forma crónica y años que han aplicado plaguicidas, así como los métodos y modo de aplicación, no estuvieron estadísticamente relacionados con la frecuencia observada de micronúcleos, brotes nucleares y células binucleadas.
DISCUSIÓN
A los trabajadores agrícolas que formaron parte de esta investigación se los consideró de exposición crónica a plaguicidas porque todos llevaban más de un año aplicándolos (ATSDR 2016). La exposición fue cíclica, ya sea de 3 a 4 meses por año para monocultivos o de 5 a 7 meses/año para policultivos, e intensiva en cada ciclo productivo, específicamente, en lo que respecta a insecticidas y fungicidas. Por el contrario, quienes aplicaban herbicidas relataron que lo realizaban durante todo el año según fuese necesario, con el objetivo de mantener libre de malezas la superficie que separa las hileras de plantas frutales.
La frecuencia de MN en el GE crónicamente a plaguicidas fue ocho veces mayor respecto al GR, además se observaron aproximadamente cinco veces más brotes nucleares y el doble de células BN (Fig. 1). Este último parámetro indica un efecto de alteración en la cariocinesis, sumado al daño genético evidenciado con los demás parámetros. El daño cromosómico, medido como frecuencia de AC o MN asociado con años de trabajo, ha sido demostrado en poblaciones humanas rurales con exposición continua a una mezcla compleja de plaguicidas (Bolognesi 2003). En este mismo trabajo de Bolognesi (2003), se expone que en agricultores de frutas y hortalizas que utilizan mezclas de plaguicidas que incluyen atrazina, benomil, carbaril, deltametrina, dinocap, linuron, mancozeb, metolacloro, propineb entre otros, se han encontrado niveles aumentados de ICH. En un GE a una mezcla de plaguicidas (carbamatos, ditiocarbamatos, nitro-compuestos piretroides, compuestos de azufre y de cobre), se obtuvieron resultados semejantes en el análisis de AC. Trabajadores de viñedos expuestos a sulfato de cobre, dieldrin, lindano, paratión y otros, mostraron daño genotóxico medido a través de AC y MN pero no de ICH (Bolognesi 2003). Un estudio realizado en Italia sobre biomonitoreo en aplicadores expuestos a insecticidas, fungicidas y herbicidas, mostró evidencias de daño cromosómico, detectadas como un aumento en la frecuencia de MN en aquellos sujetos expuestos a plaguicidas por más de 18 años (Pasquini et al. 1996). En nuestro estudio no se observaron relaciones entre los años de exposición y el nivel de las alteraciones nucleares analizadas, 0.32 (0.13 - 0.77) intervalo de confianza 95 %. El daño cromosómico inducido por plaguicidas parece ser transitorio en la exposición aguda o discontinua, pero acumulativo en la exposición continua a mezclas complejas de plaguicidas (Bolognesi 2003). Probablemente, la acumulación de daño tiene un límite, un punto de saturación de los sistemas de reparación a partir del cual las células mueren. Además, el tiempo de vida de las células es propio de cada tejido, es un proceso continuo y activo, en el caso de las células exfoliadas del epitelio bucal este término es a los 21 días (Tolbert et al. 1992, Thomas et al. 2009). Los otros parámetros relacionados con la práctica laboral como número de plaguicidas que aplica, equipo de aplicación que utiliza, EPP usados, cantidad de meses/año en los que aplica plaguicidas, tampoco mostraron una relación con la frecuencia de MN, brotes nucleares y células BN. Lo mismo ocurrió con los factores de confusión: género, edad, uso de medicación en forma crónica, ni tampoco con el hábito de fumar. Sin embargo, en algunos trabajos, los fumadores han mostrado casi el triple de la frecuencia de MN en comparación con los no fumadores, mientras que otros autores informan que no se observaron diferencias entre los fumadores y los no fumadores (Holland et al. 2008).
Los trabajadores de este estudio relataron usar una variedad de sustancias activas, donde 89 % de ellos utilizaban de uno a cuatro plaguicidas diferentes por año. En general esta es la realidad que se reporta en otras investigaciones similares, como las realizadas en Bolivia con MN en células de epitelio bucal y EC (Larrea Poma et al. 2010) y en Brasil también con MN y EC en células de epitelio bucal (Kvitko et al. 2012, Benedetti et al. 2013). Peralta et al. (2011) incluyeron en su estudio AC, MN en células de epitelio bucal y EC con resultados diferentes entre los grupos estudiados y detectaron que estas diferencias estaban correlacionadas con el tiempo de exposición a plaguicidas. Martínez-Valenzuela et al. (2009) analizando ICH y MN en células de epitelio bucal encuentran aumentos de estos biomarcadores en los grupos expuestos. Carbajal-López et al. (2015) al utilizar las pruebas de MN y EC, ambas en células de epitelio bucal, reportan aumentos en aplicadores de 9 a 17 años de actividad aproximadamente, sin reportar información sobre uso de EPP.
Por otro lado, en los resultados obtenidos de otras investigaciones donde se evaluó el daño genotóxico a través de MN en células epiteliales de mucosa bucal en trabajadores de España, Polonia, Grecia y Hungría expuestos a plaguicidas, no se observó aumento en la frecuencia de MN en células bucales respecto al GR (Pastor et al. 2003). En las diferencias que se observan entre las publicaciones que refieren ausencia de efectos sobre el material genético vs. daño al material genético a causa de la exposición a plaguicidas, sería importante considerar los EPP que utilizan los trabajadores como los tipos de equipo de aplicación (con o sin cabina), información que suele estar ausente en los estudios de genotoxicidad, pero que es posible que influya en los resultados.
El equipo de aplicación de plaguicidas más citado fue el “turbo dispersor”, en nuestra opinión podría ser el que produce un mayor esparcimiento del producto en el aire, el suelo y el agua superficial, comparado con el equipo de goteo con escasa dispersión o flecha de descarga manual que produce un rociado más acotado. La gran mayoría de los aplicadores del presente estudio no fumiga cuando hay viento, lo cual es considerado una buena práctica agrícola. La mochila en la espalda, con extensión en flecha y el tanque sobre tractor con igual extensión sin cabina de protección, predisponen a un aumento del riesgo de inhalación y absorción percutánea de los plaguicidas, especialmente si no se utilizan los EPP recomendados (Damalas y Eleftherohorinos 2011). En la información brindada por los aplicadores, 20 % no contaba con una protección de EPP. En una investigación realizada en la provincia de Córdoba, Argentina, se observó que 40 % de los trabajadores no usaban EPP, pero aplicaban los plaguicidas principalmente con una máquina autopropulsada con filtro y con una máquina de arrastre con cabina (Lantieri et al. 2009). En esa investigación los operadores relataron usar 13 principios activos diferentes. Por otro lado, Gentile et al. (2012) en otros departamentos de esa provincia, informaron que los fumigadores utilizaban en promedio alrededor de 10 plaguicidas diferentes y 75 % utilizaba algún tipo de EPP, aunque no mencionan cuáles fueron estos equipos de aplicación utilizados (Gentile et al. 2012). En un estudio con trabajadores de la planta de Managua, Cuba, vinculados directamente a la formulación de los plaguicidas, 50 % de los trabajadores afirmó utilizar los EPP durante más de 75 % de las veces. Los autores no encontraron aumentos en los biomarcadores de genotoxicidad analizados: AC, MN en células de epitelio bucal y EC, hallazgos que se relacionaron con el correcto uso de los EPP (Lamadrid Boada et al. 2011).
En nuestro estudio, los trabajadores relatan usar 12 ingredientes activos diferentes, la mitad de los plaguicidas se encuentran en una categoría de peligrosidad alta (clase I) y moderada (clase II) en la clasificación de toxicidad aguda de la Organización Mundial de la Salud (WHO, por sus siglas en inglés, 2010), por lo que deberían considerarse y por tanto gestionarse, como plaguicidas de alto peligro (HHP, por sus siglas en inglés; FAO 2016). Los más citados fueron, metidatión que está incluido en la clase Ib (altamente peligroso) y glifosato en la clase III (levemente peligroso). Metidatión no está listado en la clasificación sobre aspectos carcinogénicos de la Agencia Internacional de Investigación contra el Cáncer (IARC, por sus siglas en inglés) que a principios de 2015 re-categorizó al glifosato como posible carcinógeno humano (IARC 2015). El metidatión está en el grupo C (posible carcinógeno humano) en el listado de la Agencia de Protección Ambiental de los EUA (USEPA, por sus siglas en inglés), mientras que el glifosato se encuentra en el grupo E (evidencia de no carcinogenicidad en humanos) (USEPA 2015). Entre los restantes, el carbofuran es altamente peligroso (clase Ib), imidacloprid, carbosulfán y endosulfán son moderadamente peligrosos (clase II) y el resto menos riesgosos según la WHO (2010).
Las células epiteliales son las primeras que se exponen a los plaguicidas, esta puede ser una de las razones por las que se observó un incremento significativo de daño genético medido a través de MN (frecuencia del biomarcador ocho veces aumentada respecto al GR). En estudios realizados en trabajadores de la provincia de Córdoba que fumigan cultivos de cereales y oleaginosas, se observó un aumento de dos veces en el nivel de daño genético, respecto al GR en estudios realizados con MN en linfocitos de sangre periférica (Gentile et al. 2012). Las células sanguíneas dañadas están sujetas a la remoción activa por parte del sistema retículo endotelial, lo cual podría ser motivo de las diferencias observadas en la proporción de daño genético. Cabe destacar que aproximadamente 90 % de los cánceres humanos se originan en células epiteliales (Holland et al. 2008, Ceppi et al. 2010) que han mostrado capacidad relativamente limitada en relación con los linfocitos de sangre periférica para reparar daño al ADN (Visvardis et al. 1997, Dhillon et al. 2004). El uso del ensayo de MN en mucosa bucal es utilizado como blanco para determinar la inducción de daño genotóxico por exposición a plaguicidas. En América Latina se han ejecutado cuatro trabajos que utilizaron este ensayo, realizados en Bolivia (Larrea Poma et al. 2010), Brasil y Costa Rica (Castro et al. 2004, Bortoli et al. 2009, Pértile Remor et al. 2009), en una revisión en la cual se presentan 13 estudios poblacionales en mucosa bucal (Bolognesi et al. 2011). En las pruebas utilizadas, EC y MN, los citados autores encontraron un incremento significativo (p < 0.05) de daño genotóxico en los agricultores expuestos a plaguicidas, en relación a los GR (Larrea Poma et al. 2010), semejantes a los resultados obtenidos por Bortoli et al. (2009), quienes también utilizaron la prueba de MN. Sin embargo, en otros trabajos no se encontraron incrementos significativos en la frecuencia de MN en el GE comparados con el GR (Castro et al. 2004, Pértile Remor et al. 2009). Recientemente, en un estudio en cultivadores de soja en Brasil (Benedetti et al. 2013), se observó una diferencia estadísticamente significativa en casi todas las alteraciones nucleares analizadas en los individuos expuestos a plaguicidas respecto al GR. En diversos estudios, realizados en Latinoamérica en países como Argentina, Bolivia, Brasil, Colombia, Chile, Cuba, Ecuador y México, los autores advierten que en la mayoría de los casos los trabajadores expuestos a plaguicidas y mezclas de éstos, estuvieron en contacto con productos que están incluidos en la lista de plaguicidas altamente peligrosos (Gómez- Arroyo et al. 2013).
Las AC y los MN han sido considerados marcadores de etapas tempranas de enfermedades crónicas como cáncer, su presencia también indica que una alta frecuencia de los mismos permite predecir el riesgo de desarrollo neoplásico (Gómez Arroyo et al. 2013). En este punto reside el aspecto más importante del biomonitoreo genético, en la posibilidad de advertir y evitar una situación crónica de mayor seriedad antes de que ésta se presente. Se pueden tomar medidas para minimizar la exposición, ya sea a través del correcto uso de EPP o sobre las buenas prácticas agrícolas en cuanto a volúmenes, estado de los equipos de aplicación y condiciones ambientales durante la aplicación.
Los participantes del estudio recibieron un informe escrito individual donde se consignaba la frecuencia de MN/1000 células analizadas de ese participante y la media ± desviación estándar del grupo de referencia, además de una cartilla de “Recomendaciones para el uso adecuado de plaguicidas agrícolas en resguardo de la salud humana y ambiental” y un asesoramiento por parte de los investigadores del proyecto sobre la importancia del manejo adecuado de los EPP desde la preparación de las mezclas hasta la disposición final en resguardo de la salud familiar. La aplicación de plaguicidas está en crecimiento exponencial. Para cuidar la salud pública se debe monitorear los efectos de los mismos sobre los seres vivos y el ambiente, con miras a un uso sustentable. Es necesario realizar biomonitoreos periódicos y de diseño longitudinal en cada producción agropecuaria regional, con una realidad diferente en cuanto a tipos y usos de plaguicidas, modos y frecuencia de aplicación para prevenir los posibles riesgos en la salud, tales como el daño al material genético.











 nueva página del texto (beta)
nueva página del texto (beta)