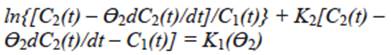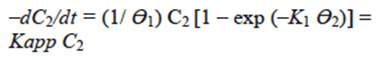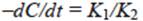INTRODUCCIÓN
Varias industrias generan contaminantes orgánicos en sus aguas residuales sin lograr, en la mayoría de los casos, un tratamiento adecuado de sus efluentes debido a que los contaminantes suelen ser recalcitrantes y no biodegradables. Por lo anterior, es imprescindible la búsqueda de nuevos métodos que permitan restaurar las aguas contaminadas hasta una condición de reúso (UNESCO 2004, Rubiano et al. 2005).
Debido a los estrictos reglamentos de muchos países respecto al control de la calidad del agua (Vergara-Sánchez et al. 2012), de manera creciente se está recurriendo al uso de los llamados procesos de oxidación avanzada (POA). Entre estas tecnologías se encuentra la fotocatálisis heterogénea, la cual hace referencia a una reacción catalítica que involucra la absorción de luz por parte de un catalizador o substrato (Esplugas et al. 2002). Si este catalizador es un semiconductor de banda ancha sensible a la luz, como el dióxido de titanio (TiO2), se originan fotorreacciones simultáneas de oxidación y reducción en diferentes zonas de la región interfacial líquido-sólido (Rincón et al. 2001, Di Paola et al. 2003, Moctezuma et al. 2003, Luna-Sánchez et al. 2013).
De manera general, el TiO2 es el fotocatalizador con mayor aplicación en la fotocatálisis solar heterogénea (Malato et al. 2009, El-Gohary et al. 2009, Pantoja-Espinoza et al. 2015), debido a que es estable a la fotocorrosión, no es tóxico, su producción se estima de bajo costo y puede activarse con radiación ultravioleta (UV < 400 nm) por acción solar (Ohno et al. 2001).
La fotocatálisis solar heterogénea puede llegar a ser altamente competitiva, posibilitando la degradación de compuestos como el fenol (Parra et al. 2003), compuestos organoclorados, como el diclorometano, el cloroformo o el pentaclorofenol (Thu et al. 2005), procedentes de plantas de policloruro de vinilo (PVC) o industrias madereras. Asimismo, el reporte sobre la degradación de productos farmacéuticos que no pueden ser tratados mediante sistemas biológicos es amplio (Pérez-Estrada et al. 2005).
Se han desarrollado nuevas técnicas de síntesis de TiO2 para llevar a cabo la inmovilización del soporte, como la de sol-gel (Horikoshi et al. 2002, Lee et al. 2004). En esta técnica el catalizador se genera a partir de un precursor como el isopropóxido de titanio (Alam y Cameron 2002, Tasbihi et al. 2007) o el cloruro de titanio (TiCl3) (Djaoued et al. 2002), tetraisopropóxido de titanio (Sheng et al. 2008) o tetrabutóxido de titanio (TBT) (González-Burciaga 2013).
En la actualidad existe una tendencia a construir instalaciones basadas en colectores que capten la luz solar sin concentrarla (Badawy et al. 2009), debido a que los sistemas concentradores son costosos, utilizan sólo radiación directa y presentan bajas eficiencias ópticas y cuánticas. Además de ver reducida su eficiencia por factores asociados con la reflexión.
Freudenhammer et al. (1997) reportan resultados de un estudio piloto con reactores de cama fija y película delgada (TFFBR, por sus siglas en inglés) para el tratamiento de aguas de desecho de la industria textil.
Los reactores solares de placa plana utilizados en fotocatálisis heterogénea están recibiendo gran interés como una alternativa de aplicación debido a su bajo costo de manufactura y mantenimiento (Feitz et al. 2000). Sin embargo, el reto principal de estos reactores radica en contar con suficiente radiación solar que penetre y se distribuya sobre una gran superficie de contacto del fotocatalizador.
Los países con gran potencial de radiación solar a nivel mundial, como México, son aquellos que tienen una localización geográfica favorable en el cinturón solar del planeta, que presenta un promedio de irradiación solar anual mayor a 5.5 kWh/m2 día y donde la radiación puede llegar cerca de los 6.5 kWh/m2 día. Estas condiciones se presentan sobre todo en los estados del noroeste, como Durango (Riveros-Rosas et al. 2010). Por ello, los estados de dicha región se convierten en potenciales usuarios de tecnologías que utilicen la radiación solar en el tratamiento de aguas residuales.
Si bien existe abundante información sobre la degradación de compuestos organoclorados presentes en agua utilizando TiO2 como fotocatalizador, se desconoce aún aquella que estudia la dinámica del reactor en la degradación de 2,5-diclorofenol (2,5-DCF) por fotocatálisis solar heterogénea. El anterior es un componente que se encuentra en las aguas residuales de las fábricas de insecticidas, herbicidas y plaguicidas. Se considera una sustancia altamente tóxica para organismos acuáticos, cuyo coeficiente de reparto octanol/agua de 3.1 ocasiona una afinidad media por los tejidos grasos de los animales y que se dispersa fácilmente si se encuentra en forma de polvo (EPA 2001, HSDB 2009).
El objetivo de este trabajo consiste en demostrar que el uso de un reactor de placa plana, impregnada con TiO2 sintetizado por el método sol-gel, degrada por fotocatálisis solar al compuesto 2,5-DCF presente en solución acuosa. Con lo anterior, se logra cumplir con los niveles permisibles para descarga de efluentes en cuerpos de agua, que es de 320 mg/L de demanda química de oxígeno (DQO) para ríos, aguas costeras y suelos. Dichos límites están establecidos en la Ley Federal de Derechos en Materia de Agua (SEMARNAT 2013).
MATERIALES Y MÉTODOS
Reactor solar con placa plana de vidrio
Se construyó un reactor solar (Freudenhammer et al. 1997, Feitz et al. 2000) con base metálica y contenedor de plástico acrílico (Fig. 1), el cual soporta una placa plana de vidrio con un área de contacto de 1 m2 (1.25 m x 0.80 m). El brazo que soporta el contenedor de plástico acrílico es ajustable a diferentes pendientes, con ángulos entre 18º y 30º. En el caso del presente trabajo, la placa plana fue ajustada a dos diferentes pendientes experimentales (20º y 26º) respecto a la horizontal, las cuales se encuentran cercanas a la latitud de la ciudad de Durango, México (24º 01’ 37” N), con el propósito de captar la mayor cantidad de energía solar (Blanco 2005).

Fig. 1 Reactor prototipo con placa plana de vidrio y área de contacto de 1m2, ajustable a diferentes ángulos de inclinación (18º a 30º) y tubo distribuidor de policloruro de vinilo
En la parte superior del reactor (Fig. 1) se observa un tubo distribuidor de policloruro de vinilo con orificios uniformemente separados (5 mm) para mantener un flujo constante (355 L/h y 407 L/h) y trabajar bajo un régimen laminar (Re < 1000). El agua es recogida al final de la placa por un sistema de desagüe y es llevada a un tanque de almacenamiento donde nuevamente es impulsada por medio de una bomba sumergible (Biopro, modelo H-450, China).
Mediante pruebas de calibración se comprobó la adecuada y total cobertura laminar de la placa plana de vidrio sobre el reactor, produciendo una película fina de líquido (Re < 1000), de espesor menor a 1 mm. Para evitar desbordes por los extremos de la placa plana de vidrio se colocó una barrera de hule, inerte y sin adhesivo para evitar interferencia física o química con la reacción.
Obtención de TiO 2 por el método sol-gel
Método
Se utilizó una ruta modificada para producir soles cristalinos de TiO2 (Sheng et al. 2008). La preparación del sol precursor sigue tres procesos: (1) una hidrólisis suficiente de tetrabutóxido de titanio (TBT) con exceso de agua y un radio molar de TBT:etanol:H2O de 1:1:110, (2) una peptización con ácido nítrico a una magnitud de pH de 1-2 y (3) una condensación del alcóxido de titanio Ti(OEt)4 a 100 ºC durante 4 h en un hornillo bajo condiciones hidrotérmicas y dejando el sol, posteriormente, en un desecador durante 24 h antes de ser impregnado en el soporte.
La reacción de síntesis del TiO2 por el método de sol-gel modificado se llevó a cabo utilizando TBT como precursor (Fluka Analytical Sigma-Aldrich, CAS: 5593-70-4, India), alcohol etílico (EtOH) al 99 % (Fermont, CAS: 64-17-5, México) y agua destilada (Hycel, CAS: 7732-18-5, México), con una relación molar TBT:EtOH:H2O de 1:1:110.
La preparación del sol se hizo por reacción de hidrólisis con agitación magnética (agitador Barnstead, modelo Nuova II, EUA), misma que se ajustó durante la agitación, el valor de pH se mantuvo entre 1 y 2 con ácido nítrico (Merck, CAS: 7697-37-2, México) y se midió por medio de un potenciómetro (Hach, modelo Sension 156, EUA). El gel se obtuvo mediante reacción de condensación moderada del sol (Sheng et al. 2008, González-Burciaga 2013). En una mufla (Ney, modelo 2-525 Series II, EUA) se dejó durante 4 h a 100 ºC y posteriormente, a temperatura ambiente (25ºC) durante 24 h. Después se impregnaron 200 mL/m2 de gel de TiO2 sobre las placas de vidrio por el método de aspersión directa (Stintzing 2003) con un compresor (Oswald, motor Siemens tipo 1RF3-054-4YC31, México), a temperatura ambiente (25 ºC).
Caracterización
Con objeto de observar las posibles diferencias cristalográficas del fotocatalizador en sus formas microestructurales características: anatasa y rutilo, se realizó un análisis cristalográfico por difracción de rayos X (DRX). El patrón de difracción de rayos X fue obtenido con un difractómetro Bruker D8 advance, a una longitud de onda Cu-kα1 = 1.5406 Å. Se midió en el intervalo angular 15º a 110º con un paso de 0.05º y un tiempo por punto de 2 s. Se usó la geometría Bragg-Brentano con un monocromador tipo Johansson en el haz primario y un detector LynxEye en el haz secundario. Por último, se determinó el tamaño de cristalita promedio a partir del patrón de difracción.
Con el fin de profundizar en la caracterización del catalizador de TiO2 obtenido por sol-gel a partir del TBT como precursor, se obtuvo un espectro de absorbancia a temperatura ambiente del mismo con un espectrofotómetro UV-visible y esfera de integración Lambda 950 UV/Vis/NIR Spectrophotometer (Perkin Elmer). Posteriormente, con el fin de determinar la apertura de banda de energía del semiconductor, se utilizó la función de Kubelka-Munk (López y Gómez 2012), que permite convertir las mediciones de reflectancia difusa en espectros equivalentes de absorbancia, empleando alúmina como referencia (Velasco-Arias 2013).
Descripción del experimento
Se llevaron a cabo experimentos de degradación de 2,5-DCF (Aldrich, CAS: 583-78-8, EUA) en solución acuosa a diferentes concentraciones iniciales (C0 ≤ 98 ppm) y magnitud de pH natural de dicha solución acuosa (pH0 = 7.5), utilizando agua desionizada (MAPLA, CAS: 7732-18-5, México) para la preparación de la solución.
Se recircularon 2.5 L de solución acuosa de 2,5-DCF sobre la placa plana de vidrio del reactor solar (fotólisis) o impregnada con TiO2 (sol-gel), para el caso de la fotocatálisis solar. Durante 60 min se tomaron volúmenes de muestra de 3 mL cada 5 min, tanto en el recipiente de mezcla (tanque de almacenamiento) como al final de la placa del reactor, incluyendo el tiempo cero. El transcurso de la reacción se siguió mediante espectrofotometría UV-visible en un rango de 200 a 500 nm (Arellano-Cárdenas et al. 2007) en un espectrofotómetro (Hach, modelo DR5000, EUA).
Para determinar la concentración del compuesto se le dio seguimiento a la evolución de los picos característicos bajo la lectura de longitud de onda a 280 nm (Łabudzińska y Gorczyńska 1995, Uchida y Okuwaki 2003), para lo cual se realizó la correspondiente línea de calibración. Asimismo, se determinó la DQO mediante el método de digestión (Hach 2000) en un espectrofotómetro Hach, modelo DR2010, EUA. Los datos del volumen inicial y final de cada experimento se determinaron para conocer los niveles de evaporación del agua. Los ángulos de pendiente experimental de la placa de vidrio impregnada fueron 20º y 26º y las velocidades de flujo utilizadas bajo régimen laminar (Re < 1000), fueron 355 L/h y 407 L/h (Stintzing 2003).
Los datos de radiación horaria fueron proporcionados por la estación meteorológica de la Secretaría de Recursos Naturales y Medio Ambiente del estado de Durango (SRNyMA), equipada con un piranómetro (Global Water´s, modelo WE300 Solar Radiation Sensor, EUA). Los experimentos se llevaron a cabo en días libres de nubosidad y de viento, bajo dos horarios establecidos (9:00 y 13:00 h), en condiciones de baja (ħʋprom = 453.6 W/m2) y alta intensidad (ħʋprom = 847.4 W/m2) de radiación solar.
Determinación de la cinética de oxidación fotocatalítica de 2,5-DCF en solución acuosa
Numerosos investigadores han demostrado que la cinética de reacción en la remoción de sustancias orgánicas por oxidación fotocatalítica puede ser descrita por la ecuación (1) de Langmuir-Hinshelwood (Turchi y Ollis 1989, Adamson y Gast 1997, Malato et al. 2009).
En donde C representa la concentración de la sustancia orgánica en medio acuoso y K 1 y K 2 son constantes de velocidad, las cuales dependen de diferentes factores físicos y químicos.
Sin embargo, cuando se utilizan reactores expuestos a una fuente de radiación por sólo una fracción de tiempo, como en este trabajo (Fig. 1), la velocidad de reacción aparente medida en el reservorio, dC/dt, no es igual a la velocidad de la reacción de oxidación fotocatalítica. Por tanto, es una expresión compuesta de elementos originados en la cinética química y en la dinámica del reactor (Davis y Hao 1991). Es por ello que en el presente trabajo la determinación de las constantes de velocidad de las reacciones de oxidación fotocatalítica (K 1 y K 2 ) de 2,5-DCF se realizó conforme a las ecuaciones del balance de masa en el recipiente y en la evaluación de la dinámica del reactor en el análisis cinético (Davis y Hao 1991, 1992). De acuerdo con estos autores el balance de masa apropiado para el recipiente en agitación continua, que en este trabajo corresponde al tanque de almacenamiento (TA) de la figura 1, está dado por la ecuación (2):
En donde C 2 representa la concentración de la sustancia orgánica en TA y C 1 es la concentración de esa sustancia que entra en el recipiente (TA) después del tratamiento a través del reactor iluminado. El símbolo Q representa el flujo a través del fotoreactor y V1 corresponde al volumen en TA.
En un trabajo posterior, Davis y Hao (1992) determinaron una expresión modificada, ecuación (3), con fundamento en las observaciones realizadas por Wolfrum y Turchi (1992), que acoplada a la ecuación (2) complementa el análisis del balance de masa en TA con base en la dinámica del reactor.
En donde Ɵ 2 , expresado en unidades de tiempo, corresponde al tiempo medio de residencia en el reactor, de acuerdo con la ecuación (4):
En donde V 2 representa el volumen total del reactor iluminado y Q representa, como se indicó, el flujo experimental utilizado a través del fotoreactor.
Finalmente, en este trabajo, las ecuaciones (2) y (3) fueron ajustadas para encontrar las constantes de velocidad K 1 y K 2 , que determinan las velocidades iniciales de la oxidación fotocatalítica de 2,5-DCF en solución acuosa. Para ello se utilizó una interacción de Newton- Raphson y un programa no lineal de mínimos cuadrados (Stat Soft Inc. 2004). Para cada experimento se tomaron en consideración las pendientes (20º y 26º) y los flujos (355 L/h y 407 L/h) en el reactor, tanto en condiciones de alta (ħʋprom = 847.4 W/m2) como de baja (ħʋprom = 453.6 W/m2) intensidad de radiación solar.
RESULTADOS Y DISCUSIÓN
Análisis microestructural del fotocatalizador
La figura 2muestra el patrón de DRX para el fotocatalizador de TiO2, obtenido por el método sol-gel. En color rojo se muestran los puntos experimentales, en negro el patrón calculado de acuerdo con el método de Le Bail et al. (1988) y en azul la diferencia entre los patrones: el calculado y el experimental. Las barras verticales, en color verde, corresponden a las posiciones de Bragg de la fase anatasa (JCPDS 01-089-4921), que fue la única forma microestructural característica del fotocatalizador encontrada.
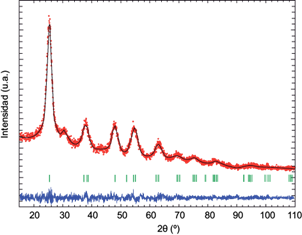
Fig. 2 Patrón de difracción de rayos X para el fotocatalizador de TiO2, obtenido por sol-gel a partir de tetrabutóxido de titanio. Se muestran en rojo los puntos experimentales, en negro el patrón calculado de acuerdo al método de Le Bail y en azul la diferencia entre los patrones calculado y experimental. Las barras verticales verdes corresponden a las posiciones de Bragg de la fase anatasa (JCPDS 01-089-4921)
El patrón de difracción fue comparado con la base de datos PDF-2 del International Centre for Difraction Data (ICDD). Se encontró una alta coincidencia con la ficha JCPDS 01-089-4921 (Legrand y Deville 1953), correspondiente a la fase anatasa del TiO2. La presencia de esa fase cristalina fue confirmada al realizar un ajuste de perfil al patrón de difracción por el método de Le Bail et al. (1988). La aplicación de dicho método fue llevada a cabo en el programa FullProf (Rodríguez-Carvajal 1990).
El tamaño de cristalita promedio obtenido a partir del patrón de difracción fue calculado con la aproximación de amplitud integral aplicada al método de Warren-Averbach (1990) para tratamiento de efectos microestructurales, en el que se encontró un tamaño de cristalita de 4.45 nm.
El sistema fotocatalizador soporte mostró una película firme en la superficie, lo que sugiere una alta pureza obtenida para el TiO2 por este método y que es congruente con lo reportado por otros autores (Yu et al. 2006, Sheng et al. 2008, González-Burciaga 2013). Dichos autores también observaron una excelente consistencia y ausencia total de desprendimiento de partículas de TiO2 de la superficie, presentándose así, una mejor definición que la reportada por Su et al. (2010), quienes sintetizaron TiO2 a partir de tetraisopropóxido de titanio Ti[OCH(CH3)2]4 como precursor, impregnándose sobre placas de acrílico.
La figura 3muestra, en color azul, el espectro de absorbancia del fotocatalizador de TiO2, obtenido por sol-gel a partir de TBT. El espectro muestra un comportamiento característico (absorbancia vs. longitud de onda) para los fotocatalizadores de TiO2, obtenidos por el método de sol-gel, sin considerar transiciones electrónicas (López y Gómez 2012).

Fig. 3 Espectro de absorbancia del fotocatalizador de TiO2, obtenido por sol-gel a partir de tetrabutóxido de titanio (TBT), con un radio molar de TBT:etanol:agua de 1:1:110. El espectro muestra, en color azul, un comportamiento característico para los fotocatalizadores de TiO2, obtenidos por el método de sol-gel, sin considerar transiciones electrónicas. En la figura 3 inserta, se muestra el valor de la apertura de banda de energía del semiconductor, obtenido por el método modificado de Kubelka-Munk, F(R)hv 2 (eV 2) contra hv (eV)
En la figura 3 inserta, se muestra la representación gráfica [F(R)hv 2 (eV 2) vs. hv (eV) ] del método modificado de Kubelka-Munk, que permitió determinar la apertura de banda de energía del semiconductor (Velasco-Arias 2013). Se ha demostrado que el uso de esa representación gráfica para el cálculo de la apertura de banda (Eg) es un método adecuado y particularmente preciso para TiO2 obtenido por sol-gel (López y Gómez 2012).
Para el caso del fotocatalizador de TiO2 obtenido en este trabajo por el método de sol-gel a partir de TBT, con un radio molar de TBT:etanol:H2O de 1:1:110, se estimó un valor de apertura de banda de 3.40 eV, como se aprecia en la figura 3 inserta. Este valor estuvo cercano al de 3.38 eV reportado por Sheng et al. (2008), al utilizar la ruta modificada de sol-gel para preparar un fotocatalizador de TiO2 a partir de tetraisopropóxido de titanio (TIPT), bajo el mismo radio molar de TIPT:etanol:H2O de 1:1:110.
Degradación de 2,5-DCF en solución acuosa
En la figura 4 se compara la variación de la DQO (mg/L) en función del tiempo, para la degradación de 2,5-DCF en solución acuosa, tanto por fotólisis como por fotocatálisis solar en condiciones de alta y baja intensidad de radiación solar. No obstante las marcadas diferencias experimentales, no se distinguieron variaciones notables en el transcurso de la reacción de degradación fotolítica en condiciones de alta (Fig. 4a) y de baja intensidad de radiación solar (Fig. 4b). Sin embargo, se muestra una ligera ventaja en la eficiencia promedio para el primer caso en todos los experimentos de fotólisis realizados.

Fig. 4 Variación de la demanda química de oxígeno (DQO) durante 60 min de reacción, a distintos ángulos (º) y flujos (L/h) en los distintos experimentos (ex) para: a) Fotólisis a alta intensidad de radiación solar, b) fotólisis a baja intensidad de radiación solar, c) fotocatálisis a alta intensidad de radiación solar y d) fotocatálisis a baja intensidad de radiación solar
Asimismo, se pueden apreciar las altas eficiencias obtenidas para la degradación de 2,5-DCF en solución acuosa por fotocatálisis solar, tanto en condiciones de alta (Fig. 4c) como de baja intensidad de radiación solar (Fig. 4d). Estos resultados coinciden con otros reportes (Giménez et al. 1999, Bahnemann 2004), debido a la apropiada activación del fotocatalizador y, consecuentemente, a la producción de radicales OH* que actúan en la oxidación de materia orgánica.
El cuadro I concentra, en forma de porcentaje, las eficiencias de degradación de 2,5-DCF en condiciones de alta y baja intensidad de radiación solar (ħʋprom = 847.4 W/m2 y ħʋprom = 453.6 W/m2). Como se observa, las eficiencias (%) de degradación de 2,5-DCF obtenidas por fotocatálisis solar para las dos variables de respuesta en condiciones de alta intensidad de radiación solar, son siempre superiores a las obtenidas a baja intensidad, lo que coincide con las teorías de máxima eficiencia de degradación de materia orgánica sobre TiO2 por fotocatálisis solar heterogénea (Feitz et al. 2000, Zhao y Yang 2003).
CUADRO I EFICIENCIAS DE DEGRADACIÓN (%) DE 2,5-DICLOROFENOL (2,5-DCF) EN SOLUCIÓN ACUOSA POR FOTÓLISIS Y POR FOTOCATÁLISIS SOLAR, EN CONDICIONES DE ALTA Y BAJA INTENSIDAD DE RADIACIÓN SOLAR

Expi = experimentos realizados en distintas condiciones de pendiente y flujo del reactor, ħʋ = radiación solar, (º) = pendiente de la superficie del reactor, [2,5-DCF]i = concentración inicial de 2,5-diclorofenol, DQO = demanda química de oxígeno, λ = longitud de onda. Error estándar para ambas variables de respuesta ± 3.55
Las eficiencias promedio de degradación superiores a 98 % para condiciones de alta radiación solar son similares a las reportadas por Ba-Abbad et al. (2010), quienes degradaron 2,4-DCF en solución acuosa (50 mg/L) por fotocatálisis solar sobre ZnO obtenido por el método sol-gel durante 60 min de reacción. Los porcentajes de degradación obtenidos en este trabajo mediante las dos variables de respuesta analizadas son similares entre sí y cumplen con los niveles permisibles para descarga de efluentes en cuerpos de agua establecidos por la Ley Federal de Derechos en Materia de Agua (SEMARNAT 2013).
Cinética de oxidación fotocatalítica de 2,5-DCF en solución acuosa
El cuadro II concentra los valores de las constantes de velocidad (K 1 y K 2 ) de la reacción de oxidación fotocatalítica de 2,5-DCF en solución acuosa. Así como el valor adimensional de K 1 Ɵ 2 y la magnitud de Ɵ 2 (expresada en unidades de tiempo), obtenidos de acuerdo con los parámetros experimentales de pendiente y flujo en el reactor utilizados y en condiciones de alta y baja intensidad de radiación solar.
CUADRO II CONSTANTES DE VELOCIDAD DE LA OXIDACIÓN FOTOCATALÍTICA DE 2,5-DICLOROFENOL (2,5-DCF) EN SOLUCIÓN ACUOSA, CONFORME A LOS PARÁMETROS EXPERIMENTALES DE PENDIENTE Y FLUJO EN EL REACTOR UTILIZADOS Y EN CONDICIONES DE ALTA O BAJA INTENSIDAD DE RADIACIÓN SOLAR

(º) = pendiente de la superficie del reactor, Q = flujo en el reactor, Ɵ 2 = tiempo medio de residencia en el reactor, ħʋ = radiación solar, K 1 = constante de velocidad de primer orden, K 2 = constante de velocidad de orden cero, K 1 Ɵ 2 = factor adimensional
Como se observa en el cuadro II, las constantes de velocidad K 1 y K 2 obtenidas en condiciones de alta intensidad de radiación solar (ħʋprom = 847.4 W/m2), muestran siempre mayores magnitudes que las obtenidas a bajas intensidades de radiación solar (ħʋprom = 453.6 W/m2) bajo las mismas condiciones experimentales utilizadas de pendiente y flujo en el reactor. Estas condiciones también corresponden a los mayores porcentajes de degradación de 2,5-DCF en solución acuosa (Cuadro I). Esto nos confirma que la intensidad de la radiación es un elemento fundamental en las reacciones de degradación de materia orgánica por fotocatálisis solar, toda vez que ésta se basa en la absorción directa o indirecta de la energía radiante, lo que influye de manera determinante en la generación de radicales OH* (Bahnemann 2004, Malato 2009).
Las unidades de K 1 (min-1) y K2 (mol/L)-1 muestran el orden de la reacción seguida en el transcurso de la oxidación fotocatalítica de 2,5-DCF en solución acuosa. Concretamente, primer orden para K 1 y orden cero para K 2 (Cuadro II). Lo anterior se explica a partir de dos orientaciones que puede tomar la ecuación (1), de Langmuir- Hinshelwood (Davis y Hao 1991):
A) Para el primer caso: si consideramos que la concentración de la sustancia orgánica en medio acuoso (C) es baja, entonces la ecuación (1) se reduce a una reacción de primer orden:
K 2 C => 0 y por tanto;
De ahí que
Y consecuentemente:
En donde Kapp es la constante aparente de la reacción, que no es igual a la constante K 1 .
B) Para el segundo caso: si consideramos que la concentración de la sustancia orgánica en medio acuoso (C) es alta, entonces la ecuación (1) se reduce a una reacción de orden cero:
1 + K 2 C => K 2 C y por tanto:
De ahí que
Y consecuentemente:
Del análisis cinético realizado para los casos A y B, tomando en cuenta el tipo de reactor que se utiliza en el presente trabajo, resulta que el orden de reacción respecto a la concentración del compuesto orgánico está determinado en el intervalo de ambos órdenes de reacción (cero y uno). En este sentido, el orden (n) de la reacción de oxidación fotocatalítica de 2,5-DCF en solución acuosa, n = 1 para K 1 y n = 0 para K 2 , se ajusta a lo reportado por Davis y Hao (1991) quienes señalan, con base en las ecuaciones antes analizadas (5) a (10), que a lo largo de esta transición del orden de reacción los cambios de velocidad son proporcionales a una magnitud que va desde [1 - exp (-K 1 Ɵ 2 ) ] hasta K 1 .
Los valores del flujo experimental (Q) determinan a Ɵ 2 (min) y consecuentemente al producto K 1 Ɵ 2 (adimensional), como puede observarse en el cuadro II. Lo anterior representa un factor fundamental en la determinación de las constantes K 1 y K 2 , como también puede inferirse de las ecuaciones (2), (3) y (4), lo que demuestra la importancia de trabajar siempre en este tipo de reactores, bajo un régimen laminar (Re < 1000).
El proceso global de degradación fotocatalítica en general no es muy sensible a la temperatura, ya que la energía de activación térmica es muy baja comparada con la energía de activación del TiO2. Como consecuencia, no es necesario incrementar la temperatura del sistema.
Sin embargo, la temperatura sí puede afectar la composición mediante transformaciones térmicas de los compuestos químicos en el agua. Leyva y Crispin (1998) desarrollaron experimentos con el fin de comparar la influencia de la temperatura en la degradación de fenol y 4-clorofenol, con diferentes catalizadores (TiO2, BaTi4O9 y hollandita). Al modificar la temperatura de 30º C a 40º C, observaron incrementos de hasta 15 % y 17 % en el porcentaje de degradación de fenol y clorofenol, respectivamente.
CONCLUSIONES
El estudio de DRX del fotocatalizador de TiO2, obtenido por el método sol-gel a partir de TBT como precursor, confirma la presencia de anatasa como la única forma microestructural característica del fotocatalizador encontrada.
El espectro de absorción realizado al fotocatalizador de TiO2, muestra un comportamiento característico para los fotocatalizadores de TiO2 obtenidos por el método de sol-gel sin considerar transiciones electrónicas.
La apertura de banda de energía del semiconductor de TiO2 estimada fue de 3.40 eV, obtenido éste por el método de sol-gel a partir de TBT, con un radio molar de TBT:etanol:H2O de 1:1:110.
Se alcanzaron eficiencias de degradación del 2,5-DCF superiores a 98 % para el caso de fotocatálisis solar con altos niveles de radiación solar.
La cinética de la reacción de oxidación fotocatalítica muestra constantes de velocidad K 1 (min-1) de orden uno y K 2 (mol/L)-1 de orden cero, respecto a la concentración de 2,5-DCF en solución acuosa.
Los valores de las constantes de velocidad K 1 y K 2 obtenidas en condiciones de alta intensidad de radiación solar (ħʋprom = 847.4 W/m2), muestran siempre mayores magnitudes que las realizadas a bajas intensidades de radiación solar (ħʋprom = 453.6 W/m2) bajo las mismas condiciones experimentales utilizadas de pendiente y flujo en el reactor.
El presente estudio demuestra que la aplicación de la fotocatálisis solar heterogénea con un reactor solar de placa plana con vidrio como soporte, impregnado con TiO2 sintetizado por el método sol-gel a partir de TBT, degrada el compuesto 2,5-DCF en solución acuosa con concentraciones C0 ≤ 98 mg/L.
Los resultados de este trabajo sugieren el uso de procesos de oxidación avanzada y, particularmente, de la fotocatálisis solar heterogénea, en territorios caracterizados por una alta incidencia de radiación solar. Los habitantes de dichos territorios pueden constituirse en potenciales usuarios de estas tecnologías en el tratamiento de sus aguas residuales.











 nova página do texto(beta)
nova página do texto(beta)