INTRODUCCIÓN
El chile (Capsicum annum L.) es uno de los cultivos de mayor importancia económica dentro de la horticultura, siendo China el principal productor mundial con más de 10.7 millones de toneladas producidas, mientras que México ocupó el segundo lugar con más 1.7 millones de toneladas (FAOSTAT 2013). Dado que el chile es un cultivo rentable, es común el uso excesivo de fertilizantes que puede superar las dosis recomendadas (Salazar-Jara y Juárez-López 2013), lo cual aumenta los costos de producción y puede generar problemas ambientales y de salud. Se estima que los cultivos sólo aprovechan entre el 20 y 50 % del fertilizante aplicado (Cassman et al. 2002, Cameron et al. 2013), el resto puede perderse por lixiviación o arrastre, contaminando cuerpos de agua superficiales, que impactan negativamente a los ecosistemas acuáticos (Smith y Schindler 2009) y mantos acuíferos que pueden poner en riesgo la salud humana (Weyer et al. 2001). Existen diferentes alternativas para reducir el uso excesivo de fertilizantes, una de ellas es el uso de rizobacterias promotoras de crecimiento vegetal (RPCV).
La siembra de C. annum se realiza en almácigo, con el propósito de obtener plántulas de mayor sanidad y vigorosidad, que garanticen subsistir su trasplante en campo (Ruso 2004, Russo y Perkins-Veazie 2010, Puerta et al. 2012). La mejores plántulas se adquieren con el suministro adecuado de nutrimentos y control de plagas y enfermedades (Guzmán y Sánchez 2003, Gravel et al. 2012). En este proceso de producción, el uso de RPCV podría brindar un beneficio a las plántulas colonizadas con ellas y así, propiciar su establecimiento en campo con un mayor éxito.
En la región de la Sierra Nevada de Puebla, la producción de chile poblano ha disminuido por la mala calidad de las plántulas producidas (García et al. 2011) ya que en almácigos a cielo abierto el vigor bajo es frecuente y la incidencia de plántulas enfermas llega a ser de 29 %, constituyendo una fuente de inóculo de fitopatógenos que los agricultores transfieren al campo durante el trasplante (González et al. 2004).
Las rizobacterias poseen varios mecanismos para promover el crecimiento de las plantas, entre los que se incluye un aumento de la movilización de nutrimentos, fijación de nitrógeno, mejoramiento en la absorción de nutrientes y control biológico de patógenos (Bais et al. 2006, De-Bashan et al. 2007, Dias et al. 2009, Hariprasad y Niranjana 2009, Altomare y Tringovska 2011). Además, sintetizan sustancias reguladoras del crecimiento como giberelinas, citoquininas y auxinas y estimulan la densidad y longitud de pelos radicales, con lo que incrementan la capacidad de absorción de agua y nutrientes, que resulta en mayor crecimiento y adaptación a condiciones de sequía, acidez y alcalinidad (Sandhya et al. 2010, Saraf et al. 2011). Algunas cepas de rizobacterias ejercen efectos antagónicos sobre otros microorganismos e inducen la resistencia sistémica en las plantas (Sharma et al. 2007).
Considerando lo anterior, el presente trabajo tuvo como objetivo aislar cepas de rizobacterias en la región de la Sierra Nevada, Puebla, México, y evaluar su potencial para promover el crecimiento de plántulas de chile poblano en invernadero.
MATERIALES Y MÉTODOS
Aislamiento y selección de cepas de rizobacterias de la rizósfera de chile poblano
Colecta de suelo rizosférico
En septiembre del 2012 se colectó suelo rizosférico de chile poblano en nueve sitios de la región de la Sierra Nevada en el estado de Puebla, México. El muestreo incluyó campos de chile poblano de tres municipios: San Matías Tlalancaleca con tres sitios, cuyas altitudes fueron desde 2414 a 2467 msnm, Chiautzingo con dos sitios de altitudes de 2404 y 2425 msnm, y Huejotzingo con cuatro sitios de altitudes que van de 2284 a 2313 msnm (Cuadro I y Fig. 1).
CUADRO I SITIOS DE AISLAMIENTO DE LAS CEPAS DE RIZOBACTERIAS Y CARACTERÍSTICAS DEL SUELO EN EL ESTADO DE PUEBLA, MÉXICO
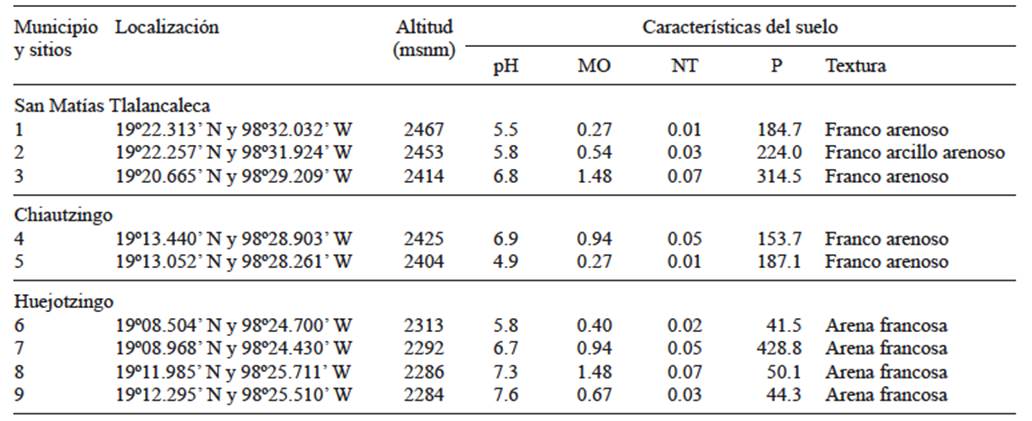
MO = materia orgánica (%), NT = nitrógeno total (%), P = fósforo (mg/kg)
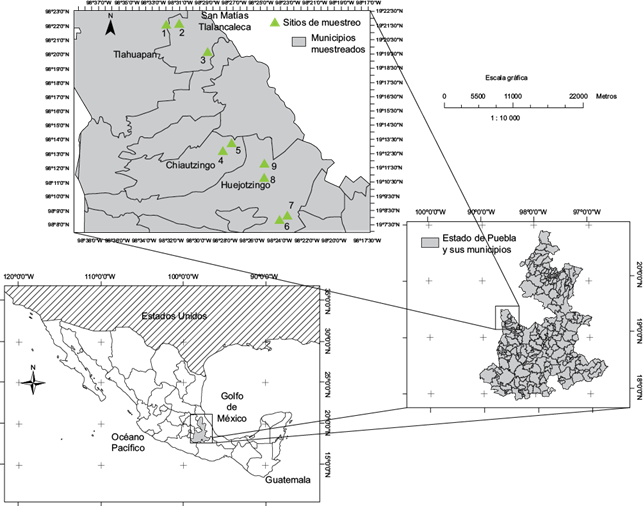
Fig. 1 Ubicación geográfica de los nueve sitios donde se colectaron muestras de suelo rizosférico de chile poblano en la Sierra Nevada, estado de Puebla, México
Se colectaron cuatro muestras por sitio, que se conservaron en hielera para su trasladado al laboratorio de Microbiología del Campus Montecillo del Colegio de Postgraduados, en Montecillo, México. En los sitios de muestreo los valores de pH (suelo, agua 1:2) fluctuaron entre 4.9 y 7.6. Los valores de materia orgánica (MO) fueron de 0.27 a 1.48 % y de nitrógeno total (NT) de 0.01 a .07 % y de fósforo (P) de 41.1 a 428.8 mg/kg. La textura del suelo fue clasificado como franco arenoso en los sitios uno, tres, cuatro y cinco; franco arcillo arenoso para el sitio dos; y de arena francosa para los sitios seis, siete, ocho y nueve (Cuadro I).
Aislamiento de cepas de rizobacterias
Las muestras de suelo colectadas fueron procesadas en campana de flujo laminar en condiciones de asepsia. Se asilaron cepas de rizobacterias a través de la técnica de diluciones seriales y cuenta viable en placa. Se usaron medios de cultivo específicos: Pikovskaya para bacterias solubilizadoras de fosfatos (BSP), Rennie, para fijadoras de nitrógeno (BFN) y Luria-Bertani (LB), para bacterias productoras de auxinas (BPA). En el caso particular de BPA, una vez que se tuvo crecimiento de colonias, el 50 % de ellas se sembraron por duplicado en microplacas de 96 pozos que contenían 150 µL de medio líquido LB, siguiendo el mismo orden de siembra en las dos microplacas, con el fin de seleccionar colonias que producen índoles. Las microplacas se incubaron por 48 h y posteriormente se agregaron 150 μL de reactivo Salkowski a cada pozo de una de las microplacas y se incubó en obscuridad por 30 min, el cambio de coloración a rosa fue el indicativo de producción de indoles. De la segunda microplaca, que se dejó sin alterar, se aislaron cepas de las colonias que resultaron positivas en la producción de índoles en la primera microplaca.
En el caso de bacterias solubilizadoras de fosfatos, se aislaron cepas con base en las colonias que presentaron un halo alrededor de ellas, las cuales se preservaron en agar nutritivo hasta su evaluación. Las cepas fijadoras de nitrógeno se aislaron de colonias de bacterias que tuvieron un mejor crecimiento en el medio de Rennie.
Caracterización de las rizobacterias por atributos promotores del crecimiento vegetal
Las cepas solubilizadoras de fosfato aisladas se cultivaron en medio líquido Pikovskaya (Pikovskaya 1948) por siete días en agitación. Se llenaron tubos Eppendorf con 1 mL de cultivo bacteriano y se centrifugaron a 5000 rpm durante 20 min. Del sobrenadante obtenido de cada tubo se tomaron alícuotas de 200 μL y se colocaron en microplacas de poliestireno marca Costar (Corning Incorporated, NY), después se les adicionaron 100 μL de solución de vanadato (NH4VO3 0.25 % en 35 % HNO3) y 100 μL de solución de molibdato [(NH4)6 MO7O24 en 5 % en agua]. Las muestras se dejaron en reposo durante 5 min hasta que desarrollaron color y posteriormente se realizaron las lecturas en el espectrofotómetro a 420 nm. Los cálculos para la determinación de fosfato soluble se realizaron a partir de una curva estándar, la cual se elaboró con diferentes concentraciones de fosfato (0, 20, 40, 60, 100, 150, 200, 250 y 300 μg/mL), que fueron procesadas de la misma forma que los extractos bacterianos.
Las cepas productoras de índoles fueron sembradas en medio de cultivo líquido Luria-Bertani y se mantuvieron en agitación durante cuatro días. Posteriormente se pasó 1 mL de cada muestra a tubos Eppendorf y se centrifugó por 20 min a 5000 rpm. Del sobrenadante se tomaron alícuotas de 150 μL y fueron colocadas en microplacas, a las cuales se les adicionaron 100 μL de reactivo Salkowski (2 % 0.5 M FeCl3 en 35 % de ácido perclórico). Las muestras fueron incubadas por 30 min en oscuridad y después se procedió a tomar las lecturas en el espectrofotómetro a una absorbancia de 530 nm. La producción de indoles se cuantificó mediante una curva estándar usando diferentes concentraciones de ácido indolacético que fueron de 0, 10, 15, 20, 25, 30, 40 y 50 μg/mL. En el caso de las cepas fijadoras de nitrógeno la evaluación sólo fue cualitativa, esto es, se seleccionaron exclusivamente por su capacidad de crecer en el medio de Rennie, un medio libre de nitrógeno.
Identificación molecular
Se extrajo el material genético de biomasa equivalente a siete colonias de las cepas a partir de cultivos jóvenes de 24 h mediante el equipo comercial EZ-10 Spin® (Column Bacterial DNA mini-preps kit, Bio Basic Inc., Canadá). Se realizó la amplificación de un fragmento de ≈1500 pb del gen 16S ADNr para realizar la asignación de identidad de manera confiable hasta nivel de género y especie. Los iniciadores empleados para la amplificación del gen 16S ADNr fueron el 27f (forward) 5´-AGA GTT TGA TCM TGG CTC AG-3´ y el 1492r (reverse) 5´-CGG TTA CCT TGT TAC GAC TT-3´ (Frank et al. 2008).
La mezcla de reacción de amplificación fue con 1X de regulador de la reacción en cadena de la polimerasa (PCR), 2 µM de desoxinucleósidos trifosfatados (dNTP´s), 0.2 µM de MgCl2, 10 µM de cada iniciador y 0.05 U/µL, en un volumen final de 25 µL. Se utilizó el programa de termociclador con una desnaturalización inicial de 5 min a 95 ºC, 30 ciclos de: desnaturalización por 1 min a 94 ºC, alineación de 1 min a 57 ºC, y extensión de 1.5 min a 72 ºC, se utilizó una extensión final a 72 ºC por 7 min.
Los amplicones fueron visualizados en geles de agarosa al 1.5 % p/v, se tiñeron con colorante verde de ADN (Green-DNA dye, Bio Basic Inc., Canadá) para visualizar en un transiluminador. Se purificaron los productos de PCR con el sistema comercial de purificación Agencourt® AMPure® XP (Beckman Coulter, EUA), se siguieron las indicaciones de uso del fabricante. Los amplicones purificados fueron enviados al servicio de secuenciación Macrogen, Corea.
Las secuencias fueron editadas con los programas BioEdit 7.0.9.0 (Hall 1999) y Seaview 4.0 (Galtier et al. 1996). Se efectuó un análisis en la plataforma Blast (http://blast.ncbi.nlm.nih.gov/Blast.cgi) para la búsqueda de genes homólogos a las secuencias, considerándose los criterios de Rosselló-Mora y Amann (2001) para la asignación a nivel de especie con porcentajes de identidad superiores al 97 % y de género al 95-96 %, con cobertura mayor al 85 %. Se hizo la filogenia en el programa Mega versión 6.0 (Tamura et al. 2013) con una minería de secuencias del GenBank (http://www.ncbi.nlm.nih.gov/genbank/) obtenidas del análisis MegaBlast (Morgulis et al. 2008) para corroborar la identidad mediante la concordancia de la topología y la identidad del Blast para cada una de las secuencias de las cepas.
Efectividad de las rizobacterias en la promoción del crecimiento en plántulas de chile poblano
Preparación del inóculo
Se incluyeron diez cepas de bacterias para evaluar sus efectos en la promoción de crecimiento, las cuales fueron seleccionadas en el laboratorio por su capacidad para solubilizar fosfatos, producir auxinas o fijar nitrógeno. Las cepas bacterianas se cultivaron en caldo nutritivo en agitación constante por tres días a 28 ºC hasta obtener una concentración de 109 células/mL. Se compararon con dos testigos: uno sin inocular y otro que consistió en la inoculación de la cepa bacteriana Bacillus pumillus R44 con probada capacidad para promover crecimiento, la cual fue proporcionada por el Laboratorio de Microbiología del Colegio de Postgraduados. Cuatro de las diez cepas utilizadas poseen capacidad para solubilizar fosfatos, cuatro más producen auxinas y dos son fijadoras de nitrógeno (Cuadro II).
CUADRO II AFILIACIÓN GENÉTICA DE LAS CEPAS DE ESTUDIO SEGÚN LAS SECUENCIAS DE AMPLIFICACIÓN DEL GEN 16S ADNr COMPARADAS CON EL GENBANK
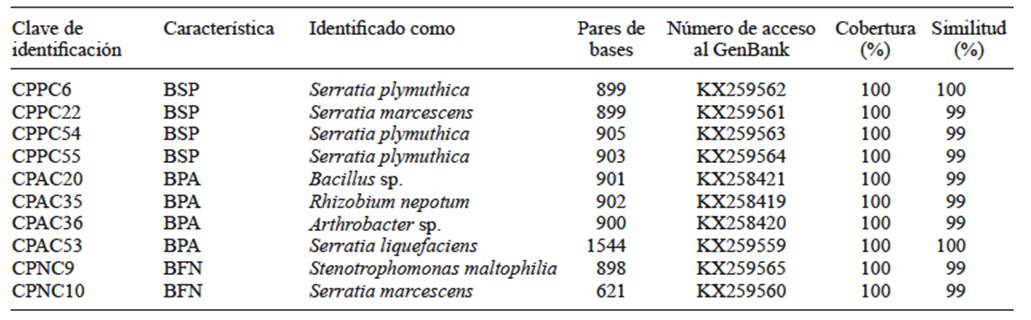
BSP = bacterias solubilizadoras de fosfatos, BPA = bacterias productoras de auxinas, BFN = bacterias fijadoras de nitrógeno, CPPC = Colegio de Postgraduados, solubilizadoras de fosfatos en Capsicum, CPAC = Colegio de Postgraduados, productoras de auxinas en Capsicum, CPNC = Colegio de Postgraduados, fijadoras de nitrógeno en Capsicum
Establecimiento del experimento
El sustrato utilizado para el crecimiento de las plántulas de chile poblano fue una mezcla de musgo de turba (peat moss), perlita y vermiculita (relación 1:1:1), mismo que fue esterilizado en autoclave a 18 lb de presión por 3 h. Con el sustrato se llenaron semilleros de 20 cavidades y después se sembraron dos semillas por cada cavidad. Antes de la siembra, la semilla de chile fue desinfectada con cloro al 1 % por 3 min y lavada tres veces con agua destilada estéril. A la emergencia se dejó una plántula por cavidad y se inoculó 1 mL de suspensión bacteriana. A los 68 días después de la inoculación las plántulas fueron cosechadas. Se midió altura con una regla y el área foliar se determinó con un medidor de área foliar (Area Meter, Modelo LI-3100; Nebraska, EUA). La parte aérea y la raíz se secaron hasta peso constante en un horno (Felisa, Modelo 242-A, Ciudad de México México) a 70 ºC por 72 h; La biomasa seca se determinó en una balanza analítica (Sartorius, Modelo Analytic AC 210S, Illinois, EUA). El experimento fue establecido utilizando un diseño experimental completamente al azar con 12 tratamientos (incluyendo los testigos) y 20 repeticiones. Los datos obtenidos fueron analizados mediante el paquete estadístico SAS para Windows (SAS Institute Inc. 2002), realizando un análisis de varianza y prueba de comparación de medias (Tukey, α = 0.05).
RESULTADOS Y DISCUSION
Aislamiento y caracterización de rizobacterias por sus atributos de promoción del crecimiento
Se aislaron un total de 215 cepas, de las cuales 74 fueron solubilizadoras de fosfatos, 70 fijadoras de nitrógeno y 71 cepas fueron productoras de indoles. Las cepas fijadoras de nitrógeno sólo se seleccionaron con base en su capacidad de crecer en medio de Rennie, el cual es un medio libre de nitrógeno. En el caso de los otros dos grupos de cepas se realizó una evaluación cuantitativa.
En las 74 cepas solubilizadoras de fosfato aisladas se encontró que éstas liberaron entre 10 y 881 µg/mL de fosfato cuando se cultivaron en medio líquido. El 31 % de las cepas solubilizaron más de 400 µg/mL de fosfato, de estas, seis cepas (CPPC23, CPPC24, CPPC25, CPPC26, CPPC28, CPPC29) provienen del sitio 3 de San Matías Tlalancaleca a 2414 msnm (Cuadro I). La mejor fue la cepa CPPC25 con 881 µg/mL de fosfato solubilizado (Fig. 2). Varios estudios han evidenciado que diversos géneros de bacterias poseen la capacidad para solubilizar fosfatos, destacando Pseudomonas, Bacillus, Rhizobium, Burkholderia, Achromobacter, Microccocus, Aereobacter, Flavobacterium, Enterobacter, Pantotea, Klebsiella, Rhodobacter, Arthrobacter, Serratia y Erwinia (Khan et al. 2010, Datta et al. 2011), los cuales han sido utilizados en plantas de arroz (Chaiharn y Lumyong 2009), trigo (Ahmad et al. 2008), soya (Son et al. 2006), maíz (Fitriatin et al. 2014), tomate (Banerjee et al. 2010) y chile (Datta et al. 2011, Hahm et al. 2012, Luna et al. 2013, Reyes-Ramírez et al. 2014).
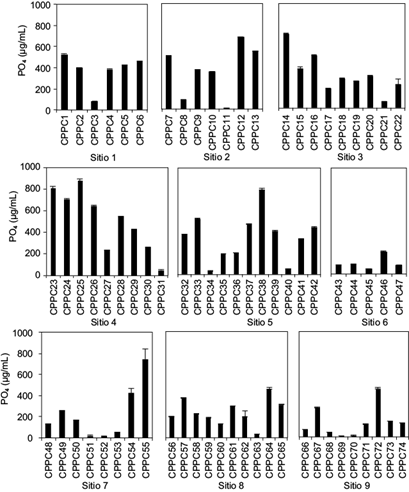
Fig. 2 Solubilización de fosfatos (PO4) por las cepas de bacterias solubilizadoras de fosfatos aislados en suelo rizosférico de chile poblano colectado en nueve sitios de la Sierra Nevada, estado de Puebla, México. Medias n = 3, ± error estándar. CPPC = Colegio de Postgraduados, solubilizadoras de fosfatos en Capsicum
En el caso de la producción de ácido indolacético, se realizó una preselección de 71 cepas con base en el cambio de color a rosa cuando al cultivo bacteriano se le adicionó el reactivo de Salkowski (indicativo de producción de indoles). La evaluación cuantitativa indicó que estas cepas produjeron entre 21 y 26 µg/mL de índoles, de las cuales el 17 % fueron aisladas en el sitio 3 de San Matías Tlalancaleca a 2414 msnm, el 15 % fueron del sitio 7 de Huejotzingo a 2292 msnm, y el 13 % de los sitios 4 (Chiautzingo, a 2425 msnm) y 9 (Huejotzingo, a 2284 msnm). La cantidad más alta de indoles producidos fue encontrada en la cepa CPAC52, proveniente del sitio 7 del municipio de Huejotzingo con 26.4 µg/mL (Cuadro I y Fig. 3). La producción de auxinas por parte de las cepas está condicionada por el tipo y edad del cultivo asociado, además de la especie y género al cual pertenece la bacteria (Ponmurugan y Gopi 2006).
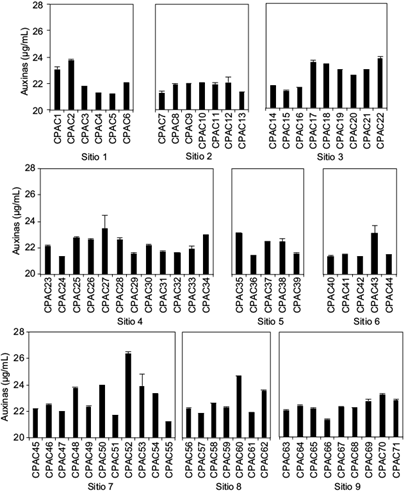
Fig. 3 Producción de auxinas por las cepas de bacterias productoras de auxinas aislados en suelo rizosférico de chile poblano colectado en nueve sitios de la Sierra Nevada, estado de Puebla, México. Medias n = 3, ± error estándar. CPAC = Colegio de Postgraduados, productoras de auxinas en Capsicum
La solubilización de fosfatos por las cepas evaluadas en este estudio fue alta respecto a lo encontrado por Datta et al. (2011), quienes al evaluar cepas de rizobacterias aisladas en rizósfera de C. annuum cultivar Suryamukhi encontraron que el nivel más alto de fosfato solubilizado (55 µg/mL) lo presentó la cepa Streptomyces sp. C32, el ácido indol acético producido por esta cepa fue menos de 10 µg/mL. En otro estudio, Arthrobacter sp. y Bacillus sp., aislados en rizósfera de tomate tuvieron valores altos de solubilización de fosfatos, que fueron entre 150 y 200 µg/mL (Banerjee et al. 2010).
Identificación molecular de las cepas
Las diez mejores cepas en sus atributos de promoción de crecimiento se identificaron a nivel molecular. Seis cepas identificadas pertenecen al género Serratia. De éstas, tres fueron de la especie Serratia plymuthica (CPPC6, CPPC54 y CPPC55), dos cepas pertenecen a Serratia mascescens (CPPC22 y CPNC10) y una fue de la especie Serratia liquefaciens (CPAC53). Las cepas CPAC35, CPAC36, CPAC20 y CPNC9 pertenecen a Rhizobium nepotum, Arthrobacter sp., Bacillus sp. y Stenotrophomonas maltophilia, respectivamente (Cuadro II).
Efectividad de las rizobacterias en la promoción del crecimiento en plántulas de chile poblano
Las cepas bacterianas inoculadas en plántulas de chile mostraron diferencias estadísticas significativas (Tukey, p < 0.05). Los resultados evidenciaron que el 49 % de los tratamientos inoculados con las rizobacterias mostraron incrementos en altura, área foliar y producción de biomasa seca total respecto al testigo. Los mejores tratamientos fueron las plántulas inoculadas con Rhizobium nepotum CPAC35 y Serratia plymuthica CPPC55. El tratamiento con la cepa CPA35 obtuvo una altura final promedio de 9.6 cm, 12 cm2 de área foliar y 82 mg de biomasa seca total, valores que fueron 22.5, 7.6 y 26.04 % mayores en comparación con el testigo, respectivamente. El tratamiento con la cepa CPPC55 incrementó altura (9 cm) en 15 %, área foliar (13 cm2) en 34 % y producción de biomasa seca (72 mg) en 11 % (Cuadro III).
CUADRO III ALTURA, ÁREA FOLIAR Y BIOMASA SECA EN PLÁNTULAS DE CHILE POBLANO POR EFECTO DE LA INOCULACIÓN DE RIZOBACTERIAS AISLADAS DE LA RIZÓSFERA DE CHILE POBLANO A LOS 68 DÍAS DESPUÉS DE LA INOCULACIÓN
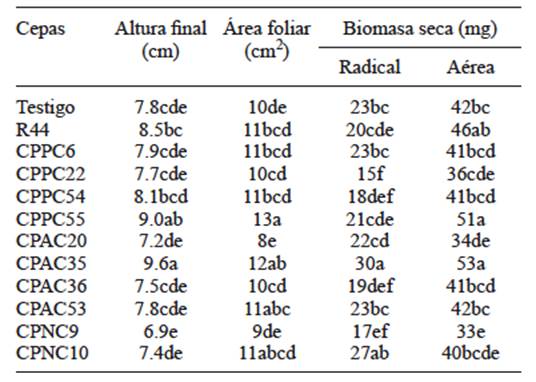
Letras distintas dentro de la misma columna, denotan diferencias estadísticas significativas (Tukey, α = 0.05, a > b). CPPC = Colegio de Postgraduados, solubilizadoras de fosfatos en Capsicum, CPAC = Colegio de Postgraduados, productoras de auxinas en Capsicum, CPNC = Colegio de Postgraduados, fijadoras de nitrógeno en Capsicum
En un estudio similar Yau et al. (2013) encontraron incrementos en altura, diámetro, número de hojas, biomasa seca y área foliar por efecto de la inoculación de S. marcescens y Bacillus cereus en plantas de chile, debido a que estos microorganismos tienen la capacidad de producir acido indolacético e inhibir fitopatógenos como P. capsicí hasta en un 75 %. En otros trabajos se han encontrado efectos benéficos al inocular S. liquefaciens en cultivos de trigo (Abaid-Ullah et al. 2015), tomate (Manas et al. 2010), soya (Pan et al. 2002) y maíz (Pan et al. 1999), pero no se han encontrado reportes en cultivos de chile, siendo este uno de los primeros estudios en cuanto a la calidad de plántulas de chile poblano.
Serratia plymuthica es una bacteria ubicua Gram negativa que se ha aislado en rizósfera de plantas de todo el mundo, ya sea en vida libre o como organismo endófito (De Vleesschauwer y Hofte 2007) y tiene potencial no sólo para suprimir los agentes patógenos del suelo, sino también para estimular el crecimiento vegetal mediante la exudación de sideróforos, producción de acido indol acético, creación de películas protectoras de la rizósfera y biosíntesis de quitinasas y proteasas (Muller et al. 2009). Sus efectos benéficos como rizobacteria promotora del crecimiento han sido evaluados en plantas de papa (Czajkowski et al. 2012), pepino (McCullagh et al. 1996), algodón, frijol, manzana, arroz, naranja, lechuga, fresa (De Vleesschauwer y Hofte 2007) y chile (Shen et al. 2006, Kim et al. 2008, Cao et al. 2009), encontrándose incrementos en altura, biomasa radical y foliar y rendimiento de fruto en el cultivo. Específicamente en C. annuum, Kim et al. (2008) reportaron que esta rizobacteria tiene la capacidad de disminuir la incidencia de patógenos como P. capsici, Rhizoctonia solani, Fusarium oxysporum y F. solani.
En otros trabajos también se han encontrado incrementos en la calidad de plántulas de C. annuum (Datta et al. 2011, Hahm et al. 2012, Luna et al. 2013) y C. chinense Jacq. (Reyes-Ramírez et al. 2014) al evaluar parámetros como germinación, altura, diámetro, biomasa seca, área foliar y rendimiento mediante la inoculación de rizobacterias. A pesar de los efectos positivos encontrados en este trabajo al inocular Rhizobium nepotum CPAC35 en plántulas de chile poblano, Pulawska et al. (2012) mencionan que este género de bacterias podría estar asociado a la formación de agallas radicales, principalmente en algunas especies de frutales como el ciruelo (Prunus cerasifera), la frambruesa (Rubus idaeus) y el cerezo (Prunus avium L.). Sin embargo, en esta investigación lo que se observó fue un incremento en el crecimiento de las plántulas.
En este trabajo se demostró que la inoculación de rizobacterias promueve crecimiento de plántulas de chile poblano, con lo que se obtienen ejemplares de mayor calidad. Probablemente los beneficios al obtener mayor altura, área foliar y biomasa seca en las plántulas son una consecuencia de la producción de ácido indolacético (la CPAC35 produjo 23 µg/mL) y solubilización de fosfatos (la CPPC55 liberó 744 µg/mL), lo cual también fue observado por Sarathambal et al. (2015). Además de estas características, posiblemente las cepas tengan otras propiedades que necesitan ser evaluadas y que no fueron estudiadas en este trabajo, por ejemplo producción de sideroforos y de antifúngicos. En un estudio Amaresan et al. (2012) encontraron que la inoculación de Bacillus sp., Serratia sp., Arthrobacter sp. y Serratia marcescens incrementan la calidad de plántulas de tomate (Lycopersicon esculentum) y chile (C. annuum) al haber aumentos en la longitud radical y numero de raíces secundarias, mayor altura y producción de biomasa seca.
CONCLUSIONES
El uso de rizobacterias promotoras de crecimiento con capacidad para solubilizar fosfatos y producir auxinas es efectivo para obtener plántulas de buena calidad en chile poblano. Serratia plymuthica CPPC55 y Rhizobium nepotum CPAC35 promovieron mayor altura y mejor producción de biomasa seca radical y área en plántulas de chile poblano. El uso de microorganismos benéficos son alternativas para disminuir el uso de fertilizantes sintéticos y reducir sus efectos adversos en el ambiente y en la salud humana. Serratia liquefaciens CPAC53 no se ha utilizado como promotor de crecimiento en Capsicum, a pesar de no encontrar efectos positivos en altura se incrementó el área foliar de las plántulas, por lo que esta cepa al igual que Serratia plymuthica CPPC55 podrían ser usadas para la obtención de plántulas con la calidad necesaria al momento del transplante y que podrían favorecer el rendimiento del chile poblano.











 nueva página del texto (beta)
nueva página del texto (beta)


