INTRODUCCIÓN
La lignocelulosa es el componente principal de la biomasa y cerca de la mitad de la materia producida por la fotosíntesis. Se compone de tres tipos de polímeros: celulosa, hemicelulosa y lignina, que están estrechamente entrelazados y químicamente unidos por fuerzas no covalentes y mediante entrecruzamientos covalentes (Pérez et al. 2002). En este contexto, el uso de residuos lignocelulósicos constituye una fuente abundante y de bajo costo, que genera además una solución al problema de su disposición final (Lin y Tanaka 2006, López-Miranda et al. 2009). La provincia de Misiones (Argentina) está ubicada en una región cuya principal actividad económica es la forestal, por lo que la generación de residuos agroforestales crea un problema ambiental que es necesario resolver (Romero 2012, Mantulak et al. 2013).
El bioetanol de segunda generación producido a partir de diferentes materiales lignocelulósicos como la madera, tiene el potencial de sustituir o complementar a los combustibles fósiles utilizados actualmente. El proceso para la conversión de lignocelulosa a etanol requiere la deslignificación de la biomasa lignocelulósica, para liberar a la celulosa de la hemicelulosa y de la lignina, presentes en el complejo celulosa-hemicelulosa-lignina y lograr así, la despolimerización de los hidratos de carbono para producir azúcares simples y la fermentación de hexosas y pentosas para producir etanol. Entre los procesos descritos anteriormente, la deslignificación de las materias primas lignocelulósicas es una de las etapas más difícil de resolver a bajo costo (Lin y Tanaka 2006). Un pretratamiento efectivo debería lograr una buena recuperación de todos los carbohidratos, aumentar la digestibilidad de la celulosa en la subsecuente hidrólisis enzimática, minimizar la generación de productos derivados de la degradación de azúcares y de lignina, ser de bajo costo y fácilmente operable. Un gran número de pretratamientos diferentes han sido sugeridos en las últimas décadas y pueden ser divididos en distintas categorías: físicos, químicos, biológicos o una combinación de éstos (Brodeur et al. 2011).
El pretratamiento de la biomasa lignocelulósica con ácido diluido es uno de los métodos más eficaces que afectan predominantemente la hemicelulosa, con poco impacto en la degradación de la lignina (Silverstein et al. 2007). Por otro lado, los pretratamientos alcalinos son más efectivos en disolver la lignina, mostrando una menor solubilización de la celulosa y la hemicelulosa. En la hidrólisis alcalina, el álcali induce el hinchamiento de la celulosa, lo que lleva a un incremento del área interna superficial, dejando a la celulosa más accesible al ataque enzimático (Carvalheiro et al. 2008). Se ha encontrado que el pretratamiento secuencial ácido-base tiene un efecto positivo en los rendimientos de azúcar producidos durante la hidrólisis enzimática, mejorando estos rendimientos en comparación con los obtenidos con una sola etapa de pretratamiento (ácida o alcalina) (Sanchez et al. 2015).
El objetivo del trabajo fue evaluar el efecto de distintas concentraciones de ácido-base, durante el pretratamiento secuencial de aserrín de pino, sobre la liberación de azúcares reductores.
MATERIALES Y MÉTODOS
Materia prima
El aserrín de Pinus sp. se recolectó del aserradero Valerio Oliva S.A. ubicado en la ciudad de Garupá (Misiones-Argentina) y se secó a temperatura ambiente hasta un contenido de humedad promedio de 18.6 %.
Pretratamiento
El material lignocelulósico se pretrató en matraces Erlenmeyer de 500 mL con 40 g (peso seco), en dos etapas: pretratamiento ácido (PT1) y pretratamiento básico (PT2). El PT1 consistió en la adición de ácido sulfúrico en una relación sólido/líquido 1:5 (m/v) y el calentamiento en autoclave a 121 ºC y 1 atm de presión durante 60 min. El material se filtró, se lavó con agua potable varias veces hasta que las aguas de lavado alcanzaron un pH 6. Posteriormente se lavó con agua destilada, se extrudió y secó a temperatura ambiente. Se realizó el PT2, en 30 g del material resultante, utilizando hidróxido de sodio en una relación sólido/líquido de 1:6 (m/v). El calentamiento se realizó en autoclave a 121 ºC y 1 atm de presión durante 90 min. El material se filtró, se lavó con agua potable hasta que las aguas de lavado alcanzaron pH 6, luego se lavó con agua destilada, se extrudió y secó a temperatura ambiente. Se obtuvo un promedio de 23 g (peso seco) de material al finalizar el PT2.
El esquema de trabajo para cada combinación de pretratamiento se muestra en la figura 1.
Sacarificación
Se pesaron 0.29 g (peso seco) de aserrín pretratado, se mezclaron con 14.5 mL de sustancia amortiguadora de acetato de sodio 0.05 M (pH 4.8) y 20 U/g celulosa (50 µL) de Celluclast 1.5 L (Sigma). La hidrólisis enzimática del aserrín pretratado se realizó a 50 ºC y 150 rpm en frascos de 50 mL (Fig. 1). Se tomaron muestras durante 0.15, 24, 48, 72 y 96 h y se utilizó aserrín de pino sin pretratar como testigo negativo del proceso, exponiéndolo a las mismas condiciones de hidrólisis que el aserrín pretratado.
Análisis
Se determinó el contenido de sólidos totales del aserrín sin pretratar y pretratado, de acuerdo con el protocolo estándar del NREL/TP-510-42621 (NREL 2008d). El contenido de extractivos se determinó mediante NREL/TP-510-42619 (NREL 2008a), el porcentaje de lignina soluble en ácido (% ASL, por sus siglas en inglés) y lignina insoluble en ácido (% AIL, por sus siglas en inglés) se determinó según NREL/TP-510-42618 (NREL 2011) y el contenido de cenizas según NREL/TP-510-42622 (NREL 2008c). El contenido de carbohidratos totales se midió calculando la diferencia entre el 100 % y la suma de porcentajes de humedad, extraíbles, cenizas y lignina (López-Miranda et al. 2009). Los azúcares reductores se midieron de acuerdo con el método del ácido dinitrosalicílico (DNS) (Miller 1959).
La actividad enzimática (FPA, por sus siglas en inglés) se realizó mediante la técnica NREL/TP-510-42628 (NREL 2008b), para ello se utilizaron 10 mg de papel filtro Whatman No. 1 como sustrato y 0.1 mL de extracto enzimático diluido en amortiguador de acetato de sodio 0.05 M (pH 4.8) a 50 ºC durante 60 min (una unidad de actividad enzimática fue definida como la cantidad de enzima requerida para liberar 1 µmol/mL min de glucosa bajo las condiciones ensayadas).
Estadística
Las variables estudiadas fueron las concentraciones de ácido y álcali en los procesos de pretratamiento secuencial PT1 y PT2, respectivamente utilizando tres niveles para cada una de ellas (1, 2 y 3 % v/v), mediante un diseño 32 factorial.
Para establecer si existían diferencias significativas entre los pretratamientos, el testigo y el tiempo de sacarificación, se realizó un análisis de varianza con un nivel de confianza del 95 %. El análisis estadístico se realizó con el programa Statgraphics Centurion XV versión 15.2.05.
RESULTADOS
Pretratamiento
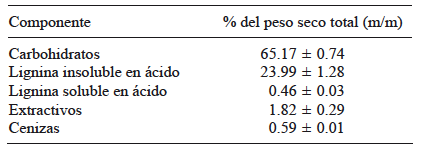
En el cuadro I se muestra la composición química del aserrín de pino utilizado.
Las combinaciones del diseño factorial, los resultados de % ASL y la cantidad de azúcares reductores liberados en el tiempo se muestran en el cuadro II.
CUADRO II DISEÑO FACTORIAL. PRETRATAMIENTO CON ÁCIDO SULFÚRICO (PT1), PRETRATAMIENTO CON HIDRÓXIDO DE SODIO (PT2), PORCENTAJE DE LIGNINA ÁCIDO SOLUBLE (% ASL)

Con los resultados obtenidos, se realizó el análisis estadístico para determinar la significancia de cada variable y su nivel óptimo en la deslignificación del aserrín de pino. Excluyendo los efectos no significativos al 95 % de nivel de confianza (PT12, PT22 y la interacción PT1 x PT2), se obtuvo el diagrama de Pareto que se muestra en la figura 2. Se observó que ambos factores influyen linealmente de manera positiva sobre el sistema y la interacción entre ambos no es significativa. El nivel óptimo de cada factor que favoreció una mayor deslignificación (medida como % ASL) fue el +1, que correspondió a 3 % de ácido sulfúrico y 3 % de hidróxido de sodio.
Sacarificación
En el cuadro III se muestra el análisis de varianza multifactorial (pretratamiento y tiempo de sacarificación), donde se observó la significancia estadística de los factores, Sin embargo, la interacción entre ellos no fue significativa. Para determinar entre qué niveles de cada factor existieron diferencias, se utilizó la prueba de la diferencia mínima significativa (LSD, por sus siglas en inglés). En el caso del factor pretratamiento, hubo diferencias significativas entre el control y todas las combinaciones de pretratamientos. Sin embargo, entre los pretratamientos, en la mayoría de los casos hubo superposición de medias (Cuadro IV).
CUADRO III ANÁLISIS DE VARIANZA PARA LOS EFECTOS PRETRATAMIENTO (A) Y TIEMPO DE SACARIFICACIÓN (B)

a Permite establecer si existen diferencias entre las varianzas de dos grupos de datos. Razón-F = 1 las varianzas coinciden.
CUADRO IV PRUEBA DE LA MÍNIMA DIFERENCIA SIGNIFICATIVA PARA LOS AZÚCARES REDUCTORES OBTENIDOS POR PRETRATAMIENTO REALIZADO

PT1 = pretratamiento ácido, PT2 = pretratamiento básico, LS = media calculada mediante la prueba de la diferencia mínima significativa
Respecto al tiempo de sacarificación, la mayor concentración de azúcares se alcanzó a las 48 h. La prueba LSD para este factor mostró superposición de medias entre las 24 y 48 h. Por lo tanto, la máxima concentración de azúcares reductores se alcanzó en ese lapso de tiempo (Cuadro V).
CUADRO V PRUEBA DE LA MÍNIMA DIFERENCIA SIGNIFICATIVA PARA LOS AZÚCARES REDUCTORES OBTENIDOS POR TIEMPO DE SACARIFICACIÓN

LS = media calculada mediante la prueba de la diferencia mínima significativa
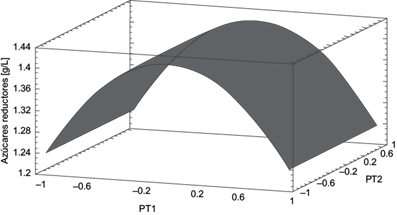
Dado que la mayor concentración de azúcares reductores se obtuvo entre las 24 y 48 h, se utilizaron ambos tiempos para analizar el diseño (Fig. 3). Eliminando los efectos no significativos (PT22 y la interacción PT1 × PT2), se encontró que el efecto PT12 presentó influencia negativa sobre la concentración de azúcares. Un factor cuadrático negativo y estadísticamente significativo, indica que la variable respuesta (concentración de azúcares) incrementó a medida que el nivel del factor se incrementaba. En tanto que la disminución de la respuesta pudo ser observada cuando el nivel del factor se continuó incrementando a partir de un cierto valor que maximice la respuesta. La concentración de azúcares reductores no se vio afectada por el PT2, pero sí por el PT1, alcanzando un máximo para el nivel 0 del mismo (2 % de ácido sulfúrico). El nivel óptimo de cada factor que favoreció la sacarificación enzimática coincidió con los puntos centrales del experimento, esto es 2 % de ácido sulfúrico y 2 % de hidróxido de sodio.
Composición química
El material lignocelulósico de madera de conífera está compuesto aproximadamente por un 40 % de celulosa, 21 % de hemicelulosa y 28 % de lignina (Galbe y Zacchi 2002). Estos resultados concuerdan con los presentados en este trabajo y por otros autores, como López-Miranda et al. (2009), para aserrín de pino. Las diferencias en algunos de los componentes pueden ser estacionales o deberse a diferencias entre especies. El contenido de carbohidratos (65 %) se aproximó a lo obtenido para Pinus taeda (64 %), P. contorta (67 %) y P. patula (62 %). Sin embargo, el contenido total de lignina (24 %) fue menor que el obtenido para las citadas especies, variando entre 27 % para P. contorta hasta 30 % para P. taeda (Ewanick et al. 2007, Gómez et al. 2013, Sannigrahi et al. 2010).
Pretratamiento
La lignocelulosa de coníferas se considera particularmente recalcitrante hacia la hidrólisis debido a la cantidad y naturaleza de su lignina (Pan et al. 2005). El pretratamiento es fundamental para permitir un mejor proceso de hidrólisis y fermentación a la hora de utilizar biomasa lignocelulósica en la producción de bioetanol (Abril y Abril 2009). Además, el proceso de pretratamiento secuencial conduce a mejorar la eficiencia consumiendo menos químicos, lo que resulta en costos más bajos y menor generación de residuos (Weerasai et al. 2014). La eliminación de lignina modifica la estructura de la madera creando poros o aumentando el tamaño de los ya existentes, lo que produce una organización más abierta y accesible a la penetración de enzimas en la etapa de sacarificación.
Camesasca et al. (2015) obtuvieron 0.024 g glucosa/g pasto y bajos niveles de subproductos inhibidores con ácido sulfúrico a 1.5 % durante 60 min a 121 ºC. Este valor es bajo comparado con el reportado en este trabajo (1.81 g/L corresponde a 0.077 ± 0.014 g azúcares/g aserrín en los puntos centrales del diseño, según la cantidad de material sacarificado). Ma et al. (2010) encontraron que, aumentando el tiempo y la temperatura del pretratamiento con ácido sulfúrico diluido, se incrementa el rendimiento en azúcares reductores en la hidrólisis enzimática. Sin embargo, lo anterior puede ocasionar un aumento en la concentración de subproductos inhibidores del proceso fermentativo como furfural y 5-hidroximetilfurfural (Saha et al. 2005, Camesasca et al. 2015, Martínez et al. 2015).
El contenido de lignina soluble se midió en el licor resultante del PT2 debido a que la lignina se solubiliza en solución alcalina acuosa (Jagtap et al. 2013). Las condiciones que generaron mayor pérdida de lignina corresponden al 3 % de NaOH (57.07 % calculado a partir del % ASL). Hosgun y Bozan (2014) obtuvieron un valor similar de remoción de lignina (58.89 %) con hidróxido de sodio al 2.25 % utilizando tallos de Papaver somniferum. Silverstein et al. (2007) hallaron que el pretratamiento con ácido sulfúrico a 121 ºC fue más eficaz para la solubilización de xilano y el pretratamiento con hidróxido de sodio produjo el 66 % de pérdida de lignina al 2 % por 90 min a 121 ºC. En este último caso, la mayor pérdida de lignina puede deberse a las diferencias en el tipo de material utilizado. En concentraciones menores de ácido (1 %) y álcali (1.25 %), Weerasai et al. (2014) obtuvieron una pérdida de lignina del 45.69 % utilizando paja de arroz.
Sacarificación
El principal desafío tecno-económico en todo proceso de bioconversión de lignocelulosa a bioetanol es superar la fracción de celulosa recalcitrante ante la hidrólisis enzimática. La celulosa es intrínsecamente resistente al ataque enzimático y además está protegida por la matriz envolvente de lignina y hemicelulosa (Pan et al. 2005).
Para degradar biológicamente la celulosa son necesarias distintas enzimas con diferentes especificidades trabajando juntas: endoglucanasas y celobiohidrolasas que producen celobiosa como producto final, y β-glucosidasas que rompen la celobiosa y liberan dos moléculas de glucosa (Pérez et al. 2002).
El valor máximo de azúcares reductores obtenidos (1.81 g/L) fue comparable al obtenido por Jeya et al. (2010) con biomasa leñosa y una carga enzimática de 20 unidades de papel de filtro, (FPU, por sus siglas en inglés)/g sustrato (2.9 g azúcares/L a las 50 h de sacarificación). Yamashita et al. (2010) no observaron producción de glucosa y azúcares reductores en la sacarificación enzimática del bambú sin pretratar. Sin embargo, en el presente trabajo el aserrín de pino sin pretratar (testigo) produjo azúcares reductores al ser sacarificado (0.43 g/L a las 96 h). No obstante, existieron diferencias estadísticamente significativas entre los azúcares obtenidos entre el material pretratado y el material sin pretratar.
Respecto al tiempo de sacarificación, la mayor concentración de azúcares se obtuvo entre las 24 - 48 h (1.21 g/L en promedio), datos que coinciden con lo reportado por otros autores (Dogaris et al. 2009, López-Miranda et al. 2009, Jeya et al. 2010).
CONCLUSIONES
Se obtuvo una elevada deslignificación del aserrín de pino que se correspondió con las mayores concentraciones de ácido y álcali empleadas en el trabajo (3 % de cada una). Se optimizaron las concentraciones de ácido y álcali del pretratamiento secuencial de aserrín de pino, respecto a la producción, por hidrólisis enzimática de su contenido de celulosa en azúcares reductores, siendo éstos cuatro veces mayores que el aserrín sin pretratar. Esto evidencia que la mayor eliminación de lignina en el pretratamiento, condujo a una mejor acción de las enzimas en la sacarificación. La cantidad de azúcares reductores obtenidos fue comparable a lo obtenido por otros autores. Sin embargo, es posible alcanzar mejores resultados optimizando además la etapa de sacarificación, al ajustar por ejemplo, la carga enzimática respecto del material pretratado.











 nueva página del texto (beta)
nueva página del texto (beta)