INTRODUCCIÓN
El diseño de un sistema de biomonitoreo que permita determinar la calidad del ecosistema de ribera, requiere establecer el valor indicador de las especies que ahí habitan, usando la presencia y abundancia de los organismos en el río y el monitoreo físico y químico del agua. El monitoreo biológico da una visión histórica de la salud del ecosistema y los datos fisicos y químicos son necesarios para establecer las causas concretas de cambios naturales cuando los hubiere, o bien para el seguimiento y cuantificación de impactos antrópicos en el ecosistema (Friberg et al. 2011). El valor indicador de las especies enfrenta una dificultad que tiene que ver con el hecho de que las comunidades de organismos son muy diferentes entre cuencas y entre ríos de la propia cuenca. Por tal motivo, cualquier estudio ecológico o extrapolación del valor indicador de las especies creados en circunstancias diferentes de las de un sitio dado, sólo puede ser considerada como una aproximación relativa, ya que la combinación de determinadas características climáticas y geológicas de los ecosistemas locales tienen un efecto sobre la respuesta de los organismos a la composición química del agua (Stoermer y Smol 1999).
La solución al problema de cómo calcular el valor indicador de las especies ha supuesto una sistematización e intercalibración de datos entre países con sistemas muy diferentes de medida del estado de los ríos (European Commission 2000). Para el caso de la comunidad de las algas bentónicas y su valor indicador, esta sistematización se ha concretado en protocolos de estudio tales como los de Van Dam et al. (1994), Foerster et al. (2004), Cambra et al. (2005), Birk et al. (2006) y Tornés et al. (2007). Las comunidades de algas bentónicas son sensibles a los cambios químicos en el agua, son fáciles de obtener y se pueden evaluar cuantitativamente. Sin embargo, hay problemas con la identificación taxonómica de las especies y el reconocimiento de las fases de sus ciclos de vida. De tal manera que es importante la participación de especialistas que puedan caracterizar e interpretar la variación morfológica de las poblaciones y su relación con la abundancia y la calidad del ambiente.
El río Magdalena es uno de los principales afluentes periurbanos de la Cuenca de México y en particular de la Ciudad de México (Legorreta 2009). En él se han llevado a cabo diversos estudios sobre la riqueza de las algas bentónicas y su relación con las condiciones ambientales (Ramírez et al. 2001, Ramírez y Cantoral 2003, Bojorge-García 2006, Bojorge-García y Cantoral-Uriza 2007). Sin embargo, aún existe el problema de la determinación del valor indicador de las especies individuales. En ese contexto, el objetivo de nuestra investigación es una propuesta de evaluación para determinar el valor indicador ecológico de las algas bentónicas a través de: i) caracterizar la dinámica de la comunidad y los parámetros ambientales que determinan su estructura y ii) determinar los sitios de referencia de buena calidad ambiental y su relación con el valor indicador de las especies. Esta aproximación está basada en los trabajos realizados por Dufrené y Legengre (1997) y Tornés et al. (2007) en ríos europeos y constituye un primer esfuerzo por generar una valoración basada en las comunidades bentónicas locales y su eventual empleo para el biomonitoreo, la gestión ambiental y la protección del río.
MATERIALES Y MÉTODOS
Área de estudio. El río Magdalena está localizado en la provincia morfotectónica de la Faja Volcánica Transmexicana (Ferrusquía-Villafranca, 1998) en el Parque Nacional Los Dinamos, Delegación Magdalena Contreras, Ciudad de México (19° 16' 00'' N - 99° 18' 22'' O). Nace a una elevación de 3650 msnm y se extiende 21.6 km hasta los límites de la zona urbana de la Ciudad en donde se presentan numerosos aportes con descargas urbanas, las que se canalizan al drenaje profundo (Fig. 1). El clima de la región es templado subhúmedo, con abundantes lluvias durante junio a octubre y una época seca de noviembre a mayo (García 2004). Los cuerpos rocosos están constituidos por paquetes de rocas alternantes de lavas andesíticas a basálticas (Ferrusquía-Villafranca 1998) y la diversa topografía de la cuenca ha favorecido la presencia de una abundante vegetación de pino Pinus hartwegii Lindl. en la parte alta de la cuenca, de oyamel Abies religiosa (Kunth) Schltdl. y Cham. en la parte media y de encinos Quercus spp. y bosque mixto en la porción baja de la cuenca (Ávila-Akerberg 2010).
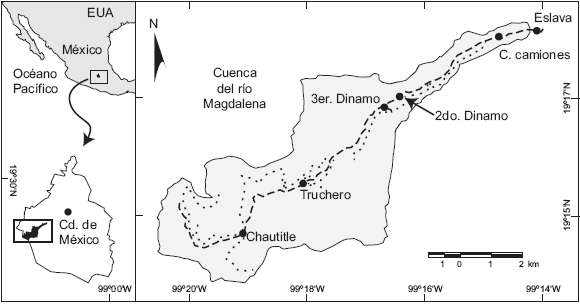
Fig. 1 Localización de los sitios de estudio en el río Magdalena, Ciudad de México. 1. Chautitle, 2. Truchero, 3. Tercer Dinamo, 4. Segundo Dinamo, 5. Central de Camiones, 6. Confluencia con el río Eslava
Selección de los sitios de referencia. La selección de los sitios de muestreo se realizó con base en la distancia entre sitios menor a 5 km y la ubicación en puntos estratégicos para la calidad del agua. Es decir, los sitios de referencia fueron seleccionados por su conservación y los posibles impactos que en ellos se producen, que son el origen de la diferente calidad ecológica del río. Si esto se produce o no, se validará con la estimación del valor indicador de las comunidades de las algas bentónicas. Fueron examinados seis sitios que presentan distinta influencia derivada de actividades humanas: Chautitle (CH) y Truchero (TR), sin actividades humanas visibles; Tercer Dinamo (3D) y Segundo Dinamo (2D) con actividades recreacionales y restaurantes rústicos; y Central de Camiones (CA) y la confluencia con el río Eslava (ES) con evidente influencia urbana.
Evaluación física y química del agua. La frecuencia del muestreo fue trimestral y representa las estaciones contrastantes del año: periodo seco cálido (SC), periodo lluvioso (Ll) y periodo seco frío (SF). Las colectas de diatomeas y macroalgas se realizaron en el periodo (mayo 2006 a enero 2007), empleando las técnicas estándares para cada grupo biológico de Bojorge-García (2006) y de Necchi et al. (1995). En cada sitio se registraron los siguientes parámetros físicos y químicos: la temperatura del agua (T oC) y la conductividad específica (normalizada a 25 °C, K25) fueron estimadas con un medidor de PC-18 Conductronic (Puebla, México). El oxígeno disuelto (OD) se determinó con un medidor YSI-85 (YSI Environmental, Massachusetts, EUA). Los nutrientes disueltos tales como el fósforo reactivo soluble (FRS), los nitritos (N-NO2), los nitratos (N-NO3), el amonio (N-NH4) y el nitrógeno inorgánico disuelto (NID) se estimaron a partir de 30 mL de muestras de agua. Estas muestras se filtraron in situ con membranas de 0.45 y 0.22 p.m de diámetro de poro y fueron preservadas con cloroformo y en congelación hasta que los análisis se realizaron en el laboratorio con un analizador de flujo segmentado (Skalar Inc., Georgia, USA), de acuerdo con la norma ASTM (1989) y APHA (1995).
Muestreo de la comunidad bentónica algal (macroalgas y diatomeas). Esta comunidad se caracterizó por el registro de crecimientos algales visibles y de las diatomeas epilíticas. Las observaciones se realizaron sobre sustratos naturales (rocas) directamente en el lecho del río. La abundancia de los crecimientos visibles fue calculada con la técnica de cuadrante (Necchi et al. 1995, Necchi y Branco 1999, Carmona et al. 2006) que estima la influencia de las variables a nivel microambiental (velocidad de la corriente y la profundidad) en el porcentaje de cobertura de las poblaciones. El sitio de muestreo consistió de un segmento del río de 10 m de longitud. En cada segmento se muestrearon cinco cuadrantes, cada uno separado por 2 m y su ubicación se determinó mediante una tabla de números aleatorios, en cada punto se colectó una muestra de crecimientos algales visibles y una de diatomeas. Las algas con crecimiento visible fueron estimadas con un círculo de 10 cm de radio. La abundancia de las diatomeas epilíticas fue estimada a partir del cepillado de cantos rodados en un área de 100 cm2 (Kelly et al. 1998). La limpieza de los frústulos se realizó con la técnica de Kelly et al. (2001) y se montaron tres preparaciones semipermanentes (submuestras) de 200 μL c/u con resina Naphrax®. Por cada preparación se contaron 400 valvas a una magnificación de 1000x a través de un microscopio óptico con contraste interdiferencial Olympus BX51 (Olympus Corporation, Tokio, Japón), que representan a cada punto de muestreo por sitio en las tres épocas del año consideradas (Squires y Sinnu 1986, Kelly y Whitton 1995). Las variables microambientales se midieron in situ en el centro de cada unidad de muestreo. La velocidad de la corriente se midió tan cerca como fue posible de los crecimientos algales, con un medidor de velocidad de corriente Swoffer 3100 (Seattle, EUA).
Estimación del valor indicador de las especies. La relación entre la distribución espacial y temporal de las comunidades bentónicas de algas y de las características físicas y químicas del agua se examinó por un lado para las algas de crecimiento visible y por otro para las diatomeas. En cada caso se realizó un análisis de correspondencia canónica (ACC) seguido por una prueba de Monte Carlo (999 permutaciones, ɑ = 0.05), que establece la importancia de la correlación entre la distribución de las especies y los parámetros ambientales. El análisis temporal permite reconocer los parámetros hidrológicos relacionados con la abundancia de las especies, la cual no necesariamente está relacionada con la contaminación del cauce (Dufrené y Legendre 1997, Tornés et al. 2007). Asimismo, permite seleccionar y confirmar los sitios de referencia y los posibles impactos que en ellos se producen. Los análisis estadísticos se realizaron con el programa PC-ORD 4 (McCune y Mefford 1999). El valor del indicador ecológico de cada especie (IndVal) fue evaluado por el método de Dufrené y Legendre (1997). Este método IndVal se basa en el grado de especificidad del hábitat de la especie, es decir, la exclusividad a un hábitat determinado y la fidelidad o la frecuencia de ocurrencia dentro de un mismo hábitat, ambos medidos de forma independiente para cada taxón y se expresa con un valor porcentual. El índice se calcula mediante las fórmulas:
Aij = N individuosij / N individuosi
Aij es una medida de especificidad,
N individuosij = número promedio de individuos de la especie i en todos los sitios del grupo j,
N individuosi = suma de las cifras promedio de individuos de la especie i en todos los grupos.
Bij = N sitios ij / N sitiosj
Bij es una medida de la fidelidad,
N sitiosij = número de sitios en grupo j en la que la especie i está presente,
N sitiosj = número total de sitios en el grupo j.
Por lo tanto, el valor total del indicador (IndVal) de la especie i en el grupo j es:
Cuanto mayor sea la especificidad y fidelidad de una especie, su presencia en las muestras procedentes de un hábitat particular se incrementará. Las especies que tienen un IndVal igual o mayor que 50 son consideradas como indicadores para un sitio dado, mientras que aquellas con una IndVal menor que 50, pero mayor o igual que 25 son consideradas como especies detectoras. Las especies detectoras pueden responder mejor a los cambios ambientales y proporcionan información para más de un hábitat (Tornés et al. 2007).
RESULTADOS
Calificación de los sitios de referencia. De acuerdo con el estado trófico (Dodds et al. 1998, Dodds 2003) se reconocieron tres grupos de sitios (Cuadro I). El primer grupo (G1): Chautitle y Truchero fue valorado como de referencia de condiciones oligotróficas (NID, 0.15-0.28 mg/L y FRS, 0.0005-0.0009 mg/L). El segundo grupo (G2): Tercer y Seguno Dinamo con agua oligotrófica a mesotrófica (NID, 0.20-1.8 mg/L y FRS, 0.0005-0.0006 mg/L). Finalmente el tercer grupo (G3): Central de camiones y confluencia con el río Eslava presentó valores que indican agua eutrofizada (NID, 1.02-8.2 mg/L y FRS, 0.1-5.8 mg/L). En general la mayor concentración de nutrientes registrada en los seis sitios se presentó en el periodo seco frío (SF).
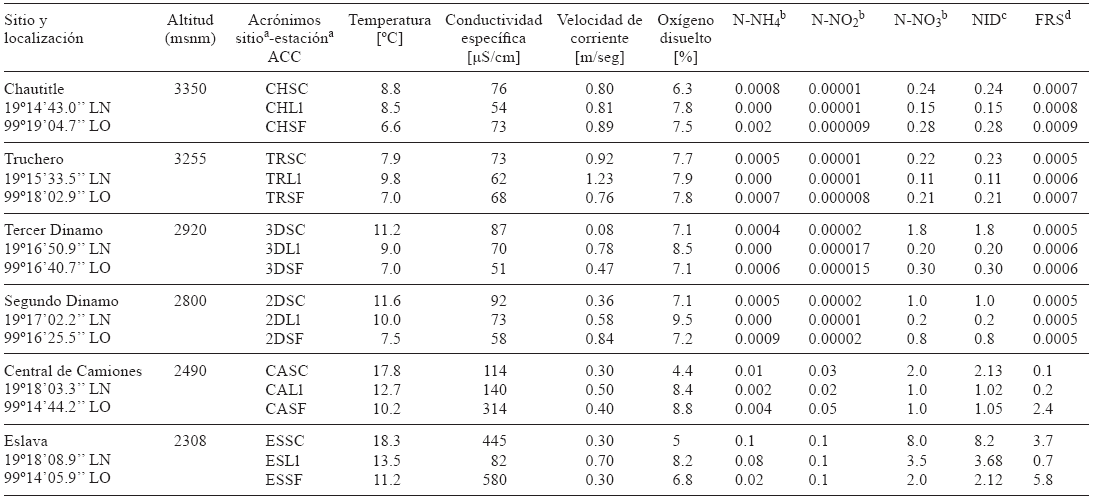
a Sitio: CH = Chautitle, TR = Truchero, 3D = Tercer Dinamo, 2D = Segundo Dinamo, CA = Central de Camiones, ES = Eslava.
a Estación: SC = seca cálida, Ll = lluviosa, SF = seca fría.
b Concentración de nutrientes en mg/L.
c NID= Nitrógeno inorgánico disuelto. Oligotrófico ≤ 0.7 mg/L, mesotrófico 0.7-1.50 mg/L, eutrófico ≥ 1.5 mg/L (Dodds et al. 1998 y Dodds 2003).
d FRS= Fósforo reactivo soluble. Oligotrófico ≤ 0.025 mg/L, mesotrófico 0.025-0.075 mg/L, eutrófico ≥ 0.075 mg/L (Dodds et al. 1998 y Dodds 2003). ACC= Análisis de correspondencia canónica.
Cuadro I Características físicas y químicas en los sitios de colecta en el río Magdalena
La ordenación de las diatomeas. El ACC identificó señales ecológicas congruentes en los tres primeros ejes del análisis (Fig. 2). El primero de los dos ejes explicó el 43 % de la varianza (p = 0.01) y agrupó especies de diatomeas relacionadas con el OD y la velocidad de corriente. Las especies que estuvieron relacionadas con agua bien oxigenada y flujo de corriente considerable en los grupos G1 y G2 fueron: Cocconeisplacentula, Diatoma mesodon, Encyonema silesiacum, Fragilaria capucina, Gomphoneis clevei, Gomphonema gracile, Gomphonema parvulum, Melosira varians, Navicula capitatoradiata, Navicula cryptocephala, Planothidium lanceolatum, Reimeria sinuata, Rhoicosphenia abbreviata y Ulnaria ulna. Los sitios menos oxigenados y con menor flujo de agua fueron los del G3. Las especies más abundantes en esta zona fueron Fistulifera saprophila, Nitzschia minuta y Nitzschia palea. El segundo y tercer eje explicaron el 13 % y 11 % de la varianza respectivamente (p = 0.01) y agruparon a las especies en función de los nutrientes y de la temperatura. Los sitios con los valores más altos de nutrientes estuvieron relacionados con Fistulifera saprophila y Nitzschia minuta. Por el contrario, los sitios del G1 y G2 presentaron agua con menor concentración de nutrientes que estuvieron relacionados con Cocconeis placentula, Diatoma mesodon, Encyonema silesiacum, Fragilaria capucina, Navicula cryptocephala, Planothidium lanceolatum, Rhoicosphenia abbreviata y Ulnaria ulna.

Fig. 2 Análisis de correspondencia canónica con la distribución de sitios y especies de diatomeas y su relación con los parámetros físicos y químicos. Abreviatura de los sitios, estaciones y especies de acuerdo con los cuadros I y II
El IndVal de las diatomeas. Se reconocieron 28 especies con un alto valor indicador (≥ 50 %), las cuales fueron características de los grupos altamente contaminados, o bien, del grupo que presentó agua sin rastros de perturbación humana (Cuadro II). Se identificó un efecto estacional sobre el IndVal de las especies, en el periodo seco cálido (SC) se presentó el mayor número de especies con un alto valor indicador, mientras que el menor número de especies y menor IndVal estuvo relacionado con la época de lluvia (Ll). Las especies con el mayor IndVal promedio del G1 (Fragilaria capucina, Navicula capitatoradiata, Navicula minuscula, Navicula rynchocephala, Nitzschia incospicua y Staurosirella pinnata;Cuadro II) mostraron preferencia por aguas oligotróficas y una alta especificidad. Las especies del G2 Achnanthidium minutissimum, Diatoma mesodon, Encyonema silesiacum, Gomphoneis clevei, Gomphonema gracile, Gomphonema parvulum, Luticola mutica, Melosira varians, Navicula cryptocephala, Navicula gregaria, Rhoicosphaenia abbreviata y Ulnaria ulna (Cuadro II), presentaron preferencia por aguas oligotróficas pero tolerantes a la presencia de NID y FRS en alguna época del año. Finalmente, las especies del G3 Fistulifera saprofila, Nitzschia minuta, Nitzschia palea y Nitzschia recta fueron específicas de los sitios de la zona urbana con alta contaminación (CA y ES).
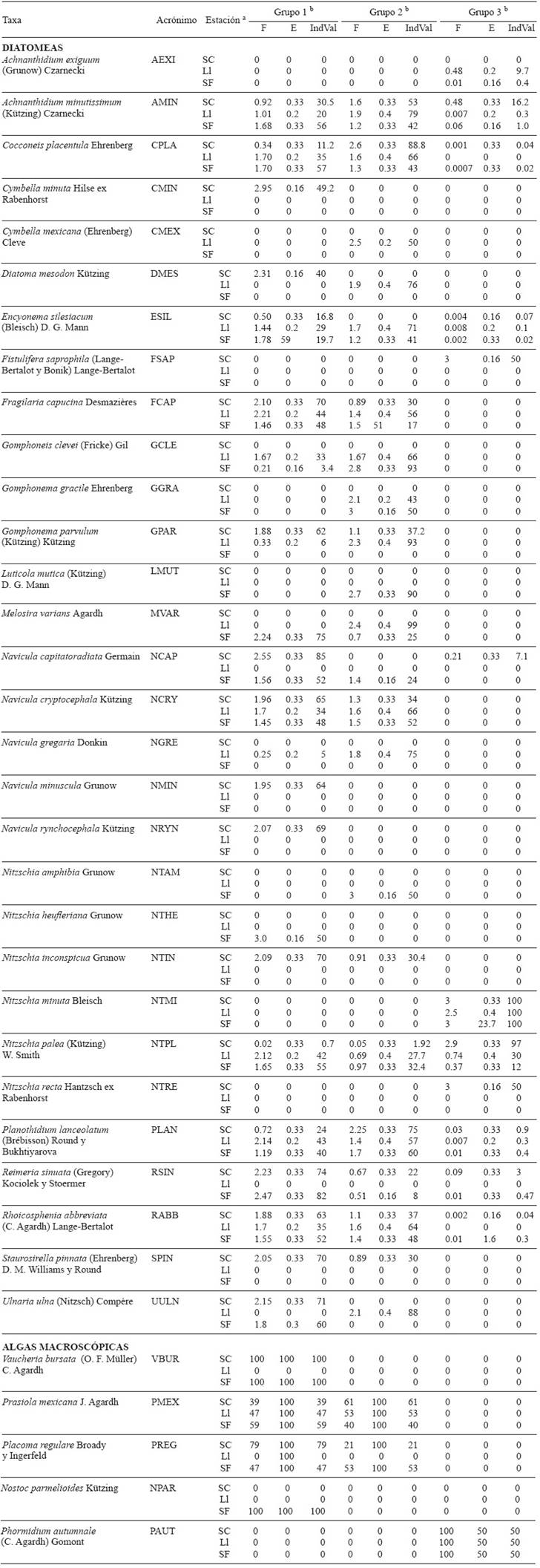
Notas: a Estación: SC= seca cálida, Ll= lluviosa, SF= seca fría. b n= 2 sitios. F= Fidelidad. E= Especificidad. IndVal= Valor indicador
Cuadro II Valor indicador de las especies de diatomeas y macroalgas bentónicas en el río Magdalena
La ordenación de las algas con crecimiento visible. El ACC mostró una correlación de factores físicos y químicos con la distribución y la abundancia de algas similar a la observada para las diatomeas (Fig. 3). El primer eje explicó el 78 % de la varianza. La relación entre la distribución de las especies y los parámetros fisicos y químicos fue significativa a un eje (p = 0.01) y formó dos grupos, el primero de los cuales contenía Phormidium autumnale, que fue encontrado en los sitios que tienen los valores más bajos de oxígeno disuelto y velocidad de corriente (G3). El segundo grupo estuvo integrado por Nostoc parmelioides, Placoma regulare, Prasiola mexicana y Vaucheria bursata las cuales fueron registradas en las aguas más oxigenadas del río (G1-G2). El segundo eje con 12 % de la varianza explicada relacionó especies en función de los nutrientes y de los gradientes de temperatura (Fig. 3), la asociación de Phormidium autumnale a los sitios de mayor NID y Nostoc parmelioides, Placoma regulare, Vaucheria bursata y Prasiola mexicana a los sitios que tienen una menor concentración de nutrientes en la cuenca media (3D y 2D) y alta (CH y TR).
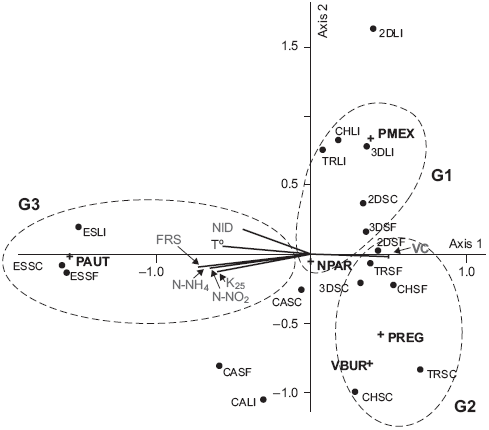
Fig. 3 Análisis de correspondencia canónica con la distribución de sitios y especies de algas con crecimiento visible y su relación con los parámetros físicos y químicos. Abreviatura de los sitios, estaciones y especies de acuerdo con los cuadros I y II
El IndVal de las algas con crecimiento visible. Las cinco especies registradas en el estudio: Vaucheria bursata, Prasiola mexicana, Placoma regulare, Nostoc parmelioides y Phormidium autumnale presentaron un alto IndVal (> 50 %), y fueron características del grupo de sitios altamente contaminados (G3) como Phormidium autumnale, o bien, del grupo que presentó agua sin rastros de perturbación humana (G1) como Vaucheria bursata y Nostoc parmelioides (Cuadro II). El periodo seco cálido (SC) presentó el mayor número de especies con un alto valor indicador (> 50 %), mientras que el menor número de especies e IndVal estuvo relacionado con la época lluviosa (Ll) (Cuadro II). Las especies con el mayor IndVal del G1 (Placoma regulare, Vaucheria bursata y Nostoc parmelioides) mostraron una preferencia por aguas oligotróficas y una alta especificidad (CH y TR). Se reconoció una especie detectora, Prasiola mexicana, que mostró un IndVal variable y una preferencia por agua oligotrófica, aunque puede ser tolerante a la presencia de NID y FRS (presente en G1 y G2). Finalmente, el G3 formado por Phormidium autumnale, fue específico de los dos sitios de la zona urbana con alta concentración de nutrientes (CA y ES).
DISCUSIÓN
La riqueza específica de las algas bentónicas corresponde a los reportes anteriores en el río Magdalena (Ramírez et al. 2001, Ramírez y Carmona 2005, Bojorge et al. 2010), 22 especies (63 % de las especies de diatomeas y macroalgas) se registraron en al menos dos épocas del estudio, lo cual puede estar relacionado con una relativa estabilidad espacial y temporal de las comunidades. Asimismo, el periodo seco frío presentó la mayor abundancia (reflejada a través del valor indicador) de diatomeas y de algas macroscópicas en la cuenca alta (CH-TR [G1]) y media (3D-2D [G2]), lo que sugiere una afinidad con floras de regiones templadas o ríos de alta montaña (Sheath y Cole 1992, Bojorge et al. 2010). El efecto erosivo que ejerce el flujo de agua sobre el sustrato y la disolución de algunos de los nutrientes por el incremento de volumen de agua en el río puede explicar la diferencia en la riqueza específica y su abundancia entre épocas (Biggs 1996, Cantonati y Spitale 2009): 57 % de las especies se registraron en la época de lluvia y el 94 % de las especies en el periodo seco cálido y/o seco frío. Cabe mencionar que Cymbella mexicana y Navicula gregaria fueron exclusivas de la época lluviosa y, de acuerdo con los reportes previos (Cox 1995, Bahls 2007), podrían incluirse en el grupo de especies que se ven favorecidas por el flujo de corriente alta, tal como Achnanthidium minutissimum y Diatoma mesodon (Kelly 2002, Potapova 2009). La dinámica de la comunidad y el valor indicador de las especies fueron congruentes y confirman a los sitios del G1 (CH y TR) como referentes de buena calidad ambiental. El ACC resaltó la importancia de evaluar parámetros fisicos y químicos (temperatura del agua y velocidad de corriente) distintos a los micronutrientes y al oxígeno, los cuales generalmente son el referente ambiental para determinar la calidad de agua en los sistemas acuáticos mexicanos (NOM 1994).
El IndVal estableció tres categorías de especies relacionadas con la calidad del agua. La primera categoría (G1) reunió ocho especies: dos de algas macroscópicas y seis diatomeas típicas de sitios oligotróficos (CH y TR), y en un 50 % coincide con descripciones previas de ríos fríos de alta montaña y agua poco mineralizada (León-Tejera et al. 2003, Potapova et al. 2004, Soininen et al. 2004, Tornés et al. 2007, Ramírez et al. 2007, Bojorge et al. 2010). Las excepciones fueron Navicula minuscula, Navicula rhynchocephala, Nitzschia incospicua y Staurosirella pinnata, las cuales se describen en una amplia variedad de ríos y con tolerancia a la contaminación, por lo que son especies tolerantes. La segunda categoría, con 15 especies de diatomeas consideradas como detectoras, mantuvieron su abundancia con el incremento de nutrientes y son referidas en la literatura como tolerantes a la contaminación (Potapova et al. 2004). Los sitios de esta categoría (G2: 3D y 2D) presentan actividad recreacional evidente, razón por la cual podrían ser considerados de transición entre el área conservada (G1: CH y TR) y la zona con influencia humana (G3: CA y ES). En particular, se ha reportado a Diatoma mesodon y Prasiola mexicana como habitantes frecuentes de ríos oligotróficos a mesotróficos en la Faja Volcánica Trasnmexicana, los cuales presentan como principal característica, baja temperatura del agua y flujo de agua continuo (Bojorge et al. 2010). La tercera categoría incluyó cinco especies con amplia tolerancia a la contaminación en los sitios de la cuenca baja en la zona urbana (CA y ES). La mayor abundancia de Fistulifera saprophila, Nitzschia minuta, Nitzschia palea, Nitzschia recta y Phormidium autumnale coincidió con los reportes previos de estas especies (Lobo y Kobayasi 1990, Van Dam et al. 1994, Kelly y Whitton 1998, Chevalier et al. 2000, Tornés et al. 2007, Loza et al. 2013). Es importante mencionar que los individuos que determinamos como Phormidium autumnale, se encuentran relacionados con una serie de características morfológicas y ecológicas atribuidas a un complejo de especies (Komárek y Anagnostidis 2005, Comte et al. 2007, Strunecky et al. 2010). Para confirmar la identidad taxonómica de estas poblaciones, se requieren futuros estudios de fisiología, genética molecular y ultraestructura (Palinska y Marquardt 2008).
Para propósitos prácticos de la evaluación de la calidad del agua, es importante tener en cuenta que las diferencias observadas en las respuestas de las especies justifican la necesidad de estudios regionales (Licursi y Gómez 2003, Potapova et al. 2004, Besse-Lototskaya et al. 2011). En varios países de América del Norte y Europa, los ríos son monitoreados en un número significativo de segmentos que pueden exceder los 145 sitios (Rimet et al. 2004, Birk et al. 2006, Tornés et al. 2007, Johnson et al. 2009). No obstante el bajo número de sitios incluidos en la muestra del presente trabajo, se han establecido los sitios de referencia de buena calidad ambiental y los más contrastantes en la región que aparecen alterados por las actividades humanas. Es necesario incrementar el número de sitios de muestreo (Prat y Munné 2014), para observar la sensibilidad de los resultados de este estudio. En consecuencia, la aproximación metodológica utilizada se propone como una estrategia para obtener el valor indicador de las especies y como el primer paso que permita el seguimiento a largo plazo a través de un índice biológico para el río Magdalena. La aproximación a través del valor indicador posibilitó definir la importancia de las especies en relación con su respuesta en las diferentes condiciones ambientales del río y, por tanto, ser un referente de comparación regional.











 nueva página del texto (beta)
nueva página del texto (beta)


