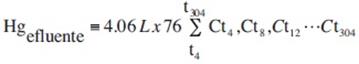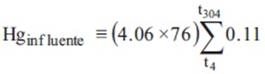INTRODUCCIÓN
Entre los problemas que enfrenta la sociedad actual destacan los relacionados con la contaminación del agua por la magnitud y diversidad que presentan. Como parte de éstos, la contaminación con metales pesados (MP) constituye una de las principales amenazas por su alta toxicidad y persistencia en el ambiente (Rajaganapathy et al. 2011, CONAGUA 2014). Dentro de los metales contaminantes sobresale el mercurio por su alta interacción con moléculas orgánicas en la cadena trófica y por sus características físicas y químicas que dificultan su control, manejo y tratamiento (Pirrone y Mahaffey 2005, Porto et al. 2005, Fu y Wang 2011).
Existen numerosas prácticas industriales que liberan mercurio al ambiente, tales como la minería, la producción de compuestos clorados e hidróxido de sodio, el tratamiento de residuos y la industria automotriz (Hylander y Goodsite 2006, Fu y Wang 2011). A pesar de ello, no se cuenta con sistemas para su tratamiento en aguas residuales, que sean tanto eficientes como asequibles para la mayoría de las poblaciones. En este sentido, los humedales artificiales (HA) pueden ser una alternativa, en especial en países en vías de desarrollo, dado sus bajos costos de instalación, operación y mantenimiento. Diversos estudios han demostrado su efectividad en la remoción de MP por la interacción biológica que se da entre organismos (autótrofos y heterótrofos) y el medio de empaque (Cheng et al. 2002). En efecto, Anjum et al. (2012) y Lominchar et al. (2015) reportan altas cantidades de mercurio en las especies de Phragmites australis y Typha dominguensis presentes en humedales naturales. Además, recientemente se han investigado microorganismos procarióticos que presentan tolerancia a los MP, lo que plantea la posibilidad de utilizar HA inoculados con cepas metalotolerantes para la remoción de mercurio en aguas residuales.
Con base en lo anterior, el presente estudio tuvo como objetivos analizar la acumulación y la distribución de mercurio removido por el carrizo (Phragmites australis) como barrera biológica en un sistema de HA y su interacción con bacterias tolerantes a MP, lo que permitirá conocer la factibilidad técnica de utilizar estos sistemas para reducir la contaminación de aguas residuales.
MATERIALES Y MÉTODOS
Condiciones y características experimentales
Se utilizaron nueve humedales artificiales (HA) a escala de laboratorio construidos con cilindros de cloruro de polivinilo de 39 cm de altura y 20 cm de diámetro. Los contenedores fueron llenados con roca volcánica denominada tezontle con diámetro de partícula de 4.2 mm y porosidad de 38 %, según las especificaciones de la Agencia de Protección Ambiental de los Estados Unidos (USEPA, por sus siglas en inglés, 2000). En ellos, se mantuvo una columna de agua de 5 cm por debajo del nivel del tezontle, lo que resultó en un volumen de llenado de 4.06 L y una relación altura/diámetro de 1.7, proporciones sugeridas para este tipo de sistemas a escala de laboratorio (Wood 1995, Winter y Goetz 2003, Puigagut et al. 2008). Seis de los nueve reactores fueron sembrados con la macrófita Phragmites australis, de los cuales tres fueron inoculados con un consorcio de cepas bacterianas tolerantes a metales pesados (HAVI), mientras que otros tres no fueron inoculados (HAV). Los tres reactores restantes solamente contenían el medio de empaque (tezontle) y se consideraron como testigos (HC). Así, se contó con tres réplicas para cada HA estudiado.
Los ejemplares de P. australis utilizados son procedentes del HA de viveros de Coyoacán, Ciudad de México, con las consideraciones fisonómicas requeridas para este tipo experimento, que son la altura de los tallos de aproximadamente 30 cm, longitud de las raíces alrededor de 10 cm y rizomas con cinco nudos (Kadlec y Wallace 2009). En esta etapa los rizomas y raíces de la vegetación de los tres HAVI fueron esterilizados con NaClO y C2H6O (De Souza et al. 1999) para que solamente contuvieran al consorcio bacteriano de interés.
Para la inoculación de los humedales HAVI, se empleó un consorcio microbiano conformado por bacterias del género Bacillus, que proviene de estudios previos a este trabajo por Salgado-Bernal et al. (2012). El inóculo tuvo una densidad de 4.5 x 107 UFC/mL, obtenido durante la fase estacionaria de los cultivos bacterianos.
Los nueve HA operaron durante 304 días con alimentación discontinua (por lotes) de agua sintética cada cuatro días. La composición de esta agua de alimentación fue similar a la composición de aguas residuales municipales, con la adición de mercurio (Cuadro I).
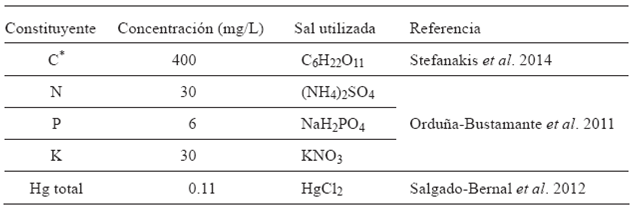
Cuadro I Composición química del agua residual sintética utilizada para la alimentación de los humedales durante el tiempo de operación
Al transcurrir los 304 días de operación, se extrajeron las seis plantas (una por humedal) y se separaron en su sección hipogea (rizomas y raíces) y epigea (hojas y tallos). Posteriormente, todas las muestras fueron secadas a 70 °C durante 24 h. Transcurrido este tiempo se pulverizó el material para el análisis del contenido de mercurio en las plantas y del material de soporte. Para ello, se realizó una digestión ácida según el procedimiento analítico de Allen (1990) y Dulski (1996) y se determinó la concentración de mercurio en cada una de las muestras obtenidas (vegetación, medio de empaque, influente y efluente) por espectrometría de absorción atómica con generación de hidruros, según el protocolo de USEPA (1996).
Acumulación y distribución de mercurio en la vegetación y otros compartimentos ambientales
Además de la vegetación, los posibles destinos ambientales del mercurio en los HA fueron el medio de empaque, el efluente (agua retirada del humedal una vez transcurridos los cuatro días de tiempo de recambio de agua o reacción) y el volatilizado. Por lo que para conocer el efecto real de la vegetación sobre la remoción del mercurio, se cuantificó el metal en cada uno de los compartimentos ambientales mencionados. Acorde con esto, se realizó un balance de masa considerando el volumen de cada HA uniforme (4.06 L) y los cambios de agua que fueron realizados cada cuatro días durante los 304 días de operación (76 recambios de agua en total). Finalmente, la masa total de mercurio determinada en el efluente de cada sistema se calculó con la siguiente ecuación:
donde: Hgefluente = masa total de mercurio en el efluente no acumulada ni volatilizada (mg), Ct = concentración determinada en el día de operación respectivo (mg/L).
Para el influente (agua de alimentación de los humedales incorporada en cada tiempo de recambio de agua), la concentración de mercurio fue siempre la misma (0.11 mg/L), por lo que la masa del metal influente se calculó con la siguiente ecuación:
donde: Hginfluente = masa total del metal en el influente (mg).
La masa total de mercurio acumulada en la parte aérea de las plantas (Hgepigea) se calculó al multiplicar la concentración del metal de cada muestra digerida (mg/kg), por su biomasa seca. La masa total en la parte radical (Hgvegetación hipogea) se determinó de la misma manera, al igual que la masa del mercurio total adherido al medio de empaque (Hgempaque). El mercurio volatilizado (Hgvolatilizado) se determinó teóricamente con la ecuación:
Análisis estadísticos
Para determinar las diferencias estadísticas entre los valores obtenidos para cada uno de los tres HA, se aplicó un análisis de varianza de un factor (mercurio acumulado) en conjunto con la prueba de rangos múltiples de Duncan. El grado de certeza de las pruebas fue del 95 % (a = 0.05). Previamente, se evaluó la normalidad y homogeneidad de los datos con la prueba de Kolmogorov-Smirnov, con el paquete Minitab 15.
RESULTADOS Y DISCUSIÓN
Acumulación y volatilización del mercurio en los humedales artificiales
La figura 1 muestra la cantidad de mercurio acumulado y volatilizado en cada uno de los sistemas evaluados. Con base en los cálculos realizados, ingresaron 33.94 mg de mercurio, de los cuales el sistema con carrizo e inoculación bacteriana (HAVI) acumuló 11.14 mg (± 1.01 mg), seguido por los sistemas con carrizo sin inocular (HAV) con 9.08 mg (± 0.92 mg). Por último, los sistemas que presentaron menor acumulación fueron los que sólo contenían el medio de empaque (HC) con 6.5 mg (± 0.63 mg). El análisis estadístico evidenció diferencias significativas entre los tres sistemas (P < 0.05), en el que también se obtuvo como resultado que los sistemas con vegetación fueron diferentes al que se encontraba solamente empacado con tezontle. Esta similitud y mayor acumulación en los sistemas HAVI y HAV se relaciona con la capacidad de la vegetación para acumular metales pesados. Al respecto, Patra y Sharma (2000), Clemens et al. (2002) y Clemens (2006) mencionan que los MP se ligan con los ácidos carboxílicos (uniones a malato y citrato) y los exudados radicales, lo que permite que atraviesen las membranas de la raíz y del rizoma para después ser precipitados en la vacuola y posteriormente trasportados por el xilema hacia las hojas y los tallos. En estos órganos de las plantas el mercurio puede encontrarse como especie orgánica, ya sea como metilmercurio o dimetilmercurio. Esta última se caracteriza por su alta volatilidad (Mason y Sulivan 1998, Kabatas-Pendias y Pendias 2001), lo cual podría relacionarse con el hecho de que los sistemas HAVI y HAV hayan transferido mayor cantidad de mercurio a la atmósfera en comparación con el sistema HC que no contenía vegetación (Fig. 1).
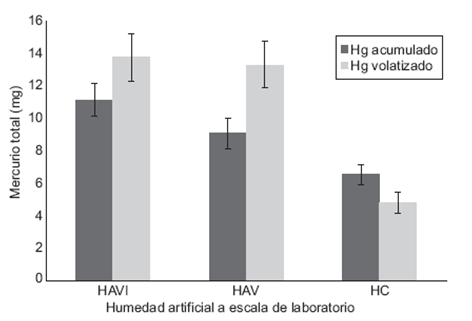
Fig. 1 Masa promedio de mercurio acumulado y volatilizado en cada uno de los sistemas de humedales artificiales evaluados. Se presenta la desviación estándar de las tres réplicas por sistema. HAVI = Humedal artificial con vegetación e inoculado, HAV = Humedal artificial con vegetación, HC = Humedal testigo (sin plantas ni inóculo)
Aunado a lo anterior, en solución acuosa, el dimetilmercurio sólo existe en condiciones neutras y oxidantes, que son precisamente en las que operaron los HA (Parequetti et al. 2004). Las condiciones fisicas y químicas del medio acuoso también dan lugar al mercurio en su estado elemental, el cual además del dimetimercurio, es la otra forma química del metal que tiende a volatilizarse debido a la presión de vapor (Kabata-Pendias y Pendias 2001, Ventura et al. 2005). Este hecho puede explicar que el sistema HC a pesar de no contener plantas ni bacterias, haya transferido a la atmósfera alrededor de 4 mg (± 0.45 mg) de mercurio al término de los 304 días de operación, aunque fue significativamente menor (P < 0.05) que la cantidad transferida por los sistemas con vegetación (Fig. 1).
Distribución del mercurio acumulado en los diversos compartimientos que integran los humedales artificiales
Los cuatro posibles destinos del mercurio ingresado en los HA son la vegetación, el medio de empaque, la evapotranspiración y el mercurio no removido en el efluente, según lo reportan Stottmeister et al. (2003). Al respecto, en la figura 2 se indica la distribución del mercurio al término de los 304 días de operación. Los sistemas HAVI y HAV presentaron similitud estadística (P > 0.05) en todos los compartimentos evaluados (Fig. 2a y 2b), lo cual puede estar relacionado con la capacidad que tienen las macrófitas emergentes para acumular cationes independientemente de la densidad y diversidad bacteriana presente en el sistema (Weis y Weis 2004, Sheoran y Sheoran 2006). En contraparte, la capacidad de acumulación de metales pesados que exhibe el material de empaque se encuentra en función de la cantidad de microorganismos asociados o adheridos a él, ya que en conjunto dan lugar a un bioadsorbente con capacidad de realizar intercambio iónico con los metales (Akar y Divriklioglu 2010, Zhang 2011). En efecto, el HAVI acumuló 7 % más de mercurio que el HAV (Fig. 2a y 2b). Este último contiene microorganismos convencionales asociados a la rizósfera, por lo que pudieron verse inhibidos y por ello, tener una menor capacidad de bioadsorción en comparación con los utilizados en el HAVI, tal y como lo describen Von Canstein et al. (1999) y Teitzel y Parsek (2003).
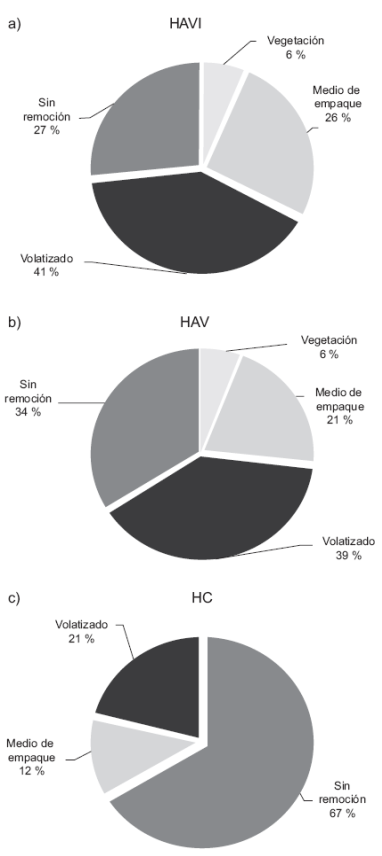
Fig. 2 Distribución del mercurio en humedales artificiales por compartimento ambiental. HAVI = Humedal artificial con vegetación e inoculado, HAV = Humedal artificial con vegetación, HC = Humedal testigo (sin plantas ni inóculo)
Con base en lo expuesto acerca de la acumulación de mercurio en la vegetación y el medio de empaque, era de esperarse que el sistema HC removiera significativamente menor cantidad del metal al compararlo con los sistemas con carrizo (P < 0.05). Estos últimos sistemas removieron 33 % del total ingresado, del cual el 21 % fue transferido a la atmósfera (Fig. 2c). Este fenómeno físico se relaciona con el gradiente de concentraciones que experimenta el mercurio metálico, que al igual que las formas metiladas del metal, se suscita en ambientes con condiciones similares a las de los HA utilizados (Von Canstein et al. 1999, Ventura et al. 2005).
Distribución del mercurio acumulado en Phragmites australis
La figura 3 muestra la distribución del mercurio acumulado en los carrizos de los sistemas HAVI y HAV. La raíz y el rizoma constituyen la sección radical de la planta en las que no se encontraron diferencias entre los dos HA (P > 0.05). No obstante, tanto la cantidad de mercurio en el tallo como en las hojas fue diferente de manera significativa para los dos HA (P < 0.05). En la figura 3a se señala que el HAVI acumuló significativamente mayor cantidad del metal en las hojas que en el tallo (P < 0.05). Por su parte, en la figura 3b se indica que la vegetación presente del HAV acumuló 48 % de mercurio en las hojas y 41 % en el tallo, sin diferencias significativas entre los dos (P > 0.05).
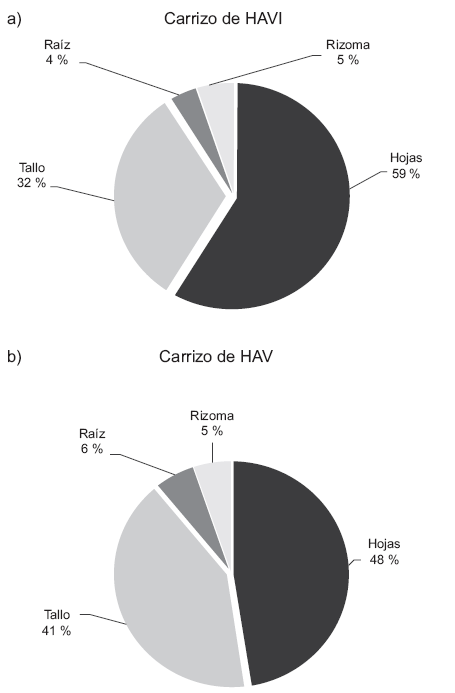
Fig. 3 Distribución de mercurio en Phragmites australis a 304 días de establecido el sistema. HAVI = Humedal artificial con vegetación e inoculado, HAV = Humedal artificial con vegetación, HC = Humedal control (sin plantas ni inóculo)
Cabe mencionar que independientemente de la diferente distribución de mercurio en los HA sembrados con carrizo (HAVI y HAV), ambos acumularon en la planta sólo el 6 % del mercurio total ingresado al sistema, tal y como se indica en la figura 2a y 2b.
La importancia que exhibió el carrizo como sistema de tratamiento de aguas residuales en los HA fue la capacidad de translocar el metal para propiciar su continua volatilización (Fig. 2). Acorde con LeDuc y Terry (2005) y Clemens (2006), se trata de un mecanismo de desintoxicación de algunos metales como el mercurio, que no tienen afinidad por la raíz, aunque también es dependiente de la especie vegetal (García-Gallegos et al. 2011).
CONCLUSIONES
Con base en los resultados del presente trabajo es posible concluir que Phragmites australis puede ser utilizada como barrera biológica para mercurio en HA sin que la presencia de las bacterias metalotolerantes influya sobre la remoción y acumulación del metal dentro del sistema. No obstante, los resultados también indicaron que la mayor proporción del mercurio removido es transferido a la atmósfera por volatilización, por lo que resulta necesario hacer una evaluación sobre los riesgos de contaminación atmosférica y de salud pública que pueda ocasionar la implementación de estos sistemas.
Finalmente, los datos generados en este estudio amplían el conocimiento sobre la factibilidad técnica de utilizar HA inoculados con bacterias tolerantes a metales para el tratamiento de aguas residuales con contenido de mercurio, por lo cual es conveniente realizar el estudio a escala piloto para su posterior análisis de factibilidad técnica-económica.











 nueva página del texto (beta)
nueva página del texto (beta)