Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista internacional de contaminación ambiental
versión impresa ISSN 0188-4999
Rev. Int. Contam. Ambient vol.31 no.4 Ciudad de México nov. 2015
Caracterización y recuperación de sales de cromo hexavalente de un pasivo ambiental
Characterization and recovery of hexavalent chromium salts from a hazardous waste site
Agustín Alexander Rangel Cordova1*, Eloy Isarain Chávez1 y María Maldonado Vega2
1 Centro de Innovación Aplicada en Tecnologías Competitivas (CIATEC), Omega 201, Fraccionamiento Industrial Delta, León, Guanajuato, México, C.P. 37545 *Autor para correspondencia: r.cordova.alexander@gmail.com
2 Hospital Regional de Alta Especialidad del Bajío, Bulevard Milenio 130, San Carlos la Roncha, León, Guanajuato, México, CP. 37660
Recibido noviembre 2014;
aceptado marzo 2015
Resumen
La presente investigación exploró diferentes soluciones de lavado con la finalidad de llevar a cabo la recuperación de cromo hexavalente a partir de un residuo industrial regulado por la NOM-147-SEMARNAT/SSA1-2004. El tratamiento consistió en un muestreo aleatorio simple así como su caracterización fisicoquímica, teniendo como base la alta solubilidad de la especie hexavalente de cromo. Posterior a ello se realizaron una serie de lavados utilizando cinco diferentes disoluciones (agua, ácido sulfúrico, ácido cítrico, hidróxido de sodio e hidróxido de calcio). Con la finalidad de optimizar recursos, se empleó un diseño factorial 32 cuyos resultados muestran una eficiencia del 80 % en remoción de cromo hexavalente y por tanto una recuperación de 33 g/kg como CaCrO4 (cromato de calcio). La concentración del Cr+6 presente en los lixiviados fue cuantificada por espectrometría de UV-Vis a una λ = 540 nm mientras que en la caracterización de las sales recuperadas por evaporación se empleó la técnica de fluorescencia de rayos X. Se determinó que las sales recuperadas pueden ser utilizadas como materia prima de uso industrial ya que sus principales elementos son Cr, Ca, Fe, y Mg, cuya concentración está en función de la disolución de lavado.
Palabras clave: cromo, residuos, lixiviado, tratamiento, recuperación.
Abstract
The purpose of this study was to examine a diverse group of washing solutions for its use in the recovery of the industrial waste hexavalent chromium, in compliance with the Mexican regulation NOM-147-SEMARNAT/SSA1-2004. The recovery process consisted of a simple random sampling and a physical-chemical characterization with consideration to the high solubility of hexavalent chromium compounds. A test was performed which implemented five different washing solutions (water, sulfuric acid, citric acid, sodium hydroxide, calcium and hydroxide). This was followed by a factorial experimental design to optimize resources with a removal efficiency of 80 % and hence a recovery of 33 g/kg as CaCrO4 (calcium chromate). Chromium hexavalent concentration in the leachate was quantified using UV-Vis spectrometry at a wavelength λ = 540 nm, while the salts recovered by evaporation were characterized using XRF analysis, leading to the conclusion that precipitate can be used as raw material, the main elements are Cr, Ca, Fe and Mg, and their concentration depends on the washing solution.
Key words: chromium, wastes, leachate, treatment, recovery.
INTRODUCCIÓN
En los últimos años el desarrollo industrial ha provocado un incremento en la generación de agentes contaminantes en el ambiente, prueba de ello son los procesos metalúrgicos como es el caso de la industria del cromo (USEPA 2000). Este metal se encuentra entre los primeros 20 elementos más abundantes en la corteza terrestre con una presencia de 100 (μg/g (Miller 1992). El Cr es explotado primordialmente en forma de cromita (FeCr2O4) (Volke et al. 2005). Durante el procesamiento de la cromita se generan compuestos de Cr+6 en las formas de cromato y dicromato, cuyos usos van dirigidos a las industrias metalúrgica (65 %), de aislantes (18 %) y química (17 %). En el primer caso se utilizan menas con óxido de cromo (III) (Cr2O3) mayores al 48 % y una relación Cr2O3/FeO > 3, con contenidos de S y P < 1 %. La industria química tiene una carga de Cr2O3 > 44 %, FeO < 14 %, SiO2 < 5 %, mientras que la industria de aislantes tiene la siguiente composición: Cr2O3 > 32 %, SiO2 < 6 % y CaO < 1 % (Vassallo 2008). Por otra parte, los compuestos de Cr+6 con mayor importancia industrial son el dicromato de potasio (K2Cr2O7) y el óxido de Cr+6 (CrO3), para la generación de metalizados, pinturas, pigmentos y recubrimientos plásticos, en tanto que el dicromato de sodio (Na2Cr2O7) y los sulfatos básicos de Cr son utilizados en el curtido de pieles, catalizadores y conservadores de madera (Miller 1992, Albert 1997).
El uso intensivo de sales de Cr en diversas industrias ha generado una enorme demanda y por ende un gran problema ambiental pues la exposición a este metal y a sus residuos muestran efectos nocivos a los organismos siendo el más tóxico el Cr+6 (INE 2009). Por lo anterior, la legislación en materia de regulación del Cr+6 lo clasifica como irritante, alérgeno y cancerígeno. Las vías más importantes de exposición a estos compuestos son la dérmica, la respiratoria y la gastrointestinal (Dayan y Paine 2001, Rangel y Maldonado 2014).
En México, el Cr+6 es uno de los 12 metales pesados regulados por la Norma Oficial Mexicana NOM-147-SEMARNAT/SSA1-2004 y como residuo peligroso por la NOM-052-SEMARNAT-2005. Datos de la Procuraduría Federal de Protección al Ambiente (PROFEPA, informe 1995-2000) muestran 61 sitios contaminados por metales pesados en México. De manera particular, en el estado de Guanajuato se identifican seis sitios contaminados con metales pesados o metaloides, dos con prioridad tipo "A", la de mayor relevancia, dos con prioridad "B" y dos de carácter "C" (Volke et al. 2005). Por otra parte se estima que existen en el país, 7336 empresas con un total de 43 242 personas involucradas en actividades donde se utilizan compuestos con Cr+6 (Rangel y Maldonado 2014).
Uno de los casos relacionados con la contaminación por dispersión de Cr+6 fue la empresa Cromatos de México S.A de C.V, ubicada en el estado de México, la cual operó de 1958 a 1978 con una producción aproximada de 12 ton/día de Na2CrO4 (cromato de sodio) y 1 ton/día de K2Cr2O7 (dicromato de potasio). Los residuos de dicha empresa con Cr+6 ascienden a 400 000 ton que fueron dispuestas al aire libre dentro de las instalaciones de la industria. Estos residuos, al contener aniones cromato (CrO42-) y (HCrO4) o dicromato (Cr2O72-) se pueden lixiviar ya que son muy solubles y móviles a través del suelo (Stollenwerk y Grove 1985, Salem et al. 1989, Pantsar-Kallio et al. 2001, Stewart et al. 2003, Fonseca et al. 2011).
Autores como Adriano (2001) y Zayed y Terri (2003) concluyen que en la mayoría de los suelos el Cr estará presente como Cr+3. Bajo condiciones reductoras el Cr+6 será reducido a Cr+3 por reacciones de reducción y oxidación (redox) con especies inorgánicas u orgánicas (no húmicas) solubles en agua, como carbohidratos, proteínas o por reducción con sustancias húmicas del suelo. La reducción del Cr+6 a Cr+3 es dependiente del pH, magnificándose a pH bajos. Para suelos aerobios ligeramente alcalinos, la reducción del Cr+6 a Cr+3 es posible si el suelo contiene compuestos orgánicos para llevar a cabo la reacción redox (Bartlett y Kimble 1976, Jardine et al. 1999, Adriano 2001, Zayed y Terry 2003). Bajo ciertas circunstancias como secreciones en forma de ácido húmico, el Cr+3 puede oxidarse a Cr+6, generando efectos nocivos al ambiente (Salem et al. 1989, Pantsar-Kallio et al. 2001).
Una situación similar de residuos industriales que contienen óxidos de cromo en cerca de 400 000 ton ocurre en el estado de Guanajuato, generando un problema de dispersión de la contaminación por Cr+6. Estudios hidrogeológicos realizados por el Sistema Estatal de Información del Agua (SEIA), cercanos al área de disposición del residuo, demuestran que el área presenta una litografía de tipo aluvión, cuya granulometría causan un alto grado de permeabilidad por la heterogeneidad de la grava, arena y arcillas, aunado a la alta solubilidad que tiene el metal. Lo anterior representa riesgos en el suelo, mantos freáticos y cuerpos de agua de uso humano. Adicionalmente la zona presenta vientos de 0.5 a 3.6 m/s, lo cual facilita la dispersión de partículas con el metal hacia otras direcciones con efectos desconocidos a largo y mediano plazo a poblaciones cercanas, así como a los organismos vivos presentes en la región.
Estudios realizados por Armienta-Hernández y Rodríguez-Castillo (1995) muestran la presencia de Cr+6 en 11 de 12 muestras de suelo en un área de 10 km2 de la zona de disposición del residuo. Además de la afectación a siete pozos de un total de 30 monitoreados, con valores de 0.05 a 50 mg/L, algunos de ellos por encima del límite permitido (0.05 mg/L) por la NOM-127-SSA1-1994 (SSA 1996) de Cr total para agua potable.
A nivel mundial se han desarrollo diversas tecnologías de reducción y estabilización del Cr+6 (Cuadro I), basadas en la conversión del Cr de un estado de oxidación al de reducción. Lo más común en lixiviados es llevar a cabo la reducción mediante iones ferroso, compuestos de sulfuro o compuestos orgánicos como ácido ascórbico, ácido cítrico, carbohidratos y ácidos húmicos (Eary 1988).
En ninguno de los tratamientos de residuos que contienen Cr+6 se consideran los subproductos generados, cuya mayoría corresponden a emisiones de productos ácidos y corrosivos. Debido a esta problemática y considerando que el volumen total a tratar es de 400 000 ton, en este trabajo se presenta una alternativa sustentable de recuperación de sales de Cr+6 mediante el lavado del residuo y su posterior evaporación disminuyendo el consumo de reactivos químicos para cumplir la normativa, y de ser posible, obtener un beneficio a partir del material recuperado.
MATERIALES Y MÉTODOS
El residuo industrial fue muestreado aleatoriamente en 12 puntos del pasivo ambiental ubicado en el municipio de San Francisco del Rincón, Guanajuato a una profundidad de 0 a 15 cm. La cantidad total de material recolectado fue aproximadamente de 10 kg. Las muestras del residuo industrial fueron homogeneizadas y se determinaron sus características fisicas y químicas conforme a la Norma Oficial Mexicana NOM-147-SEMARNAT/SSA1-2004. La concentración inicial de Cr+6 se basa en reacciones redox donde el Cr+6 se oxida en medio ácido con la 1,5-difenilcarbazida a 1,5-difenilcarbazona reduciéndose a Cr+3 y formando un complejo rojo-violeta a una 1 λ = 540 nm. Las lecturas se hicieron en un espectrofotómetro Evolution 300 UV-Vis (Thermo Scientific®).
Se aplicaron lavados al residuo con agua desionizada, así como cuatro diferentes disoluciones: ácido cítrico, ácido sulfúrico, hidróxido de sodio e hidróxido de calcio a una concentración del 1 % y una relación solvente-residuo de 1:1 (100 g/100 mL). Se realizó la comparación del tratamiento en caso de utilizar un lavado contra dos, para estos ensayos se emplearon 5 g de residuo y 250 mL de agua desionizada. En el caso del segundo tratamiento, el volumen total se dividió en las dos etapas (125 mL para cada una). El tiempo de tratamiento también fue modificado, en uno de ellos se realizó en un intervalo de 10 min y en el otro fue dividido en un intervalo de 30 min. De manera adicional se realizó un análisis de la cinética de liberación del cromo para conocer el punto de saturación del tratamiento.
Los reactivos de grado analítico fueron suministrados por tres fabricantes (Karal®, Fluka® y Kem®). Todas las disoluciones fueron preparadas con agua Millipore Elix 5® con una conductividad < 1 μS/cm. El pH en todos los ensayos fue determinado mediante un potenciómetro Thermo OrionStar®. En esta etapa se realizaron los mismos tratamientos que en los ensayos anteriores pero incrementando la capacidad del tratamiento a 1 kg para cuantificar la concentración de Cr+6 en el remanente presente en el residuo industrial después del lavado.
Derivado de estos análisis fue seleccionado el disolvente con mayor arrastre y se utilizó un diseño factorial 32 para obtener su optimización mediante el seguimiento del Cr+6. Como variable de respuesta a minimizar fue el Cr remanente mientras que el valor a maximizar fue la sal recuperada. Los niveles de diseño fueron bajo, medio y alto, de 1:5, 1:10 y 1:20 para la relación residuo/solución, mientras que para el tiempo de tratamiento los niveles fueron de: 10, 20 y 40 min. Se realizó un análisis de medias y un análisis de la mínima diferencia significativa (LSD, por sus siglas en inglés) de Fisher al 95 % de confiabilidad, así como un análisis de varianza multifactorial con el software Statgraphics XVI Centurion®. Los lixiviados obtenidos fueron evaporados para obtener las sales generadas derivadas de cada tratamiento. La caracterización de las especies químicas se hizo mediante un equipo de fluorescencia de rayos X (Fischerscope, XAN® 250), con lo que se determinó su composición elemental expresada en porcentaje.
RESULTADOS Y DISCUSIÓN
Caracterización fisica y química del suelo
Las características físicas y químicas del suelo se aprecian en el cuadro II, donde se muestra una concentración de al menos 9355 mg/kg de Cr+6,lo cual excede 18 veces el valor limite establecido en la NOM 147 - SEMARNAT/SSA1-2004 para suelos industriales (510 mg/kg). Por otra parte, se aprecia que el 58 % de las partículas poseen tamaños mayores a 10 mm, lo que dificulta el proceso de lavado si se piensa en un sistema de tratamiento a gran escala. Estos resultados corroboran la fuerte dependencia del pH en reacciones redox según lo descrito por autores como Bartlett y Kimble (1976) y Adriano (2001) donde en condiciones neutras el Cr+6 existe como H2CrO4, HCrO4- y CrO4-2 con valores de pK de 0.86 (reacción 1) y 6.51 (reacción 2).

Dado que el ión CrO4-2 es la especie predominante a pH > 6.5, estos resultados sirven como punto de partida para la selección de la disolución de lavado así como para inferir cuáles son los compuestos químicos de Cr+6 presentes en el evaporado, ya que en condiciones ácidas se favorecerá la presencia del H2CrO4 (Beattie y Haight 1972).
Cinética de liberación de Cr+6 en lavados con agitación y sin agitación
Los resultados del ensayo con un sólo lavado tuvieron menor eficiencia en la liberación del Cr+6. En este caso se obtuvieron 21.9 mg en 50 min, mientras que en los ensayos de dos lavados (intervalo de 10 min) se recuperaron 31.9 mg, lo que representa un incremento de 12.4 %. Estos datos se interpretan como saturación para el primer caso, con la ventaja de que el segundo lavado completa el arrastre de iones de Cr favoreciendo su recuperación. Al utilizar un sólo lavado se tiene un rápido arrastre de Cr+6 que va de un 30 a un 50 % de la concentración inicial en el residuo, el tiempo de saturación del medio ocurre a los 40 min, lo que provoca una alta concentración de Cr+6 remanente en la muestra. Por otra parte, el tratamiento con dos lavados (intervalo de 30 min) presenta una rápida extracción de hasta 24.8 mg (56 %) durante los primeros 10 min y en el segundo lavado a los 30 min se aprecia una alta concentración en la extracción con un incremento de 8 mg (18 %). Probablemente este comportamiento es causado por la interacción física de las partículas, que al encontrarse en un ambiente más compacto provocan una mayor liberación del metal. A pesar de que un volumen superior evitaría la rápida saturación del solvente, también otorgaría mayor espacio entre las partículas del residuo por lo que la liberación del Cr sucedería únicamente en función de su solubilidad. Finalmente, la eficiencia global en el arrastre del contaminante mediante este método demostró un aumento considerable en la remoción con un valor de 32.8 mg cercano al 74 %.
Lavados del residuo con diferentes disoluciones
Los resultados obtenidos en las pruebas se presentan en la figura 1, donde la mayor concentración de Cr+6 en el lixiviado corresponde al lavado con solución de H2SO4. Seguido por las disoluciones alcalinas, las que no muestran una diferencia significativa pese a la disponibilidad de distintos iones de cada disolución como se aprecia para el Ca(OH)2 o el NaOH. Lo anterior indica una débil interacción de estas especies con el metal de interés. En el caso del C6H8O7 (ácido cítrico) este parece tener una baja eficiencia en el arrastre de cromo. Sin embargo, este resultado puede deberse a que el ácido cítrico no sólo disuelve el Cr soluble, sino que puede transformarlo a Cr+3 o a otras formas debido a su potencial redox, provocando que no sea cuantificado (Xing ru et al. 2012).

Es de destacar la coloración amarilla para los lavados con agua y con soluciones alcalinas, las cuales forman iones cromato (HCrO4- y CrO4-2) mismos que le confieren ese color amarillo "fosforescente" característico. Mientras que las soluciones ácidas producen un color naranja causado por la polimerización del HCrO4- para formar el ión dicromato (Cr2O7-2) lo cual concuerda con lo reportado por Beattie y Haight (1972) conforme a la reacción 3.

Concentración de Cr+6 en el remanente del residuo industrial
Como se puede apreciar en la figura 2, la disolución de H2SO4 es la que mayor capacidad de arrastre posee, con la concentración de cromo más baja en el residuo (2059 mg/kg). Mientras que para las disoluciones alcalinas se consiguen concentraciones parecidas, donde las más altas corresponden a 2845 mg/kg para el NaOH y 2891 mg/kg para el Ca(OH)2 lo que demuestra que son las menos eficientes en el proceso de lavado y arrastre del cromo.

El comportamiento en el caso de la solución de ácido cítrico corresponde con los datos anteriores, lo que confirma el carácter reductor de este ácido, donde las especies del Cr+6 o soluble son estabilizadas para formar especies menos solubles. Esto concuerda con las pruebas realizadas en residuos de limón por el Instituto Nacional de Ecología (INE 2009).
Influencia de las soluciones de lavado en el pH y en el porcentaje de arrastre de Cr+6
Como se mencionó anteriormente los compuestos de Cr+3 son muy estables en suelos, caso contrario para el Cr+6 el cual es fácilmente movilizado en condiciones acidas y alcalinas (Adriano 2001). De esta manera las sales de ácido crómico son fácilmente solubles en agua, mientras que en medio alcalino las especies son menos solubles (Bartlett 1991). Es por ello que en esta etapa se evalúo la influencia de las soluciones de lavado con el residuo original, el cual presentaba un pH de 9 y una humedad del 6.2 % debido a su exposición a la intemperie.
En el cuadro III, se presentan los valores promedio de pH en las soluciones de lavado, lixiviado y remanente, así como el porcentaje de líquido retenido y el de arrastre de Cr+6. Para la columna "pH solución", se ven las unidades propias de cada una, mientras que en la columna "pH lixiviado", se observa que el agua lixiviada tuvo un cambio de 1.9 unidades hacia valores alcalinos. Este efecto fue más notorio para las soluciones ácidas de H2SO4 y C6H8O7 las cuales varían 6.4 y 5.7 unidades de pH respectivamente. En cambio para las soluciones alcalinas la variación es menos significativa, 0.3 unidades de pH para el NaOH y 0.2 para el CaOH2.
Esta información refleja que el residuo posee una elevada capacidad de amortiguamiento al modificarse en fracciones menores a la unidad de pH en el remanente ya sea para las disoluciones alcalinas o ácidas, estas últimas además evidencian la presencia de carbonatos y bicarbonatos en la muestra.
Análisis factorial 32 para la solución de lavado del residuo
En la etapa del análisis factorial se evaluaron los factores tiempo y relación solvente/residuo y su interacción. Estos no mostraron una diferencia estadísticamente significativa respecto a las variables de respuesta como cromo residual y sales recuperadas con un nivel de confianza del 95 %. El valor de R2 es 92.34 para el primer caso y 93.7 para las sales, lo que indica un alto índice de variabilidad entre las respuestas.
En las figuras 3a y 3b se representan los diagramas de Pareto para los efectos implicados en la remoción de Cr, así como para la recuperación de sales a partir del residuo. Mientras que la figura 3c muestra el diagrama de los efectos principales, los cuales indican que a medida que el tiempo aumenta la concentración de Cr en el residuo lavado es menor. Por otra parte, en el caso de la recuperación de sales (Fig. 3d), la mayor cantidad se obtiene al incrementar el volumen del solvente en el tratamiento y al disminuir el tiempo de reacción.
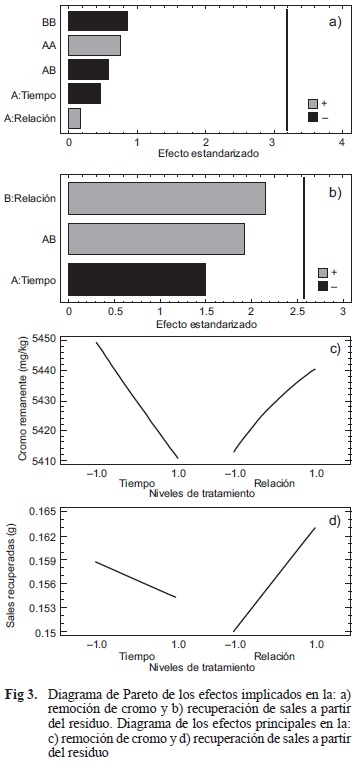
El cuadro IV muestra el resultado del análisis de medias donde se aprecian las diferencias significativas con un 95 % de confianza entre los valores utilizados para el tratamiento. En los dos casos mostrados se aprecia que no existe una diferencia significativa entre los niveles 5 y 10. Sin embargo, ambos difieren estadísticamente con los otros niveles.
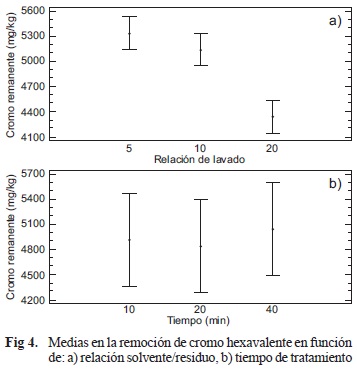
Para el análisis de varianza se determinaron disimilitudes entre los factores de los niveles establecidos, los cuales indican una diferencia significativa en la variable de respuesta causada por el factor relación solvente/residuo, con una repercusión poco significativa en la eficiencia del tratamiento pero sí en los recursos necesarios para ello. En el primer caso se señala una diferencia entre los niveles del tratamiento referidos a la remoción de Cr, donde la relación 1:20 posee un efecto mayor en el arrastre del metal, mientras que el tiempo no muestra una influencia significativa (Figs. 4a y 4b). De igual forma, la obtención de sales a partir del residuo muestra un mejor comportamiento si se utiliza un mayor volumen para realizar el lavado y al igual que en el caso anterior, el factor tiempo presenta una menor influencia en el tratamiento (Figs. 5a y 5b).

De esta manera se concluye que en la optimización de respuesta en el tratamiento por lavados, el factor determinante es la relación solvente/residuo cuyos valores aplicables están en función de la meta a minimizar. En este caso dicha meta es el Cr remanente con un valor óptimo en la variable de respuesta de 5394.73 mg/kg. Mientras que la meta a maximizar son las sales recuperadas con valores óptimos de 0.165 g por cada 5 g de residuo, lo que equivale a 33 g/kg. Estos valores óptimos quedan representados por los niveles altos de tiempo y la relación solvente/ sólido para ambos casos.
Caracterización de las sales evaporadas y de los residuos remanentes generados después del lavado
En la figura 6 se pueden apreciar los espectros de las especies arrastradas por lixiviación para diferentes medios. En primer lugar, se tiene la figura 6a que muestra la caracterización del residuo original con un bajo contenido de Cr (13.4 %) y un alto contenido de hierro (40.1 %) y calcio (45.1 %). La figura 6b corresponde al lavado con agua la cual presenta el mayor contenido de Cr recuperado con un 84.9 % y un 13.8 % de calcio, así como una pequeña fracción de magnesio. Seguido por el lavado de hidróxido de calcio con un 78.3 % en cromo y 21.6 % en calcio (Fig. 6d). Un porcentaje similar se logró para el tratamiento de lavado con la disolución de ácido sulfúrico con un 77.9 % de Cr y un 22 % en calcio (Fig. 6c). Estos datos corroboran lo reportado por Armienta-Hernández y Rodríguez-Castillo (1995), donde los lixiviados contienen sales cromadas principalmente de calcio, la cromita (CaCrO4) como el compuesto más probable.
Por otra parte las figuras 6e, 6f y 6g corresponden al análisis del residuo tratado con agua, disoluciones de ácido sulfúrico y disoluciones de hidróxido de calcio. En la primera de ellas se aprecia que el porcentaje más bajo corresponde al cromo, con un 9.6 %, mientras que en los tratamientos con ácido sulfúrico e hidróxido de calcio se tienen valores de 14 y 12 %, respectivamente. Estos resultados corresponden con lo obtenido en trabajos similares realizados por Xing ru et al. (2012), donde los compuestos de Cr+6 son fácilmente solubles en agua debido a la naturaleza de los iones negativos (aniones). Por otra parte, en condiciones de medio ácido o básico, suponemos que ocurrió una solubilización no específica (Davis 2000) por lo que el contenido total de Cr es mayor.
CONCLUSIONES
Debido al tamaño así como a la irregularidad del material se debe considerar un preproceso de molienda y tamizado con el objetivo de homogeneizar el tratamiento para la recuperación de Cr+6.
El fierro es un elemento presente en las muestras del residuo, pero no exhibe una interacción con las disoluciones del lavado ni con las sales de Cr. No así para el pH de las disoluciones ya que este parámetro afecta fuertemente la reducción del Cr+6 a Cr+3 y con ello la generación del tipo de sales.
Con lavados de agua en dos etapas en un tiempo de entre 20 y 30 min se recupera hasta el 75 y 80 % del cromo presente en el residuo. Al comparar los lavados de agua contra los de disoluciones ácidas, ambos mostraron resultados parecidos por lo que la relación solvente/residuo resulta ser el elemento de mayor impacto por costos y volumen. Esta información demuestra que el arrastre por agua favorece la generación de sales cromadas de calcio, con posibilidades de revalorarlas como materia prima para uso industrial.
Con lavados de agua en dos etapas se consiguen extracciones de Cr+6 del 75 % ± 5 en 20 y 30 min, mientras que con extracciones de una sola etapa se consigue un 55 %. Aunque se recupera una porción importante de cromo hexavalente, este proceso no es suficiente para obtener un suelo estable de acuerdo con la NOM-147-SEMARNAT/SSA1-2004. Además, el uso de un segundo lavado implica un alto consumo de agua y un mayor volumen de lixiviado.
La revaloración de residuos industriales para recuperar el Cr+6 aprovechando su propiedad química de alta solubilidad es una alternativa para tratar grandes cantidades de residuos industriales reduciendo la dispersión del contaminante hacia el suelo, aire y agua, lo cual mejora el entorno donde se localizan pasivos ambientales.
AGRADECIMIENTOS
Al CIATEC por el apoyo a través del proyecto 0FBC01401 "Caracterización del sitio denominado: depósito de residuos industriales de cromo". Al Dr. Juan José Peña Cabriales y al Dr. Juan Ramiro Pacheco Aguilar por su invaluable tiempo y asesoría en la mejora y desarrollo del artículo.
REFERENCIAS
Adriano D.C. (2001). Chromium. Trace elements in the terrestrial environment: biogeochemistry, bioavailability, and risks of metals. 2da ed. Springer-Verlag, Nueva York, EUA, 867 pp. [ Links ]
Albert L.A. (1997). Cromo. En: Introducción a la toxicología ambiental (L. Albert, Ed.) Centro Panamericano de Ecología Humana y Salud. Metepec, Toluca, México, pp. 46-227. [ Links ]
Armienta Hernández M.A. y Rodríguez Castillo R. (1995). Environmental exposure to chromium compounds in the Valley of León, Mexico. Environ Health Persp. 103, 47-51. [ Links ]
Bartlett R.J. y Kimble J.M. (1976). Behavior of chromium in soils: II. Hexavalent Forms. J. of Environ. Qual. 5, 383-386. [ Links ]
Bartlett R.J. (1991). Chromium cycling in soils and water: links, gaps and methods. Environm. Health Persp. 92, 17-24. [ Links ]
Beattie J. K. y Haight G. P. (1972). Chromium (VI). Oxidations of inorganic substrates. Progress in Inorganic Chemistry. Inorg. React. Mech. 17, 93-145. [ Links ]
Davis A.P. (2000). Chemical and engineering aspects of heavy metal-contaminated soils. Rev. Int. Contam. Ambient. 16, 169-174. [ Links ]
Dayan A.D. y Paine A.J. (2001). Mechanisms of chromium toxicity, carcinogenicity and allergenicity: Review of the literature from 1985 to 2000. Hum. Exp. Toxicol. 20, 439-451. [ Links ]
Eary L.E. y Dhanpat Rai (1988). Chromate removal from aqueous wastes by reduction with ferruos ion. Environ. Sci. and Technol. 22, 972-977. [ Links ]
Fonseca B., Figueiredo H., Rodrigues J., Queiroz A. y Tavares T. (2011). Mobility of Cr, Pb, Cd, Cu and Zn in a loamy sand soil: A comparative study. Geoderma 164, 232-237. [ Links ]
INE (2009). Estudio de pruebas piloto para el tratamiento de los residuos peligrosos de cromatos de México mediante la aplicación de sulfuro de sodio. Instituto Nacional de Ecología. Informe técnico. México, 124 pp. [ Links ]
Jardine P.M., Fendorf S.E., Mayes M.A., Larsen I.L., Brooks S.C. y Bailey W.B. (1999). Fate and Transport of Hexavalent Chromium in Undisturbed Heterogeneous. Soil. Environ. Sci. Technol. 33, 2939-2944. [ Links ]
Miller N.J. (1992). Chromium. Techniques and instrumentation in analytical chemistry. En: Hazardous metals in the environment. (M. Stoeppler, Ed.). Elsevier, Amsterdam, Holanda, 540 pp. [ Links ]
Pantsar-Kallio M., Reinikainen S.P. y Oksanen M. (2001). Interactions of soil components and their effects on speciation of chromium in soils. Anal. Chim. Acta. 439, 9-17. [ Links ]
Rangel A.A. y Maldonado M. (2014). Cromo hexavalente en la industria: Repercusiones a la salud y medidas de control. REMESAT. 6, 77-84. [ Links ]
Salem F.Y., Parkerton T.F., Lewis R.V, Huang J.H. y Dickson K.L. (1989). Kinetics of chromium transformations in the environment. Sci. Total Environ. 86, 25-41. [ Links ]
SCFI (2006). Norma Mexicana NMX-AA-132.SCFI-2006. Muestreo de suelos para la identificación y la cuantificación de metales y metaloides, y manejo de la muestra. Secretaria de Comercio y Fomento Industrial. Diario Oficial de la Federación. 5 de septiembre de 2006. [ Links ]
SEMARNAT (1993). Norma Oficial Mexicana NOM-052-SEMARNAT-2005. Que establece las características, el procedimiento de identificación y los listados de los residuos peligrosos. Secretaria de Medio Ambiente y Recursos Naturales. Diario Oficial de la Federación. 22 de octubre de 1993. [ Links ]
SEMARNAT/SSA (2004). Norma Oficial Mexicana NOM-147-SEMARNAT/SSA1-2004. Criterios para determinar las concentraciones de remediación de suelos contaminados para arsénico, berilio cadmio, cromo hexavalente, mercurio, níquel, plomo, selenio, talio y vanadio. Secretaria de Medio Ambiente y Recursos Naturales. Diario Oficial de la Federación. 02 de marzo de 2007. [ Links ]
SSA (1996). Norma Oficial Mexicana NOM-127-SSA1-1994. Salud Ambiental. Agua para uso y consumo humano. Límites permisibles de calidad y tratamientos a que debe someterse el agua para su potabilización. Secretaría de Salud. Diario Oficial de la Federación. 18 de enero de 1996. [ Links ]
Stewart M.A., Jardine P.M., Barnett M.O., Mehlhorn T.L., Hyder L.K. y McKay L.D. (2003). Influence of soil geochemical and physical properties on the sorption and bioaccessibility of chromium (III). J. Environ. Qual. 32, 129-137. [ Links ]
Stollenwerk K.G., Grove D.B. (1985). Adsorption and desorption of hexavalent chromium in an alluvial aquifer near Telluride, Colorado. J. Environ. Qual. 14, 150-155. [ Links ]
USEPA (2000). EPA 625/R-00/004. In situ treatment of soil and groundwater contaminated with chromium. Technical Resource Guide. Office of Research and Development and EPA. Enviromental Protection Agency. Reporte Técnico. Cincinnati, EUA, 84 pp. [ Links ]
Vassallo L.F. (2008). Yacimientos minerales metálicos. 4a ed. Centro de Geociencias, UNAM. Querétaro, México, 388 pp. [ Links ]
Volke Sepúlveda T., Velasco Trejo J.A, y De la Rosa Pérez D.A. (2005). Suelos contaminados por metales y metaloides: muestreo y alternativas para su remediación. Instituto Nacional de Ecología. México D.F., 141 pp. [ Links ]
Xing-run W., Yan-xia Z., Qi W. y Jian-min S. (2012). Effect and removal mechanisms of 6 different washing agents for building wastes containing chromium. Scientific World Journal 2012, 1-8. [ Links ]
Zayed A.M. y Terry N. (2003). Chromium in the environment: factors affecting biological remediation. Plant Soil 249, 139-156. [ Links ]














