Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista internacional de contaminación ambiental
versión impresa ISSN 0188-4999
Rev. Int. Contam. Ambient vol.31 no.4 Ciudad de México nov. 2015
Evaluación preliminar de la reducción de microcistina-LR en muestras de florecimiento a través de sistemas sedimentarios
Preliminary assessment of the reduction of microcystin-LR in bloom samples through sedimentary systems
Natalia Andrea Herrera1*, María Teresa Flórez2 y Luis Fernando Echeverri1
1 Grupo de Química Orgánica de Productos Naturales, Facultad de Ciencias Exactas y Naturales, Universidad de Antioquia, Carrera 53 No. 52 - 59, Medellín, Colombia *Autor para correspondencia: nahelo241980@gmail.com
2 Grupo de Investigación en Gestión y Modelación Ambiental (GAIA), Universidad de Antioquia, Carrera 53 No. 52 - 59, Medellín, Colombia
Recibido septiembre 2014;
aceptado febrero 2015
Resumen
Las cianotoxinas son producidas por cianobacterias e incluyen las microcistinas, consideradas como las toxinas cianobacteriales (hepatotoxinas) más comunes. Niveles elevados de microcistinas pueden persistir en el ambiente durante varios días, lo que significa un riesgo para la salud y un reto para la gestión del servicio público. En este estudio se evaluó el efecto de la interacción entre la microcistina-LR (MC-LR) procedente de un florecimiento cianobacterial y el sedimento obtenido del embalse Riogrande II (Antioquia). Se observó una disminución de la concentración de microcistina-LR hasta niveles inferiores al límite de detección en presencia del sedimento. En muestras de agua sin sedimento la concentración de MC-LR se mantuvo constante (5.0 ± 0.1 μg/mL). Estos resultados se atribuyen a una posible adsorción por materiales sólidos o a la degradación de la MC-LR por acción biológica o química. Además, los datos indican que los sedimentos juegan un rol en la degradación de microcistinas en sistemas de agua dulce, proporcionando información importante que puede ser aplicada en estrategias de gestión para el mejoramiento de la calidad del agua.
Palabras clave: cianotoxinas, sedimentos, agua dulce, cianobacterias.
Abstract
Among toxins produced by cyanobacteria, the microcystins are the most common livertoxins. High levels of microcystins can persist in the environment for several days, which represents a hazard to human health, and a challenge for drinking water management. In this study, the effect of the interaction of microcystin-LR from a cyanobacterial bloom and sediment was evaluated. A decrease in the concentration of microcystin-LR was detected from the third day, and a decrease to below the detection limit was observed. Water samples without sediment concentration of MC-LR were held constant (5.0 ± 0.1 μg/mL) throughout the test. These results were attributable to a possible adsorption on solid materials or a probable degradation of MC-LR by chemical or biological action. In addition, the data indicate that sediments play an important role in the degradation of microcystins in freshwater systems, providing relevant information that could be applied to management strategies for improving water quality in lakes, reservoirs and other water bodies.
Key words: cyanotoxines, sediments, freshwater, cyanobacteria.
INTRODUCCIÓN
A través de su evolución las cianobacterias se han adaptado a casi todos los hábitats disponibles en la tierra, especialmente a los marinos y de agua dulce. Además, tienen la capacidad de crecer en fuentes de agua afectadas por actividades antrópicas y por el cambio climático (Paerl et al. 2011). Uno de los principales factores responsables de la proliferación de cianobacterias en el agua es el aporte de nutrientes derivados de las prácticas agrícolas modernas y de la descarga de aguas residuales. A nivel mundial se ha incrementado la temperatura, los flujos de los ríos varían ampliamente como resultado de la reducción de la capacidad regulatoria de los suelos y la calidad del agua se ha deteriorado (Paerl y Huisman 2009). Además, se ha favorecido la proliferación de cianobacterias en los sistemas de almacenamiento de agua para la potabilización en todo el mundo.
Las cianotoxinas, entre ellas las microcistinas (MCs), se encuentran frecuentemente en cuerpos de aguas y son altamente tóxicas (Zurawell et al. 2005) lo que puede afectar gravemente la salud humana (Bartram et al. 1999). Otros metabolitos producidos por las cianobacterias como el 2-metilisoborneol (MlB) y la geosmina le confieren sabores y olores desagradables al agua, adicionalmente estas sustancias se consideran perjudiciales en ambientes acuáticos.
Las microcistinas son heptapéptidos producidos por algunas cepas de cianobacterias como Microcystis, Anabaena, Planktothrix y Nostoc. Su estructura cíclica y estable presenta muchos desafíos a las plantas de tratamiento de agua que tienen una capacidad limitada para su eliminación (Himberg et al. 1989) y pueden provocar un aumento en el costo de tratamiento del agua. Aunque las microcistinas pueden ser removidas por adsorción con los sedimentos y degradadas física o biológicamente, su naturaleza cíclica las hace altamente estables y potencialmente recalcitrantes. Esta situación implica un peligro para los ambientes acuáticos y para los usuarios del recurso hídrico.
Las microcistinas son compuestos estables, resistentes a la oxidación, a la hidrólisis química, a las altas temperaturas y a los pH bajos (Harada et al. 1996, Metcalf et al. 2000). Las concentraciones de estas toxinas en la columna de agua de varios lagos eutróficos normalmente son mucho menores a los niveles estimados producidos por cianobacterias (Tsuji et al. 1996). La baja correlación entre la concentración de MCs en la columna de agua y la densidad celular ha inducido un gran interés (Sivonen y Jones 1999). Se han propuesto cinco vías para explicar las reducciones naturales en los niveles de microcistinas: la dilución, la adsorción por sedimentos, la descomposición térmica ayudada por el pH, la fotólisis y la degradación biológica (Tsuji et al. 2001). Entre estos cinco factores, se ha enfatizado la investigación sobre la dilución, la fotólisis y la degradación biológica como procesos de mejoramiento, pero no sobre los procesos de adsorción por los sedimentos o por descomposición térmica (Jones y Orr 1994, Welker y Steinberg 2000, Tsuji et al. 2001, Harada et al. 2004).
La mayoría de los estudios de degradación de cianotoxinas se han orientado principalmente a las microcistinas (Ho et al. 2012) en fuentes de agua potable (Jones y Orr 1994, Rapala et al. 1994, Christoffersen et al. 2002, Holst et al. 2003) y más recientemente en aguas residuales, lagunas y estanques de estabilización (Ho et al. 2010). Por otra parte, las microcistinas se biodegradan en suelos y sedimentos (Grutzmacher et al. 2009, Chen et al. 2010) donde la temperatura del agua puede ser un factor crítico en la biodegradación. Sin embargo, la tasa de degradación es afectada por varios factores ambientales, entre ellos la temperatura, los nutrientes (Surono et al. 2008) y la preexposición a microcistinas (Rapala et al. 1994, Ho et al. 2007). La vida media de las microcistinas por lo general oscila entre unas pocas horas a tres semanas en un ambiente natural (Holst et al. 2003, Ho et al. 2007). Otros metabolitos asociados a las cianobacterias como la geosmina y el MIB presentan un rango de temperatura entre 11 y 30 °C para su efectiva biodegradación.
Muchos de los metabolitos, entre ellos las microcistinas, no pueden ser eliminados a través de las prácticas convencionales de tratamiento de agua y requieren de técnicas costosas como el empleo de carbón activado o procesos de oxidación avanzada, que a su vez pueden presentar limitaciones. Varias guías de manejo de aguas establecen que es importante utilizar tratamientos multibarrera como una opción para asegurar que estos contaminantes no lleguen al producto final. Sin embargo, los suelos con un alto contenido de materia orgánica y de arcilla son más eficientes en la eliminación de microcistinas, probablemente debido a su alta capacidad de unión con sustancias orgánicas (Wu et al. 2011). Además, se conoce que las microcistinas son adsorbidas por superficies como la arcilla y el carbón activado. Esta capacidad de adsorción se ha aprovechado en la eliminación de microcistinas en aguas superficiales utilizadas para agua potable (Holst et al. 2003).
Durante los últimos 25 años los lodos han sido investigados en muchos países como un medio de remoción de florecimientos algales a través de la columna de agua (Chen et al. 2008). Una amplia variedad de estudios de laboratorio en sistemas estáticos han confirmado que los sedimentos pueden remover efectivamente células algales potencialmente productoras de microcistinas desde la columna de agua. Algunos estudios de laboratorio con especies de algas nocivas mostraron que minerales de arcilla son eficaces en la eliminación de las células de dicha columna (Sengco et al. 2001). El objetivo de este estudio trabajo fue evaluar, a través de sistemas estáticos y con agitación, la reducción en la concentración de microcistina-LR (leucina-arginina) por sedimentos nativos de la zona de estudio.
MATERIALES Y MÉTODOS
Sitios de muestreo
El florecimiento que contenía la toxina microcistina-LR (MC-LR) fue colectado en el embalse Porce II, en julio de 2011 cerca de la presa (6°48'18.88" N y 75°8'49.93" W) en la estación 12 donde se presentan florecimientos durante todo el año (Herrera et al. 2015). Dicho embalse se localiza en jurisdicción de los municipios de Gómez Plata, Yolombó y Amalfi, entre las coordenadas 75°09'14" - 75°04' 59" W y 6°44'57" - 6°48'45" N. El embalse está formado por dos ramales principales alargados (Río Porce y quebrada Guaduas), que se unen en un tercero limitado por la presa (quebrada La Cancana). Su propósito es generar energía eléctrica con una capacidad instalada de 392 mW.
El sedimento se sustrajo del brazo del Río Chico (6°30'34.128" N y 75°30'23.648" W) en el embalse Riogrande II, en julio de 2013. Este embalse tiene como principal función la potabilización y se ubica al noroccidente de Medellín, en jurisdicción de los municipios de Don Matías, San Pedro, Belmira, Santa Rosa de Osos y Entremos, entre 75°32'30': W - 75°26'10'' W y 6°33'50'' N - 6°28'07'' N. El embalse entró en operación en 1991, tiene un volumen total hasta la cota de vertedero (2270 msnm) de 240 millones de m3 y cubre un área media de 1214 ha, recibe las aguas de los ríos Riogrande y Chico y de la quebrada Las Ánimas, entre otras. La profundidad máxima del embalse es 47.2 m en condiciones de operación normal.
Recolección de la muestra de florecimiento
La muestra del florecimiento fue recolectada haciendo un arrastre durante cinco min en el punto de muestreo, usando una red de nylon de 20 μm de malla. La muestra se almacenó en frascos de plástico de 5 L, refrigerada y protegida de la luz y se transportó al laboratorio para su procesamiento. Esta muestra fue liofilizada y 1 g del material liofilizado fue diluido en 50 mL de agua y sometido a sonicación durante 15 min en un equipo Maxiclean 1600 Unique, posteriormente se centrifugó por 15 min a 4000 rpm (Centribio 80-2B). El sobrenadante fue empleado para la detección y cuantificación por cromatografía líquida de alta eficiencia con detector de arreglo de diodos (HPLC-DAD, por sus siglas en inglés) acoplada a espectrometría de masas en modo tándem (HPLC-MS/MS, por sus siglas en inglés)
Identificación del fitoplancton
Para la determinación de cianobacterias se tomaron seis litros de agua con una botella tipo Van Dorn y una submuestra de 250 mL en recipientes plásticos ámbar que se fijaron con 1 mL de solución de lugol al 1 %. Las muestras se agitaron 30 veces y se sedimentaron, siguiendo el método de Utermóhl. Un mL del precipitado se dispuso en una cámara de conteo de Sedgwick-Rafter y las observaciones al microscopio se realizaron según Ros (1979) por medio de un conteo de campos aleatorios con una magnificación total de 400X hasta completar 100 individuos del morfotipo más abundante o el conteo de 60 campos.
Muestra de sedimento
Se tomó un kg de sedimentos por medio de una draga Eckman. El material se almacenó en bolsas con sello previamente rotuladas y luego se refrigeró hasta su tratamiento en el laboratorio. A estos sedimentos se les realizó una descripción litológica (textura, color, olor y apariencia), análisis mineralógico (orgánicos, inorgánicos, silicofósiles y mixtos), granulometría, humedad, materia orgánica, carbono orgánico, carbono inorgánico, fósforo total, nitrógeno total kjeldahl (NTK), Fe, Mn, Ca, Na, K, Mg y Cr.
Para la obtención de los núcleos de sedimento se utilizó un nucleador de gravedad tipo UWITEC, el cual no causa distorsiones ni pérdidas del material colectado (Parra 2005). Con el fin de evitar deformaciones y daños del material durante el transporte, los núcleos de sedimento fueron sellados y almacenados en una cava a 4 °C para su preservación.
Uno de los núcleos tomados en el embalse fue abierto y cortado longitudinalmente con ayuda de una guillotina marca Dremel. Se fotografiaron y se describieron las características estratigráficas del núcleo, así como los rasgos dominantes como color, textura, presencia de materia orgánica, macrominerales, olor y apariencia. Una de las mitades de cada núcleo se guardó como testigo a 4 °C, el segundo núcleo se utilizó para el ensayo de reducción de la microcistina-LR.
Ensayos de laboratorio
En el laboratorio se realizaron dos ensayos diferentes para la evaluación de la disminución de la concentración de MC-LR. Inicialmente, se montó una columna cilindrica de policloruro de vinilo (PVC) con un diámetro de 5.08 cm y una altura de 50 cm que contenia sedimento del embalse Riogrande II, la tercera parte de esta columna se llenó con 600g de sedimento. A través de este sistema se hizo pasar una solución de microcistina-LR por gravedad que previamente fue cuantificada con el HPLC-DAD (6.07 ± 0.03 μg/mL). Durante siete dias consecutivos se tomaron muestras cada 24 h, con el fin de observar la permanencia de la toxina en el sistema a través del tiempo. La cuantificación de microcistina-LR en las muestras recolectadas se realizó por medio de HPLC-DAD. Para corroborar los resultados del primer experimento se hizo una segunda prueba bajo las siguientes condiciones:
• Agua del embalse Riogrande II (10 mL) y MC-LR (5 ± 0.2 μg/mL)
• Agua del embalse Riogrande II (10 mL), sedimento del embalse Riogrande II (35 g) y MC-LR (5 ± 0.2 μg/mL)
• Agua destilada (10 mL), sedimento del embalse Riogrande II (35 g) y MC-LR (5 ± 0.2 μg/mL)
Cada ensayo se realizó por triplicado y todos los sistemas se mantuvieron en agitación constante y en condiciones de oscuridad (Fig. 1). Se tomaron muestras cada 24 h durante cinco días para determinar, con HPLC-DAD, la concentración de MC-LR a través del tiempo.

Análisis de MC-LR por HPLC-DAD y su cuantificación
La MC-LR fue detectada usando un cromatógrafo liquido de alta resolución (HPLC Gilson 305 & 306) con detector de arreglo de diodos (DAD). Se utilizó una columna Luna C-18 (4.6 x 150 mm, 5 μm, Phenomenex) con una fase móvil que contenia agua acidificada (0.05 % de ácido trifluroacético (TFA)) en la bomba A y acetonitrilo acidificado en la bomba B, con un gradiente de incrementos desde 10 % hasta 60 % de B por 25 min, seguido por 10 minutos al 100 % de B. Finalmente se volvió a las condiciones iniciales (10 % de B) (Aguete et al. 2003). Se usó un flujo de 1 min y cada corrida tuvo una duración de 40 min. La absorbancia fue monitoreada a 238 nm y los volúmenes de inyección fueron de 20 μL. Para la cuantificación se prepararon cinco concentraciones del estándar de MC-LR. Las diluciones se realizaron con metanol acuoso y las concentraciones fueron (50, 25, 2.5, 1.25 y 0.25 μg/mL). Cada concentración fue inyectada por triplicado en tres eventos diferentes. Tomando en cuenta los tiempos de retención y el área bajo la curva, se realizó una gráfica y se obtuvo la ecuación de la curva para determinar la concentración de MC-LR con el programa Gilson.
Análisis de microcistina-LR por HPLC-MS/MS
La confirmación de la microcistina-LR se realizó por cromatografía líquida de alta eficiencia (HPLC) acoplada a espectrometría de masas en modo tándem (HPLC-MS/MS), con un HPLC Agilent modelo 1200 y un espectrómetro de masas de marca Apllied Biosystem modelo 3200 Q-trap, bajo las siguientes condiciones:
• Columna Kinetex 2.6 U C18 100a, 50 x 2.1 mm.
• Fase móvil A: 5 mM de acetato de amonio en agua + 0.1 % de ácido fórmico.
• Fase móvil B: 5 mM de acetato de amonio en acetonitrilo + 0.1 % de ácido fórmico, flujo de 450 μL/min, con un volumen de inyección de 10 μL y un gradiente que comenzó desde 85 % de A y 15 % de B, a los 6 minutos 65 % A y a los 10 min 10 % de A hasta retornar a las condiciones iniciales de 85 % A.
Para los ensayos de masas se utilizó una fuente de electroatomización, con ionización en modo positivo. El ion precursor analizado fue de 995 m/z y los fragmentos 135 m/z y 103 m/z, donde el fragmento 135 fue utilizado para cuantificación y el 103 para la confirmación de la presencia del metabolito (Prakash et al. 2009).
Análisis estadístico
Para confirmar diferencias estadísticamente significativas entre los resultados de la concentración de MC-LR en diferentes sistemas, se llevó a cabo un análisis no paramétrico de Kruskal-Wallis con un nivel de significancia de 0.05. En los casos en los que se encontraron diferencias estadísticas, se realizó un análisis de comparaciones múltiples.
RESULTADOS
El género Microcystis se encontró en todas las muestras y durante todo el tiempo de muestreo en los dos embalses (Herrera et al. 2014). Los resultados de los análisis por HPLC-MS/MS evidenciaron la presencia de MC-LR a una concentración de 434 μg/g de material liofilizado (Fig. 2).
Análisis del sedimento
En el análisis del sedimento recuperados con draga Eckman (primeros 20 cm del depósito sedimentario), que constituye la capa bioactiva o interfase agua-sedimento, se puede observar una estratigrafía en la cual los primeros 5 cm están constituidos por una capa de sedimentos finos limosos, floculosos y poco consolidados. Dicha estratigrafía está subyacida por otras dos capas de sedimento que varían en espesor (entre 8 y 7 cm respectivamente), pero que están más consolidados y cuyas texturas se encuentran entre limo arenosas y arenosas finas. Los datos promedio de los microcomponentes (Cuadro I), indican el predominio de inorgánicos (41.63 %) y de silicofósiles (26.65 %). En contraste, los orgánicos representaron sólo el 11.15 % y los organominerales el 20.6 %. Estas proporciones, permiten clasificar a los sedimentos predominantemente inorgánicos. Las texturas de los sedimentos en estos primeros 20 cm pueden variar en el tiempo debido a los aportes directos de las propias cuencas. En este caso el río Chico hace que se produzcan cambios en las texturas que pueden variar entre arenosas (A), areno arcillo limosas (AArL) o a areno limo arcillosas (ALAr). Las proporciones entre limos y arcillas son muy cercanas, lo que permite definir las texturas de los sedimentos más consolidados como francoarenosas (FA) o arenosas (A), mientras que para los primeros 5 cm del depósito en todos los casos las texturas son limosas.

Evaluación de la disminución de la concentración de MC-LR
Respecto a los análisis de laboratorio, en el primer ensayo donde se analizó la disminución de MC-LR en una columna en presencia de sedimento, se observó un notable decrecimiento en su concentración (Fig. 3). Durante los primeros tres días de análisis se observó una reducción de 73.1 % de MC-LR. El cuarto y quinto día la reducción fue de 91.7 % y a partir del sexto día no se detectó MC-LR en el sistema evaluado.

Para el segundo ensayo se evidenció una disminución de la concentración de MC-LR en los sistemas donde se empleó el sedimento. El primer día la concentración de MC-LR se redujo un 63.4 %, el segundo día un 80.7 % y a partir del tercer día la reducción fue de un 100 %. Aunque los dos sistemas empleados para el análisis de la reducción de MC-LR fueron diferentes, los porcentajes de reducción fueron similares. Se encontraron diferencias estadísticamente significativas entre los tratamientos con sedimento y los que no contenían sedimento (P = 0-01). Según la prueba de comparaciones múltiples, los dos tratamientos con sedimentos son grupos homogéneos, aunque el tratamiento con agua del embalse fue más efectivo que el tratamiento con agua destilada. Mientras que en los dos sistemas con sedimentos la disminución de la concentración de MC-LR se dio a partir del segundo día. En el sistema sin sedimento la concentración de MC-LR se mantuvo muy similar durante los cinco días del análisis (4.9 ± 0.1 μg/mL; Fig. 4).
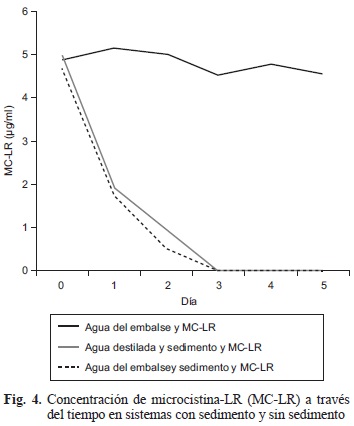
Los análisis por HPLC/DAD de la muestra sin sedimento evidenciaron la persistencia de la microcistina-LR durante cinco días. En los ensayos con sedimentos (Fig. 1), sólo fue posible detectar MC-LR durante los dos primeros días. En la figura 5 se observan los dos picos del cromatograma HPLC/DAD, correspondientes al análisis de los dos primeros días.

DISCUSIÓN
El objetivo de este estudio fue determinar la contribución del sedimento en la reducción de MC-LR presentes en muestras de florecimientos naturales. Aunque los sedimentos juegan un papel importante en el proceso de degradación y adsorción de sustancias en diferentes ambientes acuáticos (Holst 2003), hasta el momento existen pocos reportes acerca de la influencia de éstos en el destino de las cianotoxinas (Tsuji et al. 2001, Chen et al. 2006, Song et al. 2014).
Los resultados de este estudio confirman la reducción de la concentración de MC-LR en sistemas controlados con sedimentos, similar a lo observado por Song et al. (2014) quienes observaron que las concentraciones de MC-LR decrecen exponencialmente en presencia de sedimento. Sin embargo, los procesos responsables de la disminución aún no son claros, se pudiera deducir que tanto el sedimento investigado por Song et al. (2014) como el analizado en este trabajo tienen características y propiedades muy diferentes.
Los resultados del análisis de la disminución de la concentración de MC-LR en los cuales se usaron solamente muestras de agua del embalse sin sedimentos no varió en el tiempo, lo que evidencia la estabilidad de estos compuestos. Algunos autores han reportado que las cianotoxinas son caracterizadas, en general, por ser extremadamente estables y persisten en ambientes acuáticos aún semanas después de ser liberadas de las células cianobacteriales (Chen et al. 2008, Edwards et al. 2008)
En algunos estudios se reporta que las MCs en grandes lagos poco profundos se pueden biodegradar en la columna de agua, siendo entonces los sedimentos la vía principal para la eliminación de toxinas en el ambiente natural. Por tal motivo, es importante conocer el proceso mediante el cual las cianotoxinas llegan al sedimento, proceso que fue previamente reportado por Wórmer et al. (2011) en el embalse Valmayor (España). En dicho estudio se encontró que inicial-mente y mientras se llevaba a cabo el florecimiento de cianobacterias, la toxina se hallaba principalmente en muestras subsuperficiales, una semana más tarde, cuando la sedimentación comenzó, se observó un aumento en las MCs sestónicas y una importante sedimentación epilimnética en el agua circundante, lo que indica que la sedimentación hipolimnética de la MC seguía siendo poca. Otra semana más tarde la sedimentación epilimnética se mantuvo en curso y comenzó a llegar al hipolimnio. Esto indicaría un tiempo aproximado de 2 o 3 semanas entre el asentamiento inicial de MCs y su llegada a la superficie del sedimento. Sin embargo, el viaje a lo largo de la columna de agua para colonias de Microcystis es posiblemente más rápido y las colonias pueden sobrevivir dentro o sobre el sedimento por largos periodos de tiempo, donde pueden estar expuestas a procesos de herbivoría (Bostróm et al. 1989). Visser et al. (1995) observaron que los patrones de sedimentación son notables, lo que señala que las partículas de MCs se están asentando conjuntamente durante el periodo de floración.
Adicionalmente, un papel complementario a la adsorción-degradación química de los sedimentos es su alto contenido bacteriano, que influye en la degradación de cianotoxinas en la columna de agua (Chen 2008). En el lago Taihu (China), Chen (2008) demostró la presencia de toxinas en sedimentos e indicó que probablemente los sólidos en suspensión contribuyen a la eliminación de toxinas de la columna de agua, en la que las bacterias asociadas a los sólidos en suspensión y a los sedimentos desempeñan un papel importante en la biodegradación de MCs. Sin embargo, Song et al. (2014) evaluaron la incidencia del sedimento en la disminución de la concentración de MCs y encontraron que la biodegradación de MC-LR es más rápida y eficiente en presencia de sedimentos que la biodegradación por la actividad bacteriana en presencia únicamente de agua y en ausencia de sedimentos.
Por otra parte, los procesos de aireación también cumplen un rol importante, ya que de acuerdo con los resultados de Song et al. (2014) se logró evidenciar que dichos procesos tuvieron un efecto significativo en la reducción de la concentración de Mcs. El estudio de estos autores concuerda con lo observado en la presente investigación, en la que se aplicó agitación para reproducir el proceso natural del movimiento de las aguas. Esa aireación, así como el recambio de sedimentos, constituyen un proceso dinámico que probablemente permite una mayor remoción de toxinas en el seno de los reservorios de agua.
Los resultados de este trabajo indican que la sedimentación puede contribuir a la remoción de MC-LR del agua de una manera rápida y efectiva en los embalses. A pesar de que se trata de un estudio preliminar, los resultados puede servir como base para futuros proyectos de implementación de métodos de remoción de MCs con materiales nativos, disponibles en grandes cantidades en los propios embalses.
CONCLUSIONES
En este estudio analizamos el potencial del sedimento en la disminución de la concentración de MC-LR. Observamos que esta toxina puede ser rápidamente reducida a través de sistemas controlados con sedimentos.
Las muestras con MC-LR en presencia de sedimentos presentaron una mayor disminución de la concentración con porcentajes de reducción desde 73.1 % y 63.4 % el primer día hasta 91.7 y 100 % a partir del tercer día. Esto contrasta con las muestras que sólo contenían agua y MC-LR, que exhibieron un porcentaje de reducción del 5.8 % hasta el quinto día del estudio.
El análisis de la disminución de la concentración de MC-LR con muestras de agua del embalse sin sedimentos no varió en el tiempo, lo que indica la estabilidad de estos compuestos y la contribución de los sedimentos para eliminar la MC-LR del medio acuático. Los datos generados en este estudio sugieren que la reducción significativa de las concentraciones tóxicas puede ser alcanzada a través de procesos naturales y mejorados por medios artificiales.
AGRADECIMIENTOS
Los autores de esta investigación agradecen a Empresas Públicas de Medellín por la financiación #29990832845.
REFERENCIAS
Aguete E., Gago-Martínez A., Leao J., Rodríguez-Vázquez J., Menard C. y Lawrence J. (2003). HPLC and HPCE analysis of microcystins RR, LR and YR present in cyanobacteria and water by using immunoaffinity extraction. Talanta 59, 697-705. [ Links ]
Boström B., Pettersson A.K. y Ahlgren I. (1989). Seasonal dynamics of a cyanobacteria-dominated microbial community in surface sediments of a shallow, eutrophic lake. Aquat. Sci. 51, 153-178. [ Links ]
Chen J., Hu L.B., Zhou W., Yan S.H., Yang J.D., Xue Y.F. y Shi Z.Q. (2010). Degradation of microcystin-LR and RR by a Stenotrophomonas sp. strain EMS isolated from Lake Taihu, China. Int. J. Mol. Sci. 11, 896-911. [ Links ]
Chen J., Xie P., Zhang D., Ke Z. y Yang H. (2006). In situ studies on the bioaccumulation of microcystins in the phytoplanktivorous silver carp (Hypophthalmichthys molitrix) stocked in Lake Taihu with dense toxic Microcystis blooms. Aquaculture 261, 1026-1038. [ Links ]
Chen W., Song L., Peng L., Wan N., Zhang X. y Gan N. (2008). Reduction in microcystin concentrations in large and shallow lakes: water and sediment-interface contributions. Water Res. 42, 763-773 [ Links ]
Bartram J., Carmichael W.W., Chorus I., Jones G. y Skulberg O.M. (1999). Introduction. En: (J. Bartram, I. Chorus, Eds.). Toxic cyanobacteria in water. A guide to their public health consequences, monitoring and management. E & FN Spon, Londres, Inglaterra, pp. 1-14. [ Links ]
Christoffersen K., Lyck S. y Winding A. (2002). Microbial activity and bacterial community structure during degradation of microcystins. Aquat. Microb. Ecol. 27, 125-136. [ Links ]
Edwards C., Graham D., Fowler N. y Lawton L.A. (2008). Biodegradation of microcystins and nodularin in fresh-waters. Chemosphere 73, 1315-1321. [ Links ]
Elhadi S.L., Huck P.M. y Slawson R.M. (2006). Factors affecting the removal of geosmin and MIB in drinking water biofilters. J. Am. Water Works Ass. 98, 108-119. [ Links ]
Grützmacher G., Wessel G., Klitzke S. y Chorus I. 2009. Microcystin elimination during sediment contact. Environ. Sci. Technol. 44, 657-662. [ Links ]
Harada K-I., Imanishi S., Kato H., Mizuno M., Ito E. y Tsuji K. (2004). Isolation of Adda from microcystin-LR by microbial degradation. Toxicon 44, 107-109. [ Links ]
Harada K.I., Oshikata M., Uchida H., Suzuki M., Kondo F., Sato K., Ueno Y., Yu S.Z., Chen G. y Chen, G.C. (1996). Detection and identification of microcystins in the drinking water of Haimen City, China. Nat. Toxins 4, 277-283. [ Links ]
Herrera N., Echeverri F. y Ferräo-Filho A. (2015). Effects of phytoplankton extracts containing the toxin microcystin-LR on the survival and reproduction of cladocerans. Toxicon 95, 38-45. [ Links ]
Herrera N., Palacio J., Echeverri F. y Ferräo-Filho A. (2014) Effects of a cyanobacterial bloom sample containingmicrocystin-LR on the ecophysiology of Daphnia similis. Toxicology Reports 1, 909-914. [ Links ]
Himberg K., Keijola A.M., Hiisvirta L., Pyysalo H. y Sivonen K. (1989). The effect of water treatment processes on the removal of hepatotoxins from Microcystis and Oscillatoria cyanobacteria: A laboratory study. Water Res. 23, 979-984. [ Links ]
Ho L., Sawade E. y Newcombe G. (2012). Biological treatment options for cyanobacteria metabolite removal-A review. Water Res. 46, 1536-1548. [ Links ]
Ho L., Hoefel D., Palazot S., Sawade E., Newcombe G., Saint C.P. y Brookes J.D. (2010). Investigations into the biodegradation of microcystin-LR in wastewaters. J. Hazard. Mater. 180, 628-633. [ Links ]
Ho L., Hoefel D., Bock F., Saint C.P. y Newcombe G. (2007). Biodegradation rates of 2-methylisoborneol (MIB) and geosmin through sand filters and in bioreactors. Chemosphere 66, 2210-2218. [ Links ]
Hoefel D., Ho L., Monis P.T., Newcombe G. y Saint C.P. (2009). Biodegradation of geosmin by a novel Gram-negative bacterium; isolation, phylogenetic characterisation and degradation rate determination. Water Res. 43, 2927-2935. [ Links ]
Holst T., Jorgensen N.O., Jorgensen C. y Johansen A. (2003). Degradation of microcystin in sediments at oxic and anoxic, denitrifying conditions. Water Res. 37, 4748-4760. [ Links ]
Jones G.J. y Orr P.T. (1994). Release and degradation of microcystin following algicide treatment of a Microcystis aeruginosa bloom in a recreational lake, as determined by HPLC and protein phosphatase inhibition assay. Water Res. 28, 871-876. [ Links ]
Metcalf J., Bell S. y Codd G. (2000). Production of novel polyclonal antibodies against the cyanobacterial toxin microcystin-LR and their application for the detection and quantification of microcystins and nodularin. Water Res. 34, 2761-2769. [ Links ]
Paerl H.W., Hall N.S. y Calandrino E.S. (2011). Controlling harmful cyanobacterial blooms in a world experiencing anthropogenic and climatic-induced change. Sci. Total Environ. 409, 1739-1745. [ Links ]
Paerl H.W. y Huisman J. (2009). Climate change: a catalyst for global expansion of harmful cyanobacterial blooms. Env. Microbiol Rep. 1, 27-37. [ Links ]
Parra-Sánchez L.N. (2005). Análisis facial de alta resolución de sedimentos del Holoceno tardío en el Páramo de Frontino, Antioquia. Tesis Doctoral, Instituto de Ciencias Naturales Universidad Nacional de Colombia. Bogotá, Colombia, 215 pp. [ Links ]
Prakash S., Lawton L.A. y Edwards C. 2009. Stability of toxigenic Microcystis blooms. Harmful Algae 8, 377-384. [ Links ]
Rapala J., Lahti K., Sivonen K. y Niemelä S. (1994). Biodegradability and adsorption on lake sediments of cyanobacterial hepatotoxins and anatoxin-a. Lett. Appl. Microbiol. 19, 423-428. [ Links ]
Ros J. (1979). Prácticas de Ecología. Ediciones Omega, S.A., Barcelona, España, 181 pp. [ Links ]
Sengco M.R., Li A., Tugend K., Kulis D. y Anderson D.M. (2001). Removal of red-and brown-tide cells using clay flocculation. I. Laboratory culture experiments with Gymnodinium breve and Aureococcus anophagefferens. Mar. Ecol-Prog. Ser. 210, 41-53. [ Links ]
Sivonen K. y Jones G. (1999). Cyanobacterial toxins. En: (J. Bartram, I. Chorus, Eds.). Toxic cyanobacteria in water. A guide to their public health consequences, monitoring and management. E & FN Spon, Londres, Inglaterra, pp. 41-112. [ Links ]
Song H., Reichwaldt E.S. y Anas Ghadouani. (2014). Contribution of sediments in the removal of microcystin-LR from water. Toxicon 83, 84-90. [ Links ]
Surono I., Collado M., Salminen S. y Meriluoto J. (2008). Effect of glucose and incubation temperature on metabolically active Lactobacillus plantarum from dadih in removing microcystin-LR. Food Chem. Toxicol. 46, 502-507. [ Links ]
Tsuji K., Masui H., Uemura H., Mori Y. y Harada K-I. (2001). Analysis of microcystins in sediments using MMPB method. Toxicon 39, 687-692. [ Links ]
Tsuji K., Setsuda S., Watanuki T., Kondo F., Nakazawa H., Suzuki M. y Harada K.I. (1996). Microcystin levels during 1992-95 for lakes sagami and tsukui-japan. Nat. Toxins 4, 189-194. [ Links ]
Visser P.M., Ibelings B.W. y Mur L.R. (1995). Autunmal sedimentation of Microcystis spp. as result of an increase in carbohydrate ballast at reduced temperature. J. Plankton Res. 17, 919-933. [ Links ]
Welker M. y Steinberg C. (2000). Rates of humic substance photosensitized degradation of microcystin-LR in natural waters. Environ. Sci. Technol. 34, 3415-3419. [ Links ]
Wörmer L., Cirés S. y Quesada A. (2011). Importance of natural sedimentation in the fate of microcystins. Chemosphere 82, 1141-1146. [ Links ]
Wu X., Xiao B., Li R., Wang C., Huang J. y Wang Z. (2011). Mechanisms and Factors Affecting Sorption of Microcystins onto Natural Sediments. Environ. Sci. Technol. 45, 2641-2647. [ Links ]
Zurawell R.W., Chen H., Burke J.M. y Prepas E.E. 2005. Hepatotoxic cyanobacteria: a review of the biological importance of microcystins in freshwater environments. J. Toxicol. Env. Heal. B 8, 1-37. [ Links ]














