Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista internacional de contaminación ambiental
Print version ISSN 0188-4999
Rev. Int. Contam. Ambient vol.31 n.3 Ciudad de México Aug. 2015
Formulación de Metarhizium anisopliae (Metschnikoff) Sorokin con polímeros biodegradables y su virulencia contra Heliothis virescens (Fabricius)
Formulation of Metarhizium anisopliae (Metschnikoff) Sorokin with biodegradable polymers and their virulence against Heliothis virescens (Fabricius)
Mónica Acuña Jiménez1, Cipriano García Gutiérrez1*, Ninfa María Rosas García2, Melina López Meyer1 y Juan Carlos Saínz Hernández1
1 Centro Interdisciplinario de Investigación para el Desarrollo Integral Regional, Unidad Sinaloa, Instituto Politécnico Nacional, Juan de Dios Bátiz Paredes No. 250, Guasave, Sinaloa, México, C.P. 81101*Autor para correspondencia: cgarciag@ipn.mx, garciaciprian@hotmail.com
2 Centro de Biotecnología Genómica, Instituto Politécnico Nacional, Bulevard del Maestro S/N esq. Elías Piña, Colonia Narciso Mendoza, Ciudad Reynosa, Tamaulipas, México, C.P. 88710
Recibido enero 2014;
aceptado: febrero 2015
RESUMEN
Propágulos de Metarhizium anisopliae (Metchnikoff) Sorokin obtenidos por fermentación sólida en granos de arroz se usaron para producir microcápsulas mediante la técnica de secado por aspersión. Como matriz se probaron gelatina bovina, maíz nixtamalizado, almidón de maíz, así como un fagoestimulante y un protector de rayos UV. Se elaboraron ocho formulaciones variando la composición y ajustando las temperaturas de entrada y de salida del secador a 120 °C/70 °C respectivamente y la velocidad del flujo a 3.34 mL/min. Previamente se determinó la preferencia alimenticia de Heliothis virescens (Fabricius) a dos fagoestimulantes (garbanzo y aceite de maíz). Para seleccionar la formulación con la mayor capacidad de adherencia se realizó una prueba de adherencia sobre portaobjetos después de cinco lavados con agua (64 mL/min durante 24 s). Se evaluó la virulencia de estas formulaciones mediante bioensayos con larvas del primer estadio de H. virescens. La mortalidad fue evaluada después de siete días. La mejor formulación (F6) mostró la mayor adherencia a portaobjetos (85.55 ± 1.79 %), la mejor preferencia por las larvas (6.6 ± 1.24 %) y estuvo compuesta por gelatina bovina (26 g), aceite de maíz (20 mL), colorante rojo (4 g) y M. anisopliae 1.49 x 109 esporas/g. El proceso de secado logró la encapsulación del hongo en gránulos con un tamaño de partícula < 20 µm, con humedad de 8.74 ± 3.6 % y 5.4 ± 0.6 % de germinación de esporas a las 24 h, con una virulencia de 10.31 % sobre larvas del primer estadio de H. virescens. Los resultados de virulencia fueron bajos, por lo que se sugiere reducir la temperatura de entrada del secador (entre 60 °C y 70 °C) para aumentar la sobrevivencia de esporas y la mortalidad de larvas.
Palabras clave: hongos entomopatógenos, microencapsulación, secado por aspersión, polímeros biodegradables.
ABSTRACT
Propagules of Metarhizium anisopliae (Metchnikoff) Sorokin were obtained from solid fermentation of rice grains to produce microcapsules by the spray drying technique. Bovine gelatin, nixtamalized corn, and corn starch were used as matrix, in addition to a feeding stimulant and a UV protector. Eight microencapsulated formulations were obtained adjusting the spray drying conditions to 120 °C and 70 °C of inlet and outlet temperatures, respectively, and to a flow rate of 3.34 mL/min. Previously, feeding preference tests with Heliothis virescens (Fabricius) were conducted with two feeding stimulants (chickpea and vegetable oil). To select the formulation with the highest adherence capacity, adhesion trials were performed with five water washes (64 mL/min during 24 s) on glass slides. The virulence of these formulations was assessed through a bioassay using first instar H. virescens larvae. Mortality was recorded after seven days. The selected formulation (F6) showed the highest adherence to slide (85.55 ± 1.79 %), highest larvae feeding preference (6.6 ± 1.24 %), and contained bovine gelatin (26 g), corn oil (20 mL), red dye (4 g) and M. anisopliae (1x109 spores/g). The results showed that the drying process of the fungus produced encapsulating granules with particle size < 20 µm, moisture content of 8.74 ± 3.6 °%, spore germination values of 5.4 ± 0.6 % (after 24 h), and fungi virulence of 10.31 % tested on first instar H. virescens larvae. Since virulence was low, decreasing dryer's inlet temperature (between 60 °C and 70 °C) may increase the spore survival as well as the effectivity of the formulation on larval mortality.
Key words: entomopathogenic fungi, microencapsulation, spray drying, biodegradable polymers.
INTRODUCCIÓN
En 2013 se sembraron en Sinaloa, México 15 362 ha de tomate (Lycopersicon esculentum Mill.) en las cuales se obtuvo una producción de 983 288 ton (SIAP 2013). En cada ciclo agrícola este cultivo se ve afectado por diversas plagas y enfermedades, entre las cuales se encuentra el gusano del fruto Heliothis virescens (Fabricius). Existen diversos métodos de control para esta plaga, sin embargo los más utilizados son los insecticidas químicos, por lo que se requiere de nuevas alternativas más amigables con el ambiente, como los bioinsecticidas a base de hongos entomopatógenos (HE).
El hongo Metarhizium anisopliae (Metschnikoff) Sorokin es uno de los principales entomopatógenos empleado como bioinsecticida. Este hongo tiene, un amplio rango de insectos hospederos de diferentes órdenes, entre los que se incluyen plagas de lepidópteros de importancia agrícola (Faria y Wraight 2007). El ciclo biológico de este HE comprende una fase infectiva celular en el interior del insecto y otra saprofita cuando el hongo completa su ciclo al aprovechar los nutrientes del cadáver del insecto (Khachatourians y Qazi 2008). Los insectos muertos por este hongo son inicialmente cubiertos de forma total por micelio de color blanco, el cual se torna verde cuando el hongo esporula (Wraight et al. 2007). En cuanto a los mecanismos de acción de los HE presentan una ventaja sobre las bacterias y los virus debido a que éstos deben ser ingeridos por el insecto para actuar. En el caso de los HE pueden ingresar por contacto a través de un proceso de infección en la cutícula del insecto.
Debido al interés en estos hongos para el control de plagas de los cultivos hortofrutícolas se continúa en la búsqueda de estrategias para mejorar el proceso de producción a fin de ser empleados en la elaboración de bioinsecticidas. Algunos ejemplos son los trabajos realizados por Pham et al. (2010) quienes produjeron B. bassiana por fermentación en sólidos a través del arroz en bolsas de polietileno (14 días a 25 °C) en las que colocaron un inóculo de 107 esporas/g de arroz. La producción obtenida en este caso fue de 4.05 g de esporas/100 g de arroz. Otra investigación reciente es la realizada por Taylor et al. (2013) quienes produjeron B. bassiana en arroz con una producción de 108 a 109 esporas/g de arroz.
La eficacia de los HE usados en campo se ve afectada por factores abióticos como la radiación solar, la temperatura y la humedad (Rangel et al. 2005) por lo que se requiere adicionar adyuvantes que permitan proteger al ingrediente activo (IA) para incrementar su persistencia y residualidad. En las nuevas tecnologías que involucran a los agentes de control biológico se incluye el diseño y la elaboración de bioinsecticidas de hongos, bacterias y virus a través de formulaciones microencapsuladas por el proceso de secado por aspersión (SA). En el caso de los hongos el IA son esporas y micelio, los cuales se pueden encapsular en una matriz de adyuvantes y fagoestimulantes para mejorar su efectividad en controlar las poblaciones del insecto blanco (Behle et al. 1997).
La técnica de secado por aspersión ha sido investigada para su uso con HE. Horaczeck y Viernstein (2004) compararon la técnica de secado por aspersión con otros dos métodos (liofilización y lecho fluidizado) para secar esporas de B. brongniarti y M. Anisopliae. Dichos autores evaluaron el efecto que el proceso tiene en la actividad y persistencia de los esporas de 14 a 20 días de desarrollo. Para el secado por aspersión, utilizaron un equipo de laboratorio B-191 marca Buchi con un flujo de 3 mL y una duración de la corrida de 8 min. Con el equipo mencionado se probaron diferentes temperaturas de entrada (60, 80 y 100 °C) y de salida (40 ± 2, 53 ± 2 y 41 ± 2) y como agentes microencapsulantes se utilizaron la polivinilpirrolidona (PVP) y leche descremada. Después del proceso de microencapsulación, los autores demostraron que M. anisopliae fue más resistente al estrés por calor que B. brongniarti. Además reportaron que la temperatura de salida fue clave para minimizar la pérdida de viabilidad de las esporas, aunque en ese equipo no pudo ser controlada, ya que está en función de la temperatura de entrada, del flujo de alimentación y de la corriente de aire.
En otros trabajos se han probado diferentes agentes microencapsulantes. De Luna et al. (2011) encontraron como mejor agente a la gelatina bovina sobre la pectina y almidón de maíz. Por su parte Jin y Custis (2011) microencapsularon al hongo Trichoderma harzianum (Rifai) con una solución de sacarosa al 2 %, a temperaturas óptimas de entrada y de salida (60/31 °C), las microcápsulas formadas bajo estas condiciones tuvieron un tamaño de partícula 10 a 25 micras.
Los polímeros como almidón de maíz, el maíz nixtamalizado y la gelatina bovina son capaces de conferir al IA, la capacidad de adherirse al follaje de la planta, protegiéndola de la lluvia y del viento, además de formar una matriz protectora (McGuire et al. 1994, Rosas y De Luna 2006) característica deseable en una formulación para el gusano del fruto de tomate. En el caso de bioinsecticidas a base de HE aún cuando no es necesario que sean ingeridos por el insecto, puede resultar conveniente adicionar fagoestimulantes específicos para atraer a la plaga a la formulación y con esto propiciar la infección del insecto por contacto con el hongo.
Considerando lo anterior, este trabajo tiene como objetivo elaborar un microencapsulado a base de M. anisopliae y polímeros biodegradables con virulencia para el gusano del fruto del tomate H. virescens.
MATERIALES Y MÉTODOS
Origen de la cepa de Metarhizium anisopliae
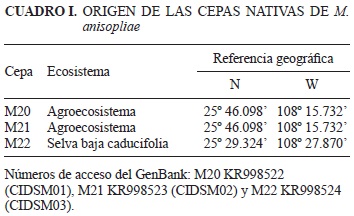
Se utilizaron cepas nativas de M. anisopliae de la colección del Laboratorio de Bioinsecticidas (CIIDIR-Sinaloa) las cuales se obtuvieron a partir de muestras de suelo y se aislaron con la técnica de insecto trampa Galleria mellonella (Zimmermann 1986; Cuadro I). Dichas cepas se encuentran identificadas morfológicamente en las claves de Humber (1998) y molecularmente al amplificar la región ITS1/ITS2 con una homología del 98 y 99 % consultada en la base de datos del Centro Nacional para la Información Biotecnológica.
Evaluación de la patogenicidad de Metarhizium anisopliae
Con el fin de seleccionar una cepa con patogenicidad sobre el insecto se prepararon suspensiones a una concentración de 1 × 108 esporas/mL ajustando la concentración con ayuda de la cámara de Neubauer. Se sumergieron larvas del quinto estadio del gusano del fruto de 14 días de desarrollo durante 1 min. Posteriormente se colocaron de manera individual en un recipiente de plástico de 30 mL con una dieta artificial para la cría del gusano del fruto siguiendo la metodología de Greene et al. (1976) con algunas modificaciones (Cuadro II). Para determinar la patogenicidad de las esporas se usaron 10 larvas por triplicado. El testigo negativo fue una solución de Tween 80 al 0.1 %. A los 7 días se determinó el porcentaje de insectos muertos. Los datos de mortalidad fueron corregidos con la fórmula de Abbott (1925).

Producción de esporas por fermentación en sólido
Se utilizaron granos de arroz comercial tratado con 0.3 mg/mL de antibiótico (2 pastillas de cloranfenicol/L de agua). Para inocular al hongo se colocaron previamente 300g de arroz con200mLde agua destilada en bolsas de plástico de 2 kg esterilizadas por 15 min a una temperatura de 121 °C. Posteriormente se enfriaron por 2 h a temperatura ambiente. Con una micropipeta se añadió la suspensión de esporas a una concentración de 2.32 × 108 esporas/100 g de arroz y se dejaron incubar por 20 días a 25 ± 2 °C. Se removió el arroz cada cuatro días para aumentar la superficie de contacto entre esporas y sustrato e incrementar el desarrollo del hongo. Después se determinó la concentración y el porcentaje de germinación de las esporas. Para separar el hongo del arroz y obtener el IA se uso 1 L de Tween 80 al 0.1 % por cada 200 g de arroz, la mezcla se pasó por una gasa esterilizada para separar el arroz y obtener el hongo. La concentración de esporas fue determinada por conteo directo en una cámara de Neubauer. Para obtener dicha concentración de esporas se colocaron 10 µL en la cámara, el conteo de esporas/mm2 se llevó a cabo en el cuadrante central, se tomaron cinco puntos (cuatro esquinas y centro) y se aplicó la siguiente fórmula: Número de esporas/mL = (esporas por mm2) (factor de dilución) (10 000).
Prueba de preferencia alimenticia
Con el propósito de elegir el fagoestimulante más adecuado para hacer atractiva la formulación para el insecto se utilizó el método de dos alternativas Bartelt et al. (1990) modificado. Se evaluó el extracto de garbanzo y el aceite vegetal de maíz. Para preparar el extracto de garbanzo se remojaron 500 g de grano previamente lavado en 1.3 L de agua destilada durante 16 h, posteriormente se homogeneizó la mezcla en una licuadora marca Osterizer. En una caja de Petri se colocó un rectángulo de 2 g con cada dieta artificial en polos opuestos para ofrecerla al insecto de prueba. La dieta artificial consistió en 21 mL para el caso del aceite vegetal o 21 g para el caso del extracto de garbanzo. Se realizaron 15 repeticiones, cada una de las cuales consistió en una caja de Petri con 10 larvas de H. virescens de dos días de desarrollo y las dos alternativa de dieta. Las cajas de Petri se sellaron con Parafilm® y se incubaron a 28 °C por 16 h. Finalmente se congelaron a -30 °C por 8 h para inmovilizar a las larvas. El número de larvas presentes en cada rectángulo fue registrado después de 16 h a fin de determinar la preferencia alimenticia de las larvas entre cada fagoestimulante. Los datos obtenidos fueron sometidos a una prueba t de Student (P < 0.05) mediante el paquete estadístico SAS v 9.0.
Microencapsulación
Para elaborar las formulaciones se utilizaron los polímeros almidón de maíz, maíz nixtamalizado, gelatina bovina y aceite de maíz como matriz encapsulante en ocho combinaciones con la composición de los ingredientes que aparecen en el cuadro III.
Secado por aspersión. Cada uno de los formulados se procesó en forma de suspensión líquida con un volumen de 800 mL y una concentración de esporas de 1 × 1011 esporas/mL. El ingrediente activo se obtuvo homogeneizando los granos de arroz con 1 L de solución de Tween 80 al 0.1 % y posteriormente filtrando con ayuda de una gasa estéril. Para obtener el polvo microencapsulado se usó un secador por aspersión Mini Spray Dryer B-290 Buchi. Las condiciones de operación fueron: temperatura de entrada de 120 °C y de salida de 70 °C, una velocidad de flujo de 3.34 mL/min, flujo de aire de aspersión de 157 mL/s y una presión del aspersor de 6.2 kg/cm2. Con estas condiciones se obtuvo un polvo seco con la presencia del hongo y una capacidad de adherencia a superficies. El contenido de humedad de las muestras del formulado obtenido se analizó con el método de secado en estufa NMX-F-83-1986. Por otro lado para observar la morfología y el tamaño de las microcápsulas se empleó un microscopio electrónico de barrido Dual Beam marca Fei, modelo Quanta 3D FEG.
Capacidad de adherencia de las formulaciones a portaobjetos
La determinación de esta propiedad se realizó con la finalidad de seleccionar la fórmula que proporcionó mejor adherencia con la metodología de McGuire y Shasha (1992). Se utilizaron cinco portaobjetos limpios con peso conocido por cada muestra previamente humedecidos con 100 µL de agua destilada a los que se les agregó 20 mg del formulado. Después se inclinaron y se dejaron secar a temperatura ambiente. Los portaobjetos se colocaron 2 cm por debajo de una bureta que liberó 25 mL de agua destilada a una velocidad de 64 mL/min, se movieron hacia adelante y hacia atrás manualmente hasta vaciar la bureta (24 s). Los portaobjetos se secaron a temperatura ambiente, el procedimiento de lavado y de secado se repitió cinco veces. La pérdida de gránulos en el portaobjetos se determinó por la diferencia de peso en cada formulado.
El diseño experimental empleado para elegir la formulación que presentó mejor adherencia fue un diseño estadístico aleatorio en arreglo factorial. Los factores fueron los tres polímeros con 2 niveles (con y sin el polímero), lo que dio como resultado ocho tratamientos. El formulado 6 (F6) fue el que se utilizó para las siguientes pruebas debido a que tuvo la mejor adherencia al portaobjetos (85.55 ± 1.79 % por 2 min; Cuadro III).
Concentración de esporas
Se disolvió 0.1 g del microencapsulado F6 en 10 mL de Tween 80 al 0.1 %. Se realizó una dilución 10-2 para contar las esporas germinadas en la cámara de Neubauer. Para resaltar las esporas se agregó azul de lactofenol. Las observaciones se realizaron con un microscopio marca Leica® en el objetivo de 40X, las esporas se consideraron viables si el tubo germinativo era dos veces el diámetro de las mismas, después de 24 h de crecimiento en papa, dextrosa, agar (PDA) (Mata 2008, Lopes et al. 2013).
Porcentaje de germinación
El porcentaje de germinación de las esporas se determinó por medio de microcultivos. En una caja de Petri con glicerina se colocó un portaobjetos con un cuadro de 1 cm2 de PDA acidificada con ácido láctico. Se prepararon diluciones en serie de la suspensión de esporas (10-1 a 10-5). Para obtener la dilución 10-1 se tomó 1 mL de la suspensión de esporas al que se le colocaron 9 mL de agua destilada estéril con una solución de Tween 80 al 0.1 %, la dilución se puso en un vórtex por 1 min. Este procedimiento se repitió hasta obtener las diluciones necesarias. Sobre pequeños cuadros de PDA se colocaron 50 µL de la dilución 10-5 y se colocó encima un cubreobjetos. Se incubaron las cajas de Petri a 28 °C durante 24 h. Se adicionó azul de lactofenol y se contó el número de esporas germinadas con la metodología descrita previamente.
Evaluación de la actividad bioinsecticida de la formulación microencapsulada
Se elaboraron dos suspensiones a una concentración de 1 × 108 esporas/mL: una de esporas de M. anisopliae cepa M20 provenientes de una caja de Petri con PDA y otra de la formulación microencapsulada. Se usaron larvas del gusano del fruto de dos días de desarrollo provenientes del Centro de Biotecnología Genómica del Instituto Politécnico Nacional (CBG-Reynosa). Las larvas se colocaron en un recipiente de plástico de 30 mL y se les agregó cada una de las suspensiones, se dejaron en contacto durante 1 min y luego se colocaron de manera individual en un recipiente de plástico de 30 mL con dieta artificial para continuar su desarrollo. Para cada tratamiento se utilizaron 25 larvas por triplicado, lo que dio un total de 75 insectos. Para el testigo negativo se usó una solución de Tween 80 al 0.1 %. Posteriormente los recipientes se almacenaron a 25 °C. Se evaluó el total de larvas muertas y el proceso de infección del hongo durante siete días. Los datos de mortalidad fueron corregidos por la fórmula de Abbott (1925).
RESULTADOS Y DISCUSIÓN
Es este trabajo la producción de esporas aéreas y micelio fue de 109 esporas/g de arroz a los 20 días, lo que se considera una cantidad aceptable. Al respecto Taylor et al. (2013) produjeron entre 108 y 109 esporas/g de arroz de B. bassiana, mientras que Jenkins (1995) logró producir 1010 esporas/g de sustrato de M. anisopliae a través de una fermentación bifásica. En la prueba de patogenicidad las tres cepas (M20, M21 y M22) causaron el 100 % de mortalidad de larvas en el quinto estadio del gusano del fruto en 14 días, lo que demostró la patogenicidad del hongo sobre este insecto.
Prueba de preferencia alimenticia
Los fagoestimulantes son aditivos necesarios en algunas formulaciones de bioinsecticidas debido a que tienen la finalidad de hacer más atractivo el producto al insecto blanco. En este trabajo el mejor de los fagoestimulantes fue el aceite de maíz debido a que obtuvo una mayor aceptación de los insectos de prueba (6.6 ± 1.24 larvas) en contraste con el preparado de garbanzo (2.7 ± 1.24 larvas), por lo que se le adicionó aceite de maíz a la formulación (Cuadro IV).

De Luna et al. (2011) encontraron que los fago-estimulantes más adecuados para Spodoptera exigua (Huber) fueron la espiga de maíz y el repollo, entre cinco fagoestimulantes probados (espiga de maíz, mazorca de maíz fresca, alfalfa, hojas de sorgo y repollo), lo que muestra la capacidad del insecto para seleccionar un fagoestimulante en particular.
En el caso H. virescens aún cuando el insecto es polífago, prefirió los componentes del aceite vegetal (ácidos grasos insaturados). Este insecto no sólo es plaga del cultivo de tomate sino también del garbanzo (del cual se alimenta tanto del follaje como del fruto tierno). En cuanto al cultivo de garbanzo, la plaga prefiere al fruto cuando este se encuentra en la vaina, pero ya no es preferido cuando está fuera de ella, como grano. Por otro lado, el aceite vegetal resultó ser más económico y fácil de conseguir en el mercado que el garbanzo, por lo que es más recomendable para la elaboración de este tipo de microencapsulados.
Capacidad de adherencia de las formulaciones a portaobjetos
Los polímeros biodegradables proporcionan a los microencapsulados la capacidad de adherencia al follaje de la planta cuando es necesario. De esa manera dan resistencia al bioinsecticida ante situaciones extremas como el lavado por la lluvia o el arrastre por el viento. La formulación que proporcionó mejor adherencia a portaobjetos fue la F6, que contenía M. anisopliae en una concentración de 1.49 ×109 esporas/mL, 26 g de gelatina bovina, 20 mL aceite de maíz y 4 g de colorante rojo (Fig. 1). Según Winder et al. (2003) la microencapsulación es una buena estrategia para realizar formulaciones efectivas. Los autores utilizaron alginato de sodio, gelatina y agar, con lo que lograron formar microcápsulas con hongos y virus entomopatógenos de 100 µm de tamaño. Lo que demuestra que las microcápsulas interfieren con la germinación de las esporas al producir una mayor resistencia para salir de la microcápsula. El microencapsulado de este estudio logró liberar el IA después de 20 días de haber sido elaborado. El IA pudo crecer en PDA aún con la resistencia que le proporcionan los aditivos empleados lo que indica, además, una posible ventaja de la formulación para su liberación continua en futuras pruebas de invernadero y campo.

En esta investigación la gelatina bovina confirió mayor adherencia a la superficie del portaobjetos (85.55 ± 1.79 %), lo que da al microencapsulado mayor capacidad para adherirse a las superficies donde se asperje y mayor resistencia a los efectos del lavado por lluvia, factor que puede limitar su actividad en invernadero y en campo.
Microencapsulación
Se obtuvo un microencapsulado de color rojo, de tamaño menor a 20 µm con 1.49 × 109 esporas/g y una humedad de 8.74 ± 3.6 %. El porcentaje de germinación de esporas al inicio, antes del secado, fue de 88.7 ± 0.6 % en la suspensión líquida y al final del secado bajó a 5.4 ± 0.6 %. Esto último concuerda con investigaciones realizadas en secado por aspersión con este tipo de equipos, donde los porcentajes de germinación bajan significativamente. Aún cuando el secado por aspersión ocasiona la disminución en la viabilidad de las esporas de los hongos entomopatógenos, este método podría tener potencial para formar las microcápsulas debido a su bajo costo. Horaczeck y Viernstein (2004) demostraron que M. anisopliae fue más resistente al estrés por calor que B. brongniarti, ya que el primero puede tolerar 50 °C durante 2 min sin pérdida de viabilidad. La combinación de temperaturas que reportaron como más adecuada de entrada y salida fue de 60 y 40 °C, a pesar de que dicha combinación hace que se pierda el 65 % de la viabilidad inicial germinación (24 h de incubación en PDA). La pérdida máxima de viabilidad para M. anisopliae se registró a los 100 °C en que la germinación desciende al 3.8 % con un porcentaje de humedad en las microcápsulas de 5.7 %, mientras que para B. brongniatii en estas condiciones hubo un 0 % de germinación.
En nuestro proceso se obtuvo un porcentaje de germinación de esporas bajo (5.4 ± 0.6 %), lo que confirma los valores registrados en otros trabajos para este hongo. Una vez determinados los parámetros en el secado (temperaturas de entrada de 120 °C y de salida de 70 °C) se logró obtener un gránulo seco, lo que podría servir de base para pruebas con temperaturas de entrada más bajas (60 °C y 70 °C) con la finalidad de aumentar la viabilidad de esporas y mejorar el nivel de la actividad insecticida.
Evaluación de la actividad bioinsecticida
El resultado de este bioensayo con la formulación microencapsulada usando larvas del primer estadio del gusano del fruto tuvo una mortalidad acumulada de 10.31 ± 2.3 % a los 7 días del contacto con el hongo que, comparada con la del testigo (2.67 ± 2.3 %) demuestra una baja actividad insecticida del microencapsulado (Fig. 2). Esto concuerda con los valores de viabilidad de esporas que inicialmente fue del 88.7 % y bajó al 5 % después del proceso de secado. No obstante, al segundo día después de haber estado en contacto con la formulación las larvas mostraron los síntomas típicos de infección por hongos: inactividad, cese de alimentación y protuberancias en el dorso, mientras que en el testigo se observaron larvas sanas con desarrollo normal, lo que evidenció la capacidad de infección del hongo, más no su virulencia.

CONCLUSIONES
Se obtuvo un formulado microencapsulado a base de M. anisopliae de color rojo con un tamaño de partícula menor a 20 µm, con 1.49 × 109 esporas/g y una humedad de 8.74 ± 3.6 %.
En el microencapsulado el aceite vegetal fue el fagoestimulante preferido sobre el garbanzo por los insectos de prueba. Por otro lado, la gelatina bovina fue el componente que proporcionó la mayor adherencia del compuesto a la superficie de prueba del portaobjetos.
La actividad insecticida del microencapsulado obtenido fue baja debido a que la viabilidad de las esporas se redujo en un 94.4 % por lo que se consideró no satisfactoria. Se recomienda probar temperaturas más bajas en el proceso de secado e incrementar la concentración del IA con el fin de aumentar la estabilidad y la viabilidad de esporas durante el proceso de elaboración de la fórmula.
AGRADECIMIENTOS
Al CONACyT, CIIDIR-IPN Unidad Sinaloa, CBG Reynosa, PIFI. Al técnico investigador Jesús Manuel Villegas Mendoza del CBG, por su ayuda en los bioensayos de laboratorio. A la Dra. Mayahuel Ortega del CNMN por su apoyo en la obtención de imágenes por microscopia MEB.
Este trabajo se realizó con el apoyo económico del proyecto: SIP-IPN 20140490 Diseño y evaluación de bioinsecticidas micro- y nano-encapsulados para el control de plagas del tomate.
REFERENCIAS
Bartelt R. J., Mcguire M. R. y Black D. A. (1990). Feeding stimulants for the european corn borer (Lepidoptera: Pyralidae): Additives to a starch-based formulation for Bacillus thuringiensis. Environ. Entomol. 19, 182-189. [ Links ]
Broome J. R., Sikorowski P. P. y Norment B.R. (1976). A mechanism of pathogenicity of Beauveria bassiana on larvae of the imported fire ant, Solenopsis richteri. J. Invertebr. Pathol. 28, 87-91. [ Links ]
Behle R. W., Mcguire M. R. y Shasha B. S. (1997). Effects of sunlight and simulated rain on residual activity of Bacillus thuringiensis formulations. J. Econ. Entomol. 90, 1560-1566. [ Links ]
De Luna E., Rodríguez M. A., Ali A. M., Morales L. H., Gopal H. y Arevalo K. (2011). Evaluation of potential microencapsulated agents for oral entomopathogens with phagostimulant activity against Spodoptera exigua (Hüber). Southwest. Entomol. 36, 433-442. [ Links ]
Jin X. y Custis D. (2011). Microencapsulating aerial conidia of Trichoderma harzianum through spray drying at elevated temperatures. Biol. Control. 56, 202-208. [ Links ]
Faria M. R. y Wraight S. P. (2007). Mycoinsecticides and mycoacaricides: a comprehensive list with worldwide coverage and international classification of formulation types. Biol. Control. 43, 237-256. [ Links ]
Greene G. L., Leppla N. C. y Dickerson W. A. (1976). Velvetbean caterpillar: a rearing procedure and artificial diet. J. Econ. Entomol. 69, 487-488. [ Links ]
Horaczeck A. y Viernstein H. (2004). Comparison of three commonly used drying technologies with respect to activity and longevity of aerial conidia of Beauveria brongniartii and Metarhizium anisopliae. Biol. Control. 31, 65-71. [ Links ]
Humber R. A. (1998). ARS Collection of entomopathogenic fungal culture. En: Systematic collections of the agricultural research service (J. R. Lichtenfels, J. H. Kirkbride y D. J. Chitwood, Eds.). USDA-ARS Misc. Publ., Washington, EUA, pp 8-12. [ Links ]
Khachatourians G. G. y Qazi S. S. (2008). Entomopathogenic fungi: biochemistry and molecular biology. En: Human and animal relationships (A. A. Brakhage y P. F. Zipfel, Eds.). Springer, Berlin, Alemania, pp 33-61. [ Links ]
Lopes R. B., Martins I., Souza D. A. y Faria M. (2013). Influence of some parameters on the germination assessment of mycopesticides. J. Invertebr Pathol. 112, 236-242. [ Links ]
Mata T. (2008). Evaluación de matrices de esporulación y formulación de un micoinsecticida a base de esporas del hongo entomopatógeno Beauveria bassiana. Tesis de maestría. Centro de Investigación en Biotecnología aplicada CIBA-Tlaxcala, México, 82 pp. [ Links ]
McGuire M. R. y Shasha B. S. (1992). Adherent starch granules for encapsulation of insect control agents. J. Econ. Entomol. 85, 1425-1433. [ Links ]
McGuire M. R., Shasha B. S., Lewis L. C. y Nelsen T. C. (1994). Residual activity of granular starch-encapsulated Bacillus thuringiensis. J. Econ. Entomol. 87, 631-637. [ Links ]
Pham T. A., Kim J. J. y Kim K. (2010). Optimization of solid-state fermentation for improved conidia production of Beauveria bassiana as a Mycoinsecticide. Mycobiology 38, 137-143. [ Links ]
Rangel D., Braga G., Anderson A. J. y Roberts D. W. (2005). Variability in conidial thermotolerance of Metarhizium anisopliae isolates from different geographic origins. J. Invertebr. Pathol. 88, 116-25. [ Links ]
Rosas N. M. y De Luna E. (2006). Diseño de una matriz microencapsulante a partir de compuestos biodegradables para la elaboración de un bioinsecticida. Rev. Int. Contam. Ambie. 22, 135-142. [ Links ]
SIAP (2013). Base de datos de indicadores de producción agropecuaria, pesqueros y agentes económicos que participan en las cadenas agroalimentarias en México. Servicio de Información Agroalimentaria y Pesquera. SAGARPA [en línea] http://www.siap.gob.mx/cierre-de-la-produccion-agricola-por-cultivo/ [ Links ]
Taylor B., Edgington S., Luke B. y Moore D. (2013). Yield and germination of the entomopathogenic fungus Beauveria bassiana when grown on different rice preparations. J. Stored. Prod. Res. 53, 23-26. [ Links ] Winder R. S., Wheeler J. J., Conder N., Otvos I. S., Nevill R. y Duan L. (2003). Microencapsulation: a strategy for formulation of inoculum. Biocontrol Sci Tech. 13,155-169. [ Links ]
Wraight S. P., Inglis G. D. y Goettel M. S. (2007). Overview of pathogen groups: fungi. En: Field manual of techniques in invertebrate pathology (L.A. Lacey y H. K. Kaya, Eds.). Springer, Holanda, pp 223-248. [ Links ]
Zimmermann G. (1986). The Galleria bait method for detection of entomopathogenic fungi in soil. J. Appl. Entomol. 102, 213-215. [ Links ]














