Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista internacional de contaminación ambiental
Print version ISSN 0188-4999
Rev. Int. Contam. Ambient vol.30 n.4 Ciudad de México Nov. 2014
Efecto de la aplicación de lodos crudos de la industria textil en la productividad y en la composición química de lechuga (Lactuca sativa)
Effect of the application of raw sludge from the fabric industry into the productivity and chemical composition of lettuce (Lactuca sativa)
Willian Alfredo NARVÁEZ-ORTÍZ, Adalberto BENAVIDES-MENDOZA*, Mario Ernesto VÁZQUEZ-BADILLO y Marcelino CABRERA-DE LA FUENTE
Universidad Autónoma Agraria Antonio Narro, México *Autor de correspondencia: abenmen@gmail.com
Recibido marzo 2013;
aceptado agosto 2014
RESUMEN
Los lodos industriales constituyen un serio problema de contaminación, pero en algunos casos su uso puede aportar beneficios agrícolas y ambientales. El objetivo de este trabajo fue determinar el efecto de lodos textiles aplicados a un sustrato de turba de musgo y perlita, sobre la productividad y la composición química de la lechuga. Los lodos fueron caracterizados bajo la NOM-004-SEMARNAT-2002. Se utilizó lechuga de la variedad Great Lakes que fue trasplantada en macetas de 14 L donde se mezcló el sustrato con el lodo textil en concentraciones de 0, 5, 10, 15 y 20 %. La fertilización se realizó aplicando una solución Steiner. El contenido de minerales en las plantas presentó efectos positivos al aplicar lodos textiles ya que aumentó la concentración de N, P, K, Ca, Na, Zn, Cu, Mn y Fe en 30.88, 43.46, 50.11, 15.81, 70.46, 257.5, 32.55, 126.8 y 1.04 %, respectivamente, mientras que para el Mg el testigo fue superior. La vitamina C se incrementó en 21 % al aplicar lodos textiles a una concentración del 20 %. La capacidad antioxidante aumentó en 4.63 % al aplicar lodos textiles a una concentración del 5 %. La biomasa no se vio afectada por la aplicación de lodos textiles, cuyos valores fueron estadísticamente iguales al testigo. Con respecto a los metales pesados no se encontró en los tejidos vegetales la presencia de dichos elementos en concentración mayor a la indicada por las normas de salud e ingesta diaria. Para el caso de microorganismos patógenos se encontró transferencia de coliformes fecales y huevos de helmintos del lodo textil a las plantas pero con valores por debajo de los establecidos por las normas de salud.
Palabras clave: fertilizantes, análisis microbiológicos, metales, lodo residual.
ABSTRACT
The industrial sludge is a serious pollution problem, but in some cases its use can be beneficial in agriculture and also to the environment. The aim of this study was to determine the effect of textile sludge applied to a substrate (mixture of peat moss and perlite) on productivity and chemical composition of lettuce. The sludge was characterized using the NOM-004-SEMARNAT-2002. The lettuce of the variety Great Lakes was transplanted into pots of 14 L with a mix of peat moss and perlite. The textile sludge was added to this substrate in concentrations of 0, 5, 10, 15 and 20 %. The fertilization was performed with a Steiner fertilizer solution. The plant mineral content had positive effects with the application of the textile sludge, showing a concentration increase of N, P, K, Ca, Na, Zn, Cu, Mn and Fe of 30.88, 43.46, 50.11, 15.81, 70.46, 257.5, 32.55, 126.8 and 1.04 % respectively, while for the control treatment the Mg content was higher. Likewise the content of vitamin C increased 21 % by applying the sludge at a 20 % concentration. The antioxidant capacity increased in a 4.63 % by applying sludge at a 5 % concentration. The biomass was not affected by the addition of textile sludge, its values were not statistically different from the control. Heavy metals were not found in plant tissues at concentrations higher than the indicated by the health standards and the recommended standards of daily intake. We found fecal conforms and helminth eggs in the plants grown in the textile sludge, but the values were below the established health standards.
Key words: fertilizers, microbiological analysis, metals, wastewater sludge.
INTRODUCCIÓN
El incremento de la población ha ocasionado una gran producción de residuos sólidos, entre los que se encuentran los lodos generados en plantas de tratamientos de aguas residuales (Salcedo-Pérez et al. 2007). Con el aumento en la demanda de productos textiles, la industria ha acrecentado los volúmenes de descargas de aguas residuales, lo que se ha constituido como uno de los principales problemas de contaminación en el mundo (Dos Santos et al. 2007). La fabricación de los diferentes productos textiles se lleva a cabo utilizando procesos de limpiado, lanzado, estirado, acabado y teñido, entre otros, como resultado de estas actividades se generan aguas residuales que contienen fenoles, sulfuros, cromo y colorantes. Estos últimos constituyen uno de los contaminantes más visibles a causa de su color, siendo además algunos de ellos de difícil degradación (Garcés y Peñuela 2007). Existen diversas alternativas para la disposición de lodos, desde depositarlos en rellenos sanitarios e incinerarlos, hasta utilizarlos provechosamente en la producción vegetal. Sin embargo, hay limitaciones para su utilización en la agricultura debido a que pueden presentar carga patógena alta y los metales afectar a la cadena trófica a través de los cultivos y contaminar las aguas freáticas (Legret et al. 1988, Cennaro et al. 1991, Barbarick et al. 2004). De allí, que la metodología de aplicación debe guiarse por criterios sanitarios y agronómicos, así como por el contenido de metales pesados, tanto de los lodos como de los suelos receptores (Castro et al. 2007).
El uso agrícola de los lodos residuales textiles puede ser una alternativa que proporcione un doble beneficio: 1) el ambiental, al eliminarse los subproductos sin alteración significativa del equilibrio ecológico, 2) el agrícola, al modificar, manipular o incorporar los lodos en los sustratos o suelos para así mejorar las características físicas y la concentración de nutrimentos de los materiales mencionados (Benavides-Mendoza et al. 2007).
Considerando lo anterior los objetivos de este trabajo fueron evaluar si la aplicación de lodos textiles crudos al sustrato de crecimiento origina cambios negativos en la biomasa y composición química de plantas de lechuga y, por otra parte, si existe transferencia de metales pesados o patógenos por parte del lodo hacia las plantas bajo cultivo.
MATERIALES Y MÉTODOS
El experimento se llevó a cabo en un invernadero de la Universidad Autónoma Agraria Antonio Narro, ubicada en Saltillo, Coahuila, en la latitud norte 25° 23' y longitud oeste 101° 02', con una altitud de 1743 msnm. Se usaron lodos crudos de la empresa "Fábrica La Estrella", S.A. de C.V. (FLESA), ubicada en el municipio de Parras de la Fuente, Coahuila. Estos sólidos que constituyen el subproducto cuentan con certificado de no peligrosidad para el ambiente, con base en el análisis de corrosividad, reactividad, explosividad, toxicidad, inflamabilidad y biológico-infeccioso (CRETIB) de la Ley General de Equilibrio Ecológico y Protección al Ambiente (LGEEPA) de la Secretaría de Medio Ambiente y Recursos Naturales (SEMARNAT). Los lodos fueron colectados del centro de confinamiento de la empresa y se analizaron de acuerdo con la NOM-004-SEMARNAT-2002 (SEMARNAT 2002) en un laboratorio certificado por la Entidad Mexicana de Acreditación, A. C. (EMA) para verificar la presencia y concentración de coliformes fecales, Salmonella sp., huevos de helmintos, arsénico (As), cadmio (Cd), cromo (Cr), cobre (Cu), plomo (Pb), mercurio (Hg), níquel (Ni) y zinc (Zn). Adicionalmente se determinó la salinidad, la sodicidad, las características físicas y de fertilidad según la NOM-021-SEMARNAT-2000 (SEMARNAT 2000). Los lodos fueron mezclados con el sustrato de turba de musgo y perlita (relación 70:30 v/v) en concentraciones de 5, 10, 15 y 20 %, estableciendo además un testigo sin aplicación de lodo. Las mezclas fueron colocadas en macetas de polietileno de color negro con capacidad de 14 L. Como material biológico se utilizaron plántulas de lechuga (Lactuca sativa) de la variedad Great Lakes, las cuales germinaron sobre turba de musgo y perlita (70:30 v/v). A los 20 días después de la siembra fueron trasplantadas a las macetas que contenían las mezclas de sustrato y lodo, a razón de una planta por maceta. La incorporación de nutrimentos fue a través de la solución nutritiva de Steiner (Steiner 1961) mediante un sistema de riego por goteo.
Los lixiviados de los sustratos se monitorearon durante el transcurso del cultivo y se les determinó el pH y la conductividad eléctrica (CE) con un potenciómetro marca Hanna modelo Combo.
Se realizó un único muestreo al alcanzar las plantas la etapa de madurez necesaria para la cosecha, que ocurrió a los 64 días después del trasplante (ddt). En dicho muestreo se determinaron las variables descritas a continuación.
Para el peso fresco (PF) de la parte aérea se separó ésta de la raíz a la altura de la corona y se pesó en una balanza digital de la marca Medí Data modelo PS-5. Posteriormente, para obtener el peso seco (PS), las muestras fueron colocadas en una estufa deshidratadora marca Robertshawa a 60 0C durante 72 h, transcurrido ese tiempo se pesaron en una balanza analítica de la marca Ohaus modelo Pioneer. Se determinó la concentración de nitrógeno total (Nt) por el método micro Kjelhdal (AOAC 1980), fósforo (P) por el método colorimétrico (AOAC 1980) y para el potasio (K), calcio (Ca), magnesio (Mg), sodio (Na), hierro (Fe), manganeso (Mn), cobre (Cu) y zinc (Zn) se utilizó un espectrofotómetro de absorción atómica marca Varian AA-1275, de acuerdo con los métodos descritos por Rick et al. (1976). La concentración de vitamina C se determinó por el método volumétrico (AOAC 1980).
Para el análisis de la capacidad antioxidante total en hojas se utilizó un equipo de ensayo del estado total de antioxidantes Calbiochem® que consta de una solución amortiguadora de fosfato (pH 7.2), cromógeno (metmioglobina y ABTS® [catión radical 2,2-azinobis-(3-etilbenzotiazolin-6-sulfonato)]), sustrato (peróxido de hidrógeno estabilizado) y como estándar se utilizó trolox (6-hidroxi-2, 5, 7, 8-tetra-metilcroman-2-ácido carboxílico) en concentración 2.3 mM. Las hojas colectadas fueron congeladas de inmediato con nitrógeno líquido hasta su llegada al laboratorio, donde se depositaron en morteros de porcelana enfriados previamente. El tejido vegetal fue molido mientras se aplicaba constantemente nitrógeno líquido. Una vez terminada la molienda se tomaron 5 g del tejido macerado y se depositaron en tubos de plástico, se agregaron 10 mL de amortiguador de fosfato pH 7.2. Posteriormente se centrifugó a 3000 rpm por 10 min. Del sobrenadante se tomaron 20 (μL que se colocaron en microtubos para centrífuga con 1 mL de cromógeno. La lectura de la absorbancia se llevó a cabo en un espectrofotómetro de UV-Visible marca Thermo electron modelo Biomate 5, a una longitud de onda de 600 nm. A continuación se le agregaron 200 μL del sustrato, tras una espera de 3 min se tomó una segunda lectura. La fórmula para calcular la capacidad antioxidante total fue:
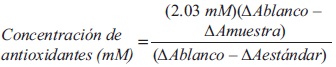
El diseño experimental utilizado fue completamente al azar con 15 repeticiones, siendo la unidad experimental una maceta con una planta de lechuga. Los datos se sometieron a un análisis de varianza y pruebas de medias Tukey (a ≤ 0.05), así como a un análisis de correlación de Pearson para la concentración de nutrimentos, con el paquete estadístico Statistical analysis system versión 6.0 (SAS 2001).
Para el análisis microbiológico y concentración de metales pesados en lechuga se tomaron al azar cinco unidades experimentales de cada tratamiento para obtener una muestra compuesta de 1 kg. Las muestras fueron conservadas a 4 °C para su transporte y se analizaron en un laboratorio acreditado por la EMA de acuerdo con la NOM-004-SEMARNAT-2002 (SEMARNAT 2002). Los resultados reportados se consideraron como un índice de la transferencia de microorganismos y metales del lodo a la planta.
RESULTADOS Y DISCUSIÓN
Análisis microbiológico y metales del lodo textil industrial
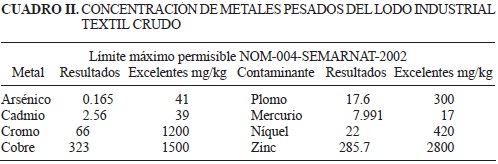
De acuerdo con los resultados del análisis microbiológico (Cuadro I) según la NOM-004-SEMAR-NAT-2002 (SEMARNAT 2002), el lodo textil fue categorizado tipo C por el contenido de coliformes fecales, lo que permite su uso con fines agrícolas, forestales y como mejorador de suelos.

El lodo textil industrial (Cuadro II) presentó concentraciones muy por debajo de lo indicado por la NOM-004-SEMARNAT-2002 (SEMARNAT 2002), para As, Cd, Cr, Cu, Pb, Hg, Ni y Zn, clasificándolo como un material excelente, con características adecuadas para su uso en la producción agrícola.
Análisis fisicoquímico del lodo textil industrial
Los resultados del análisis de salinidad y sodicidad del extracto de saturación de los lodos textiles crudos mostraron una conductividad eléctrica de 20.8 mS/cm, calificándolo como extremadamente salino. Por otra parte su pH de 8.4 lo convierte en material alcalino de acuerdo con la NOM-021-SEMARNAT-2000 (SEMARNAT 2000). Se encontraron concentraciones altas de cloruros (15.5 meq/L) y bicarbonatos (5.12 meq/L), una concentración media de sodio (3.713 meq/L) y moderadamente baja de sulfatos (21.95 meq/L; Richards 1980). Por las características anteriores el uso de estos lodos no puede ser indiscriminado y se requiere una adecuada supervisión (Otero et al. 1996). Lo anterior debido a que un empleo incorrecto puede ocasionar efectos indeseables (Felipó 1995), como es la reducción del desarrollo de las plantas debido a un aumento en el potencial osmótico del medio de crecimiento y, en consecuencia, de su potencial hídrico, así como restricciones en la absorción de nutrientes, presencia de efectos tóxicos y quemaduras (Madueño-Molina et al. 2006, Villa et al. 2006, Martínez-Villavicencio et al. 2011). Por ello, no fue posible su uso directo como sustrato y se mezcló con musgo de turba y perlita para diluir las sales presentes. Estudios anteriores (Benavides-Mendoza et al. 2007) indicaron que los lodos textiles deben mezclarse con musgo de turba en una proporción en volumen no mayor del 25 % por su alto contenido de sales.
Dentro de las características físicas el lodo textil presentó una textura franco arcillosa, con una densidad aparente de 1.05 g/cm y un 58 % de porosidad, contenido de materia orgánica de 4.69 % que se clasifica como alto, así como 3 % de carbonatos.
En cuanto al análisis nutrimental del lodo textil industrial se encontraron concentraciones extractables muy bajas de P (4.12 mg/kg), N inorgánico bajo (8.78 mg/kg), un contenido medio de Cu extractable (1.17 mg/kg), moderadamente alto de Mn extractable (14.76 mg/kg) y muy alto contenido de Ca (11 500 mg/kg), Mg (1412.50 mg/kg), Zn (56.90 mg/kg) y Fe (213.50 mg/kg), según la NOM-021-SEMAR-NAT-2000 (SEMARNAT 2000).
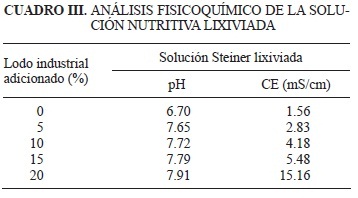
Análisis fisicoquímico de la solución nutritiva lixiviada
Los lixiviados de la solución nutritiva presentaron un aumento en el pH y CE (Cuadro III) conforme se incrementó el volumen de los lodos textiles en el sustrato. Estos cambios con toda seguridad ocurrieron en respuesta a las sales y otros compuestos presentes en el lodo textil crudo.
Peso de las plantas
La figura 1 ilustra los resultados para PF y PS, en donde se encontraron diferencias significativas entre los tratamientos para estas dos variables. El PF disminuyó frente al testigo al aplicar 20 % de lodo. En general, el PF de las plantas se consideró adecuado, a pesar de haber obtenido valores inferiores al testigo, rebasando incluso a la reportada en otros estudios con plantas bajo un buen manejo, cultivadas en suelo (Aruani et al. 2008) o hidroponia (Montero et al. 2006). En cambio, Mañas et al. (2000) afirman que la aplicación de lodos residuales al suelo en cantidad de 20 000 kg/ha duplicó el peso individual de las plantas de lechuga, respuesta no observada en el presente estudio en las plantas con el sustrato de musgo de turba y perlita.
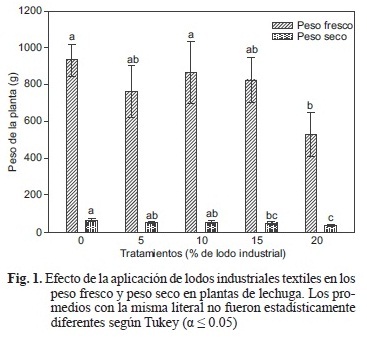
Resultados similares se obtuvieron para el PS, al observar que mediante la aplicación de lodos industriales textiles se obtuvieron valores por debajo del testigo (Fig. 1). Sin embargo, la disminución fue menor a la reportada por Carranza et al. (2009) quien cultivó lechugas en un suelo con CE de 2.6 mS/cm, que es inferior a la CE aportada por los lodos textiles en los diferentes tratamientos de esta investigación. Al igual que para el PF, es probable que esta respuesta frente a la mayor concentración de lodo textil sea resultado de la salinidad aportada por el material. Se sabe que la presencia de sales en alta concentración se asocia con menor biomasa (Aslam et al. 1993, Ebert et al. 1999), menor crecimiento foliar (Curtis y Láuchli 1986) y disminución en la capacidad fotosintética (Cramer et al. 1990).
Concentración de nutrimentos en las hojas de lechuga
La concentración de macronutrientes presentó diferencias significativas entre los tratamientos (Fig. 2). Para el caso del N y el P el tratamiento con 15 % de lodo industrial fue el que obtuvo la mayor concentración. Se sabe que bajo situaciones de exposición a la salinidad la concentración de estos elementos aumenta conforme crece la planta (Khan et al. 1998, Mariña 2001). No se encontraron efectos antagónicos ni sinérgicos para estos dos elementos. La absorción del nitrógeno no se vio afectada directamente por el lodo textil ni el pH que éste indujo al sustrato, debido a que el N posee un amplio rango en cual se encuentra disponible que va de 6.8 a 8. Por otro lado, el P se vio afectado positivamente con el incremento del lodo textil a pesar de que éste indujo una elevación en el pH del sustrato, contrario a lo que menciona Mendieta-Muñoz (2011) que a pH superior a 7.5 disminuye la disponibilidad y absorción del P. Por su parte el K aumentó junto con la concentración de lodo textil, seguramente al aporte adicional del elemento por parte del material. El K juega un papel relevante en los ajustes de la planta, que son necesarios para regular la absorción de agua y el potencial hídrico celular (Marshner 1995). El Ca mostró una respuesta irregular, con los valores más altos en los extremos de concentración del lodo textil. No se dispone de una explicación sobre esta respuesta ya que, si la presencia del lodo aumentara o disminuyera la absorción de este elemento, se observaría en una tendencia ascendente o descendente con respecto a la concentración de Ca. Por otra parte, si la absorción de Ca hubiese sido interferida por un exceso de otros cationes como el K, Mg y Na se observaría alguna correspondencia entre las respuestas con dichos elementos, lo cual no parece ocurrir. En cuanto al Mg se observó una tendencia parecida a la del Ca en la que se encontró una correlación positiva y significativa entre estos dos elementos (Cuadro IV). Esto puede deberse a que ambos elementos son muy asimilables en valores altos de pH (Mendieta-Muñoz 2011). Un efecto similar se dio entre el Ca y el Fe, contrario a lo indicado por Castellanos y Ojodeagua (2011). Para el contenido de Na la mayor concentración se presentó en el tratamiento al 5 % de lodo industrial, en tanto que disminuyó para el resto de los tratamientos, incluido el testigo. De nuevo la respuesta no parece responder a un aumento en la disponibilidad de Na al aumentar la cantidad de lodo textil incorporado al sustrato.
Por otro lado, al comparar estos valores de concentración de los macronutrientes con los reportados por Aruini et al. (2008), al aplicar N en forma química y gallinaza, se observa que las concentraciones de N y Ca son mayores, mientras que las de P y K son menores. Un caso similar fue el publicado por Olivares et al. (2002) al evaluar lechugas hidropónicas donde las concentraciones de N, P y K son menores, siendo por otra parte parecidas las de Ca y Mg. Estos resultados parecen indicar que la aplicación de lodos textiles industriales no se asocia con efectos negativos en la absorción de los macronutrientes, que se mantiene por encima de los rangos de suficiencia (Salisbury y Ross 1992)
La concentración de micronutrientes en los tejidos vegetales (Fig. 3) mostró resultados diversos según el elemento. El Cu y el Zn no mostraron cambio frente al testigo en los tratamientos con menor contenido de lodo. Sin embargo, con los mayores porcentajes de lodo sí hubo cambios. La respuesta fue negativa en el caso del Cu y positiva para el Zn. En cuanto al Fe y al Mn no se observó respuesta que indique que la absorción de los elementos se incrementa o disminuye en consideración al contenido de los lodos textiles en el sustrato. Ello hace difícil afirmar que la absorción de estos metales sea debida a la alta concentración presente en los lodos textiles. Udovenko (1985) sostiene que los micronutrimentos frenan la acumulación de iones tóxicos en las plantas, lo que conlleva a un incremento de la tolerancia al estrés. Sin embargo, es necesario destacar que estos funcionan solamente en suelos débilmente salinizados y que cuando los niveles de sales son altos, el efecto puede revertirse y ser perjudicial para las plantas (González et al. 2002).
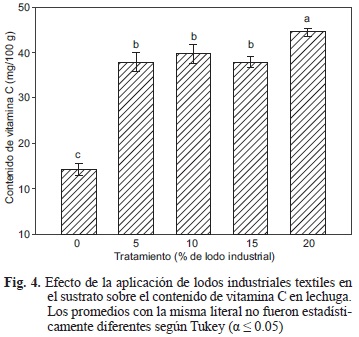
Contenido de vitamina C en hojas de lechuga
Se obtuvo una tendencia ascendente en el contenido de vitamina C conforme se incrementó el contenido del lodo textil industrial en el sustrato (Fig. 4). Vallejo y Estrada (2004) mencionan que el contenido nutricional promedio de la lechuga en cuanto a vitamina C es de 18 mg/100 g, valor cercano al obtenido por el testigo. Mientras que los estudios realizados por Ismail y Fun (2003) con lechuga en un sistema de producción orgánico reportaron valores similares a los del tratamiento con 20 % de lodo industrial, lo cual parece indicar cierta similitud en la respuesta de la vitamina C foliar frente al tratamiento orgánico, así como a la aplicación de los lodos industriales. El incremento de la vitamina C en la lechuga pudiera provenir del ajuste de la planta frente a la condición salina inducida por el lodo sobre la solución (Krauss et al. 2006), ya que aquel da lugar a un aumento de la conductividad eléctrica de la solución nutritiva. Se sabe que la vitamina C foliar está involucrada en una gran cantidad de procesos biológicos, muchos de los cuales se dirigen al balance redox y al control del estrés oxidante (Rice-Evans 2001, Marín et al. 2004) que son modificados por la salinidad. Asimismo, Serio et al. (2004) reportaron que un aumento en la cantidad de sales en la solución de riego se traduce en una mayor concentración de vitamina C.
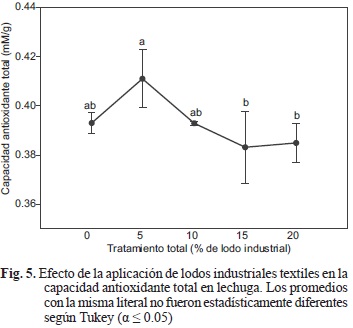
Capacidad antioxidante total
No se encontraron diferencias estadísticamente significativas para la capacidad antioxidante total entre los tratamientos de aplicación de lodo industrial y el testigo sin aplicación. Se observó, sin embargo, una mayor capacidad antioxidante al aplicar el lodo textil industrial al 5 % en comparación con las concentraciones mayores del mismo (Fig. 5). Es posible que esta respuesta negativa frente a la cantidad de lodo industrial aplicado sea el resultado de la condición de estrés inducida por las sales contenidas en los lodos (Hernández et al. 2000). La salinidad causa en las plantas la producción excesiva de especies reactivas del oxígeno (Mittler 2002, Chookhampaeng et al. 2008), que alteran el metabolismo celular normal mediante el daño oxidante a lípidos, proteínas y ácidos nucleicos (Zhu 2001, Imlay 2003). Es por ello que las plantas han desarrollado mecanismos de protección como la síntesis de antioxidantes (Harinasut et al. 2003), que son el conjunto de compuestos que se determinan al medir la capacidad antioxidante total. Cuando las plantas son sometidas a la salinidad, en el corto plazo responden acumulando antioxidantes (Frary et al. 2010) y ello eleva de forma transitoria la capacidad antioxidante total (Mittova et al. 2002). Sin embargo, la exposición a tiempos largos de salinidad parece que causa una disminución en la capacidad antioxidante, que fue lo que reflejaron los resultados aquí obtenidos.
Cantidad de microorganismos patógenos y metales pesados en las hojas de lechuga
La cantidad de los microorganismos patógenos en la lechuga mostró valores similares entre los tratamientos (Cuadro V). En cuanto al contenido de coliformes fecales los resultados están por debajo de los límites permisibles que establece la NOM-093-SSA1-1994 (SSA 1994). En el caso de huevos de helmintos los resultados fueron similares entre los tratamientos, manteniéndose por debajo de los criterios recomendados por la NOM-EM-034-FITO-2000 (SAGARPA 2000) y la NOM-004-SEMARNAT-2002 (SEMARNAT 2002).
Estas dos últimas normas, aunque no están enfocadas a los alimentos, pueden constituir un indicador de la posibilidad de transferencia de los patógenos del sustrato hacia las plantas. Para el caso de Salmonella, ésta se hizo presente en todos los tratamientos en la misma cantidad, a pesar de que los análisis del lodo y del agua de riego dieran como resultado ausencia de la misma. Lo que podría apuntar a la posibilidad de una contaminación externa a los lodos o en su caso a una propagación de esta bacteria por la presencia de características adecuadas como es la humedad, la temperatura y las concentraciones elevadas de nutrientes (Byappanahalli y Fujioka 1998). Se conoce por otro lado la gran movilidad y facilidad de estas bacterias para entrar en las plantas por medio de los estomas, radículas en germinación y áreas emergentes de las raíces laterales (Huang 1986, Hallmann et al. 1997, Sturz et al. 2000). Estos microorganismos pueden sobrevivir cuando se encuentran en las áreas húmedas y protegidas del vegetal (Seoanez 1987).
Para la concentración de metales pesados en las partes aéreas de plantas de lechuga los análisis no detectaron presencia de As, Cd, Cr, Cu, Pb, Hg y Ni. Esto puede deberse a que los metales pesados preferentemente se quedan en el córtex de las raíces (Zimdahl y Koeppe 1977), así como al alto pH de los lodos textiles que este influye negativamente en su disponibilidad, aumentando para el caso del Hg en un rango de pH de 4.0 a 5.0 (McLaughlin et al. 1999). Mientras que para la buena absorción de Pb, Cd, Ni y Cu los valores adecuados de pH deben de ser inferiores a 6.5 (Brown et al. 1989, Kabata-Pendias y Pendias 2001). Por su parte el Cr incrementa su disponibilidad a partir de un pH inferior a 5.5 y superior a 8.0. En general la mayoría de los metales pesados tienden a estar más disponibles con pH bajo, exceptuando el metaloide As, el cual muestra mayor disponibilidad con pH mayor a 7.0 (Kabata-Pendias 2011), aunque tiende a precipitarse formando hidróxidos con pH moderadamente altos, similares a los presentados por los lixiviados de los lodos de este estudio (Brown et al. 1989). Por otra parte, el alto contenido de materia orgánica presente en los lodos industriales pudo inhibir la biodisponibilidad de algunos metales (Basta et al. 2005), como en el caso específico del Cu (Doménech 1995). Un efecto similar de inmovilización se ha reportado por los carbonatos para el Cd (Rooney et al. 2006, Zhao et al. 2006), Ni (Kukier y Chaney 2001) y otros metales, con lo que se reduce de esta forma la fitotoxicidad. Es posible que haya ocurrido un efecto antagónico entre los altos contenidos de Ca, Fe y Zn presentes en el lodo industrial y el Ni (Wood et al. 2004) y el Cd (Perez-Carreras et al. 2004). En particular el Pb y el As parecen mostrar antagonismo con el Zn (Kabata-Pendias y Pendias 2001). En la literatura se describen efectos tanto antagónicos como sinérgicos entre los elementos mencionados (Williams y David 1976, Welch et al. 1999). Sin embargo, los efectos conjuntos son complejos y difíciles de modelar ya que dependen, entre otros factores, de la concentración y de la disponibilidad de los elementos, de la concentración y de la actividad de la materia orgánica, así como de la actividad biológica de las raíces y de los microorganismos asociados. En este sentido Kabata-Pendias (2011) señala que cada elemento parece mostrar niveles de bioacumulación preferencial en las plantas. En general se presenta el siguiente orden de alta a baja bioacumulación: Cd, Zn, Hg, Pb, As, Ni y Cr. Sin embargo, otros autores como Intawongse y Dean (2006) indican que la biodisponibilidad de los metales presentes en los sustratos muestra el siguiente orden de mayor a menor disponibilidad: Mn, Zn, Cd, Cu y Pb (2006). Lo anterior parece indicar que la respuesta de acumulación de metales en los tejidos de las plantas está relacionada de forma compleja a múltiples factores. El Zn (Fig. 3) probablemente se acumuló en las plantas en gran concentración debido a su alta disponibilidad en el lodo industrial. Sin embargo, las concentraciones elevadas de Zn no superan los limites permisibles de ingesta diaria que son de 12 y 15 mg/día para mujeres y hombres, respectivamente (Nirmal et al. 2007). Aunque se ha reportado que por lo general los efectos tóxicos del Zn sólo se presentan a partir de la ingesta prolongada de dosis superiores a los 150 mg (Olivares-Grohnert et al. 2010).
CONCLUSIONES
La aplicación de los lodos textiles industriales en el sustrato de crecimiento incrementó los valores tanto de pH como de la CE en los lixiviados. Sin embargo, esto no afectó desfavorablemente el PF y PS, mientras que en el contenido mineral incrementó el N, P, K, Ca, Na, Cu, Mn, Fe y Zn, pero disminuyó el Mg. La presencia del lodo industrial aumentó la concentración de vitamina C sin modificar la capacidad antioxidante total. No se encontró transferencia de metales pesados por parte del lodo textil, pero sí de huevos de helmintos y coliformes fecales hacia la planta, aunque los valores de transferencia estuvieron por debajo de lo establecido en las normas ambientales regulatorias de México. Con lo anterior se sugiere utilizar los lodos textiles industriales en cultivos en donde la parte comestible no se encuentre en contacto directo con el sustrato o bien en cultivos ornamentales o para la producción industrial de fibras u otros productos.
REFERENCIAS
AESAN (2005). CE Nº 2073/2005. Relativo a los criterios microbiológicos aplicables a los productos alimenticios. Agencia Española de Seguridad Alimentaria y Nutrición. Diario Oficial de la Unión Europea. 15 de noviembre de 2005. 26 p. [ Links ]
AOAC (1980). Official Methods of Analysis. 13a ed. Association of Official Analytical Chemists. Washington, D.C. 1018 p. [ Links ]
Aruani M.C., Gili P., Fernández L., González R., Reeb P. y Sánchez E. (2008). Utilización del nitrógeno en diferentes manejos de fertilización en lechuga (Lactuca sativa L.) y su efecto sobre algunas variables biológicas del suelo, Neuquen Argentina. Agro Sur. 36, 147-157. [ Links ]
Aslam M., Qureshi R.H. y Ahmed N. (1993). A rapid screening technique for salt tolerance in rice (Oryza sativa L.). Plant Soil 150, 99-107. [ Links ]
Barbarick K., Doxtader K., Rédente E. y Brobst R. (2004). Biosolids effects on microbial activity in shrubland and grassland soils. Soil Sci. 169, 176-187. [ Links ]
Basta N.T., Ryan J.A. y Chaney R.L. (2005). Trace element chemistry in residual-treated soil: key concepts and metal bioavailability. J. Environ. Qual. 34, 49-63. [ Links ]
Benavides-Mendoza A., Ramírez H., Ruiz-Torres N., Perales-Huerta A., Cornejo-Oviedo E., Ortega-Ortiz H. y Dávila-Salinas R.V. (2007). Aplicación de subproductos industriales de la Compañía Industrial de Parras, S.A. de C.V en sustratos para la siembra y crecimiento de plantas. En: Tópicos selectos de botánica. (M. González-Álvarez y S.M. Salcedo Martínez, Eds.). Universidad Autónoma de Nuevo León, Monterrey, México, pp. 147-162. [ Links ]
Brown P.H., Dunemann L., Schultz R. y Marschner H. (1989). Influence of redox potential and plant species on the uptake of nickel and cadmium from soils. Zh. Pflanzenernahr. Bodenkd. 152, 85-91. [ Links ]
Byappanahalli M.N. y Fujioka R.S. (1998). Evidence that tropical soil environment can support the growth of Escherichia coli. Wat. Sci. Tech. 38, 171-174. [ Links ]
Carranza C., Lanchero O., Miranda D. y Chávez B. (2009). Análisis del crecimiento de lechuga (Lactuca sativa L) "Batavia" cultivada en un suelo salino de la sabana de Bogotá. Agron. Colomb. 27, 41-48. [ Links ]
Castellanos J. y Ojodeagua J.L. 2011. Formulación de solución nutritiva. En: Manual de producción de tomate en invernadero. (J. Castellanos, Ed.). Ocma soluciones impresa. León, Guanajuato, México. pp 132-156. [ Links ]
Castro-Paz C., Henríquez O. y Freres R. (2007). Posibilidades de aplicación de lodos o biosólidos a los suelos del sector norte de la Región Metropolitana de Santiago. Rev. Geogr. Norte Gd. 37, 35-45. [ Links ]
Cennaro M., Vanni A., Ferrara E., Petronio B., Petruzzelli G. y Liberatori A.A. (1991). Characterization study of organic matter in municipal treatment sludges by reversed-phase HPLC cromatography. J. Environ. Sci. Health. 26, 1115-1138. [ Links ]
Chookhampaeng S., Pattanagul W. y Theerakulpisut P. (2008). Effect of salinity on growth, activity of antioxidant enzymes and sucrose content in tomato (Lycopersicon esculentum Mill.) at the reproductive stage. Sci. Asia. 34, 69-75. [ Links ]
Cramer G.R., Epstein E. y Láuchli A. (1990). Effects of sodium, potassium, and calcium on salt-stressed barley. I. Growth analysis. Physiol. Plant. 80, 83-88. [ Links ]
Curtis P.S. y Láuchli A. (1986). The role of leaf area development and photosynthetic capacity in determining growth of kenat under moderate salt stress. Aust. J. Plant Physiol. 18, 553-565. [ Links ]
Digesa (2003). 615-2003-SA/DM. Norma sanitaria que establece los criterios microbiológicos de calidad sanitaria e inocuidad para los alimentos y bebidas de consumo humano. Dirección General de Salud Ambiental del Perú. Presidencia del consejo de ministros. 30 de mayo de 2003. [ Links ]
Doménech X. (1995). La Química del Suelo. El impacto de los contaminantes. Ediciones Mirahuano, Madrid, España. 190 p. [ Links ]
Dos Santos A.B., Cervantes F.J. y Van Lier J.L. (2007). Review paper on current technologies for decolonisation of textile wastewaters: Perspectives for anaerobic biotechnology. Bioresour. Technol. 98, 2369-2385. [ Links ]
Ebert G., Casierra F. y Lüdders P. (1999). Influence of NaCl salinity on growth and mineral uptake of lulo (Solanum quitoense L.). Angewandte Bot. 73, 31-33. [ Links ]
Felipó O.M.T. (1995). Reutilización de residuos urbanos y posible contaminación. En: Gestión y utilización de residuos urbanos para la agricultura. (AEDOS, Ed.). AEDOS, Barcelona, España, pp. 27-37. [ Links ]
Fick K.R., Miller S.M., Funk J.D., McDowell L.R. y Houser R.H. (1976). Methods of mineral analysis for plant and animal tissues. University of Florida Institute of Food and Agriculture. Gainesville, FL. 81 p. [ Links ]
Frary A., Gol D., Keles D., Okmen B., Pinar H., Sigva H., Yemenicioglu A. y Doganlar S. (2010). Salt tolerance in Solanum pennellii: antioxidant response and related QTL. BMC Plant Biology 10, 1-16. [ Links ]
Garcés-Giraldo L.F. y Peñuela-Mesa G.A. (2007). Tratamiento de las aguas residuales de una industria textil utilizando colector solar. Rev. Lasallista Investig. 4, 24-31. [ Links ]
González L.M., González M.C. y Ramírez R. (2002). Aspectos generales sobre la tolerancia a la salinidad en las plantas cultivadas. Cultivos Tropicales 23, 27-37. [ Links ]
Hallmann J., Quadt-Hallman A., Mahaffee W.F. y Kloep-per J.W. (1997). Bacterial endophytes in agricultural crops. Can. J. Microbiol. 43, 895-914. [ Links ]
Harinasut P., Poonsopa D., Roengmongkol K. y Charoen-sataporn R. (2003). Salinity effects on antioxidant enzymes in mulberry cultivar. Sci. Asia. 29, 109-113. [ Links ]
Hernández J.A., Jiménez A., Mullineaux P.M. y Sevilla F. (2000). Tolerance of pea (Pisum sativum L.) to long-term salt stress is associated with induction of antioxidant defenses. Plant Cell Environ. 23, 853-862. [ Links ]
Huang J.S. (1986). Ultrastructure of bacterial penetration in plants. Annu. Rev. Phytopathol. 24, 141-157. [ Links ]
Imlay J. (2003). Pathways of oxidative damage. Annu. Rev. Microbiol. 57, 395-418. [ Links ]
Intawongse M. y Dean J. (2006). Uptake of heavy metals by vegetable plants grown on contaminated soil and their bioavailability in the human gastrointestinal tract. Food Addit. Contam. 23, 36-48. [ Links ]
Islmail A. y Fun C.S. (2003). Determination of vitamin C, p-carotene and riboflavin contents in five green vegetables organically and conventionally grown. Malaysian J. Nutr. 9, 31-39. [ Links ]
Kabata-Pendias, A. y Pendias H. (2001 ). Trace elements in soils and plants. 3ra. edición. CRC Press, Boca Raton, 413 p. [ Links ]
Kabata-Pendias A. (2011 ). Trace elements in soils and plants. 4ta. edición. CRC Press, Boca Raton, 467 p. [ Links ]
Khan M.G., Silberbush M. y Lips S.H. (1998). Responses of alfalfa to potasium, calcium, and nitrogen under stress induced by sodium chloride. Plant Biol. 40, 251-259. [ Links ]
Krauss S., Schnitzler W.H., Grassmann J. y Woitke M. (2006). The influence of different electrical conductivity values in a simplified recirculating soilless system on inner and outer fruit quality characteristics of tomato. J. Agric. Food Chem. 54, 441-448. [ Links ]
Kukier U. y Chaney R.L. (2001). Amelioration of nickel phytotoxicity in muck and mineral soils. J. Environ. Qual. 30, 1949-1960. [ Links ]
Legret M., Divet L. y Juste C. (1988). Migration et speciation des metauxlourdsdans un sol soumis á des epandages de boues de station d'epuration á tres forte charge en Cd et Ni. Water Residual 22, 953-959. [ Links ]
Mañas P., Castro E., Sánchez J.C. y de las Heras J. (2000). Uso de lodos digeridos procedentes de una e.d.a.r. de lechos bacterianos en cultivos hortícolas. Memorias. II Congreso Ibérico sobre Planeamento e Gestao de Agua. Oporto. 9 al 12 de noviembre, 2000. pp. 1-6. [ Links ]
Madueño-Molina A., García-Paredes D., Martínez-Hernández J. y Rubio-Torres C. (2006). Germinación y desarrollo de plántulas de frijolillo Rhynchosia minima (L) DC en condiciones de salinidad. Terra Latinoamericana 24, 47-54. [ Links ]
Marín A., Ferreres F., Tomás-Barberán F.A. y Gil M.I. (2004). Characterization and quantification of antioxidant constituents of sweet pepper (Capsicum annuum L.). J. Agric. Food Chem. 52, 3861-3869. [ Links ]
Mariña C. (2001). Efecto de la fertilización nitrogenada sobre algunos aspectos fisiológicos del arroz (Oryza sativa L.) en suelos salinizados. Tesis de Maestría. Universidad de La Habana. La Habana, Cuba, 80 pp. [ Links ]
Marschner H. (1995). Mineral Nutrition of Higher Plants. 2da. edición. Academic Press Ltd. Londres, Reino Unido, 889 pp. [ Links ]
Martínez-Villavicencio N., López-Alonzo C.V., Basurto-Sotelo M. y Pérez-Leal R. (2011). Efectos por salinidad en el desarrollo vegetativo. Tecnociencia 5, 156-161. [ Links ]
McLaughlin M.J., Parker D.R. y Clarke J.M. (1999). Metals and micronutrients - food safety issues. Field Crops Res. 60, 143-163. [ Links ]
Mendieta-Muñoz L. (2011). Distribución espacial de nutrimentos en la solución del suelo para la producción intensiva de fresa. Tesis de maestría. Postgrado de edafología. Colegio de Postgraduados. Montecillo, Texcoco, Estado de México, México, 86 pp. [ Links ]
Mittler R. (2002). Oxidative stress, antioxidants and stress tolerance. Trends Plant Sci. 7, 405- 410. [ Links ]
Mittova V., Tal M., Volokita M. y Guy M. (2002). Salt stress induces up-regulation of an efficient chloroplast antioxidant system in the salt-tolerant wild tomato species Lycopersiconpennellii but not in the cultivated species. Physiol. Plant. 115, 393-400. [ Links ]
Montero S. M., Singh B. K. y Taylor R. (2006). Evaluación de seis estructuras de producción hidropónica diversificada en el trópico húmedo de Costa Rica. Tierra Tropical 2, 27-37. [ Links ]
Nirmal-Kumar J. I., Soni H. y Kumar R. N. (2007). Characterization of heavy metals in vegetables using inductive coupled plasma analyzer (ICPA). J. Appl. Sci. Environ. Manage. 11, 75-79. [ Links ]
Olivares E., Peña E. y Aguilar G. (2002). Nutrición mineral y estrés oxidativo por metales en espinaca y lechuga, en comparación con dos malezas asociadas, en cultivos semi-urbanos. Interciencia 27, 454-564. [ Links ]
Olivares-Grohnert M., Castillo-Durán C. y Dagach-Imbarach R. U. (2010). Cobre y cinc. En: Tratado de nutrición: Bases fisiológicas y Bioquímicas de la nutrición. (A. Gil, Ed.). Editorial Médica Panamericana, Madrid, España, pp. 687-704. [ Links ]
Otero J. L., Andrade M. L. y Marcet P. (1996). Caracterización química y evaluación agronómica de dos tipos de lodos residuales. Inv. Agric. Prod. Veg. 11, 117-131. [ Links ]
Pérez-Carreras L., Moreno-García A. M. y González-Parra J. (2004). Índices de acumulación de metales pesados en granos y hojas de trigo. Schironia 3, 5-9. [ Links ]
Richards L. A. (1980). Suelos salinos y sódicos. Editorial Limusa, D.F., México, 169 pp. [ Links ]
Rice-Evans C. (2001). Flavonoid antioxidants. Curr. Med. Chem. 8, 797-807. [ Links ]
Rooney C. P., Zhao F. J y McGrath S. P. (2006). Soil factors controlling the expression of copper toxicity to plants in a wide range of European soils. Environ. Toxicol. Chem. 25, 726-732. [ Links ]
RTCA. (2009). RTCA 67.04.50:08. Establece los parámetros microbiológicos de la inocuidad de los alimentos y sus límites de aceptación para el registro y la vigilancia en los puntos de comercialización. Ministerio de Salud Pública. Reglamento Técnico Centroamericano. 20 de marzo de 2009. [ Links ]
Salcedo-Pérez E., Vázquez-Alarcón A., Krishnamurthy L., Zamora-Natera F., Hernández-Álvarez E. y Rodríguez-Macías R. (2007). Evaluación de lodos residuales como abono orgánico en suelos volcánicos de uso agrícola y forestal en Jalisco, México. Interciencia 32, 115-120. [ Links ]
Salisbury F.B. y Ross C.W. (1992). Plant Physiology. Wadsworth Publishing Company, Inc., Belmont, E.U.A, 759 pp. [ Links ]
SAGARPA (2000). Norma Oficial Mexicana NOM-EM-034-FITO-2000. Requisitos y especificaciones para la aplicación y certificación de buenas prácticas agrícolas en los procesos de producción de frutas y hortalizas frescas. Secretaria de Agricultura Ganadería, Desarrollo Rural, Pesca y Alimentación. Diario Oficial de la Federación. 31 de octubre de 2000. [ Links ]
SAS Institute. (2001). PROC user's manual. 6ta. edición. SAS Institute. Cary, NC, E.U.A. 252 pp. [ Links ]
SEMARNAT (2000). Norma Oficial Mexicana NOM-021-RECNAT-2000. Que establece las especificaciones de fertilidad, salinidad y clasificación de suelos. Estudios Muestreo y análisis. Secretaria de Medio Ambiente y Recursos Naturales. Diario Oficial de la Federación. 31 de diciembre de 2002. [ Links ]
SEMARNAT (2002). Norma Oficial Mexicana NOM-004-SEMARNAT-2002. Protección ambiental lodos y biosólidos especificaciones y límites máximos permisibles de contaminantes para su aprovechamiento y disposición final. Secretaria de Medio Ambiente y Recursos Naturales. Diario Oficial de la Federación. 15 de agosto de 2003. [ Links ]
Seoanez M. (1987). La contaminación agraria. Instituto Nacional de Investigaciones Agrarias, Madrid, España, 275 pp. [ Links ]
Serio F., De Gara L., Caretto S., Leo L. y Santamaría P. (2004). Influence of an increased NaCl concentration on yield and quality of cherry tomato grown in posidonia (Posidonia oceanica (L) Delile). J. Sci. Food Agric. 84, 1885-1890. [ Links ]
SSA (1994). Norma Oficial Mexicana NOM-093-SSA1-1994. Bienes y servicios. Prácticas de higiene y sanidad en la preparación de alimentos que se ofrecen en establecimientos fijos. Secretaria de Salud. Diario Oficial de la Federación. 4 de octubre de 1995. [ Links ]
Steiner A.A. (1961). A universal method for preparing nutrient solutions of a certain desired composition. Plant Soil. 15, 134-154. [ Links ]
Sturz A.V, Christie B.R. y Nowak J. (2000). Bacterial endophytes: potential role in developing sustainable systems of crop production. Crit. Rev. Plant Sci. 19, 1-30. [ Links ]
Udovenko G. V. (1985). Vías para la elevación de la productividad de las plantas cultivadas en suelos salinizados.Ciencias de la Agricultura 25, 77-84. [ Links ]
Vallejo-Cabrera F.A. y Estrada-Salazar E.I. (2004). Producción de hortalizas de clima cálido. Universidad Nacional de Colombia, Cali, Colombia, 345 pp. [ Links ]
Villa-Castorena M., Catalán-Valencia E.A., Inzunza-Ibarra M.A. y Ulery A.L. (2006). Absorción y traslocación de sodio y cloro en plantas de chile fertilizadas con nitrógeno y crecidas con estrés salino. Rev. Fitotec. Mex. 29, 79-88. [ Links ]
Welch R.M., Hart J.J., Norvell W.A., Sullivan L.A. y Kochian L.V (1999). Effects of nutrient solution zinc activity on net uptake, translocation, and root export of cadmium and zinc by separated sections of intact durum wheat (Triticum turgidum L. var durum) seeding roots. Plant Soil 208, 243-250. [ Links ]
Williams C. H. y David D. J. (1976). The accumulation in soil of cadmium residues from phosphate fertilizers and their effect on the cadmium content of plants. Soil Sci. 121, 86-93. [ Links ]
Wood B.W., Reilly C.C y Nyczepir A.P. (2004). Mouse-ear of Pecan: A nickel deficiency. HortScience. 39, 1238-1242. [ Links ]
Zhao F.J., Rooney C.P., Zhang H. y McGratht S.P. (2006). Comparison of soil solution speciation and diffusive gradients in thin-films measurement as an indicator of copper bioavailability to plants. Environ. Toxicol. Chem. 25, 733-742. [ Links ]
Zimdahl R.L. y Koeppe D.E. (1977). Uptake by plants. En: Lead in the Environment. (W.R. Boggess y B.G. Wixson, Eds.). Castle House Publications Ltd. Washington D.C., E.U.A. pp. 99-104. [ Links ]
Zhu J.K. (2001). Plant salt tolerance. Trends Plant Sci. 6, 66-71. [ Links ]














