Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista internacional de contaminación ambiental
versão impressa ISSN 0188-4999
Rev. Int. Contam. Ambient vol.30 no.2 Ciudad de México Mai. 2014
Efecto de la salinidad en la adsorción de un herbicida en suelos agrícolas
Effect of salinity on adsorption of a herbicide in agricultural soils
Luis Carlos GONZÁLEZ-MÁRQUEZ1 y Anne M. HANSEN2*
1 Departamento de Ingeniería y Tecnología, Universidad de Occidente, Unidad Guasave, Sinaloa, México
2 Coordinación de Hidrología Subcoordinación de Hidrología Subterránea, Instituto Mexicano de Tecnología del Agua *Autora responsable; ahansen@tlaloc.imta.mx
Recibido octubre 2013,
aceptado abril 2014
RESUMEN
Para entender el efecto de la salinidad sobre la adsorción del herbicida atrazina en suelo, se determinó la influencia de las concentraciones de cloruros de sodio y de calcio en este proceso en dos suelos de una zona agrícola de México. Los experimentos de adsorción se realizaron con muestras de suelo del Distrito de Riego 063 (DR 063), Guasave, Sinaloa, México, suspendidas en 10 mM de CaCl2, en presencia de varias concentraciones de diferentes electrolitos y atrazina (0.01, 0.05, 0.1, 0.5 y 1.0 mg/L) con trazador radiactivo (347.4 Bq U-ring-14C, Sigma Chemical Company, San Luis, MO, EUA). Se encontró que para todos los electrolitos el tiempo requerido para alcanzar el equilibrio de adsorción de atrazina fue menor a 24 h y las isotermas de adsorción se ajustaron al modelo de Freundlich. La presencia de sodio en la solución acuosa favoreció la adsorción e inhibió la desorción de atrazina en los suelos. El incremento de las concentraciones de sodio y de calcio a aproximadamente 40 mM y 60 mM, respectivamente, no afectó significativamente (P < 0.05) la adsorción de atrazina. Sin embargo, sí se presentaron diferencias en la desadsorción del herbicida con el incremento de las sales. Los resultados de este estudio indican que el incremento de la salinidad, principalmente por el aumento de sodio en el sistema agua-suelo, tiene efectos importantes en el destino final de la atrazina, dado que la salinización de los suelos favorece la adsorción de este compuesto e inhibe su desadsorción. Es importante considerar estas propiedades cuando se analizan las opciones de aplicación y en el manejo del saneamiento de suelos contaminados con atrazina.
Palabras clave: atrazina, cloruro de sodio, cloruro de calcio, adsorción, desorción, atenuación natural.
ABSTRACT
To understand the effect of salinity on the adsorption of the herbicide atrazine in two soils from a Mexican agricultural area, the influence of sodium and calcium chloride concentrations were determined. Adsorption experiments were performed with soil samples from Irrigation District 063 (DR 063), Guasave, Sinaloa, Mexico, suspended in 10 mM CaCl2, in the presence of several concentrations of different electrolytes and atrazine (0.01, 0.05, 0.1, 0.5 and 1.0 mg/L) with radioactive tracer (347.4 Bq U-ring-14C, Sigma Chemical Company, St. Louis, MO, USA). It was found that for all the electrolytes, the time required to reach equilibrium adsorption of atrazine was less than 24 h and the adsorption isotherms were adjusted to Freundlich model. The presence of sodium in the aqueous solution favored the adsorption and inhibited desorption of atrazine in soils. Increasing the concentrations of sodium and calcium to about 40 mM and 60 mM, respectively, did not significantly affect (P <0.05) the adsorption of atrazine. However, there were differences in desorption of the herbicide with the increase of salts concentrations. The results of this study indicate that increased salinity, mainly caused by increased sodium concentrations in the soil-water system, has important effects on the fate of atrazine, due to salinization of soils favors the adsorption of atrazine, and inhibits its desorption. It is important to consider these properties when application options are analyzed as well as in the management and remediation of soils contaminated with atrazine.
Key words: atrazine, sodium chloride, calcium chloride, adsorption, desorption, natural attenuation.
INTRODUCCION
Como consecuencia del proceso de adsorción, los herbicidas se retienen sobre superficies de partículas minerales y orgánicas del suelo, provocando un comportamiento diferente de las moléculas disueltas en el agua del suelo. Por su menor tamaño y consecuente mayor área de superficie, la fracción coloidal del suelo tiende a retener las moléculas de los herbicidas. Por consiguiente, la adsorción de los herbicidas por la fracción coloidal del suelo actúa modificando los procesos de degradación y transporte de herbicidas en el suelo, así como la actividad de estas sustancias para combatir a las plagas a los que son destinados. Estos procesos tienen importantes repercusiones para el destino final de los herbicidas y sobre los mecanismos de transporte en el suelo, por lo que el conocimiento del proceso de adsorción en la fracción coloidal del suelo es fundamental en la descripción de la actividad herbicida y el destino de la atrazina en el suelo (Sánchez Martín y Sánchez Camazano 1984). La atrazina (2-cloro-4-etilamino-6-isopropilamino-1,3,5-triazina) es un herbicida selectivo ampliamente utilizado en las zonas agrícolas de México para el control de malezas de hoja ancha, es absorbido principalmente por las raíces y las hojas, provocando la inhibición de la fotosíntesis en las malezas (Syngenta 2006). Dado que se ha encontrado que este herbicida llega a contaminar fuentes de abastecimiento de agua, se asocia con riesgos para la salud (Van Leewen et al. 1999, Tappe et al. 2002, Gilliom et al. 2006, Hernández-Antonio y Hansen 2011).
La adsorción de atrazina se puede favorecer o inhibir por la influencia de diferentes componentes del suelo (Blume et al. 2004, Ling et al. 2005, González-Márquez y Hansen 2009a), mientras que por efecto de envejecimiento se incrementa la resistencia para que el herbicida sea desadsorbido del suelo (Mersie et al. 1998, Gao et al. 1998, Lesan y Bhandari 2003). Dependiendo del tipo de suelo y de la concentración de materia orgánica (M.O.), se ha reportado histéresis en las curvas de adsorción-desadsorción de la atrazina en función del tiempo (Ma et al. 1993, Lesan y Bhandari 2003), donde la tasa de desadsorción es menor que la de adsorción. Entre las posibles causas de esta histéresis se encuentra la incapacidad del herbicida de alcanzar el equilibrio durante la adsorción o desadsorción (Altfelder et al. 2000), interacciones irreversibles del herbicida con la M.O. o los minerales arcillosos del suelo (Bhandari et al. 1996) y a la retención de moléculas adsorbidas en meso y micro poros dentro de las estructuras minerales y de la M.O. (Farrell y Reinhard 1994, Weber et al. 1998).
La concentración de sales en el suelo también puede afectar la adsorción de plaguicidas, dependiendo de la composición y concentración de la sal y de las características del plaguicida y del suelo adsorbente (Alva y Singh 1991, De Jonge y De Jonge 1999, Kah 2007). Clausen et al. (2001) reportaron un incremento en la capacidad de adsorción de mesocrop y de 2,4-D en caolinita, con el aumento en la concentración de CaCl2 en sistemas agua-suelo. Asimismo, Kah (2007) reportó resultados similares sobre la adsorción de 2,4-D y flupirsulfurón-metil en suelos franco arcillo arenosos. Sin embargo, Hyun y Lee (2004) reportaron que el incremento en la concentración de CaCl2 disminuyó la adsorción de prosulfurón en un suelo con alta capacidad de intercambio catiónico.
La influencia positiva de las sales en la adsorción de la atrazina se debe en parte a que los cationes que componen las sales sustituyen los protones en las superficies minerales y orgánicas del suelo, causando una ligera disminución en el pH y aumentando la carga positiva del suelo, favoreciendo así la adsorción del herbicida (De Jonge y De Jonge 1999). Las sales también ocasionan la compresión de la capa difusa de los componentes del suelo, favoreciendo la formación de complejos entre cationes multivalentes en el suelo y plaguicidas como atrazina y glifosato (Laird et al. 1992, De Jonge y De Jonge 1999, Mao y Ren 2010). De Jonge y De Jonge (1999) encontraron que la estabilidad de los coloides en un suelo franco arenoso también influye en la adsorción de plaguicidas, ya que estos sólidos, igual que la M.O. del suelo, tienden a aglomerarse e incrementar su masa específica con el aumento de la salinidad, logrando así favorecer la adsorción. Sin embargo, resultados reportados por González-Márquez y Hansen (2009b) indican que la adsorción de atrazina en la materia orgánica (ácido húmico Aldrich) se inhibe con el incremento de la salinidad, aun cuando la masa específica del adsorbente aumenta.
Debido a lo anterior, no se puede generalizar el efecto de la concentración de sales en la adsorción de plaguicidas en suelos, ya que las interacciones o mecanismos de adsorción son complejos y dependen tanto de la naturaleza del plaguicida como del suelo como medio adsorbente. Es por ello que en la literatura se han reportado tanto efectos positivos como negativos de la salinidad del suelo en la adsorción de plaguicidas. En este trabajo se investiga el efecto del incremento de la concentración de sales de sodio y de calcio en las cinéticas e isotermas de adsorción y desadsorción de atrazina, en suelos agrícolas del noroeste de México, con el fin de contribuir al entendimiento de la migración del herbicida en suelos salinos.
MATERIALES Y MÉTODOS
Caracterización de muestras de suelo
Se caracterizaron dos muestras de suelo obtenidas de parcelas agrícolas del noroeste del país (Cuadro I). La muestra de suelo I fue caracterizada por González-Márquez y Hansen (2009a). La muestra II se colectó en marzo de 2007, de una parcela donde el principal cultivo sembrado fue maíz. La muestra se obtuvo de los primeros 20 cm de la superficie del suelo con una barrenadora manual, obteniendo 2 kg de suelo que se colocaron en bolsas de plástico y bajo refrigeración en hielo durante el transporte al laboratorio. El suelo fue secado a temperatura ambiente, disgregado, tamizado (≤ 2 mm) y almacenado en refrigeración a 4 °C. En las muestras de suelo se evaluó el pH (Eckert y Sims 1995) y la conductividad eléctrica (C.E.) (Gartley 1995) en suspensiones de suelo:agua (relación 1:2). La M.O. se evaluó acorde al método D 2974-00 (ASTM 2000), el cual consiste en la calcinación de la muestra de suelo a 440 °C y por diferencia de pesos se determina el contenido de M.O. El contenido de arena, limo y arcilla se evaluó por el método D42-63 (ASTM 1998); la distribución de partículas de tamaño mayor a 0.074 mm se determinó por tamizado, mientras que las partículas de tamaño menor se evaluaron mediante un proceso de sedimentación. Sodio, nitratos y amonio se evaluaron con un electrodo ion selectivo; el sodio se evaluó en una suspensión suelo:agua (relación 1:2) (Instrulab 5771101); los nitratos y el amonio en una suspensión suelo:2MKCl (relación 1:2.5) (Griffin et al. 1995). La concentración de calcio se evaluó fotométricamente en una suspensión suelo:agua (relación 1:2) (Merck 2006).
Evaluación de la adsorción y desadsorción de atrazina
La metodología para evaluar las cinéticas e isotermas de adsorción y desadsorción de atrazina fue acorde con la guía TG 106 de la Organización para la Cooperación y el Desarrollo Económico (OCDE 2000) y a una modificación de la misma. La modificación consistió en el uso de diferentes concentraciones salinas como electrolito de fondo y diferentes concentraciones de atrazina de las descritas en la guía. En recipientes de Teflon® de 50 mL, a 25 ± 1 °C, se pusieron en contacto 2 g de suelo con 9 mL de solución salina (preparada con agua MilliQ, Millipore®, Billerica, MA., resistividad de 18.2 MΩ cm). En el cuadro II se presentan las características de las soluciones salinas utilizadas. Los experimentos realizados con la solución con clave "Ia" fueron experimentos testigo. Se agitaron los recipientes a 80 rpm en un rotador (Cole Palmer, modelo 7637) durante al menos 20 h, con el fin de hidratar el suelo y homogeneizar el sistema agua-suelo. Posteriormente, se agregó 1 mL de una solución de atrazina 10 mg/L a cada recipiente; la solución se preparó a partir de un estándar analítico de atrazina (grado cromatográfico; Chem service, West Chester, PA, EUA) y atrazina marcada isotópicamente (334 Bq U-ring-14C, Sigma Chemical Company, San Luis, MO, EUA). La concentración final de atrazina en los recipientes fue de 1 mg/L. Se preparó un recipiente adicional sin suelo (blanco) para evaluar la posible adsorción de atrazina en las paredes, y un recipiente sin trazador radiactivo para cuantificar la radiactividad "de fondo". Los recipientes se agitaron a 80 rpm durante 1, 7, 15, 24, 48 y 72 h y posteriormente, se centrifugaron a 12 000 rpm durante 15 min. Se homogeneizó 1 mL de sobrenadante con 9 mL de coctel de centelleo (BSC® Amersham Biosciences) y se cuantificaron las emisiones beta de 14C-atrazina en un equipo de centelleo líquido (LS 6500 Beckman Coulter). La eficiencia del equipo fue del 96.5 %, con base en el conteo de 104 decaimientos por minuto de un estándar de 14C (Beckman Coulter, lote S312102). La concentración de atrazina adsorbida se calculó con base en la diferencia entre la atrazina total aplicada y la concentración disuelta, cuantificada en el sobrenadante con el equipo de centelleo líquido. Con base en los resultados del blanco se encontró que la adsorción del herbicida en los recipientes fue despreciable (P < 0.05).
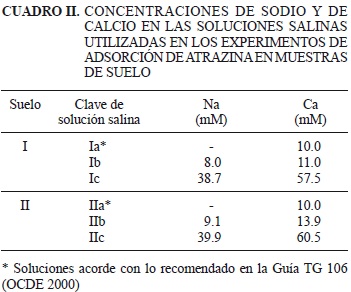
Las cinéticas de desadsorción de la atrazina se evaluaron en suelos donde previamente el herbicida había alcanzado el equilibrio de adsorción. Se retiraron 8.8 mL de la solución salina con atrazina disuelta y se adicionó la misma cantidad de solución salina, sin atrazina. Los recipientes se agitaron a 80 rpm durante 1, 7, 15, 24, 48 y 72 h, se centrifugaron a 12 000 rpm durante 15 min y se midieron las actividades de atrazina en el sobrenadante. Todos los experimentos se realizaron a temperatura ambiente (25 ± 1°C) y la reproducibilidad de los resultados se confirmó a través de al menos 10 % de duplicados experimentales.
Se obtuvieron las isotermas de adsorción y desadsorción de la atrazina con un procedimiento similar al que se llevó a cabo para evaluación de la cinética, con concentraciones de atrazina de 0.01, 0.05, 0.1, 0.5 y 1.0 mg/L. De acuerdo con los resultados de cinética, los tiempos para alcanzar el equilibrio de adsorción y desadsorción de atrazina, fueron de 24 h. Se realizó una segunda etapa de desadsorción de manera similar a la primera etapa; consistió en remover de cada recipiente 8.8 mL de sobrenadante y adicionar el mismo volumen de solución salina. Los resultados experimentales se ajustaron a los modelos de Langmuir y de Freundlich, encontrando un mejor ajuste con el modelo de Freundlich (Ec. 1):

Donde Cs (mg/kg) es la concentración de atrazina adsorbida en el suelo, Ce (mg/L) es la concentración del herbicida en la solución acuosa, Kf (mg1-n Ln/kg) es la constante de Freundlich y n es un parámetro relacionado a la curvatura de la isoterma que indica la heterogeneidad de los sitios de adsorción. En adelante, Kf y n representan los parámetros de adsorción y Kfd y nd, los parámetros de desadsorción. Se evaluó la normalidad de los datos de adsorción y desadsorción a través de la prueba de Shapiro-Wilk. Las diferencias en adsorción y desadsorción fueron evaluadas estadísticamente por análisis de varianza; mientras que la diferencia de medias se realizó a través de la prueba de Tukey, con un nivel de significancia de 5 %, utilizando el programa estadístico SAS versión 9.0 (SAS Institute 2002).
El coeficiente de histéresis, H, de la desorción de atrazina, fue calculado acorde con la ecuación 2 (Barriuso et al. 1994):

donde n y nd son los parámetros de la ecuación de Freundlich, de las isotermas de adsorción y desorción, respectivamente.
RESULTADOS Y DISCUSION
Los resultados de la caracterización de las muestras de suelo se presentan en el cuadro I. El suelo I es arcillo limoso y el suelo II es franco limoso, ambos con pH ligeramente alcalino. El contenido de M.O. está en el rango de 1.2 a 3.5 %, valores típicos para suelos minerales (Tinsley 2004). Tanto la muestra del suelo I, como la muestra del suelo II fueron ligeramente salinas.
El tiempo requerido para alcanzar el equilibrio de adsorción y desadsorción de la atrazina en las muestras de suelo fue menor o igual a 24 h (Fig. 1). El incremento de las concentraciones de sodio y de calcio no afectó el tiempo requerido para alcanzar el equilibrio de adsorción y desadsorción del herbicida en los suelos.
Las isotermas de adsorción y desadsorción de la atrazina en el suelo se presentan en la figura 2. Los valores de Kf y Kfd se presentan en el cuadro III, donde se observa que los valores de Kf son acorde con los reportados en la literatura para suelos agrícolas (Socías-Viciana et al. 1999, Coquet 2003, Drori et al. 2005, González-Márquez y Hansen 2009a). Los coeficientes de adsorción entre 0.83 y 1.84 mg1-n Ln/kg indican baja adsorción de atrazina, respecto a estudios reportados para glifosato y DDT, que se adsorben fuertemente con coeficientes entre 17 y 280 mg1-n Ln/kg (Al-Rajab et al. 2008, Lalah et al. 2009).
El promedio de atrazina adsorbida varió entre 24 y 29 % (Cuadro III). Las isotermas de adsorción fueron no lineales, con valores de n entre 0.90 y 0.96, con curvaturas cóncavas a la abscisa, indicando que la adsorción del herbicida se desfavorece al incrementar su concentración inicial en la solución.
Las concentraciones bajas de sodio (aproximadamente 9 mM) y de calcio (aproximadamente 10 mM), favorecieron la adsorción de atrazina en los suelos (Fig. 2a y Fig. 2c). Se han reportado resultados similares por Li et al. (2006), quienes investigaron el efecto del potasio y el calcio en la adsorción de atrazina en K- y Ca-esmectita, donde la adsorción del herbicida en K-esmectita se favoreció al incrementar la concentración de KCl en la solución del suelo, mientras que la adsorción en Ca-esmectita permaneció casi constante en presencia de diferentes concentraciones de CaCl2. Estos autores concluyeron que la formación de cuasi cristales mejor ordenados de la esmectita y la reducción de la distancia entre las capas de la arcilla, debido al incremento de la concentración de KCl, facilitó la retención de atrazina y, por lo tanto, su adsorción. Nuestros resultados indican que el incremento de la concentración de sodio tuvo un efecto similar sobre la adsorción de atrazina en la parte inorgánica de los suelos. El incremento en las concentraciones de sodio y de calcio (a aproximadamente 40 y 60 mM, respectivamente) en la solución acuosa no afectó significativamente (P < 0.05) la adsorción de atrazina. Sin embargo, se presentaron diferencias en la desadsorción del herbicida con el incremento de la salinidad (Fig. 2b y Fig. 2d). El promedio de atrazina desadsorbida varió entre 34 y 44 % (Cuadro III). El suelo que adsorbió más atrazina (suelo II) fue el que presentó menor desorción del herbicida; indicando que la naturaleza de las interacciones entre la atrazina y el suelo cambiaron, durante o después de la adsorción del herbicida.
Los resultados indican que el proceso de adsorción no es controlado por la fracción orgánica del suelo, ya que si fuese controlado por la M.O. las isotermas de adsorción se ajustarían mejor al modelo de adsorción lineal (Barriuso et al. 1994, Yang et al. 2009) y la adsorción del herbicida disminuiría con el incremento de la concentración de calcio, como ha sido reportado por González-Márquez y Hansen (2009b), quienes indican que la adsorción de atrazina en la M.O. se inhibe con el incremento de la salinidad, debido a la oclusión de sitios de adsorción, producto de cambios en la conformación de la estructura de la M.O. Sin embargo, es más irreversible la adsorción de atrazina en la M.O. de los suelos (Yang et al. 2009).
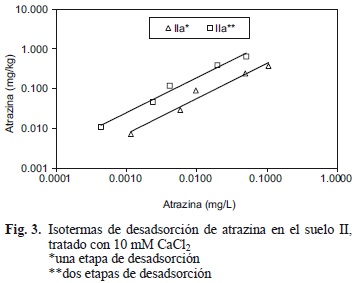
En el cuadro III se presentan los valores del coeficiente de histéresis, H, de las isotermas de adsorción y desadsorción de atrazina en los suelos estudiados. Tras una etapa de desadsorción, los valores de H fueron cercanos a 1, indicando que la histéresis es mínima (Tang et al. 2009). Mientras que en el suelo II, tras una segunda etapa de desadsorción (Fig. 3), el valor de H fue menor a 1, indicando que la tasa de desadsorción es menor que la de adsorción, por lo que se presenta mayor histéresis. A medida que la atrazina es desadsorbida del suelo, el proceso se hace más difícil, lo que incrementa la histéresis (Fig. 3). En la literatura se ha reportado que el proceso de desadsorción de compuestos orgánicos en suelo y sedimentos suele ser bifásico; uno regido por cinéticas lentas de adsorción/desadsorción y otro por atrapamiento físico (Pignatello y Xing 1996, Alexander 2000). Yang et al. (2009) estudiaron la adsorción y desadsorción de atrazina en suelos y concluyen que debido a que los equilibrios entre estos procesos fueron relativamente cortos (tres días), la difusión no fue el principal mecanismo que controló la resistencia a la desadsorción de la atrazina; el mecanismo dominante fue el atrapamiento físico del herbicida. Los resultados presentados en este trabajo indican un comportamiento similar, con equilibrios de adsorción y desadsorción de un día, por lo que asumimos que el atrapamiento físico es el mecanismo que controla la resistencia a la desadsorción de la atrazina en los suelos estudiados. El mecanismo de atrapamiento físico en la M.O. es explicado por Weber et al. (1998) y Yang et al. (2009), quienes sugieren que la adsorción de grandes cantidades de un adsorbato puede ocasionar que el adsorbente se vuelva más flexible y que a medida que el adsorbato se desadsorbe la flexibilidad disminuye, pudiendo ocasionar el atrapamiento físico del adsorbato; tal conjetura también explica por qué el suelo que adsorbe más herbicida es el que presenta menor desadsorción.
CONCLUSIONES
El incremento de la salinidad no afectó el tiempo requerido para alcanzar el equilibrio de adsorción y desadsorción de la atrazina en los suelos estudiados; sin embargo, sí favoreció la adsorción de atrazina en los suelos y desfavoreció su desadsorción (a concentraciones de sodio de aproximadamente 9 mM). El incremento de la concentración de sodio y de calcio a 40 y 60 mM, respectivamente, no afectó significativamente (P < 0.05) la adsorción de atrazina. Esto pudo deberse a que inicialmente los iones de sodio alteraron la configuración de los componentes del suelo y la capa difusa de los mismos, hasta un valor límite, el cual favoreció la interacción de la atrazina con las superficies adsorbentes; por lo que el incremento en la concentración de este electrolito no siguió favoreciendo la adsorción del herbicida.
Los resultados de este estudio indican que el incremento de la salinidad, principalmente por el aumento de sodio en el suelo, tiene efectos importantes en el destino final de la atrazina; dado que la salinización de los suelos favorece la adsorción de atrazina e inhibe la desadsorción, por lo que es importante considerar tal efecto en su destino ambiental; así como en el manejo y remediación de suelos contaminados con atrazina.
AGRADECIMIENTOS
Se agradece al Consejo Nacional de Ciencia y Tecnología por la beca de Doctorado otorgada al primer autor y al Instituto Mexicano de Tecnología del Agua por el apoyo para la realización de este estudio (números de proyecto TH-0803 y TH-0709).
REFERENCIAS
Alexander M. (2000). Aging, bioavailability, and overestimation of risk from environmental pollutants. Environ. Sci. Technol. 34, 4259-4265. [ Links ]
Al-Rajab A.J., Amellal S. y Schiavon M. (2008). Sorption and leaching of 14C-glyphosate in agricultural soils. Agron. Sustain. Dev. 28, 419-428. [ Links ]
Altfelder S., Streck T. y Richter J. (2000). Nonsingular sorption of organic compounds in soil: the role of slow kinetics. J. Environ. Qual. 29, 917-925. [ Links ]
Alva A.K. y Singh M. (1991). Sorption desorption of herbicides in soil as influenced by electrolyte cations and ionic strength. J. Environ. Sci. Heal. B. 26, 147-163. [ Links ]
ASTM (1998). D422-63 Standard test method for particle-size analysis of soils. American Society for Testing and Materials. West Conshohocken, PA, EUA, pp. 1-8. [ Links ]
ASTM (2000). D2974-00 Standard test methods for moisture, ash, and organic matter or peat and other organic soils. American Society for Testing and Materials. Philadelphia, PA, EUA, 04.08, pp. 31-33. [ Links ]
Barriuso E., Baer U. y Calvet R. (1992). Dissolved organic matter and adsorption-desorption of dimefuron, atrazine and carbetamide by soils. J. Environ. Qual. 21, 359-367. [ Links ]
Barriuso E., Laird D. A., Koskinen W.C. y Dowdy R.H. (1994). Atrazine desorption from smectites. Soil Sci. Soc. Am. J. 58, 1632-1638. [ Links ]
Bhandari A., Novak J.T. y Berry D.F. (1996). Binding of 4-monochlorophenol to soil. Environ. Sci. Technol. 30, 2305-2311. [ Links ]
Blume E., Bischoff M., Moorman T.B. y Turco R.F. (2004). Degradation and binding of atrazine in surface and subsurface soils. J. Agr. Food Chem. 52, 7382-7388. [ Links ]
Clausen L., Fabricius I. y Madsen L. (2001). Adsorption of pesticides onto quartz, calcite, kaolinite, and alpha-alumina. J. Environ. Qual. 30, 846-857. [ Links ]
Coquet Y. (2003). Sorption of pesticides atrazine, isoproturon, and metamitron in the vadose zone. Vadose Zone J. 2, 40-51. [ Links ]
De Jonge H. y De Jonge L.W. (1999). Influence of pH and solution composition on the sorption of glyphosate and prochloraz to a sandy loam soil. Chemosphere 39, 753-763. [ Links ]
Drori Y., Izenshtat Z. y Chefetz B. (2005). Sorption-desorption behavior of atrazine in soils irrigated with reclaimed wastewater. Soil Sci. Soc. Am. J. 69, 1703-1710. [ Links ]
Eckert D. y Sims J.T. (1995). Recommended soil pH and lime requirement tests. Recommended soil testing procedures for the Northeastern United States. 3a ed. Northeastern Regional Publication No. 493. [en línea]. http://extension.udel.edu/lawngarden/files/2012/10/CHAP3.pdf 31/08/2013. [ Links ]
Farrell J. y Reinhard M. (1994). Desorption of halogenated organics from model solids, sediments, and soil under unsaturated conditions. 2. Kinetics. Environ. Sci. Technol. 28, 63-72. [ Links ]
Gao J.P., Maguhn J., Spitzauer P. y Kettrup A. (1998). Sorption of pesticides in the sediment of the Teufels-weiher pond (Southern Germany). II: Competitive adsorption, desorption of aged residues and effect of dissolved organic carbon. Water Res. 32, 2089-2094. [ Links ]
Gartley K.L. (1995). Recommended soluble salts tests. Recommended soil testing procedures for the Northeastern United States. 3a ed. Northeastern Regional Publication No. 493. [en línea]. http://extension.udel.edu/lawngarden/files/2012/10/CHAP10.pdf 31/08/2013. [ Links ]
Gilliom R.J., Barbash J.E., Crawford C.G., Hamilton P.A., Martin J.D., Nakagaki N., Nowell L.H., Scott J.C., Stackelberg P.E., Thelin P.G. y Wolock D.M. (2006). The quality of our nation's waters - Pesticides in the nation's streams and ground water, 1992-2001. U.S. Geological Survey, Circular 1291. [en línea]. http://pubs.usgs.gov/circ/2005/1291/ 29/09/2009. [ Links ]
González-Márquez L.C. y Hansen A.M. (2009a). Adsorción y mineralización de atrazina y relación con parámetros de suelos del DR 063 Guasave, Sinaloa. Rev. Mex. Cienc. Geol. 26, 587-599. [ Links ]
González-Márquez L.C. y Hansen A.M. (2009b). Effects of salinity on the aggregation, composition, and sorption capacity of humic acid. 237th ACS National Meeting, Division of Geochemistry. Salt Lake City UT, marzo 22-26, 2009. [en línea]. http://oasys2.confex.com/acs/237nm/techprogram/P1255431.HTM 29/09/2012. [ Links ]
Griffin G., Jokela W. y Ross D. (1995). Recommended soil nitrate-N Tests. En: Recommended soil testing procedures for the Northeastern United States. (T. Sims y A. Wolf, Eds.). U. Delaware Agric. Exp. Stn. Bull. 493, 22-29. [ Links ]
Guillén-Garcés R.A., Hansen A.M. y Afferden van M. (2007). Mineralization of atrazine in agricultural soil: Inhibition by nitrogen. Environ. Toxicol. Chem. 26, 844-850. [ Links ]
Hernández-Antonio A. y Hansen A.M. (2011). Uso de plaguicidas en dos zonas agrícolas de México y evaluación de la contaminación de agua y sedimentos. Rev. Int. Contam. Ambie. 27, 115-127. [ Links ]
Hyun S. y Lee L.S. (2004). Factors controlling sorption of prosulfuron by variable charge soils and model sorbents. J. Environ. Qual. 33, 1354-1361. [ Links ]
Kah M. (2007). Behaviour of ionisable pesticides in soils. Tesis de Doctorado. Environment Department. University of York, 228 pp. [en línea]. http://tel.archives-ouvertes.fr/docs/00/18/54/85/PDF/PhD_thesis_Melanie_Kah.pdf 21/04/2014. [ Links ]
Laird D.A., Barriuso E., Dowdy R.H. y Koskinen W.C. (1992) . Adsorption of atrazine on smectites. Soil Sci. Soc. Am. J. 56, 62-67. [ Links ]
Lalah J.O., Njogu S.N. y Wandiga S.O. (2009). The effects of Mn2+, Ni2+, Cu2+, Co2+ and Zn2+ ions on pesticide adsorption and mobility in a tropical soil. B. Environ. Contam. Tox. 83, 352-358. [ Links ]
Lesan H.M. y Bhandari A. (2003). Atrazine sorption on surface soils: time-dependent phase distribution and apparent desorption hysteresis. Water Res. 37, 1644-1654. [ Links ]
Li H., Teppen B.J., Laird D.A., Johnston C.T. y Boyd S.A. (2006). Effects of increasing potassium chloride and calcium chloride ionic strength on pesticide sorption by potassium- and calcium-smectite. Soil Sci. Soc. Am. J. 70, 1889-1895. [ Links ]
Ling W.T., Wang H.Z, Xu J.M. y Gao Y.Z. (2005). Sorption of dissolved organic matter and its effects on the atrazine sorption on soils. J. Environ. Sci. 17, 478-48. [ Links ]
Ma L., Southwick L.M., Willis G.H. y Selim H.M. (1993) . Hysteretic characteristics of atrazine adsorption-desorption by a Sharkey soil. Weed Sci. 41, 627-633. [ Links ]
Mao M. y Ren L. (2010). Effects of ionic strength and temperature on adsorption of atrazine, deethylatrazine and deisopropyatrazine in an alkaline sandy loam. 19th World Congress of Soil Science. Soil Solutions for a Changing World. Brisbane, Australia 1 al 6 de agosto, 2010. [en línea]. http://www.iuss.org/19th%20WCSS/Symposium/pdf/0308.pdf 02/02/2013. [ Links ]
Merck (2006). Calcium Test. [en línea]. http://www.merckmillipore.com/chemicals/test-calcio/MDA_CHEM-114815/spanish/p_4heb.s1LpCYAAAEWNuIfVhTl?attachments=brochure 26/04/2007. [ Links ]
Mersie W., Liu J., Seybold C. y Tierney D. (1998). Extractability and degradation of atrazine in submerged sediment. Weed Sci. 46, 480-486. [ Links ]
OECD (2000). Test No. 106. Adsorption-Desorption using a batch equilibrium method. OECD Guidelines for the Testing of Chemicals. Organización para la Cooperación y el Desarrollo Económico. [en línea]. http://www.oecd-ilibrary.org/environment/oecd-guidelines-for-the-testing-of-chemicals-section-1-physical-chemical-properties_20745753 06/04/2013. [ Links ]
Pignatello J.J. y Xing B. (1996). Mechanisms of slow sorption of organic chemicals to natural particles. Environ. Sci. Technol. 30, 1-11. [ Links ]
Sánchez Martín M.J. y Sánchez Camazano M. (1984). Los plaguicidas: adsorción y evolución en el suelo. [en línea]. http://digital.csic.es/bitstream/10261/12919/1/plaguicidas.pdf 06/04/2013. [ Links ]
SAS Institute (2002). The SAS system for Windows, ver. 9.0. SAS Institute Inc., Cary NC, EUA. [ Links ]
Socías-Viciana M.M., Fernández-Pérez M., Villafranca-Sánchez M., González-Pradas E. y Flores-Céspedes F. (1999). Sorption and leaching of atrazine and MCPA in natural and peat-amended calcareous soils from Spain. J. Agr. Food Chem. 47, 1236-1241. [ Links ]
Syngenta (2006). Gesaprim 90 WG. [en línea]. http://www.syngenta.com/country/cl/cl/soluciones/proteccioncultivos/Documents/Etiquetas/Gesaprim90WG.pdf 12/12/2013. [ Links ]
Tang Z., Zhang W. y Chen Y. (2009). Adsorption and desorption characteristics of monosulfuron in Chinese soils. J. Hazard. Mater. 166, 1351-1356. [ Links ]
Tappe W., Groeneweg J. y Jantsch B. (2002). Diffuse atrazine pollution in German aquifers. Biodegradation 13, 3-10. [ Links ]
Tinsley I.J. (2004). Chemical concepts in pollutant behavior. 2a ed. Wiley, Hoboken, NJ, EUA, 402 pp. [ Links ]
Van Leewen J.A., Waltner-Toews D., Abernathy T., Smith B. y Shokri M. (1999). Associations between stomach cancer incidence and drinking water contamination with atrazine and nitrate in Ontario (Canada) agroecosystems, 1987-1991. Int. J. Epidemiol. 28, 836-890. [ Links ]
Weber Jr. W.J., Huang W.L. y Yu H. (1998). Hysteresis in the sorption and desorption of hydrophobic organic contaminants by soils and sediments: II. Effect of soil organic matter heterogeneity. J. Contam. Hydrol. 31, 149-165. [ Links ]
Yang W., Zhang J., Zhang C., Zhu L. y Chen W. (2009). Sorption and resistant desorption of atrazine in typical Chinese Soils. J. Environ. Qual. 38, 171-179. [ Links ]














