Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista internacional de contaminación ambiental
versión impresa ISSN 0188-4999
Rev. Int. Contam. Ambient vol.30 no.2 Ciudad de México may. 2014
Remoción de plomo(II) en vidrio volcánico y propuesta de adsorbedor por etapas
Lead (II) removal in volcanic glass and proposal for an adsorber by contact
Alien BLANCO FLORES1*, Luis Ibrain ORTEGA HERNÁNDEZ2, Jaime DUEÑAS MORENO, Rolando BATISTA GONZÁLEZ3, Ricardo SERAFÍN PÁEZ4 y Miguel Armando AUTIÉ PÉREZ5
1 Departamento de Fundamentos Químicos y Biológicos, Facultad de Ingeniería Química, Instituto Superior Politécnico José Antonio Echeverría (CUJAE), La Habana, Cuba *Autora responsable; abf81rey@gmail.com
2 Departamento de Ingeniería Química, Facultad de Ingeniería Química, Instituto Superior Politécnico José Antonio Echeverría, La Habana, Cuba
3 Instituto de Geología y Paleontología, La Habana, Cuba
4 Laboratorio Central de Rocas y Minerales de Cuba, La Habana
5 Universidad de La Habana e Instituto Superior Politécnico José Antonio Echeverría, La Habana, Cuba
Recibido octubre 2012,
aceptado enero 2013
RESUMEN
Se utilizó vidrio volcánico cubano para estudiar el proceso de adsorción de Pb (II) desde soluciones acuosas. Para evaluar la eficiencia de la remoción del ion metálico se consideró tanto el tiempo de contacto como las concentraciones iniciales del adsorbato. La cinética de adsorción se describió con el modelo de pseudo segundo orden. Este resultado indicó que el mecanismo de adsorción fue a través de una quimisorción sobre el mineral cubano. Los resultados mostraron que la remoción de Pb (II) fue mejor descrita con el modelo de Langmuir. La capacidad de adsorción de Pb (II) fue de 0.67mmol/g, superior a la mostrada por otros materiales pero inferior a la adsorción de Cu (II) por el vidrio volcánico. El diseño de adsorbedores por contacto mostró que se consume menos cantidad de adsorbente realizando el experimento a flujo a contracorriente con respecto al diseño de etapa simple y flujo cruzado.
Palabras clave: contaminación, metales pesados, adsorción, vidrio volcánico cubano.
ABSTRACT
Cuban volcanic glass was used to study the process of sorption of Pb (II) from aqueous solutions. To evaluate the removal efficiency of the metallic ion we considered the contact time and the initial concentration of adsorbate. The sorption kinetics was described with the pseudo second-order model. This result indicated that the mechanism of adsorption was through chemisorption on the Cuban mineral. The results showed that the removal of Pb (II) was better described with the Langmuir model. The largest ion adsorption capacity was 0.67 mmol/g, greater than that demonstrated by other materials but below the adsorption of Cu (II) by volcanic glass. The design of adsorber by contact showed that less quantity of adsorbent is needed when conducting the experiment in countercurrent flow with respect to the single stage design and crossflow.
Key words: pollution, heavy metals, adsorption, Cuban volcanic glass.
INTRODUCCIÓN
La contaminación de las aguas hoy en día es un problema alarmante en todos los países. En el mundo la población crece y el consumo de agua se duplica cada veinte años. Así las aguas residuales que generan las actividades industriales y domésticas también aumentan, de las cuales sólo el 5% son tratadas para purificarlas y reciclarlas. Datos reportados por las Naciones Unidas muestran que una de cada cinco personas en el mundo no tiene acceso al agua potable, mientras que alrededor de 2400 millones carecen de condiciones adecuadas de salubridad (ONU 2014).
Un grave problema a nivel mundial son las descargas directas a los medios acuáticos de grandes cantidades de aguas residuales con elevados contenidos de metales pesados como el plomo. Los metales pesados no son biodegradables, además se acumulan en la naturaleza y por tanto en el hombre, el cual los recibe de forma preconcentrada a través de la cadena alimenticia (Chen et al. 2007).
Existen varios métodos para la eliminación de plomo desde medios líquidos. Estos incluyen: precipitación (involucra el empleo de reactivos químicos), ósmosis reversa, intercambio iónico, tratamiento electroquímico, la biorremediación y tecnologías de membrana, entre otros (Ghassabzadeh et al. 2010). Estos procesos suelen ser costosos e inefectivos, especialmente cuando se aplican en ambientes con concentraciones del ion por debajo de 100 mg/L (Babel y Kurniawan 2003). La selección del método adecuado se basa en la concentración del metal en el agua residual y el costo del tratamiento.
La adsorción es uno de los métodos referidos para la remoción de metales pesados, empleando materiales adsorbentes como son zeolitas, arcillas, carbones activados entre otros, siendo estos últimos los más empleados (Ejikeme et al. 2011). La adsorción es aplicada en procesos industriales diseñando unidades de tratamiento con buenos rendimientos de remoción (Alkan et al. 2008).
Con respecto a los materiales adsorbentes empleados en diferentes procesos Günay et al. (2007), estudiaron la remoción de Pb (II) desde solución acuosa en clinoptilolita, para evaluar el efecto de los parámetros concentración inicial del metal, tiempo de contacto y pretratamiento a la zeolita. Los investigadores obtuvieron la isoterma de adsorción, la cual fue ajustada al modelo de Temkin, obteniendo una capacidad máxima de adsorción de 80 933 y 122 400 mg/g para la clinoptilolita natural y tratada, respectivamente, para una concentración inicial de Pb (II) de 400 mg/L.
Hernández-Morales et al. (2012) hicieron funcional un material silíceo mesoporoso con un grupo amino para mejorar la remoción de Pb (II) en un rango de concentraciones iniciales del ion metálico de 20-200 mg/L. Los autores lograron remover un 93 % del ion a pH entre 5 y 6 en un intervalo de tiempo de 60 minutos. Los resultados obtenidos con este material fueron superiores al logrado con el material sin funcionalidad.
El uso de los materiales adsorbentes de bajo costo para hacer más económico el proceso de adsorción se ha incrementado en la última década. En este sentido, Mondal (2009) refiere la remoción de Pb (II) utilizando residuos de té generado después del proceso de fabricación del té, el autor logró para un sistema de adsorción en columna diferentes cantidades removidas del ion dependiendo de las concentraciones iniciales. Además, se ha removido este ion utilizando zeolita, ceniza volante, ceniza de cáscara de arroz y salvado de trigo entre otros materiales de este tipo (Pei-Sin et al. 2013).
Souga et al. (2009) reportan la remoción de Cd2+, Zn2+ y Pb (II) por adsorción en medio acuoso en material adsorbente preparado desde cascos de ovejas de Argelia. El tamaño de partícula seleccionado fue menor que 90 µm y la concentración inicial fue de 100 mg/L para todos los metales. El tiempo de equilibrio alcanzado fue de 60 minutos para Cd2+ y 90 minutos para Zn2+ y Pb (II), con pH óptimos entre 8.5, 7.0 y 5.6. Los investigadores lograron porcentajes de remoción de 59, 70 y 65 % respectivamente.
Cuba es un país que presenta diversos yacimientos de recursos minerales. Teniendo en cuenta sus propiedades geológicas y algunas fisicoquímicas. estos presentan potencialidades para emplearlos en el tratamiento de residuales líquidos contaminados, como medios filtrantes o adsorbentes. Sin embargo la mayoría de estos minerales son poco explotados para la remoción de contaminantes.
Entre los minerales no metálicos cubanos se encuentra el vidrio volcánico. El material se ha estudiado muy poco; el mayor volumen se dedica a la industria del cemento, otra parte a la cerámica y otra a la fabricación de elementos prefabricados. Uno de los grupos de investigación que más ha investigado las características y aplicaciones del vidrio volcánico (también conocido como toba o perlita) pertenece a la Universidad de Balikesir, de Turquía (Doğan et al. 2004). Se ha referido al vidrio volcánico turco como de gran potencial en la disminución de los niveles de colorantes: azul de metileno (Doğan et al. 2004) y violeta de metilo (Doğan y Alkan 2003) y metales pesados como el Cu (II) (Doğan y Alkan 2001).
Este mineral natural está compuesto fundamentalmente por silicio, aluminio, potasio y sodio aunque su composición varía de acuerdo al yacimiento, pero su origen es siempre el mismo. Aunque son conocidos los estudios del mismo para la remoción de compuestos orgánicos, recientemente se han comprobado sus potencialidades en la remoción de metales pesados tales como Cr3+, Cd2+ y Cu (II) (Mostafa et al. 2011), sin embargo no se han encontrado en la literatura reportes sobre el uso de este mineral para la descontaminación de aguas con presencia de Pb (II).
Cuba, en trabajos previos se realizó la caracterización del material a través de diferentes técnicas: difracción de rayos-X, análisis elemental, superficie específica y porosimetría de mercurio. Los resultados obtenidos y publicados indicaron la presencia predominante de silicio y aluminio, con un 82 % de vidrio volcánico y una superficie específica de 32 m2/g. Es un material fundamentalmente meso-macroporoso constituido por los grupos silanoles y silanodioles (y lo mismo para el aluminio) superficiales (Blanco et al. 2009).
El objetivo del presente trabajo fue evaluar la capacidad de adsorción del vidrio volcánico cubano para disminuir las concentraciones de Pb (II) desde soluciones acuosas, a partir del estudio cinético y de equilibrio del proceso. Se diseñó un sistema de adsorbedor por contacto para estimar la mejor relación volumen de residual a tratar/cantidad de material adsorbente a utilizar para lograr un 90% de remoción del ion.
MATERIALES Y MÉTODOS
Soluciones de Pb (II)
Las soluciones de Pb (II) se prepararon en un intervalo de concentración de 10-2-10-1mol/L, empleando la sal Pb(NO3)2 grado analítico de Merck, a partir de una solución patrón de concentración 10-1mol/L.
Las concentraciones de Pb (II) presentes en las soluciones se determinaron mediante un espectrómetro de emisión atómica con plasma inductivamente acoplado (ICP-OES), Spectroflame FTMO8, Spectro. La línea de plomo seleccionada fue 220.350 nm, con un rango de concentración lineal entre 1.4x10-7mol/L y 0.014 mol/L.
Vidrio volcánico
El vidrio volcánico cubano (VVAC) fue obtenido del yacimiento de Ají de la Caldera, en la provincia de Guantánamo, en el oriente de Cuba. El material se molió y tamizó para obtener la fracción de trabajo de 0.25 mm, utilizada para los experimentos de cinética y los de adsorción de Pb (II) en VVAC
Cinética de adsorción
La cinética de remoción de plomo con el material VVAC fue desarrollada mezclando 0.5 g de adsorbente y 25 mL de una solución de 0.09 mol/L, la mezcla se agitó manteniendo el sólido en suspensión a temperatura de 25°C. Cada cierto intervalo de tiempo (5, 10, 15, 20, 25, 30, 35, 40 y 45 min) se tomaron muestras hasta 1 h, las que se filtraron y se determinó la concentración de plomo como se describió anteriormente. Todos los experimentos fueron realizados en lote y por duplicado sin control del pH de las soluciones. El objetivo fue determinar el tiempo de equilibrio así como el modelo cinético que mejor describiera el proceso y la etapa controlante del mismo.
Isotermas de adsorción
Se pusieron en contacto 0.5 g del mineral VVAC con 25 mL de las soluciones de Pb (II) a diferentes concentraciones (10-2-10-1mol/L) durante el tiempo de equilibrio a 25 °C y sin ajustar el pH de las soluciones. Las concentraciones de plomo en solución se determinaron como se describió anteriormente.
La capacidad de adsorción del ion fue calculada utilizando la ecuación (1):

Donde Qads es la capacidad de adsorción en el equilibrio, Cini y Ceq son la concentración inicial y en el equilibrio (mol/L) de Pb (II) en solución respectivamente, V (L) es el volumen y m (g) la masa de adsorbente.
Diseño de los sistemas de adsorbedores por contacto.
Para el de diseño de adsorbedores por contacto se utilizó una concentración inicial del ion de 0.09 mol/L y un volumen de solución de 1 L, asumiendo un 90 % de remoción del ion. Los cálculos de los pesos de mineral a utilizar para tratar el volumen fijado se realizaron a partir de un balance de masas, conociendo la concentración del ion en solución en el equilibrio (Ceq).
También se previó que en el proceso se debía reducir la concentración del ion de Cini y Ceq que la concentración del ion metálico en el adsorbente debía cambiar desde un valor inicial Qini = 0 hasta un valor final Qf = Qeq.
Por el balance de masa se igualó la cantidad de ion removido del efluente líquido a la cantidad adsorbida por el mineral para cada caso, o sea:
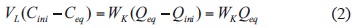
Donde Qini y Qeq (mol/g) es la cantidad de plomo adsorbido al inicio y en el equilibrio por el mineral VVAC respectivamente y WK (g) es la carga o masa de adsorbente que se introduce en el depósito de tratamiento. La ecuación (2) permitió calcular la carga de adsorbente para cada diseño, necesario para tratar un volumen de 1 L de solución de plomo.
RESULTADOS Y DISCUSIÓN
Validación de la curva de calibración
La curva de calibración fue obtenida en función de la emisión contra la concentración de Pb (II) de las soluciones de trabajo. Del análisis de los valores de los coeficientes de correlación (r = 0.9998) y de determinación (r2 = 0.9997), se pudo inferir la buena correlación entre las variables graficadas. Tanto el valor de r2 como de r, fueron cercanos a la unidad.
Determinación del tiempo mínimo de adsorción
La figura 1 muestra la relación entre el tiempo de contacto y la adsorción de Pb (II) por el adsorbente VVAC. De acuerdo con la forma de la gráfica, la mayor cantidad adsorbida de plomo (0.465 mmol/g) se alcanzó a los 20 minutos, siendo este el tiempo de equilibrio del proceso para las condiciones experimentales fijadas. Se puede observar un rápido incremento de la cantidad adsorbida del ion antes de los 20 minutos, luego esta se mantuvo constante, indicando que el equilibrio se había alcanzado.

Por la forma de la gráfica el proceso de adsorción puede ser dividido en dos etapas: una primera donde la cantidad adsorbida aumenta rápidamente en el tiempo, debido quizás a la difusión del sorbato desde el seno de la solución hasta la superficie del adsorbente. Una segunda etapa donde el proceso se hace muy lento y cesa, manteniéndose constante la cantidad removida. Esta etapa puede estar relacionada con la saturación de los sitios de adsorción del material y la llegada del sistema al equilibrio.
Los resultados experimentales fueron ajustados con diferentes modelos cinéticos para obtener los parámetros que describen el proceso de adsorción, así como la posible etapa de control del mismo.
El modelo de pseudo primer orden (Lagergren) (Gutiérrez et al. 2012) está representado por la siguiente ecuación lineal (3):

Donde Qeqy Qt son las cantidades adsorbidas (mmol/g) en el equilibrio y en el tiempo (min) respectivamente y kL (min-1) es la constante cinética de Lagergren
Los resultados experimentales fueron ajustados con la ecuación de Lagergren utilizando el programa Origin 8.0 y se obtuvieron los parámetros cinéticos que se muestran en la cuadro I. El ajuste con este modelo fue bueno, este comportamiento indica que el mecanismo de adsorción de plomo puede estar descrito por adsorción física. Sin embargo el valor de la cantidad adsorbida del ion, calculada a través del modelo (Qeq) fue diferente al valor experimental de este parámetro (Qeq exp = 0.4635 mmol/g) lo cual condujo a pensar que no fue una fisisorción mayoritariamente la que permitió la disminución de las concentraciones de Pb (II) desde el medio acuoso.
El modelo de segundo orden (Elovich) (Herrejón 2009) es representado por la ecuación (4).

Donde Qt es la cantidad del ion metálico adsorbido en el tiempo t (min), α es la velocidad de adsorción inicial del ion plomo (mmol/g min) y β es la constante de velocidad de adsorción (mmol/g min). Este modelo ha sido usado en quimisorción de materiales altamente heterogéneos.
Los parámetros de adsorción según este modelo fueron bastante diferentes, la velocidad de adsorción fue casi 50 veces menor que la velocidad de adsorción inicial del ion. Esto indica que la afinidad del Pb (II) por los sitios de unión al material fue alta.
El modelo de pseudo segundo orden (Ho) (Chen 2009) es representado por la ecuación (5):

Donde Qt y Qeq son las cantidades adsorbidas en el tiempo t (min) y en el equilibrio (mmol/g) respectivamente y k2 es la constante de velocidad de pseudo segundo orden para el proceso de adsorción (g/mmol min).
El buen ajuste de los datos experimentales indica que el proceso de adsorción fue descrito por el modelo de pseudo segundo orden y que el paso limitante puede deberse un proceso de quimisorción. El valor obtenido de Qeq (0.4699 mmol/g, cuadro I) por este modelo y el valor experimental fueron muy similares (Qeq exp = 0.4635 mmol/g), lo cual reafirma lo antes planteado. Además, la diferencia en un orden de los valores de las cantidades adsorbidas del ion por el modelo de primer orden (0.0498 mmol/g) y de pseudo segundo orden (0.4699 mmol/g), sugiere el mecanismo de quimisorción sobre la fisisorción. Por tanto, el proceso de adsorción de Pb (II) en medio acuoso con VVAC, fue descrito fundamentalmente por una quimisorción. El valor de la constante de velocidad del modelo que mejor describe el proceso indica que la remoción fue un proceso rápido.
En este sentido, Dong et al. (2010) removieron Pb (II) desde solución acuosa con un compuesto de hidroxiapatita y magnetita. En este caso la cinética también fue mejor descrita por el modelo de pseudo segundo orden, siendo desde un inicio un proceso rápido. En el caso de la remoción del ion metálico empleando una mezcla de materiales de bajo costo (zeolita-kaolinita-bentonita) también el proceso cinético siguió el modelo de pseudo segundo orden, de acuerdo con lo reportado por Salem et al. (2011) aun para intervalos de concentraciones iniciales diferentes a los seleccionados en este estudio.
Isotermas de adsorción
La dependencia de la cantidad adsorbida con la concentración en un medio líquido a temperatura constante se representa a través de las isotermas de adsorción (Agouborde Manosalva 2008).
La isoterma de adsorción obtenida en el proceso se representa en la figura 2. La isoterma de adsorción obtenida se clasificó como de tipo I, por lo cual se se hizo lineal utilizando el modelo de Langmuir (Foo y Hameed 2010). La ecuación matemática lineal de este modelo es la siguiente (6):


Donde Nm es la capacidad máxima de la mono-capa (la cantidad de moles necesarios para cubrir la superficie con una capa compacta del espesor de una molécula) y K es la constante de Langmuir que está relacionada con la energía de las interacciones adsorbato-adsorbente.
Este modelo asume que la adsorción se limita al llenado de una capa (monocapa) y que no hay interacciones entre las moléculas adsorbidas con sitios de unión adyacentes (Salim y Munekage 2009).
El cuadro II muestra los parámetros obtenidos al aplicar este modelo. Se determinó que la capacidad máxima de adsorción (Nm) fue de 0.67 mmol/g. Este valor se comparó con otros reportados en la literatura pero utilizando diferentes materiales (Cuadro III). En todos los casos el valor de plomo (II) adsorbido utilizando el material VVAC fue superior, indicando la alta afinidad del ion metálico por el material.


Sin embargo, el valor de la Nm (Pb (II)) se comparó con el obtenido en la remoción de Cu (II) utilizando este mismo material (Nm = 4.27 mmol/g) y se observó que la cantidad del ion plomo removida fue seis veces menor que la de Cu (II). Esta diferencia fue atribuida al hecho de que ambos iones presentan diferentes radios iónicos, masa molecular y número de hidratación, lo que hizo que no fuera posible la adsorción de Pb (II) en todos los sitios superficiales que presentó el material. Tal planteamiento se reafirmó al calcular el área superficial ocupada por ambos iones en el material VVAC, siendo de 20.41 m2/g para el Pb (II) y de 41.8 m2/g para el Cu (II) (Blanco 2011).
En trabajos previos donde se estudió la remoción de Cu (II) en VVAC (Blanco et al. 2009), quedó demostrado que el mecanismo principal por el cual
transcurre la adsorción del ion metálico en este mineral se debe fundamentalmente al intercambio entre los grupos H+ de los silanoles y silanodioles y el ion metálico en cuestión a través del siguiente esquema químico:

Aunque el Pb (II) no se hubiese unido a todos los sitios de adsorción en el material, por problemas geométricos, es lógico pensar que su unión debió ocurrir a través del mismo mecanismo propuesto por Blanco y colaboradores (2009) en el proceso de remoción del ion Cu (II) a la vez que se reafirma el resultado obtenido del proceso.
El valor de la constante energética de Langmuir comparada con otros valores es pequeña, lo cual indica que la interacción adsorbato-adsorbente no es tan fuerte si se compara con otros materiales adsorbentes que se emplean para remover este ion (Sari et al. 2007, Laus et al. 2010,).
Propuesta de sistema de adsorbedores por etapas
El efecto del volumen de solución para una cantidad determinada de adsorbente en el proceso de adsorción del ion metálico a diferentes concentraciones iniciales es un factor importante para realizar el diseño de adsorbedor (Kumar y Porkodi 2007). En este caso la relación volumen/ cantidad de adsorbente se obtiene usando los datos experimentales de la isoterma de adsorción de Pb (II). Así, se selecciona el modelo de isoterma que mejor se ajusta con los datos experimentales y se utiliza para predecir el diseño de sistemas de adsorbedores a etapa simple, flujo cruzado y flujo en contracorriente.
Como la adsorción de Pb (II) en el mineral cubano se pudo describir con buena aproximación con el modelo de Langmuir, fue posible presentar los siguientes sistemas de adsorbedores por etapas para la purificación de las aguas contaminadas con este metal (Cuadro IV).

Los resultados obtenidos para los diseños de adsorbedores mencionados, evidenciaron que el sistema más efectivo para lograr un 90 % de remoción del ion plomo fue el sistema de diseño de adsorbedor con flujo contracorriente, puesto que para remover una misma cantidad del contaminante se necesitó menos cantidad de mineral. Esto representa una posibilidad de ahorro de materia prima (Cuadro V), por lo que en la literatura se refiere que este sistema es el más económico en cuanto a la cantidad de material a utilizar (Ortega 2013).

Con el diseño de adsorbedores por contacto a flujo contracorriente fue posible conocer de forma rápida la mejor relación volumen a tratar/cantidad de mineral a remover para un agua contaminada. Así, es posible estimar los gastos por cantidad de material a emplear a escalas mayores de acuerdo con los porcentajes de remoción deseados y a la vez se puede describir el comportamiento del adsorbedor y su tamaño a escalas mayores (Fig. 3).
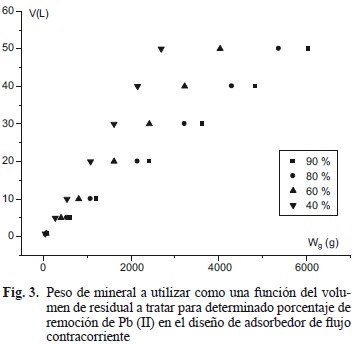
En este sentido, la alternativa de tratamiento para lograr un 40 % de remoción consumió casi la mitad de mineral utilizado para lograr un 90 % de rendimiento. Con respecto a la primera alternativa (40%), fue posible emplear el resto de la cantidad de material en otra repetición hasta lograr el porcentaje deseado de reducción del contaminante (90 %). En la medida que se requiera tratar un mayor volumen se necesitará de mayor cantidad de material adsorbente en los tres sistemas de adsorbedores por contacto planteados. El sistema de flujo en contracorriente demostró superioridad con respecto a los otros dos con respecto a la cantidad de material a utilizar.
En la medida que se necesite tratar un mayor volumen, con la propuesta de diseño de adsorbedores por contacto fue posible conocer de forma rápida la relación entre sistema de adsorbedor-cantidad de mineral a utilizar referida a diferentes porcentajes de remoción (Fig. 4). En este caso, al establecer una comparación entre la mejor y la peor opción (flujo contracorriente y etapa simple), es evidente que la diferencia de carga de mineral es tres veces inferior a la peor opción y que la reducción de costo de mineral, sería también tres veces menor, sin considerar otros factores.

Además de las evidentes ventajas económicas, se debe incluir el aumento del valor agregado del mineral, que se podrá usar en otras aplicaciones de forma más racional que hasta el momento (uso limitado a la industria de la construcción y a la cerámica) (Alujas et al. 2010).
CONCLUSIONES
El mineral VVAC es efectivo para la reducción de los niveles de Pb (II) en solución acuosa. El mecanismo de adsorción en este caso es dado por la interacción del ion con los grupos activos superficiales del mineral, de la misma forma que para el caso de Cu (II), a través de una quimisorción. El proceso de adsorción fue descrito con el modelo de Langmuir y la máxima capacidad de remoción de Pb (II) fue de 0. 67 mmol/g para las condiciones experimentales fijadas. El diseño de adsorbedores por contacto destaca las ventajas del diseño de flujo contracorriente en cuanto a la cantidad de mineral a utilizar para remover altos porcentajes del contaminante en medio líquido. Esto avala el uso del mineral para aplicaciones a mayores escalas y hace evidente el ahorro de material utilizando este diseño.
REFERENCIAS
Aguilar A., Gorokhovsky A., Aguilar A. y Escalante I. (2008). Síntesis y caracterización de adsorbentes cerámicos basados en polititanatos de potasio y vidrio SiO2-B203-R20-Al203. Bol. Soc. Esp. Ceram. 4, 29-34. [ Links ]
Alkan M., Kalay. B., Dogan M. y Demirbas Ö. (2008). Removal of copper ions from aqueous solutions by kaolinite and batch design. J. Hazard. Mater. 153, 867-876. [ Links ]
Alkan M. y Doğan M. (2001). Adsorption of copper (ll) onto perlite. J. Colloid and Interf. Sci. 243, 280-291. [ Links ]
Alujas A., Fernández R., Martirena F., Scrivener K. y Quintana R. (2010). Evaluación del empleo de una roca arcillosa calcinada a diferentes temperaturas como material puzolánico para el reemplazo de altos volúmenes de CPO. Revista Cubana de Química 22, 63-71. [ Links ]
Babel S. y Kurniawan T.A. (2003). Low-cost adsorbents for heavy metals uptake from contaminated water: a review. J. Hazar. Mater. dx.doi.org/10.1016/S03043894(02)00263-7. [ Links ]
Blanco A. (2011). Características superficiales del vidrio volcánico cubano y sus posibilidades en la remoción de Cu (II) y Pb (II). Tesis de maestría. Instituto de Ciencia y Tecnología de los Materiales (IMRE)-Instituto Superior Politécnico José Antonio Echeverría (CUJAE). La Habana, Cuba. [ Links ]
Blanco A., Autie G., Rodríguez D., Paez R., López R. y Autie M. (2009). Características superficiales de un vidrio volcánico cubano y remoción de Cu (II) desde soluciones acuosas. Rev. Latinoam. Rec. Nat. 5, 238-252. [ Links ]
Chen H. and Wang A. (2007). Kinetic and isothermal studies of lead ion adsorption onto palygorskite clay. J. Colloid Interf. Sci. 307, 309-316. [ Links ]
Chen H. y Zhao J. (2009). Adsorption study for removal of Congo red anionic dye using organo-attapulgite. Adsorption 15, 381-389. [ Links ]
Doğan M. y Alkan M. (2003). Adsorption kinetics of methyl violet onto perlite. Chemosphere 50, 517-528. [ Links ]
Doğan M., Alkan M., Türkyilmaz A. y Özdemir Y. (2004). Kinetics and mechanism of removal of methylene blue by adsorption onto perlite. J. Hazard. Mater. B 109, 141-148. [ Links ]
Dong L., Zhu Z., Qiu Y. y Zhao J. (2010). Removal of lead from aqueous solution by hydroxyapatite/magnetite composite adsorbent. Chem. Eng. J. 165, 827-834. [ Links ]
Eccles H. (1999). Treatment of metal-contaminated wastes: why select a biological process? Trends Biotechnol. 17, 462-465. [ Links ]
Ejikeme P.M., Okoye A.I. y Onukwuli O.D. (2011). Kinetics and isotherm tudies of Cu (II) and Pb (II) ions removal from simulated waste water by Gambeya albida seed shell activated carbon. The African Review of Physics 6:0017. [ Links ]
Foo K.Y. y Hameed B. (2010). Review. Insights into the modeling of adsorption isotherm systems. Chemical Engineering Journal, 156, 2-10. [ Links ]
Ghassabzadeh H., Torab-Mostaedi M., Mohaddespour A., Maragheh M., Ahmadi S. y Zaheri P. (2010). Characterizations of Co (II) and Pb (II) removal process from aqueous solutions using expanded perlite. Desalination 261, 73-79. [ Links ]
Günay A., Arslankaya E. y Tosun I. (2007). Lead removal from aqueous solution by natural and pretreated clino-ptilolite: adsorption equilibrium and kinetics. J. Hazard Mater. 146, 362-71. [ Links ]
Guo S., Li W., Zhang L., Peng L, Xia H. y Zhang S. (2009). Kinetics and equilibrium adsorption study of lead(II) onto the low cost adsorbent-Eupatorium adenophorum Spreng. Process Saf. Environ. 87, 343-351. [ Links ]
Gutiérrez-Segura E., Solache-Ríos M., Colín-Cruz A. y Fall C. (2012). Adsorption of cadmium by Na and Fe modified zeolitic tuffs and carbonaceous material from pyrolyzed sewage sludge. J. Environ. Manage. 97, 6-13. [ Links ]
Halim, H., Shehata A. y El-Shahat F. (2003). Removal of lead ions from industrial waste water by different types of natural materials. Water Res. 37, 1678-1683. [ Links ]
Hernández-Morales V., Nava R., Acosta-Silva Y.J., Macías-Sánchez S.A., Pérez-Bueno J.J. y Pawelec B. (2012). Adsorption of lead (II) on SBA-15 mesoporous molecular sieve functionalized with -NH2 groups. Micropor. Mesopor. Mat. 160, 133-142. [ Links ]
Herrejón M. (2009). Adsorción de plomo en suelo arcillosos calcáreo mexicano. Tesis doctoral. Facultad de Ingeniería, Centro Interamericano de Recursos del Agua. Universidad Autónoma del Estado de México (UAEM). Toluca, Estado de México, México. [ Links ]
Kumar V. K. y Porkodi K. (2007). Batch adsorber design for different solution volume/adsorbent mass ratios using the experimental equilibrium data with fixed solution volume/adsorbent mass ratio of malachite green onto orange peel. Dyes Pigments 74, 590-594. [ Links ]
Laus R., Costa T.G., Szpoganicz B. y Favere V.T. (2010). Adsorption and desorption of Cu(II), Cd(II) and Pb(II) ions using chitosan crosslinked with epichlorohydrin-triphosphate as the adsorbent. J. Hazard. Mat. 183, 233-241. [ Links ]
Agouborde Manosalva L.I. (2008). Remoción de metales pesados por medio de adsorbentes no convencionales. Tesis de Maestría.. Universidad de la Frontera, Temuco - Chile. [ Links ]
Mondal M.K. (2009). Removal of Pb (II) ions from aqueous solution using activated tea waste: Adsorption on a fixed-bed column. J. Environ. Manage. 90, 3266-3271. [ Links ]
Mostafa M.G., Yen-Hua C., Jiin-Shuh J., Chia-Chuan L. y Yao-Chang L. (2011). Kinetics and mechanism of arsenate removal by nanosized iron oxide-coated perlite. J. Hazard. Mat. 187, 89-95. [ Links ]
ONU (2014). Agua para el mundo. Organización de las Naciones Unidas. http://www.un.org/es/sustainablefuture/water.shtml. [ Links ]
Ortega I.L. (2013). Propuesta de descontaminación del residual generado por el Instituto Central de Investigaciones Digitales (ICID) empleando una toba vítrea cubana. Tesis de Diploma de Ingeniería Química. Instituto Superior Politécnico "José Antonio Echeverría" (CU-JAE), La Habana, Cuba. [ Links ]
Pei-Sin K., Siew-Ling L., Sie-Tiong H., Yung-Tse H. y Siew-Teng O. (2013). Removal of hazardous heavy metals from aqueous environment by low-cost adsorption materials. Environ. Chem. Lett. DOI 10.1007/s10311-013-0427-1. [ Links ]
Salem A. y Akbari Sene R. (2011). Removal of lead from solution by combination of natural zeolite-kaolin-bentonite as a new low-cost adsorbent. Chem. Eng. J. 174, 619-628. [ Links ]
Salim Md. y Munekage Y. (2009) Lead Removal from Aqueous Solution Using Silica Ceramic: Adsorption Kinetics and Equilibrium Studies. Int. J. Chem. 1, 23-30. [ Links ]
Sari A., Tuzen M., Citak D. y Soylak M. (2007). Adsorption characteristics of Cu(II) and Pb(II) onto expanded perlite from aqueous solution. J. Hazard. Mater. 148, 387-394. dx.doi.org/10.1016/j. jhazmat.2007.02.052 [ Links ]
Souga R., Touaibia D., Benayada B. y Boucenna A. (2009). Adsorption of heavy metals from water using keratin powder prepared from Algerien sheep hoofs. European J. Sci. Res. 35, 416-425. [ Links ]
Tofighy M. y Mohammadi T. (2011). Adsorption of divalent heavy metal ions from water using carbon nanotube sheets. Journal of Hazardous Materials. 185, 140-147. [ Links ]














