Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista internacional de contaminación ambiental
versión impresa ISSN 0188-4999
Rev. Int. Contam. Ambient vol.29 no.4 Ciudad de México nov. 2013
Efecto tóxico del ión Al3+ en el ápice radicular de dos cultivares cubanos de arroz (Oryza sativa L.)
Toxic effect of Al3+ ion in the root tip of two Cuban rice cultivars (Oryza sativa L.)
Idioleidys ÁLVAREZ1*, Ofelia SAM1, Inés REYNALDO1, Pilar TESTILLANO2 y María del Carmen RISUEÑO2
1 Instituto Nacional de Ciencias Agrícolas. Ctra. de Tapaste, km 31/2. Gaveta Postal No.1, 32700, San José de Las Lajas, Mayabeque, Cuba *Autora responsable: ialvarez@inca.edu.cu
2 Laboratorio de Organización y Desarrollo Nuclear de Plantas del Centro de Investigaciones Biológicas del CSIC. Ramiro de Maetzu, 109, 28040, Madrid, España
Recibido enero 2012,
aceptado julio 2013
RESUMEN
La toxicidad por aluminio (Al) es el efecto más importante en los suelos ácidos y constituye el mayor factor limitante del crecimiento y la producción vegetal, razón por la cual el objetivo del trabajo fue determinar el efecto tóxico del aluminio en el sistema radical de plántulas de arroz de dos cultivares cubanos de importancia comercial, así como su relación con la localización del metal en el interior de la raíz. Para imponer la condición de estrés se emplearon diferentes niveles de cloruro de aluminio (AlCl3). Las muestras radicales fueron sometidas al procesamiento tradicional para microscopía óptica e incluidas en resina Lowicryl por un método de disminución progresiva de la temperatura (PLT). Las secciones teñidas fueron observadas al microscopio óptico (Zeiss) y fotografiadas con una cámara acoplada al mismo. Se empleó la tinción con hematoxilina para la ubicación del aluminio en el interior de la raíz. Se demostró que el aluminio provocó un incremento en el número de raíces adventicias y disminución en la longitud de la radícula, como una posible respuesta de la planta para su adaptación al medio. El aluminio provocó cambios en la forma y organización de células protodérmicas y del meristemo fundamental, en la sección transversal de la radícula. Se constató una sensible disminución en el ángulo de curvatura radicular, el cual puede constituir un indicador visual de toxicidad por aluminio en el arroz. La localización del metal y el comportamiento de los indicadores de crecimiento evidenciaron los daños que el Al provoca en estos cultivares, demostrándose además, que el cultivar J-104 es más sensible que el INCA-LP7 a los efectos tóxicos del aluminio.
Palabras clave: aluminio, toxicidad, cambios estructurales, arroz.
ABSTRACT
Aluminium toxicity is an important factor limiting crop productivity in acid soils and toxic effects of this metal are primarily root related. The aim of this paper was to study responses to Al toxicity in two Cuban rice cultivars and the relation with Al localization at root of seedlings. Different AlCl3 levels were employed to impose stress condition. Root apical segments were processed to optic microscopy by a Progressive Low Temperature Method (PLT) and they were included in Lowycril resin. The stained sections were viewed with Optic Microscopy (Zeiss) and photographed with Digital Camera Coupled to microscopy. Haematoxylin were employed to Al localization. Adventitious roots number was increased while the root elongation was reduced in seedlings exposed to Al. Different modifications were observed at the structure of epidermal and cortical cells in cross section. It provoked an increased at root diameter. These changes were accompanying by deformed roots and seedlings exposed to Al exhibited more root curvature than control seedlings and it could be consider a visual indicator to Al toxicity in rice plants. Differential Al localization and these results evidenced the toxic effect of Al in rice root cells and it evidenced that J-104 cultivar is more sensible to Al toxicity than INCA LP-7 cultivar.
Key words: aluminium, toxicity, structural changes, rice.
INTRODUCCIÓN
La acidificación de los suelos se ha intensificado en los últimos años, estimándose que aproximadamente el 30 % de la superficie terrestre y el 50 % de las tierras cultivadas están afectadas por este fenómeno y de estas últimas cerca de un 60 % se localiza en las zonas tropicales y subtropicales (Kochian et al. 2004, Pereira et al. 2006).
Aunque los suelos de Cuba no han sido de los más afectados por la acidez (Morales et al. 2001), diversos factores naturales y antrópicos han generado alrededor de 557 400 hectáreas de suelos alíticos con el transcurso de los años, los que se encuentran distribuidos en casi toda la isla, con una mayor incidencia en las provincias de Pinar del Río, Camagüey y Granma (Hernández et al. 2004, Hernández et al. 2006).
La toxicidad por Al es el efecto más importante en los suelos ácidos y constituye el mayor factor limitante del crecimiento y la producción vegetal (Schwarze-rová et al. 2002, Pereira et al. 2006, Liu et al. 2008). Se conoce que diferentes procesos y componentes celulares pueden ser afectados por el Al (Kochian 1995, Barceló y Postrieder 2002, Yamamoto et al. 2003, Zheng y Yang 2005, Liu et al. 2008), lo que ha limitado el estudio integrado de los mecanismos de toxicidad, de modo que falta mucho por conocer acerca de éstos. En relación con los mecanismos de tolerancia al Al se ha alcanzado un avance considerable, sobre todo en algunos cereales (Matsumoto 2000, Ryan et al. 2001), como el arroz (Oryza sativa L.), donde se ha abordado intensamente el papel de los ácidos orgánicos en la quelatación del Al intra y extracelular. Esta especie posee un valor teórico práctico importante (Simonovicova et al. 2004, Ligaba et al. 2006, Zhang et al. 2006) pero las investigaciones han estado encaminadas a la búsqueda de los genes que le confieren una mayor tolerancia al Al y no se han abordado con profundidad los efectos que este ion puede provocar en la arquitectura de la raíz, ni su relación con los diferentes procesos fisiológicos que tienen lugar en la misma; aún cuando el conocimiento detallado de las estructuras y los cambios que en ellas se producen, permiten interpretar correctamente cualquier respuesta fisiológica de la planta.
Por las razones antes expuestas, el objetivo de esta investigación fue determinar el efecto tóxico del Al en el sistema radical de dos cultivares cubanos de arroz, mediante el estudio de indicadores de crecimiento, así como su relación con la localización del metal en el interior de la raíz.
MATERIALES Y MÉTODOS
Material vegetal
Para el estudio se emplearon plántulas de arroz (Oryza sativa L.) de dos variedades comerciales cubanas. La variedad Jucarito-104 (J-104), que es empleada como patrón comercial por sus potencialidades en el rendimiento (Díaz y Morejón 2002) y la variedad INCA LP- 7, obtenida en el Departamento de Genética y Mejoramiento de las Plantas del Instituto Nacional de Ciencias Agrícolas, la cual exhibe cierto grado de tolerancia al estrés iónico (González et al., 2002) y constituye actualmente el 10% de la producción de arroz del sector no especializado y el 30% del sector especializado (MINAGRI 2009).
Condiciones experimentales
Se desarrolló un experimento en el que se definieron cuatro tratamientos, en los cuales las concentraciones de Al3+ en el medio de germinación fueron de 0 (testigo), 30, 65 y 125 μmol/L de cloruro de aluminio (AlCl3).
Las semillas de arroz se esterilizaron superficialmente con una solución de hipoclorito de sodio comercial al 10 % (Álvarez et al. 2005). Las semillas esterilizadas se colocaron en placas de Petri con papel de filtro (25 semillas por placa), las que se introdujeron en una cámara de crecimiento con 12 horas de luz y 12 horas de oscuridad y una temperatura noche/ día de 21/26 °C. Las plántulas se evaluaron después de siete días de germinadas las semillas.
Se realizaron tres réplicas del experimento y se tomaron al azar 20 plántulas por placa y un total de 60 por tratamiento, a las cuales se les tomó el sistema radical completo para realizar las evaluaciones.
Determinación de indicadores de crecimiento
Para determinar el número de raíces adventicias se realizó el conteo de todas las raíces emitidas en cada una de las plántulas y para determinar la longitud de la radícula se seccionó la misma del sistema radical y se colocó sobre papel milimétrico y para garantizar una correcta medición se fijó la base de la radícula en cero y se estiró la misma cuidadosamente hasta quedar lineal.
Para la determinación del diámetro radicular a nivel del tercer milímetro del ápice radicular se colocó un micrómetro ocular al microscopio, el cual fue previamente calibrado para realizar las determinaciones de la sección circular de la radícula. Las secciones transversales de la radícula se obtuvieron mediante el procesamiento para microscopía óptica empleado por Sam et al. (2003), donde se utilizó la resina hidrofílica Lowicryl K4M, que polimeriza a -30 °C, por lo que la infiltración y polimerización se llevó a cabo en un sistema refrigerado de sustitución automática (Leica, Viena).
Los bloques ya polimerizados se llevaron a un ultramicrotomo (LKB) y con una cuchilla de cristal se le realizaron cortes semifinos de 1 μm de espesor, los cuales se tiñeron con una solución de azul de toluidina al 0.075 % (m/v) y se observaron en un microscopio óptico de luz (Zeiss).
Las secciones apicales de cinco milímetros se observaron al estereoscopio para determinar el ángulo de curvatura radicular y se fotografiaron con una cámara digital (DSC-S85; Sony, Tokyo) acoplada al mismo. Se obtuvieron imágenes digitales que se exportaron al programa morfométrico Image J, con una ampliación de 20x, para determinar el ángulo de curvatura de la radícula, según el procedimiento descrito por Álvarez (2009).
Localización del Al
Para localizar el Al se empleó la tinción con hematoxilina. Las plántulas fueron tomadas cuidadosamente de las cámaras y transferidas a una malla suspendida en un vaso de precipitados con 200 mL de agua destilada. Posteriormente fueron colocadas en un vaso de precipitados similar, con solución acuosa de hematoxilina [0.2 % de hematoxilina (Merck) y 0.02 % de yodato de potasio (KIO3) m/v] en agitación lenta durante 20 minutos de acuerdo con Polle et al. (1978). Una vez lavadas nuevamente las radículas se seccionaron a cinco milímetros de la punta y los ápices se fotografiaron con una cámara digital (DSC-S85; Sony, Tokyo) y un aumento de 20x en un estereoscopio (Zeiss). Para nombrar el color del complejo Al-hematoxilina en la radícula se empleó una escala de colores (Gotomy Color 2009).
Análisis estadísticos
Se utilizó un diseño completamente al azar. Los resultados experimentales del número de raíces, la longitud y el diámetro radicular y el ángulo de curvatura, fueron sometidos a un análisis de varianza con arreglo bifactorial, donde los factores fueron las variedades y las concentraciones de Al. En los casos que se encontraron diferencias significativas, se compararon las medias según la prueba de Tukey, para el 5 % de probabilidad de error. Para el análisis estadístico fue utilizado el paquete Statgraphics versión 4.1 en ambiente Windows.
RESULTADOS Y DISCUSIÓN
Hace algunos años se pensaba que todos los sistemas radicales eran grandes y muy ramificados, sin embargo, recientemente se ha visto que el desarrollo de los mismos está determinado por patrones característicos para cada especie, que a su vez dependen de la interacción con los factores bióticos y abióticos del suelo (Álvarez et al. 2012).
Entre los factores abióticos que más influyen se pueden mencionar, la temperatura, el contenido de agua y de oxígeno, así como una elevada concentración de elementos químicos, entre los que se encuentran el aluminio y el hierro (Cox y Muday1994, Vázquez 1999).
De manera general es necesario destacar que no se produjo interacción entre las variedades y las concentraciones de Al para ninguna de las variables estudiadas.
Al determinar el número de raíces adventicias en cada plántula se pudo apreciar un incremento del mismo para la variedad INCA LP-7 en la medida en que se intensificó la exposición al metal. Sin embargo la J-104 exibió un comportamiento diferente para este indicador (Fig. 1).
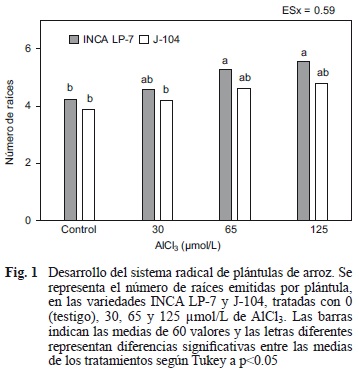
Las plántulas de la variedad INCA LP-7 que fueron crecidas con 30 μmol/L no exhibieron diferencias en cuanto al número de raíces adventicias en relación con las del testigo. Sin embargo, a partir de 65 μmol/L se favoreció la rizogénesis, de manera que las plántulas expuestas a la concentración más tóxica del metal (125 μmol/L) emitieron un 32 % más de estas raíces que las no tratadas (Fig. 1).
El número de raíces que puede desarrollar una planta está determinado desde la formación del embrión, no obstante, en esta investigación se observó una tendencia al incremento de esta variable cuando las plantas fueron expuestas a diferentes concentraciones de Al, aún cuando se ha hecho referencia a que los efectos tóxicos de este ion afectan el desarrollo de un sistema radical ramificado en algunas especies vegetales (Kochian 1995).
La variedad INCA LP-7 exhibió un mejor comportamiento ante la presencia del Al, ya que sus plántulas emitieron un mayor número de raíces que las de la J-104 (Fig. 1). El incremento de este indicador se debe entre otras razones, a una respuesta de la planta en función de mantener la capacidad de absorción de agua y sales minerales que se ve afectada con la reducción en longitud, lo que se evidencia a través de la relación inversa que se establece entre el número de raíces emitidas por las plántulas y el crecimiento en longitud de sus radículas. Por otro lado, un mayor número de raíces adventicias garantiza la fijación de la planta al suelo y ambos elementos son indispensables para un exitoso desarrollo de la misma, sobre todo en condiciones de toxicidad por Al.
Estos resultados permiten sugerir que el incremento en el número de raíces puede ser una respuesta adaptativa de la planta, teniendo en cuenta que el desarrollo del sistema radical en el arroz es de vital importancia, ya que la planta adulta no desarrolla una raíz principal sino un sistema radical ramificado del cual depende su funcionamiento.
La primera evidencia de toxicidad fue la inhibición del crecimiento en la radícula de las plántulas expuestas al Al, alteración que se considera el síntoma más frecuente ante la presencia de este ion, ya que una reducción similar del crecimiento ha sido observada en diferentes especies de plantas (Ciamporová 2000, Matsumoto 2000, Tahara et al. 2008).
Cuando se determinó el crecimiento en longitud, las plántulas testigo en la variedad J-104 exhibieron valores superiores a las de la INCA LP-7 (Fig. 2). Sin embargo, fueron las más afectadas por el ion Al3+, ya que a 30 μmol/L se observó una disminución significativa de este indicador en relación con el testigo. Aunque no se obtuvieron diferencias significativas entre las tratadas con 30, 65 y 125 μmol/L, se observó una tendencia a la disminución del mismo con el incremento en los niveles de Al (Fig. 2).

Este comportamiento indicó que 30 μmol/L es suficiente para afectar la longitud radicular en la variedad J-104 y que a partir de esta concentración se mantiene el efecto inhibitorio del Al en el crecimiento de la radícula, de manera tal que en las plántulas expuestas a 125 μmol/L se observó una reducción del 23 % en relación con las plántulas no tratadas. En la INCA LP-7 la longitud radicular no difirió entre ninguno de los tratamientos, por lo que esta variedad fue capaz de soportar dosis de hasta 125 μmol/L de AlCl3, sin tener afectaciones en la longitud de su radícula (Fig. 2).
Esta inhibición del crecimiento puede variar con la concentración de Al en cada uno de los tratamientos y el tiempo de exposición al metal, similar a lo observado en plántulas de maíz (Zea mays) (Ciamporová 2002). No obstante, estos parámetros no variaron durante el estudio, por lo que el comportamiento diferente que exhibió la longitud de la radícula en cada una de las variedades de arroz, sugiere que el crecimiento en longitud está determinado, para este cultivo, por el grado de tolerancia al metal. Aún más cuando se ha visto que la intensidad de la inhibición puede diferir entre especies y entre variedades (Matsumoto 2000).
Al evaluar microscópicamente la radícula se detectó un abultamiento entre el segundo y el cuarto milímetro del ápice en las plántulas tratadas con Al, región donde se localiza la zona de transición celular, que no es más que la zona intermedia entre la de división y la de alargamiento (Ciamporová 2002). Estos elementos indicaron la necesidad de estudiar la sección transversal del ápice radicular para conocer los daños provocados por el ion Al3+ en esta zona y determinar la magnitud del engrosamiento observado, como un posible indicador de tolerancia.
El estudio de las secciones semifinas transversales (1μm) permitió cuantificar el cambio morfológico observado y evidenció un aumento en el diámetro de la zona de transición de la radícula de las plántulas tratadas con Al (Fig. 3). No obstante, las dos variedades exhibieron un comportamiento diferente para este indicador.
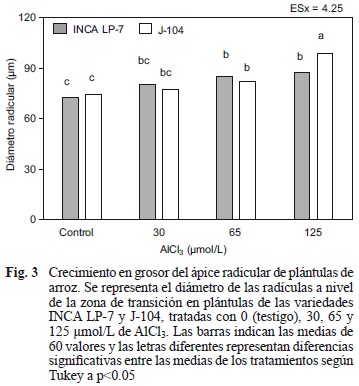
Las plántulas de la variedad J-104 que fueron expuestas a 30 μmol/L de AlCl3 no exhibieron un incremento significativo en el diámetro en relación con el testigo, mientras que en las tratadas con 65 y 125 μmol/L sí se apreciaron diferencias significativas respecto al testigo y entre ellas (Fig. 3). De manera que en las plántulas expuestas a la concentración más tóxica del ion (125 μmol/L), el diámetro radicular llegó a incrementarse en un 32.21 % en relación con las plántulas testigo.
En la variedad INCA LP-7 las plántulas expuestas a la menor concentración del ion (30 μmol/L) no mostraron un comportamiento similar a la J-104, ya que exhibieron un grosor radicular superior al testigo, sin embargo las plántulas tratadas con 65 y 125 μmol/L aunque difirieron estadísticamente en relación con las no tratadas, no lo hicieron entre ellas (Fig. 3). Estos resultados indican que la variedad J-104 fue la más afectada en este indicador de crecimiento, ya que la radícula de sus plántulas se engrosó de forma significativa ante concentraciones crecientes del ion, en relación con la INCA LP-7, donde se alcanzó un valor estable del diámetro radicular.
La evaluación histológica de las secciones transversales permitió detectar algunas alteraciones en la organización de los tejidos y las modificaciones estructurales responsables del incremento observado en el diámetro de la radícula.
La sección transversal de la radícula de las plántulas testigo exhibió una estructura típica, donde las células protodérmicas forman una capa monoestratificada y mantienen su forma poliédrica, mientras las células del meristemo fundamental están distribuidas uniformemente en varias capas circulares alrededor del procámbium (Fig. 4 a y b).

En las radículas de plántulas tratadas con las diferentes concentraciones del ion Al3+ se apreciaron diferentes cambios en este ordenamiento estructural. Aunque las células protodérmicas se mantuvieron formando una sola capa de células, se observaron deformes y ligeramente alargadas en sentido radial, mientras las células del meristemo fundamental más internas se expandieron radialmente y las más externas se observaron comprimidas y desorganizadas, lo que impidió definir las capas celulares observadas en el control (Fig. 4b).
En la figura 4 se puede apreciar como este desorden se hizo más evidente con el incremento en los niveles de Al3+, de manera tal que en las plántulas de las dos variedades, expuestas a 125 μmol/L es difícil definir las capas celulares dentro de la estructura radicular.
Lo anterior indica que este ion provocó cambios en la forma y en la organización de las células protodérmicas y del meristemo fundamental, en la sección transversal de la radícula y esto conllevó a un incremento en el diámetro de la misma, lo que impide sin lugar a dudas un adecuado crecimiento de la raíz.
Al examinar microscópicamente la morfología externa de la radícula de las plántulas testigo se constató que los ápices aparecían con una ligera curvatura, como consecuencia de la respuesta gravitrópica de la radícula crecida en posición horizontal. Sin embargo, en las plántulas tratadas con Al3+, en las que se debía esperar un comportamiento similar, se apreció una curvatura más acentuada que la observada en las plántulas testigo (Fig. 5).

Las variedades INCA LP-7 y J-104 exhibieron una reducción significativa de este ángulo en las plántulas tratadas con las diferentes concentraciones del ion, en relación con las plántulas testigo y entre ellas. Además, este crecimiento asimétrico de los ápices se hizo más evidente con el incremento de los niveles de Al3+, de manera que las plántulas expuestas a la concentración más tóxica del ion, exhibieron la mayor curvatura (Fig. 6).
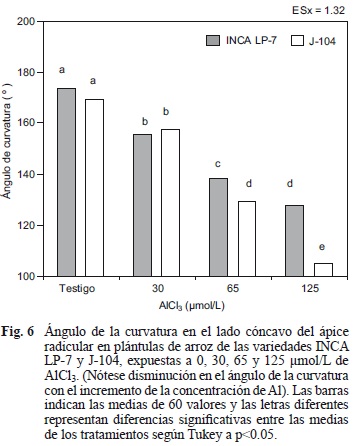
El comportamiento anterior demostró que la curvatura radical puede ser un indicador sensible al ion Al3+, si se tiene en cuenta que el ángulo de curvatura disminuyó significativamente, incluso cuando las plántulas fueron expuestas a 30 μmol/L de AlCl3.
Las plántulas testigo en ambas variedades exhibieron valores superiores a los 165° en el ángulo de curvatura radicular, sin embargo, las tratadas con el metal no superaron los 160° en ninguno de los casos, lo que sugiere la posibilidad de evaluar el ángulo de curvatura como un indicador de toxicidad por Al, a partir de este valor.
No obstante, los ápices radiculares de la variedad J-104 que fueron expuestos a 125 μmol/L, llegaron a describir ángulos cercanos a 100°, mientras que en la variedad INCA LP-7, escasas veces fueron inferiores a 130° (Fig. 6). Este comportamiento evidencia que los ápices radiculares de la variedad J-104 fueron los más afectados por el efecto del ion Al3+, lo que confirma que la curvatura radicular puede ser utilizada como un indicador visual de toxicidad.
La modificación anterior ha sido observada en raíces de maíz, sin embargo no se determinaron los valores, ni la variación del ángulo ante diferentes concentraciones de Al (Ciamporová 2002). La curvatura radicular pudieran ser una consecuencia de las alteraciones provocadas por el metal en el transporte de auxinas, ya que desórdenes similares se observaron al emplear inhibidores del transporte de esta hormona en plantas de maíz (Zea mays) (Sivaguru 1999) y trigo (Avena sativa) (Kollmeier et al. 2000).
La localización del Al en el interior de la raíz mediante la tinción con hematoxilina fue un elemento esencial para relacionar los cambios morfológicos observados con el grado de tolerancia al metal. Se constató la ausencia del ion en la radícula de las plántulas del control para las dos variedades estudiadas, mientras que en las plántulas tratadas con Al se pudo apreciar la ubicación de este elemento en el ápice radicular a través de la coloración violeta oscuro que exhibió el complejo hematoxilina-Al, donde además se hace evidente una coloración diferencial entre dosis y entre variedades (Fig. 7).

Este colorante tiene la propiedad de tornarse azul-violeta cuando forma un complejo específico con el ion Al3+, el que puede facilitar su penetración y retención en la raíz. Además, la intensidad del color en los ápices radicales teñidos es una medida cuantitativa de la sensibilidad al Al, según algunos autores (Ruiz-Torres y Carver 1992 y Cancado et al. 1999), lo que se debe a que los genotipos susceptibles tienden a acumular grandes cantidades del metal en los tejidos radicales. Por tanto, la tinción con hematoxilina, que ha sido una forma no destructiva de estudiar la sensibilidad al Al en varias especies de plantas (Delhaize et al. 1993, Wagat-suma et al. 1995, Cancado et al. 1999, Gunsé et al. 2003), permitió detectar si las variedades estudiadas absorbían más o menos Al.
En la variedad INCA LP-7, los ápices radiculares que fueron expuestos a 30 μmol/L de AlCl3, exhibieron una tenue coloración en la cofia, mientras que en los expuestos a 65 y 125 μmol/L, la misma se extendió al resto del ápice, en mayor medida para la última concentración (Fig. 7). En estas radículas la coloración no fue homogénea, sino que se pudieron apreciar numerosos puntos coloreados en todo el ápice, lo que indicó que el Al se ubicó de forma aislada dentro del tejido.
En las plántulas de la J-104 que fueron expuestas a 30 μmol/L de Al, se observó un comportamiento similar, ya que al igual que en la otra variedad, los ápices radiculares exhibieron solo la cofia coloreada. Sin embargo, las plántulas expuestas 65 μmol/L mostraron una coloración homogénea en el primer centímetro del ápice, correspondiente a la zona de división y las tratadas con 125 μmol/L mostraron sus ápices completamente coloreados, lo que indica una mayor cantidad de iones dentro del ápice radicular (Fig. 7).
Este hallazgo evidenció que la variedad J-104 no posee mecanismos eficientes de tolerancia, lo que la hace más vulnerable al efecto tóxico de este ion. No obstante, la localización del ion en la INCA LP-7 concuerda con el comportamiento que mostró esta variedad ante los indicadores de crecimiento y demuestra que la misma posee un mayor grado de tolerancia ante el estrés por Al. Esto pudiera deberse a que posee la capacidad de excluir el Al de forma eficiente, mediante la exudación de compuestos orgánicos capaces de quelar el Al fuera de la célula y formar complejos no tóxicos para las plantas, como se ha visto en diferentes investigaciones (Delhaize y Ryan 1995, Kochian 1995, Ma et al. 1998, Sivaguru et al, 2000 y Matsumoto 2000). Este mecanismo se puede relacionar con la existencia de canales aniónicos dependientes de Al en esta variedad, teniendo en cuenta que en plantas tolerantes de trigo (Ryan et al. 1997) y maíz (Piñeros y Kochian 2001) se ha evidenciado una elevada densidad de estos canales.
Como resultados de la investigación se pudo constatar que el Al provocó modificaciones en el sistema radical de las variedades comerciales de arroz, sin embargo, no todas ellas, estuvieron relacionadas con la tolerancia al metal, ya que la localización del Al en la radícula, así como el menor grado de afectación en los indicadores de crecimiento demostraron que la variedad J-104 es más sensible que la INCA-LP7 a los efectos tóxicos del metal.
REFERENCIAS
Álvarez I. (2009). Modificaciones anatomofisiológicas del sistema radical de plántulas de arroz (Oryza saliva L.) tratadas con Al. Tesis de Doctorado en Ciencias Biológicas. Facultad de Biología.Universidad de La Habana, La Habana, Cuba, 97pp. [ Links ]
Álvarez I., Sam O., Reynaldo I. (2005). Alteraciones celulares inducidas por el ión Al3+ en dos variedades cubanas de arroz (Oryza sativa L.). Cultivos Tropicales. 26, 61-64. [ Links ]
Barceló J., Postchenrieder C. (2002). Fast root growth response, root exudates, and internal detoxification, as clues to the mechanisms of aluminium toxicity and resistance: a review. Environ. Exp. Bot. 48, 75-92. [ Links ]
Cançado G. M. A., Loguercio L.L., Martins P.R, Parentoni S.N., Paiva E., Borém A., Lopes M.A. (1999). Hematoxylin staining as a phenotypic index for aluminum tolerance selection in tropical maize (Zea maysL.). Theor. Appl. Genet. 99, 747-754. [ Links ]
Ciamporová M. (2000). Diverse response of root cell structure to aluminium stress. Plant Soil. 226, 113 -116. [ Links ]
Ciamporová M. (2002). Morphological and structural responses of plant roots to aluminium at organ, tissue and cellular levels. Biol. Plant. 45, 161-171. [ Links ]
Cox D.N., Muday G.K. (1994). NPA binding activity is periferal to the plasma membrane and is associated with the cytosqueleton. Plant. Cell. 6, 1941-1953. [ Links ]
Cuba. MINAGRI. (2009). CAI Arrocero "Los Palacios". Informe de los resultados de la campaña de arroz de frío 2008-2009. 18 pp. [ Links ]
Delhaize E., Ryan P.R. (1995). Aluminium toxicity and tolerance in plants. Plant Physiol. 107, 315-321. [ Links ]
Delhaize E., Craig S., Beaton C.D., Bennet R.J., Jagadish V.C., Randall P.J. (1993). Aluminium tolerance in wheat (Triticum aestivum). Uptake and distribution of aluminium in root apices. Plant Physiol, 103, 685-693. [ Links ]
Díaz S., Morejón R. (2002). Comportamiento de variedades de arroz de diferente procedencia en la localidad de Los Palacios. Cultivos Tropicales. 23, 63-67. [ Links ]
González, M.C., Cristo, E., Pérez, N., Delgado, P. (2002). INCA LP-7, nueva variedad de arroz para suelos afectados por la salinidad. Cultivos Tropicales. 23, 89-90. [ Links ]
Gotomy Color. (2009). Escala de colores. (en línea). http://www.gotomy.com/color.html. 15/12/2009 [ Links ]
Gunsé B., Garzón T., Barceló J. (2003). Study of aluminum toxicity by means of vital staining profiles in four cultivars of Phaseolus vulgaris L. J. Plant Physiol. 105, 712-715. [ Links ]
Hernández A., Ascanio M.O., Cabrera A., Morales M., Medina N. (2004). Problemas actuales de clasificación de suelos: énfasis en Cuba. Ed. Veracruzana, Cuadernos Universitarios, México. 221pp. [ Links ]
Hernández A., Morales M., Ascanio M.O., Morell F. (2006). Manual práctico para la aplicación de la nueva versión de clasificación genética de los suelos de Cuba. Ed. Universidad de Nayarit, México. 293pp. [ Links ]
Kochian, L.V. (1995). Cellular mechanism of aluminium toxicity and resistance in plants. Annu. Rev. Plant. Physiol. Mol. Biol. 46, 237-260. [ Links ]
Kochian L.V., Hoekenga O.A., Pioneros M.A. (2004). How do crop plants tolerate acid soils? Mechanisms of aluminum tolerance and phosphorous efficiency. Annu. Rev. Plant Biol. 55, 459-93 [ Links ]
Kollmeier, M., Felle, H.H., Horst, W.J. (2000). Genotypical difference in Al resistance of Zea mays (L) are expressed in the distal part of the transition zone is reduced basipetal auxin flow involved in inhibition of root elongation by Al? Plant Physiol. 122, 945-956. [ Links ]
Ligaba A., Katsuhara M., Ryan P., Shibasaka M., Matsumoto H. (2006). The BnALMT1 and BnALMT2 Genes from Rape Encode Aluminum-Activated Malate Transporters That Enhance the Aluminum Resistance of Plant Cells. Plant Physiology. 142, 1294-1303. [ Links ]
Liu Q., Yang J.L., He L.S., Li Y., Zheng S.J. 2008. Effect of aluminum on cell wall, plasma membrane, antioxidants and root elongation in triticale. Biol. Plant. 52, 87-92. [ Links ]
Ma J.F., Hiradate S., Matsumoto H. (1998). High aluminium resistance in buck-wheat. II. Oxalic acid detoxifies aluminium internally. Plant Physiol. 117, 753-759. [ Links ]
Matsumoto H. (2000). Cell biology of aluminium toxicity and tolerance in higher plants. Int. Rev. Cytol. 200,1-46. [ Links ]
Morales M., Hernández A., Vantour A. (2001). El proceso de alitización y la clasificación de suelos alíticos en Cuba. Informe del Instituto de Suelos. MINAG, La Habana, 17pp. [ Links ]
Pereira L.M., Tabaldi L.A., Goncalves J.F., Jucoski G.O., Pauletto M.M., Weis S.N., Nicoloso F.T., Borher D., Rocha J.B.T., Schetinger M.R.C. (2006). Effect of aluminum on d-aminolevulinic acid dehydratase(ALA-D) and the development of cucumber (Cucumis sativus). Environ Exp. Bot. 57, 106-115. [ Links ]
Piñeros M.A., Kochian L.V. (2001). A patch-clamp study on the physiology of aluminium toxicity and aluminium tolerance in maize. Identification and characterization of Al3+-induced anion channels. Plant Physiol. 125, 292-305. [ Links ]
Ruiz-Torres N.A., Carver B.F. (1992). Genetic expression of aluminium tolerance in hard red winter wheat. Cereal Res. Com. 20, 233-240. [ Links ]
Ryan P.R., Di Tomaso J.M., Kochian L.V. (2001). Aluminium toxicity in roots: an investigation of spatial sensivity and the role of the root cap. J. Exp. Bot. 44, 437-446. [ Links ]
Ryan P.R., Skerrett M., Findlay G.P., Delhaize E., Tyerman S.D. (1997). Aluminium activates an anion channel in the apical cells of wheat roots. Proc. Natt. Acad. Sci. USA. 94, 6547-6552. [ Links ]
Sam O., Ramírez C., Coronado M.J., Testillano P.S., Risueño M.C. (2003). Changes promoted by saline stress in tomato plant leaves: a subcellular and ultrastructural study. Biol. Plant. 47, 361-366. [ Links ]
Schwarzerová K., Zlenkova S., Nick P., Opatrn Z. (2002). Aluminium induced rapid changes in the microtubular cytoskeleton of tobacco cell lines. Plant and Cell Physiol. 43, 207-216. [ Links ]
Simonoviková M., Tamás L., Huttová J., Mistrík I. (2004). Effect of aluminium on oxidative stress related enzymes activities in barley roots. Biol. Plant. 48, 261-266, [ Links ]
Sivaguru M., Baluska F., Volkman D., Fell H.H., Horst W.J. (1999). Impacts of aluminium on the cytosqueleton of the maize root apex. Short-term effects on the distal past of the transition zone. Plant. Physiol. 119, 1073-1082. [ Links ]
Sivaguru M., Fujiwara T., Samaj J., Baluska F., Yang Z., Osawa H., Maeda T., Mori T., Volkmann D., Matsumoto H. (2000). Aluminium induced 1-3-B-D- Glucan inhibits cell to cell trafficking of molecules through plasmodesmata. A new mechanism of aluminium toxicity in plants. Plant Physiol. 124, 991-1005. [ Links ]
Tahara K., Norisada M., Yamanoshita T., Kojima K. (2008). Role of aluminum-binding ligands in aluminum resistance of Eucalyptus camaldulensis and Melaleuca cajuputi. Plant Soil. 302,175-187. [ Links ]
Vázquez M.D., Poschenrieder C., Corrales I., Barceló J. (1999). Change in apoplastic aluminium during the initial growth response to aluminium by roots of a tolerant maize variety. Plant. Physiol. 199, 435-444. [ Links ]
Wagatsuma T., Ishikawa S., Obata H., Tawaraya K., Kathonda S. (1995). Plasma membrane ofyounger and outer cells is the primary specific site for aluminium toxicity in roots. Plant. Soil 171, 105-112. [ Links ]
Yamamoto Y., Kobayashi S., Devi R., Riklishi S., Matsumoto H. (2002). Aluminium toxicity is associated with mitochondrial dysfunction and the production of reactive oxygen species in plant cells. Plant Physiology. 128, 63-64. [ Links ]
Zhang A., Jiang M., Zhang J., Tan M., Hu X. (2006). Mitogen-Activated Protein Kinase Is Involved in Abscisic Acid-Induced Antioxidant Defense and Acts Downstream of Reactive Oxygen Species Production in Leaves of Maize Plants. Plant Physiology. 141, 475-487. [ Links ]
Zheng S.J., Yang J.L. (2005). Target sites of aluminum phytotoxicity. Biol. Plant. 49, 321-331. [ Links ]














