Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista internacional de contaminación ambiental
versión impresa ISSN 0188-4999
Rev. Int. Contam. Ambient vol.29 no.3 Ciudad de México ago. 2013
Metodología para determinar la liberación de metales del sedimento al agua en lagos y embalses
Methodology to determine the liberation of metals from sediments to water in lakes and reservoirs
Anne M. HANSEN*, Florence MAHÉ y Carlos E. CORZO-JUÁREZ
Instituto Mexicano de Tecnología del Agua, Paseo Cuauhnáhuac 8532, Col. Progreso C.P. 62550, Jiutepec, Morelos, México. *Autora responsable; ahansen@tlaloc.imta.mx
Recibido septiembre 2012,
aceptado febrero 2013
RESUMEN
Aunque el sedimento en cuerpos de agua puede actuar como fuente secundaria de contaminantes disueltos, no se conocen criterios que establezcan esta relación. En este trabajo se propone una metodología para estimar los riesgos de contaminar el agua por liberación de metales acumulados en sedimento. Se evaluó la distribución de cadmio, cobre, cromo, hierro, manganeso, níquel, plata y zinc entre agua y sedimento en ambientes experimentales que varían entre oxidados y reducidos. Una muestra de sedimento combinado de un embalse situado en una zona tropical fue suspendido en agua con agitación magnética y control del potencial redox (Eh) entre -450 y +300 mV. Se evaluó la liberación de metales y se extrapolaron los resultados, considerando que la interacción con el agua ocurre en un espesor de 5 cm de sedimento con densidad de 0.34 kg/L de peso seco. Asimismo, con modelación hidrogeoquímica se evaluó la distribución de los metales entre las fases sólida y disuelta, aplicando el programa PHREEQC v. 2. Se plantearon tres escenarios de profundidad del agua y los resultados de las concentraciones de los metales fueron comparados con los Criterios Ecológicos de Calidad del Agua de México para agua como fuente de abastecimiento (CECA). Se encontró que bajo condiciones oxidadas, cadmio, cobre, cromo, níquel, plata y zinc se adsorben en los óxidos de hierro del sedimento. Con la disolución de hierro bajo condiciones de Eh negativo, las concentraciones disueltas de la mayoría de estos metales se incrementan. Bajo condiciones de Eh aún más reducidas (Eh < -214 mV), disminuyen nuevamente dichas concentraciones, probablemente por coprecipitación con, o adsorción en, sulfuros de hierro. La metodología desarrollada, que combina evaluación experimental con modelación hidrogeoquímica, permite evaluar diferentes escenarios de contaminación del agua en contacto con el sedimento. El conocimiento de la disolución reductiva de metales es imprescindible para poder mitigar efectos a la salud y para la toma de decisiones sobre tratamientos de agua.
Palabras clave: interacción agua-sedimento, potencial redox, disolución reductiva, modelación hidrogeoquímica, adsorción, coprecipitación, sulfuros de hierro, óxidos de hierro y manganeso.
ABSTRACT
Although the sediment in water bodies may act as a secondary source of aqueous contaminants, no criteria are known that establish such relation. The present study proposes a methodology to determine risks of water pollution by release of metals accumulated in the sediment. The liberation of metals was evaluated in environments ranging from oxidized to reduced. A combined sediment sample from a reservoir in a tropical area was suspended with magnetic stirring and control of redox potentials (Eh) between -450 and +300 mV. We calculated the metals release per mass unit of sediment, considering that this occurs in a 5-cm sediment layer of 0.34 kg/L density. Likewise, distributions of metals among dissolved and solid phases were evaluated by hydrogeochemical modeling with PHREEQC v. 2. Three scenarios of water depth were evaluated and results were compared with the Mexican Ecological Water Quality Criteria for water supply sources (CECA). It was found that metals are adsorbed on solid iron oxides of the sediment in oxidized water-sediment systems. As solid iron phases dissolve at negative Eh, aqueous concentrations of most metals increased. At even more reduced conditions, Eh < -214 mV, the dissolved concentrations of metals decreased, probably due to coprecipitation with and/or adsorption on iron sulfide. The methodology presented here allows estimating future water pollution by metals contained in sediment. Understanding the reductive dissolution of metals is essential to mitigate health effects and for decision-making regarding water treatment.
Key words: water-sediment interaction, redox potential, reductive dissolution, hydrogeochemical modeling, adsorption, coprecipitation, iron sulfide, iron and manganese oxides.
INTRODUCCIÓN
La contaminación del agua y sedimento por metales es una problemática importante en los cuerpos de agua de zonas urbanas e industrializadas (Hansen 1992, Martínez 1996). Aunque algunos metales traza son esenciales para la vida a bajas concentraciones, pueden ser altamente tóxicos cuando se encuentran en concentraciones más elevadas (Florence 1982). En lagos y embalses el sedimento es el receptor final de muchos contaminantes, incluyendo metales y compuestos orgánicos persistentes (Barceló 2000). Una vez acumulados los contaminantes en el sedimento, éste puede actuar como fuente de contaminantes al agua debido a la disolución, que puede ocurrir por procesos de resuspensión y bioturbación del sedimento y durante periodos de agotamiento del oxígeno disuelto (Patrick y DeLaune 1977, Hansen y González-Márquez 2010).
Los embalses eutróficos con elevadas cantidades de nutrientes con frecuencia tienen una importante productividad fotosintética y, por tanto, de materia orgánica (MO). La descomposición de esta MO en los cuerpos de agua, así como la que proviene de descargas y escurrimientos, causa el consumo de oxígeno disuelto (OD), ocasionando zonas anaerobias con Eh reducido, sobre todo en el hipolimnio, donde no existe interacción con la atmósfera. Esto puede resultar en la disolución reductiva de minerales adsorbentes como los de hierro y manganeso (Miao et al. 2006, Hansen y González-Márquez 2010, Hansen y Márquez-Pacheco 2012). Otro factor que puede cambiar el equilibrio de la interfase agua-sedimento y causar la disolución de contaminantes, es la resuspensión del sedimento debido a la bioturbación, la acción de los vientos o durante eventos de avenidas fuertes. Entender la distribución de los contaminantes bajo estas circunstancias es imprescindible para mitigar efectos a la salud y para tomar decisiones sobre tratamientos del agua.
Se ha demostrado que las condiciones redox en lagos y embalses de zonas tropicales varían de acuerdo con el período del año (Beadle 1966, Hansen y Márquez-Pacheco 2012). Se distinguen dos estaciones: la primera caracterizada por la estratificación térmica, acompañada por anoxia en el fondo del cuerpo de agua y, la segunda, por la mezcla del agua. En época de calor, el sol calienta la superficie del agua y, debido su baja conductividad térmica, la temperatura en la superficie se difunde muy lentamente a las capas inferiores, generando así la estratificación térmica (Hutchinson 1975). Esta estratificación causa la formación de una capa de agua más caliente sobreyacente a la termoclina y que tiene contacto con la atmósfera, el epilimnio, y una capa de agua más fría, subyacente a la termoclina y que no tiene contacto con la atmósfera, el hipolimnio. La demanda de oxígeno en agua del hipolimnio y en el sedimento y el agotamiento de OD, causan que se reduzca el Eh, dando lugar a la disolución reductiva de óxidos de hierro (FeOOH) y de manganeso (MnO2), causando la solubilización de los metales adsorbidos en ellos (Harrington et al. 1998). El enfriamiento del agua del epilimnio durante la época de frío causa nuevamente la mezcla y oxigenación de los cuerpos de agua. De esta manera, el Eh puede variar entre muy oxidado (+500 mV) y muy reducido (-300 mV, Patrick y DeLaune 1977), afectando así la distribución de metales entre el agua y el sedimento (Guo et al. 1997, Mansfeldt 2004).
Aunque el FeOOH y el MnO2 en sedimento son excelentes adsorbentes de metales, son afectados por los cambios en Eh y pH (Levy et al. 1992). Al reducirse el Eh en el sedimento de cuerpos de agua abajo de -200 mV, el sulfato se reduce a sulfuro, que reacciona con el hierro disuelto, formando sulfuro de hierro sólido cuando las concentraciones de estos iones rebasan el producto de solubilidad del FeS de 1.26x1018 (Morel y Hering 1993). Al formarse este sólido actúa como nuevo sustrato de los metales traza (Pardu y Patrick 1995), coprecipitando o adsorbiendo estos contaminantes (Morse y Arakaki 1993). Contrariamente, la oxidación del sedimento causa la degradación de MO, produciendo la liberación de los metales traza asociados a ella (Cappuyns y Swennen 2005). Sin embargo, los metales liberados son nuevamente adsorbidos por el FeOOH y el MnO2 bajo las condiciones oxidadas. De esta manera, las condiciones oxidadas en la interfase agua-sedimento favorecen la insolubilidad de los metales traza, mientras que las condiciones reducidas favorecen la solubilidad de estos contaminantes y la consecuente movilidad y disponibilidad cuando las concentraciones de azufre son bajas.
Aunque el sedimento en los cuerpos de agua puede actuar como fuente de contaminantes, no se conocen criterios que permitan establecer la relación entre los contaminantes en el sedimento y su concentración en el agua. En este trabajo se desarrolla una metodología que permite evaluar la liberación de metales del sedimento al agua por disolución reductiva en embalses de zonas tropicales, donde se presenta estratificación térmica estacional y cambios en el Eh. Con este objetivo se realizan experimentos de liberación de metales en sistemas agua-sedimento, variando el Eh entre +300 y -450 mV. Asimismo, para evaluar la distribución de los metales entre las fases sólida y disuelta, se simulan los equilibrios de distribución por procesos de adsorción de metales mediante la aplicación del programa de equilibrio químico PHREEQC v. 2. Por último, se plantean diferentes escenarios para simular las implicaciones de la distribución de los metales por disolución reductiva en cuerpos de agua con diferente profundidad.
MATERIALES Y METODOLOGÍA
Se desarrolló una metodología que permite evaluar la contaminación producida por la liberación de metales del sedimento al agua en lagos y embalses. Para ello se muestreó y caracterizó una muestra compuesta de sedimento de un embalse y, mediante simulación hidrogeoquímica, se evaluó bajo qué condiciones de Eh se mantienen los metales en forma disuelta. Asimismo, se analizó experimentalmente la liberación de metales del sedimento al agua. Los resultados fueron extrapolados a los diferentes escenarios de profundidad del agua y se compararon con los CECA (SEDUE 1989) para cada metal. A continuación se describe con detalle la metodología desarrollada.
Características del sedimento
Se colectaron seis muestras de sedimento en un embalse de una zona tropical con draga Ekman. Las muestras fueron secadas a temperatura ambiente hasta peso constante y se preparó una muestra compuesta con pesos secos iguales de cada muestra de sedimento. Se caracterizó la muestra compuesta mediante los parámetros y métodos analíticos que se presentan en el cuadro I.

Los resultados fueron comparados con los límites de clasificación establecidos en la NOM 021-RECNAT-2000 (SEMARNAT 2002) y con los criterios ecológicos para sedimento resumidos por Friday (2005).
Experimento de liberación de metales por disolución reductiva
Para el desarrollo del experimento la muestra compuesta fue suspendida en agua MilliQ en relación agua: sedimento 8:1 (w:w) en un reactor de 2 L (1.541 L de agua y 193 g de sedimento) con agitación magnética y suministro de aire o de N2 para control del Eh entre +300 y -450 mV. El reactor fue cubierto con plástico negro para evitar la entrada de la luz. Se mantuvo el sedimento en suspensión mediante agitación magnética y se equilibró el sistema agua-sedimento a temperatura ambiente (25 ± 1°C) hasta registrar que el Eh y el pH fueran estables (Fig. 1).

Mediante los métodos espectrofotométricos descritos en el cuadro II se determinaron las concentraciones de metales en el agua después de los 21 días de estabilización del sistema agua-sedimento y, suministrando N2(g) (Infra de alta pureza), se disminuyó el Eh en intervalos entre 50 y 100 mV de +300 a -450 mV. A partir de Eh +100 mV fue necesario agregar nutrientes al reactor como fuente de energía para activar la actividad microbiana y alcanzar los valores de Eh más bajos. Los nutrientes fueron agregados en una sola exposición en las cantidades recomendadas por Dixon-Hardy et al. (1998), que se presentan en el cuadro III. En cada valor de Eh se equilibró el sistema agua-sedimento durante al menos 24 h y se registraron los pH. Con jeringa de plástico equipada con manguera de silicón (Masterflex) de 3.1 mm de diámetro se obtuvieron alícuotas de 50 mL de la suspensión agua-sedimento. Estas alícuotas fueron centrifugadas en tubos de polipropileno durante 20 min a 12 000 rpm. Posteriormente se filtró el sobrenadante con filtro Millipore de 0.45 μm. Todos los materiales fueron previamente lavados en baño ácido al 10 % seguido por enjuague con agua MilliQ. En el sobrenadante se determinaron las concentraciones de los metales por los métodos espectrofotométricos presentados en el cuadro II.


Para el análisis de plata se realizó una disgregación previa en termorreactor Merck TR 420. La presencia de sacarosa en el sistema a Eh menor a +100 mV, trajo como consecuencia que no fuera posible realizar la disgregación en el termorreactor para análisis de plata, ya que este nutriente se carbonizaba con el calor. Por ello, los resultados para plata se presentan únicamente hasta Eh de +100 mV.
Los resultados experimentales de la liberación de metales en función del Eh fueron extrapolados a tres escenarios de profundidad promedio de agua, considerando la interacción con el agua de una capa de 5 cm de sedimento con densidad de 0.34 kg/L de peso seco, obtenida del análisis de densidad de un espécimen de sedimento inalterado (Cuadro IV). Se compararon los resultados obtenidos con los CECA (SEDUE 1989).
Modelación hidrogeoquímica de la liberación de metales por disolución reductiva
Mediante modelación hidrogeoquímica con PHREEQC v. 2 (USGS 2005) se evaluó la distribución de los metales entre las fases sólida y disuelta. Las reacciones químicas que ocurren bajo estos escenarios son expresadas mediante ecuaciones matemáticas y resueltas numéricamente aplicando el modelo de doble capa para describir la adsorción en fases mineralógicas. Las condiciones de entrada al modelo suponen que los metales se encuentran inicialmente disueltos con la excepción de hierro que, de acuerdo con la recomendación de Dzombak y Morel (1990), forma una superficie adsorbente con 10 % de la concentración total. Las mismas consideraciones fueron aplicadas para las concentraciones iniciales de manganeso.
Se consideró la concentración y la distribución de los grupos funcionales de adsorción en óxidos de hierro, entre sitios fuertes (2.5 %) y sitios débiles (97.5 %) de acuerdo con las sugerencias del manual de PHREEQC (USGS 2005) y con Dzombak y Morel (1990). Asimismo, las concentraciones y la distribución de los grupos funcionales de adsorción en óxidos de manganeso se hizo entre sitios fuertes (50 %) y sitios débiles (50 %) de acuerdo con Tonkin et al. (2004).
RESULTADOS Y DISCUSIÓN
A continuación se describen los resultados de la caracterización de la muestra compuesta de sedimento, los resultados experimentales y los de la modelación hidrogeoquímica de la distribución de metales al variar el Eh para los diferentes escenarios de profundidad del agua.
Caracterización de la muestra compuesta de sedimento
En el cuadro V se presentan los resultados de caracterización de la muestra compuesta de sedimento. Se observa que el pH es ligeramente alcalino, la textura es principalmente limosa con contenido medio de materia orgánica, de acuerdo con los límites publicados en la NOM 021-RECNAT-2000 (SEMARNAT 2002). Las concentraciones de metales en el sedimento fueron más bajas que el nivel de probable efecto (PEL, donde frecuentemente se observan efectos biológicos; Friday 2005). Asimismo, las concentraciones de los metales antimonio, bario, cadmio, manganeso, níquel y plata fueron mayores a los niveles basales (ISQG, donde es poco probable observar efectos biológicos; Friday 2005). Los contenidos de hierro y manganeso fueron de 1.66 y 0.07 %, respectivamente.

Experimento de liberación de metales por disolución reductiva
En el cuadro VI se presentan los resultados experimentales de los metales disueltos en función del Eh. Para extrapolar estos resultados a los tres escenarios de profundidad de sedimentos, fueron multiplicados con las relaciones sólidos suspendidos escenario/ experimento, obtenidas en el cuadro IV para cada escenario. Se compararon las concentraciones extrapoladas con los CECA para cada metal (Cuadro VI).

Los resultados experimentales de los metales disueltos, extrapolados a los escenarios de profundidad del agua y expresados en porcentaje de CECA, se presentan en la figura 2 donde se observa que, con excepción de níquel y hierro, las concentraciones disueltas de los metales se encuentran en concentraciones bajas con respecto a los CECA. Lo anterior se puede explicar por la adsorción de los metales en los minerales de MnO2 (pirolusita) y FeOOH (ferrihidrita) bajo condiciones oxidadas al pH experimental de 7.5 ± 1.3. Al disminuir el Eh, las concentraciones disueltas de níquel, cadmio y cromo aumentan, alcanzando valores máximos a Eh de -123 mV (Cuadro VI). A Eh más bajo, disminuyen nuevamente las concentraciones disueltas de estos metales debido a la formación de sulfuros de hierro (Fig. 3), que los adsorben o coprecipitan.
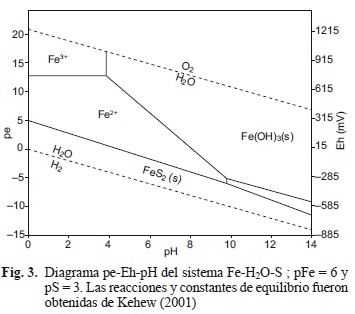
La disminución del Eh ocasiona la disolución re-ductiva de hierro, formando Fe2+ que es soluble. Sin embargo, al reducirse a sulfuro el sulfato del nutriente agregado al sistema, reacciona con el hierro disuelto, formando los sólidos FeS (mackinawita) y FeS2 (pirita), causando la formación de un nuevo sustrato para la adsorción o la coprecipitación de los metales traza divalentes (Morse y Arakaki 1993).
Este comportamiento del hierro como función del Eh explica los resultados experimentales (Fig. 2), donde aumenta la concentración de hierro disuelto a partir de Eh de -50 mV, ésta disminuye nuevamente a un Eh inferior a -350 mV debido a la formación de mackinawita y pirita, lo que ocasiona también el decremento en las concentraciones disueltas de los metales traza. Mediante la disolución reductiva, las concentraciones de hierro rebasan los CECA a partir de Eh = -50 mV. Los aumentos en las concentraciones de níquel y de manganeso se observan a partir de Eh = +100 mV, sugiriendo que el níquel se asocia con el óxido de manganeso.
Modelación hidrogeoquímica de la liberación de metales por disolución reductiva
Considerando la resuspensión o bioturbación de un espesor de 5 cm de sedimento con densidad de 0.34 kg/L de peso seco (Cuadro IV), se calcularon las concentraciones de los metales disueltos para diferentes escenarios de profundidad del agua como se describe en el cuadro VII y se simularon las distribuciones entre las fases sólida y disuelta al variar el Eh.

Los escenarios simulados de distribución de metales en función de Eh bajo diferentes escenarios de profundidad del embalse, consideran inicialmente las concentraciones de metales disueltos y la presencia de ferrihidrita y pirolusita y pH de 7.5. Se varía el Eh entre -355 y +355 mV (pe entre -6 y 6) y para cada valor de Eh se calcula la distribución de metales entre las fases disuelta y adsorbida. Las concentraciones de iones mayores en el agua fueron las reportadas por Hansen y González-Márquez (2010) y las concentraciones de los metales, las obtenidas en la caracterización de la muestra compuesta de sedimento (Cuadro VII). Considerando lo recomendado por Dzombak y Morel (1990), las concentraciones de las superficies adsorbentes (ferrihidrita y pirolusita) fueron consideradas como 10 % de las concentraciones totales de hierro y manganeso.
En la figura 4 se presentan los resultados de las simulaciones de concentraciones disueltas de los metales en equilibrio con las fases sólidas. Se observa que con excepción de manganeso y plata, todos los metales siguen una tendencia similar, con concentraciones disueltas menores a Eh positivo, debido a la adsorción en ferrihidrita. Con la disolución reductiva del hierro, las concentraciones de los metales disueltos se incrementan nuevamente a Eh negativo, aunque las concentraciones de plata y manganeso se mantienen constantes. Se observa que la concentración de níquel disuelto rebasa los CECA en todo el intervalo de Eh para los escenarios de 10 y 30 m de profundidad y para Eh menor a -250 mV en el escenario de 56 m de profundidad. Las concentraciones de manganeso disuelto son también más elevadas que los CECA para todo el intervalo de Eh en cada escenario. Las concentraciones de hierro disuelto rebasan los CECA a Eh negativo para todos los escenarios de profundidad, mientras que la concentración de cromo disuelto rebasa los CECA sólo para el escenario de 10 m de profundidad y Eh menor a -250 mV (Fig. 4).
Comparación de los resultados experimentales y de modelación
Los resultados obtenidos mediante modelación hidrogeoquímica de los sistemas agua-sedimento muestran aumentos en las concentraciones de los metales al disminuir el Eh. Los resultados obtenidos experimentalmente muestran también estos aumentos en la concentración disuelta, aunque nuevamente disminuyen cuando se reduce el Eh abajo de -214 mV. La diferencia entre los resultados experimentales y los de la modelación se puede explicar por la adición de (NH4)2SO4 como fuente de energía para disminuir el Eh experimental. A Eh de aproximadamente -214 mV, los sulfatos se reducen a sulfuros, que forman los sólidos mackinawita y pirita, que coprecipitan con, o adsorben a los metales, causando una disminución de las concentraciones disueltas. Para entender mejor este efecto se realizaron simulaciones de la distribución de hierro en presencia de la concentración de sulfato medida en campo (0.0023 mol/L; Cuadro VII) y las agregadas en el experimento (5 g/L = 0.038 mol/L de (NH4)2SO4; Cuadro III). Los resultados muestran que la adición experimental de sulfato causa la precipitación de hierro a partir de Eh = -236 mV (Fig. 5), mientras que esto no ocurre en presencia de la concentración de sulfato medida en campo.

Lo anterior explica que en los resultados del experimento se observó la disminución de la concentración de hierro disuelto a Eh inferior a -214 mV (Fig. 2) debido a la formación de mackinawita y pirita después de haber agregado nutrientes con 0.038 mol/kg de sulfato y que en la modelación hidrogeoquímica no se produjo la precipitación de estos sólidos, ya que la concentración de azufre no causa que el producto de los iones rebase la constante de solubilidad. Sin embargo, en cuerpos de agua ubicados en zonas industriales y en zonas volcánicas se podrían encontrar concentraciones elevadas de azufre (Moore 1991), semejantes a la empleada en el experimento, donde podrían esperarse comportamientos de los metales semejantes a los observados en los resultados experimentales.
Con excepción de níquel, cadmio y zinc se observó que las concentraciones modeladas son mayores a las concentraciones experimentales. Esto se puede explicar por la competencia de hierro con los demás metales por los sitios de adsorción en ferrihidrita, debido a que en las modelaciones se consideró que los metales se encontraban disueltos inicialmente y luego llegaron al equilibrio con la fase sólida. Los resultados de las simulaciones sugieren que níquel, manganeso y hierro rebasan los CECA y que el cromo sólo lo hace para el escenario de 10 m de columna de agua y para Eh menor a -236 mV. Los resultados experimentales confirman que tanto níquel como hierro rebasan los CECA, sobre todo bajo condiciones de Eh negativo.
CONCLUSIONES
Se desarrolló una metodología para determinar el riesgo de contaminación del agua por disolución reductiva de metales en sedimento y se aplicó para determinar el riesgo de contaminar el agua en contacto con el sedimento de un embalse. Esta metodología consiste en la caracterización de agua y sedimento, investigación experimental de la liberación de metales en función del Eh del sistema agua-sedimento y en la modelación hidrogeoquímica, aplicando un modelo de equilibrio químico.
Comparadas con criterios ecológicos (Friday 2005), las concentraciones de metales medidas en sedimento resultaron menores a los límites de probable efecto (PEL). La simulación hidrogeoquímica reveló concentraciones de cromo, níquel, hierro y manganeso disueltos que rebasan los CECA para agua como fuente de abastecimiento (SEDUE 1989), mientras que los experimentos de liberación de metales del sedimento por disolución reductiva confirmaron que las concentraciones de níquel y hierro disueltos rebasan los CECA en condiciones reducidas (Eh < 0 mV).
La simulación hidrogeoquímica y el experimento de liberación muestran que las interacciones agua-sedimento pueden causar la disolución de minerales de hierro y manganeso y de los metales adsorbidos en ellos y así causar la contaminación del agua, rebasando incluso los CECA (SEDUE 1989). No obstante, en presencia de sulfuros, dichas concentraciones disueltas tienden a disminuir. Esto se debe a la adsorción o coprecipitación de los metales con los nuevos sustratos de mackinawita y pirita, que se forman en ambientes muy reducidos.
La metodología desarrollada permite estimar la posible contaminación por metales en cuerpos de agua a partir de las concentraciones medidas en el sedimento. Entender la disolución reductiva de los sustratos adsorbentes y la consecuente disolución de los contaminantes adsorbidos, es importante en la mitigación de efectos a la salud y para tomar decisiones sobre tratamientos del agua.
REFERENCIAS
ASTM (1998). D422-63. Standard test method for particle-size analysis of soils. American Society for Testing and Materials. Manual, West Conshohocken, PA., 8 pp. [ Links ]
Barceló I. D. (2000). Estudio de la movilidad de Ca, Cd, Fe, Mn, Pb y Zn en sedimentos de la presa J.A. Alzate en el Estado de México. Tesis de Doctorado. Facultad de Ingeniería, Universidad Autónoma del Estado de México. Toluca, México. [ Links ]
Beadle L. C. (1966). Prolonged stratification and de-oxygenation in tropical lakes. I. Crater lake Nkugute Uganda, compared with lakes Bunyoni and Edward. Limnol. Oceanogr. 11, 152-163. [ Links ]
Cappuyns V. y Swennen R. (2005). Kinetics of element release during combined oxidation and pH leaching of anoxic river sediments. Appl. Geochem. 20, 1169-1179. [ Links ]
Dixon-Hardy J. E., Karamushka V. I., Gruzina T. G., Nikovska G. N., Sayer J. y Gadd G. M. (1998). Influence of the carbon, nitrogen and phosphorus source on the solubilization of insoluble metal compounds by Aspergillus niger. Mycol. Res. 102, 1050-1054. [ Links ]
Dzombak D. A. y Morel F. M. M. (1990). Surface complexation modeling: Hydrous ferric oxide. John Wiley & Sons, New York, EUA, 393 pp. [ Links ]
EPA (1996). Method 6010B. Inductively coupled plasma-atomic emission spectrometry. Office of Solid Waste, Environmental Protection Agency. Manual. Washington, DC. 25 pp. [ Links ]
Florence T. M. (1982). The speciation of trace elements in waters. Talanta 29, 345-364. [ Links ]
Friday G. P. (2005). Ecological screening values for surface water, sediment and soil. Westinghouse Savannah River Company. Report. Aiken, South Carolina, 141 pp. [ Links ]
Guo T. Z., DeLaune R. D. y Patrick Jr. W. H. (1997). The influence of sediment redox chemistry on chemically active forms of arsenic, cadmium, chromium, and zinc in estuarine sediment. Environ. Int. 23, 305-316. [ Links ]
Hansen A. M. (1992). Metales pesados en el sistema Lerma-Chapala: distribución y migración. Ing. Hidraul. Mex. 7, 92-98. [ Links ]
Hansen A. M. y González-Márquez L. C. (2010). Scenarios of metal concentrations in the Arcediano Dam (State of Jalisco, Mexico). J. Environ. Sci. Heal. A. 45, 99-106. [ Links ]
Hansen A. M. y Márquez-Pacheco H. (2012). Procedimiento para evaluar cargas internas de nutrientes en cuerpos de agua. Rev. Mex. Cienc. Geol. 1, 265-275. [ Links ]
Harrington J. M., Fendorf S. y Rosenzweig R. F. (1998). Biotic generation of As(III) in metal(loid) contaminated freshwater lake sediments. Environ. Sci. Technol. 32, 2425-2430. [ Links ]
Hutchinson G. E. (1975). A treatise on limnology. John Wiley & Sons, New York, EUA, Vol. 3, 660 pp. [ Links ]
Kehew A. E. (2001). Applied chemical hydrogeology. Prentice Hall, New Jersey, EUA, 368 pp. [ Links ]
Levy D. B., Barbarick K. A., Siemer E.G. y Sommers L.E. (1992). Distribution and partitioning of trace metals in contaminated soils near Leadville, Colorado. J. Environ. Qual. 21, 185-195. [ Links ]
Mansfeldt T. (2004). Redox potential of bulk soil and soil solution concentration of nitrate, manganese, iron, and sulfate in two Gleysols. J. Plant. Nutr. Soil Sc. 167, 7-16. [ Links ]
Martínez M. R. (1996). Lerma, río que nace gravemente impactado. Memorias. XXV Congreso Interamericano de Ingeniería Sanitaria y Ambiental. México D.F. 31 de octubre a 3 de noviembre, 1996. pp. 1-13. [ Links ]
Merck (2011). Merck-chemicals base-parameters-from-a-to-z [en línea]. http://www.merck-chemicals.com/base-parameters-from-a-oz/c_nt2b.s1L0LQAAAEWguIfVhTl?back=true). 07/10/2011. [ Links ]
Miao S., DeLaune R. D. y Jugsujinda A. (2006). Influence of sediment redox conditions on release/solubility of metals and nutrients in a Louisiana Mississippi River deltaic plain freshwater lake. Sci. Total. Environ. 371, 334-343. [ Links ]
Moore J. W. (1991). Inorganic contaminants of surface water: Research and monitoring priorities. Springer-Verlag New York, EUA, 395 pp. [ Links ]
Morel F. M. M. y Hering J. G. (1993). Principles and applications of aquatic chemistry. John Wiley & Sons, New York, EUA, 608 pp. [ Links ]
Morse J. W. y Arakaki T. (1993). Adsorption and coprecipitation of divalent metals with mackinawite (FeS). Geochim. Cosmochim. Ac. 57, 3635-3640. [ Links ]
Pardu J. H. y Patrick Jr. W. H. (1995). Changes in metal speciation following alteration of sediment redox status. En: Metal contaminated aquatic sediments (H.E. Allen, Ed.). Ann Arbor Press Inc., Michigan, EUA, 169-185. [ Links ]
Patrick Jr. W. H. y DeLaune R. D. (1977). Chemical and biological redox systems affecting nutrient availability in coastal wetlands. Geosci. Man. 18, 131-137. [ Links ]
SE (2001). NMX-AA-030-SCFI-2001. Análisis de agua - determinación de la demanda química de oxígeno en aguas naturales, residuales y residuales tratadas -método de prueba (cancela a la NMX-AA-030-1981). Secretaría de Economía. [ Links ] Diario Oficial de la Federación. 17 de abril de 2001. [ Links ]
SEDUE (1989). Acuerdo por el que se establecen los Criterios Ecológicos de Calidad del Agua CE-CCa-001/89. Secretaría de Desarrollo Urbano y Ecología. [ Links ] Diario Oficial de la Federación. 13 de diciembre de 1989. [ Links ]
SEMARNAT (2002). Norma Oficial Mexicana NOM 021-RECNAT-2000. Que establece las especificaciones de fertilidad, salinidad y clasificación de suelos. Estudios, muestreo y análisis. Secretaría de Medio Ambiente y Recursos Naturales. [ Links ] Diario Oficial de la Federación. 31 de diciembre de 2002. [ Links ]
Tonkin J. W., Balistrieri L.S. y Murray J.W. (2004). Modeling sorption of divalent metal cations on hydrous manganese oxide using the diffuse double layer model. Appl. Geochem. 19, 29-53. [ Links ]
USGS (2005). PHREEQC (Version 2)-A Computer Program for Speciation, Batch-Reaction, One-Dimensional Transport, and Inverse Geochemical Calculations [en línea]. http://wwwbrr.cr.usgs.gov/projects/GWC_coupled/phreeqc/). 13/06/2011 [ Links ]














